中国人群2型糖尿病易感基因研究
张瑾琨 陈 超 李志鹏 杨 泽
※为通讯作者
中国人群2型糖尿病易感基因研究
张瑾琨1,2陈 超2李志鹏2杨 泽1※
2型糖尿病(Type 2 diabetes,T2D)是由于基因和环境因素共同作用而导致的疾病。目前,伴随着该病的患病率不断升高,其在世界范围内引起了越来越广泛的关注。随着人们对T2D遗传病因学研究的深入和对疾病关联基因的不断了解,越来越多针对T2D的研究将关注点对准了T2D的易感基因。本文将针对20个已经得到验证的T2D易感基因和其在中国人群中的研究现状加以综述,内容包括T2D易感基因功能、致病机制和在中国人群中T2D易感基因的研究现状。
2型糖尿病 易感基因 致病机制 基因功能
目前,随着世界人口老龄化、生活和工作压力大、饮食不规律等现象的出现,T2D已经成为全世界最为严重的人口健康问题之一。根据国际糖尿病联合会预测,在2030年,全球T2D患者将会从2000年的1.7亿上升至3.7亿,且2/3的增长会发生在中、低收入国家[1]。而中国作为世界的人口大国,同时又经历着快速的经济发展和城市化进程,势必将会成为T2D患病率增长的中心[2]。同时,T2D在亚洲人群中的患病率呈现年轻化的趋势[2]。有文献报道,在2000~2008年间,全球青少年T2D患者从9%增长至23%;根据疾病预防控制中心预估,在未来的40年内,儿童T2D的患病率也将增长4倍[3]。T2D带来的健康威胁不容忽视,因此重视中国人民T2D的诊断治疗变得尤为重要。通过多项对T2D全基因组关联研究(Genome-wide association studies,GWAS)的报道[4~7],已经确定了基因在导致T2D发生中的重要作用,因此分析导致T2D易感的基因及其致病机制是十分有意义的。
本文中所列出的T2D易感基因均经过GWAS验证。目前在关于T2D的易感基因研究中,GWAS已经发现超过70个SNP位点与T2D有着密切的联系,而且这个数字仍在持续增长。虽然这些结果的得出最初基于欧洲人口,但后续GWAS在亚洲的研究也进一步验证了这些位点[2]。由于各个基因从不同的方面影响着T2D的发生,因此,了解每一个基因的功能及它在T2D发生过程中所扮演的角色十分重要,这不仅可以为临床提供新的T2D检测位点,同时也为T2D的治疗和人群预防提供理论依据。
1.T2D易感基因
以下所列出的20个T2D关联基因已在中国人群中重复验证,其中大多数SNPs(single nucleotide polymorphism)为导致T2D易感性的相关位点。本文将阐述这些基因变异在T2D发病过程中的作用,并根据目前论文发表的情况对该基因在中国人群中的研究现状进行综述。
1.1 C2CD4A/B(C2 Calcium-Dependent Domain Containing 4A/B) 该基因所编码的蛋白与调节细胞结构、黏度及炎症反应有关。在已有文献中报道这两个基因受促炎细胞因子IL-1hβ(Interleukin 1 beta) 调节,参与上皮细胞的炎症反应[8]。但是关于该基因导致T2D易感性的原因还并未有研究报道[2]。C2CD4A/B包含的三个SNPs(rs1370176,rs1436953,rs7172432)首次在以8000名日本人群的研究中得到证实,证明该基因与T2D的关联显著,并在随后以中国人群为基础的研究中再次得以证明,但其研究的重点主要在中国中部人口[4]。值得提出的是,针对于此基因,其与T2D关联的显著性在中国南方人口中较中国中部人口弱,研究者推测这可能与中国不同地区人口的来源不同所致[4]。
1.2 CDC123(cell division cycle 123) 其编码的蛋白参与调控细胞周期以及基因转录过程中的营养控制,而在先前GWAS的研究中也指出细胞周期失调是导致T2D发生的一个主要因素。其所包含的SNPs位点rs12779790实际上位于CDC123基因与CAMK1D(calcium/calmodulin dependent protein kinase ID)基因中间,并与CDC123的3’UTR有重叠部分。在Annemarie M等人的研究中证明含有该突基因的人群在接受葡萄糖刺激后,CDC123和CAMK1D在胰岛中的表达量会有明显的变化,但是无法确定是哪一个基因的表达改变导致T2D易感性。而在针对丹麦人群的研究也给出假设,由于涉及可调节粒细胞功能的基因CAMK1D,其可能通过增加胰岛B细胞的凋亡而影响B细胞的功能[9],进而导致T2D易感。但是,关于该基因的明确作用机制仍需后续研究。在中国人群中,已有文献证实该基因与消瘦型T2D关联显著,与肥胖型T2D并无显著关联[10]。
1.3 CDKAL1(CDK5 Regulatory Subunit Associated Protein 1 Like 1) 目前,关于CDKAL1的具体功能还不明确,但是已经在多项研究中证实其与T2D易感性的关联。在2015年的基于埃塞俄比亚人的研究报道中指出,CDKAL1表达的蛋白可以抑制CDK5蛋白的活性,从而增加胰岛素的分泌;而在CDKAL1突变后,其所表达的蛋白下降,对CDK5蛋白的抑制功能下降,从而降低了胰岛素的分泌,导致T2D的患病风险增加。在中国,早在2008年,中国人群T2D与CDKAL1多态性的关系就已经得到证实。此外,也指出该基因多态性与中国人群消瘦型T2D的关联显著[10]。
1.4 CDKN2A/B(cyclin dependent kinase inhibitor 2A/B) CDKN2A/B在代谢组织中最重要的一个产物是P16INK4A,它可以随着年龄的增长限制胰岛B细胞的增殖再生,同时降低胰岛素分泌的功能[11]。CDKN2A/B基因所包含的SNPs位点位于非编码区域(如图1),虽有文献报道这些位点的多态性对CDKN2A/B产物的表达并无直接影响,但也有研究小组对实验所选用的细胞,研究环境等提出了质疑[11],因此还需要后续的研究认证。CDKN2A/B所包含的SNP rs10811661与T2D的显著关联已在包括中国人群的多个人群中得到证实。有研究证明,在口服和静脉注射葡萄糖后,SNP rs10811661为碱基“T”时会导致胰岛素的分泌量降低。
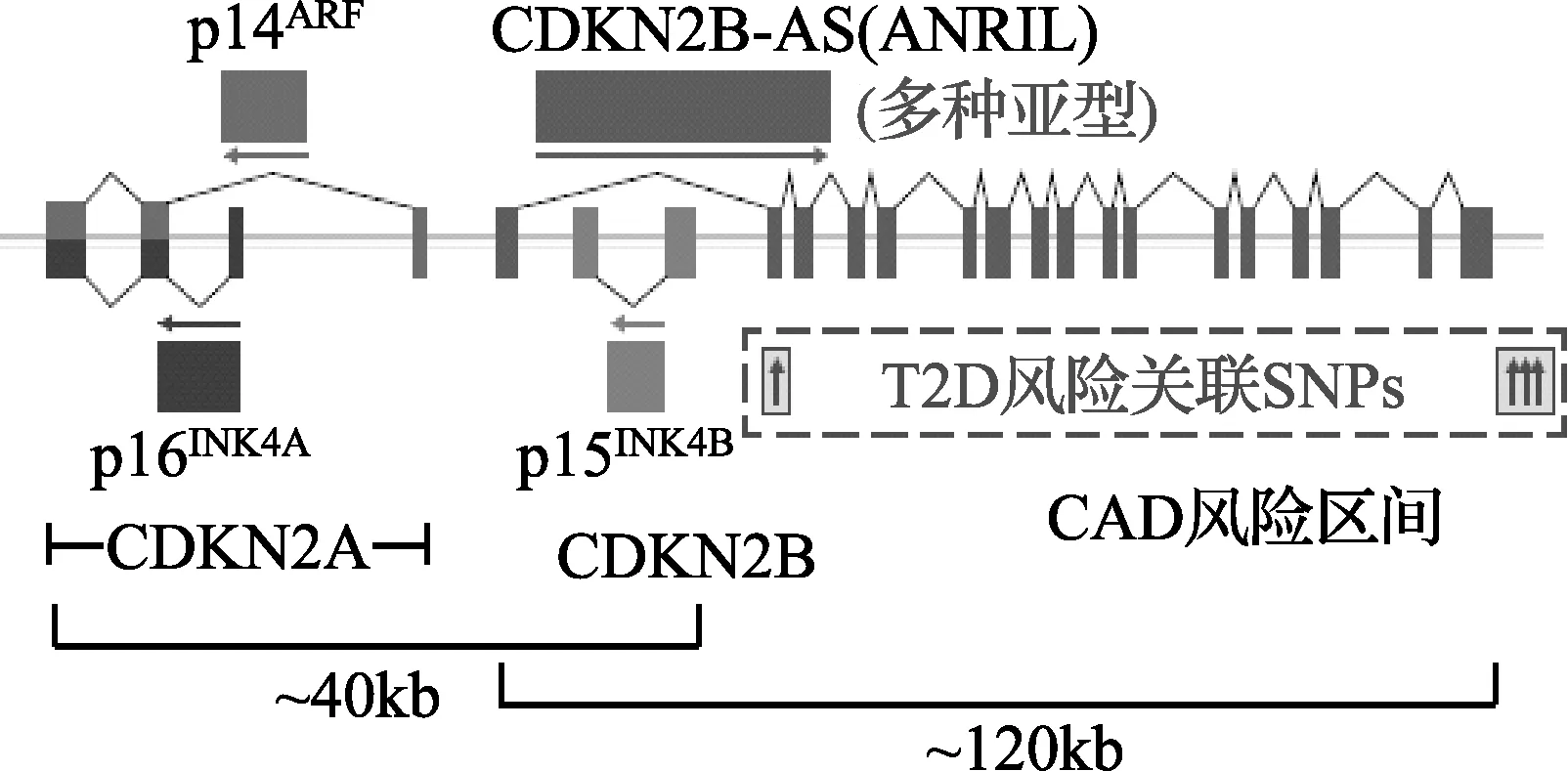
注:CDKN2A/B编码蛋白P16INK4A,P15INK4B以及P14ARF。与T2D有关的SNP位点位于CAD风险区间内。图1[11] CDKN2A/B基因所包含SNPs位点示意图
1.5 CENTD2(Centaurin-Delta-2) 该基因位于11号染色体上,其所表达的蛋白与高尔基体相连,并参与细胞调亡的过程。在已有的报道中表明了该基因与血清中胰岛素浓度降低有关,证明其是通过降低胰岛B细胞功能而导致T2D易感性的[12],但具体机制未见报道。Yun Qian[13]等人在中国人群中研究证明了位于基因 5’UTR的启动子内的SNP位点rs1552224与T2D的显著关系,同时也证明了该多态性可降低胰岛素的分泌量、增加血浆中的葡萄糖浓度进而导致T2D的发生[12]。
1.6 CHCHD9(coiled-coil-helix-coiled-coil-helix domain containing 9) 关于该基因的功能未见详细报道。该基因与T2D的关系目前已经有针对欧洲和巴基斯坦人群[14]的研究,证明其与T2D有显著关联,但是基于中国人群T2D易感性的研究未见详细报道。但是正由于现有的研究较少,目前应该更重视对其的研究。
1.7 EXT2(exostosin glycosyltransferase 2) 该基因编码两种糖基转移酶中的一种,其通过Hh信号通路(hedgehog signaling pathway)参与胰腺早期的发育以及胰岛素的合成。该基因第一次被发现是在基于法国人T2D易感基因的研究中,但是在随后针对美国、德国等人群的研究,该基因与T2D的关联并未得到证实。在中国人T2D易感性的研究中,已经存在针对该突变位点的研究。其中在2013年Lei Liu等人的报道称EXT2与中国人群T2D易感性有关联[15]。而在2015年Qian Ren等人在分析14个省的大样本后表明,EXT2与中国人群T2D并无显著关联[16]。目前关于该基因与T2D易感性的关联并无准确结果,因此需要进一步研究确定。
1.8 FTO(alpha-ketoglutarate dependent dioxygenase) 关于此基因确切的功能目前还没有准确报道,但是经常将其与肥胖联系在一起。有研究表明该基因的mRNA在下丘脑中聚集,控制着进食以及能量的支配,但是关于其导致肥胖的准确机制目前还不明确[12]。在FTO多态性与中国人群T2D易感性的研究中已经证明其与肥胖型T2D易感性有显著联系[10]。同时在对中国T2D患患者群的研究中,证明该基因与患者的血脂性状密切关联。
1.9 HHEX(hematopoietically expressed homeobox) HHEX所表达的蛋白作为转录因子参与Wnt信号通路,并在一定程度上影响着胰腺的发育。在已经有的研究分析中指出其可能通过影响胰岛B细胞的数量或者分泌功能而导致的T2D易感性。但是,在2014年Zhang J等人[17]通过小鼠模型的研究发现HHEX作为胰岛D细胞中重要的转录调控因子对于胰岛D细胞的分化及胰岛的功能有着不容忽视的作用。因此推测,HHEX多态性可能是由于影响胰岛D细胞的数量及功能从而导致T2D的发生,明确的机制仍需后续研究验证。HHEX基因中多个突变位点与中国人群T2D的关系已经得到验证[2],但仍存在SNPs位点在中国人群中还未见相关报道,例如rs10748582。
1.10 HHEX/IDE(hematopoietically expressed homeobox /insulin degrading enzyme) 在相关资料中显示IDE基因所编码的金属肽酶参与细胞内胰岛素的降解。在2013年针对小鼠的研究中也进一步证明该基因与胰岛素分泌有密切联系。在试验中敲除IDE基因的小鼠中出现了葡萄糖耐量降低、高血糖症和胰岛素分泌不足的现象,而导致这些现象的原因可能是由于胰岛B细胞中该基因表达降低导致α-突触核蛋白的增加,进而导致胰岛素分泌减少,造成T2D的易感性。在2014年对于人的研究中证明了该基因与T2D的关联性,也证明其导致疾病发生的机制是通过影响胰岛素的产生及分泌。在基于中国人群的研究中已经证实了其与T2D存在关联性[18]。值得指出的是,在对中国畲族人与该基因SNP位点rs5015480的研究结果表明,其不仅与T2D有显著关联,与心血管疾病也存在着一定关联性[18]。
1.11 HNF1B (hepatocyte nuclear factor 1β) HNF1B所编码的蛋白属于转录因子,并在多数组织中表达。在小鼠的研究中可以表明该基因产物在调控胚胎胰腺生长发育的转录调控网络中起着重要的作用[19]。其致病机制在近年的研究中得到推测,该基因所含的SNP位点rs2229295会改变miRNA在HNF1B上的结合区域,进而影响其表达,导致T2D易感性[19]。除此之外,有研究表明由HNF1B导致的T2D可能会发生胰岛素敏感度的降低,出现例如肝脏胰岛素抵抗等。2012年针对中国东北人口与2009针对中国上海居民[20]与HNF1B基因多态性的研究也已经证实该基因与T2D的显著关联。同时该基因也作为前列腺癌的易感基因被广泛研究。
1.12 IGF2BP2(insulin like growth factor 2 mRNA binding protein 2) 该基因的产物可以结合胰岛素样生长因子2(IGF2)mRNA的5’UTR区域,并调控IGF2的翻译过程。有研究指出,根据该基因所含SNPs位点的位置可以推测出其可能影响IGF2BP2的表达进而影响胰岛素的分泌。有研究分析指出,亚洲人群中该基因所含有的多个突变位点与T2D的关系显著。在中国人群中,该基因与T2D易感性的显著关联也已经得到证实[21]。
1.13 JAZF1(JAZF zinc finger 1) 该基因所编码的蛋白为核蛋白,是一种转录抑制子,其多态性可能会降低胰岛中JAZF1的表达。已有研究报道JAZF1的表达量降低可能是由于基因中的SNP位点rs1635852会改变所连接的转录因子,从而降低了JAZF1基因表达量。JAZF1的表达降低抑制了代谢调节剂NR2C2,进而造成葡萄糖耐量降低和胰岛素抵抗,导致T2D易感性。在中国人群中T2D易感性与该基因的关系已经得到证实,相较基于欧洲人的研究结果,中国人群含有SNP rs864745更易患有T2D[22]。
1.14 KCNJ11( potassium voltage-gated channel subfamily J member 11) 该基因属于钾离子通道基因家族中的一员,其所编码的蛋白Kir6.2与其受体SUR1一起组成KATP通道,调节胰岛素的分泌(如图2)。KCNJ11中存在的多个变异位点都会影响Kir6.2的活性,使得KATP通道受损,影响胰岛素分泌,导致T2D的易感性。目前KCNJ11中含有的6个SNPs位点受到了广泛关注,其中最受关注的是rs5219,它也是通过影响KATP途径抑制胰岛素的分泌。在2015年针对中国人群T2D易感性的分析中,此SNP位点与T2D易感性的显著关联得到证实。同时值得指出的是,该突变位点与高血压也有着密切的联系,并已经在中国人群中得到证实。
1.15 KCNQ1(potassium voltage-gated channel subfamily Q member 1) 该基因所编码的kcnq1蛋白在胰岛B细胞中作为钾离子通道产生信号促使胰岛素的分泌。关于该基因的多态性对于基因本身表达和功能的影响还没有准确报道。但是研究指出KCNQ1的内含子可产生非编码RNA影响着KCNQ1上游与T2D易感性有关的基因表达,当SNPs位点出现在内含子中,其会通过影响非编码RNA影响上游基因的表达,进而导致T2D患病风险增加。在中国地区,已经有针对海南省及中国哈萨克族人民与KCNQ1基因的研究,其结果证明该基因与T2D易感性有显著关联。此外,在对镇江人民的研究中,不仅验证了KCNQ1与T2D易感性的关联,也得出其与高血压及大血管病变也有着显著的关联[23]。
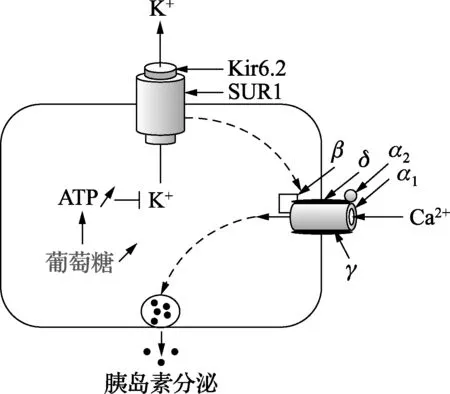
注:Kir6.2及SUR1一共调节胰岛素的分泌。葡萄糖水平的升高使得KATP通道开启,K+进入;细胞内K+浓度升高刺激Ca2+通道打开,使细胞内游离Ca2+浓度升高;Ca2+激活胰岛素分泌途径中的其他成分,在质膜附近释放胰岛素。图2[24] 胰岛B细胞胰岛素分泌途径—KATP途径
1.16 SPRY2(sprouty RTK signaling antagonist 2) SNP位点rs1359790是定位在SPRY2基因旁的多态性位点,且该位点与T2D的关系已经在欧美、韩国以及新加坡等地得到证实[25]。在对于中国人群的研究中,目前只有基于上海地区的研究,研究表明rs1359790位点与T2D的关联显著[5]。但是关于该基因的功能以及其导致T2D易感性的机制还未见详细的研究报道。
1.17 PTPRD(protein tyrosine phosphatase,receptor type D) 其所编码的蛋白属于磷酸酪氨酸酶家族,参与细胞生长、分化等多个过程。但是其导致T2D易感性的具体机制还未见报道。在对于中国台湾群体的研究中,PTPRD基因SNP位点rs17584499与T2D易感性的显著关系已经得到证实,并在随后的试验中,再次验证了该位点与中国内地人群T2D易感性之间的关联[6]。此外,该基因中存在的基因多态性位点已经在黑白种族人群中被证实与高血压有一定的关联[26]。
1.18 SLC30A8(solute carrier family 30 member 8) SLC30A8是编码锌转运体的基因,其主要在胰岛B细胞中表达并存在在胰岛素分泌颗粒中,在胰岛素结晶,储存和分泌过程中有着重要的作用。因此,此基因的多态性可能通过影响胰岛素的理化活性导致T2D的易感性[27]。目前,在对SLC30A8基因SNPs的meta分析中已经证实了该基因主要的SNP位点rs13266634在亚洲和欧洲人群中与T2D易感性的显著关联[27]。在针对中国人群的研究中,大部分的研究分析也都得出了其与T2D易感性关联显著的结果[28],但是由于样本量的大小及调查人群的分布有关,有些研究结果仍存在差异,因此仍需后续研究。
1.19 TCF7L2(transcription factor 7 like 2) TCF7L2表达产物参与Wnt信号通路。该基因的多态性,例如SNPrs7903146可以导致TCF7L2的表达增加,进而影响Wnt信号通路,降低胰岛素的分泌,造成T2D患病阈值降低[29]。同时,该位点与中国人T2D易感性的关系也已经证实[29]。该基因除了与T2D易感性有关之外,与妊娠性糖尿病也有显著联系,这已经在基于亚洲种群的研究中得到证实。
1.20 VPS26A(VPS26,retromer complex component A) 关于该基因功能和其导致T2D易感性的关系还未见详细的报道,但是在一项关于胰岛中miRNA的研究表明,胰岛中存在的miRNA与VPS26A基因上的SNPs位点有重叠的部分,因此推测该基因多态性可能影响自身与miRNA的结合而影响表达[30],进而导致胰岛B细胞功能失调。在基于中国人的研究中,该基因SNP位点rs1802295与T2D的显著关联已经得到证实[7],但是关于其与T2D易感性的研究仍相对较少,且对于VPS26A多态性的研究相对集中于帕金森病。
2.总结与展望
本文综述了20个与T2D易感性相关的基因,但是依然存在着一些基因导致T2D易感性的机理不十分清楚、在中国人群中T2D易感性的研究结果不一致的报道。此外,基于中国T2D患病率持续上升的现状,关于T2D易感基因功能、致病机制和变异性的深入研究可以给我们诊疗和预防T2D提供理论依据,因此后续开展大样本的人群验证研究是十分必要的。
1 Wild S, Roglic G, Green A, et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030[J]. Diabetes Care, 2004, 27(5): 1047-1053. DOI:10.2337/diacare.27.10.2568.
2 Qi Q,Wang X,Strizich G,et al.Genetic Determinants of Type 2 Diabetes in Asians[J]. Int J Diabetol Vasc Dis Res, 2015,2015(Suppl 1). DOI: 10.19070/2328-353X-SI01001.
3 Xue Y, Gao M, Gao Y. Childhood type 2 diabetes: Risks and complications[J]. Exp Ther Med, 2016, 12(4): 2367-2370.
4 Cui B, Zhu X, Xu M, et al. A genome-wide association study confirms previously reported loci for type 2 diabetes in Han Chinese[J]. PLoS ONE, 2011, 6(7): e22353.
5 Shu XO, Long J, Cai Q, et al. Identification of new genetic risk variants for type 2 diabetes[J]. PLoS Genet, 2010, 6(9): e1001127.
6 Chang YC, Chiu YF, Liu PH, et al. Replication of genome-wide association signals of type 2 diabetes in Han Chinese in a prospective cohort[J]. Clinical Endocrinology, 2012(3): 365-372. DOI:10.1111/j.1365-2265.2011.04175.x.
7 Lu S, Xie Y, Lin K, et al. Genome-wide association studies-derived susceptibility loci in type 2 diabetes: confirmation in a Chinese population[J]. Clin Invest Med, 2012, 35(5): E327.
8 Warton K, Foster NC, Gold WA, et al. A novel gene family induced by acute inflammation in endothelial cells[J]. Gene, 2004, 342(1): 85-95.
9 Grarup N, Andersen G, Krarup NT, et al. Association testing of novel type 2 diabetes risk alleles in the JAZF1, CDC123/CAMK1D, TSPAN8, THADA, ADAMTS9, and NOTCH2 loci with insulin release, insulin sensitivity, and obesity in a population-based sample of 4,516 glucose-tolerant middle-aged Danes[J]. Diabetes, 2008, 57(9): 2534-2540.
10 Kong X, Xing X, Hong J, et al. Genetic variants associated with lean and obese type 2 diabetes in a Han Chinese population: A case-control study[J]. Medicine (Baltimore), 2016, 95(23): e3841.
11 Kong Y, Sharma RB, Nwosu BU, et al. Islet biology, the CDKN2A/B locus and type 2 diabetes risk[J]. Diabetologia, 2016, 59(8): 1579-1593.
12 Nielsen T, SparsT, Grarup N, et al. Type 2 diabetes risk allele near CENTD2 is associated with decreased glucose-stimulated insulin release[J]. Diabetologia, 2011, 54(5): 1052-1056.
13 Qian Y, Dong M, Lu F, et al. Joint effect of CENTD2 and KCNQ1 polymorphisms on the risk of type 2 diabetes mellitus among Chinese Han population[J]. Mol Cell Endocrinol, 2015, 407: 46-51.
14 Rees SD, Hydrie MZ, Shera AS, et al. Replication of 13 genome-wide association (GWA)-validated risk variants for type 2 diabetes in Pakistani populations[J]. Diabetologia, 2011, 54(6): 1368-1374.
15 Liu L, Yang X, Wang H, et al. Association between variants of EXT2 and type 2 diabetes: a replication and meta-analysis[J]. Hum Genet, 2013, 132(2): 139-145.
16 Ren Q, Xiao J, Han X, et al. Impact of variants of the EXT2 gene on Type 2 diabetes and its related traits in the Chinese han population[J]. Endocr Res, 2015, 40(2): 79-82.
17 Zhang J, McKenna LB, Bogue CW, et al. The diabetes gene Hhex maintains δ-cell differentiation and islet function[J]. Genes Dev, 2014, 28(8): 829-834.
18 Chen G, Xu Y, Lin Y, et al. Association study of genetic variants of 17 diabetes-related genes/loci and cardiovascular risk and diabetic nephropathy in the Chinese She population[J]. J Diabetes, 2013, 5(2): 136-145.
19 Goda N, Murase H, Kasezawa N, et al. Polymorphism in microRNA-binding site in HNF1B influences the susceptibility of type 2 diabetes mellitus: a population based case-control study[J]. BMC Med Genet, 2015, 16: 75.
20 Wang C, Hu C, Zhang R, et al. Common variants of hepatocyte nuclear factor 1beta are associated with type 2 diabetes in a Chinese population[J]. Diabetes, 2009, 58(4): 1023-1027.
21 Zhang SM, Xiao JZ, Ren Q, et al. Replication of association study between type 2 diabetes mellitus and IGF2BP2 in Han Chinese population[J]. Chin Med J, 2013, 126(21): 4013-4018.
22 Zhou DZ, Liu Y, Zhang D, et al. Variations in/nearby genes coding for JAZF1, TSPAN8/LGR5 and HHEX-IDE and risk of type 2 diabetes in Han Chinese[J]. J Hum Genet, 2010, 55(12): 810-815.
23 Zhang W, Wang H, Guan X, et al. Variant rs2237892 of KCNQ1 Is Potentially Associated with Hypertension and Macrovascular Complications in Type 2 Diabetes Mellitus in A Chinese Han Population[J]. Genomics Proteomics Bioinformatics, 2015, 13(6): 364-370.
24 Haghvirdizadeh P, Mohamed Z, Abdullah NA, et al. KCNJ11: Genetic Polymorphisms and Risk of Diabetes Mellitus[J]. J Diabetes Res, 2015, 2015: 908152.
25 Sun X, Yu W, Hu C. Genetics of type 2 diabetes: insights into the pathogenesis and its clinical application[J]. Biomed Res Int, 2014, 2014: 926713.
26 Gong Y, McDonough CW, Beitelshees AL, et al. PTPRD gene associated with blood pressure response to atenolol and resistant hypertension[J]. J Hypertens, 2015, 33(11): 2278-2285.
27 Cheng L, Zhang D, Zhou L, et al. Association between SLC30A8 rs13266634 Polymorphism and Type 2 Diabetes Risk: A Meta-Analysis[J]. Med Sci Monit, 2015, 21: 2178-2189.
28 Qian Y, Lu F, Dong M, et al. Cumulative effect and predictive value of genetic variants associated with type 2 diabetes in Han Chinese: a case-control study[J]. PLoS ONE, 2015, 10(1): e0116537.
29 Jia HY, Li QZ, Lv LF. Association between transcription factor 7-like 2 genetic polymorphisms and development of type 2 diabetes in a Chinese population[J]. Genetics and Molecular Research, 2016, 15(2).
30 van de Bunt M, Gaulton KJ, Parts L, et al. The miRNA profile of human pancreatic islets and beta-cells and relationship to type 2 diabetes pathogenesis[J]. PLoS ONE, 2013, 8(1): e55272.
The Research of Genetic Risk Variants for Type 2 Diabetes in Chinese Population
(ZHANG Jinkun, CHEN Chao, LI Zhipeng, YANG Ze※.
The MOH Key Laboratory of Geriatrics, Beijing hospital, National Center of Gerontology, Beijing 100730, P.R.China.)
Type 2 diabetes has become a leading health problem contributed by a combination of multiple genetic and environmental factors.Recently,with marked increase of the people with T2D,more and more attention is concentrated on T2D within the world.Moreover,the more comprehensive studies on the T2D’s genetic etiology and understanding of the disease-associated genes,the more researches into the genes associated with type 2 diabetes’ susceptibility.This article reviews 20 verified susceptibility genes for T2D and the studies about them conducted in Chinese people,including the function of T2D susceptibility genes,pathogenic mechanism and the current research status of Chinese people.
Type 2 diabetes, Susceptibility Genes, Pathogenic Mechanism, Gene Function
1.北京医院,国家老年医学中心,卫生部老年医学重点实验室 100730 2.北京师范大学珠海分校 519087
国家自然科学基金(81061120527,81370445,81472408),卫生部公益性研究基金(201302008)和国家科技部十二五支撑计划(2012BAI10B01,2015BAI06B03)。
10.3969/j.issn.1672-4860.2016.06.004
2016-10-30

