HPLC-ELSD法测定三种植物基原金线莲的金线莲苷含量
张 超,吴建国,易 骏,吴锦忠,郑承剑,吴岩斌,*
(1.福建中医药大学中西医结合研究院,福建福州 350122;2.福建教育学院理科部,福建福州 350001;3.第二军医大学药学院生药教研室,上海 200433)
HPLC-ELSD法测定三种植物基原金线莲的金线莲苷含量
张 超1,吴建国1,易 骏2,吴锦忠1,郑承剑3,吴岩斌1,*
(1.福建中医药大学中西医结合研究院,福建福州 350122;2.福建教育学院理科部,福建福州 350001;3.第二军医大学药学院生药教研室,上海 200433)
建立HPLC-ELSD法,测定三种植物基原金线莲中金线莲苷含量。采用phenomenex NH2色谱柱(250 mm×4.6 mm,5 μm),以乙腈-水(92∶8,V/V)为流动相进行等度洗脱,流速为0.8 mL/min,柱温室温,ELSD雾化室温度为70 ℃,氮气流速为1.5 L/min。实验结果表明,金线莲苷进样量在76.02~2432.64 μg/mL范围内线性良好(r=0.9991);精密度、稳定性、重复性实验的RSD均≤3%;平均加样回收率为97.55%,RSD为1.50%(n=6)。33批次金线莲的金线莲苷含量在6.37%~22.66%之间,平均含量为15.00%,存在较大的差异(RSD=26.29%)。该方法快速、简便,结果准确、可靠,适用于金线莲中金线莲苷的定量分析。
金线莲,金线莲苷,HPLC-ELSD
金线莲来源于兰科(Orchidaceae)开唇兰属(Anoectochilus)植物的新鲜或干燥全草。具有清热凉血、祛风利湿等功效,用于肾炎、膀胱炎、糖尿病、支气管炎、风湿性关节炎、小儿急惊风等症[1]。金线莲还未被《中国药典》收载,对于金线莲原植物的来源,一直以来也有较大争议。《福建中药材标准》收载的金线莲原植物来源为兰科开唇兰属植物花叶开唇兰(金线兰)Anoectochilusroxburghii[1],《中国植物志》收载的金线莲原植物来源为台湾银线兰A.formosanus[2],《中华本草》、《全国中草药汇编》等收载的金线莲包括金线兰和台湾银线兰[3-4]。金线莲是闽台地方特色药材,民间把金线兰和台湾银线兰都当成金线莲使用。另外,云南地区把滇越金线兰A. chapaensis也当成金线莲使用[5-6]。以上这些不同植物基原的开唇兰属植物都当做金线莲使用是否合理,仍有待探明。
金线莲迄今尚未有统一的质量标准,目前国内外学者多以黄酮的含量作为金线莲质量控制的主要模式,但这些成分缺乏专属性,没有体现与药效的相关性,难以真正反映药材内在质量。如测定金线莲中槲皮素、山奈酚和异鼠李素等黄酮类成分的含量[7-10],而这些黄酮类成分既不是其主要有效成分,也不是其专属性成分,检测它们对其质量控制几乎没有实际意义。因此,需要建立更加合理的评价指标,用于金线莲的质量控制。
金线莲苷是金线莲的特征性成分,是其主要的活性成分之一,在金线兰、台湾银线兰和滇越金线兰中均有分布,具有降血糖、抗炎、保肝、抗骨质疏松、降血脂等生物活性[11-15]。目前有少量文献报道金线兰及金线兰提取物中的金线莲苷的含量[16-17],但是关于不同基原金线莲的金线莲苷含量比较研究却未见报道。本研究采用HPLC-ELSD法建立金线兰、台湾银线兰和滇越金线兰三种基原金线莲的金线莲苷含量,为金线莲药材的质量标准制定提供一定的参考依据。
1 材料与方法
1.1 材料与仪器
金线莲 16批组培金线兰鲜品、8批组培台湾银线兰鲜品均购自福建省漳州市南靖县,野生金线兰和野生滇越金线兰采自不同产地,金线兰、台湾银线兰和滇越金线兰均经福建中医药大学药学院中药鉴定教研室黄泽豪副教授鉴定,样本存放于福建中医药大学中西医结合研究院;金线莲苷对照品 购自成都普瑞法科技开发有限公司,批号:14052015;色谱乙腈 美国Fisher公司;甲醇 分析纯;水 超纯水。
1260高效液相色谱仪 安捷伦公司;Alltech 3300蒸发光散射检测器 美国GRACE 公司;MS105DU电子天平 Mettler Toledo;DFT-200手提式高速万能粉碎机 温岭市林大机械有限公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 色谱条件 色谱柱为phenomenex NH2(250 mm×4. 6 mm,5 μm);流动相为乙腈-水(92∶8,V/V),等度洗脱;流速为0.8 mL/min;柱温为室温;蒸发光散射检测器雾化室温度为70 ℃,载气为高纯氮气,载气流速1.5 L/min;进样量10 μL,比较DAD检测器和ELSD检测器对金线莲苷测定结果的影响。
1.2.2 对照品溶液的制备 精密量取金线莲苷对照品12.67 mg(含金线莲苷12.16 mg)到5 mL容量瓶,加甲醇到刻度,超声溶解,配制成每1 mL含2.432 mg的金线莲苷对照品溶液,即得。
1.2.3 样品溶液的制备 取新鲜金线莲,60 ℃干燥,粉碎,过60目筛得金线莲药材粉末。取金线莲0.5 g,精密称定,置具塞三角瓶中,精密加入甲醇100 mL,密塞,称定重量,超声处理(功率250 W,频率50 kHz)40 min,放冷,再称定重量,用甲醇补足减失重,摇匀,0.22 μm滤膜滤过,即得。
1.2.4 标准曲线及线性范围 将对照品溶液稀释至2432.64、1216.32、304.08、152.04、76.02 μg/mL,进样10 μL,测定峰面积,以峰面积积分值(A)的对数值为纵坐标(y),对照品浓度B的对数值为横坐标(X)进行线性回归,得到金线莲苷的回归方程、相关系数和线性范围。
1.2.5 方法学考察
1.2.5.1 精密度实验 精密吸取“1.2.2”项下制备的金线莲苷对照品溶液,按“1.2.1”项下的色谱条件连续重复进样6次,记录峰面积。
1.2.5.2 重复性实验 取同一批样品(NO.24)0.5 g,平行称取6份,按“1.2.3”项下处理,按“1.2.1”项色谱条件测定,记录峰面积。
1.2.5.3 稳定性实验 取同一批样品(NO.24)0.5 g,按“1.2.3”项下处理,按“1.2.1”项色谱条件,分别于0、2、4、6、12、24、48 h测定,记录峰面积。
1.2.5.4 回收率实验 取已知含有量的样品(NO.24)0.25 g,平行称定6份,精密称定,置50 mL容量瓶中,精密加入对照品15 mg(含金线莲苷14.40 mg),加甲醇至刻度,浸泡20 min,250 W超声40 min,按“1.2.1”项色谱条件测定,记录峰面积,计算回收率。
1.2.6 样品含量的测定 取不同植物基原的金线莲药材各0.5 g,以“1.2.3”项下方法制备供试品溶液,进样10 μL,按“1.2.1”项下测定峰面积,根据标准曲线计算其含量。
2 结果与分析
2.1 色谱条件的选择
以乙腈-水(92∶8,V/V)为流动相进行等度洗脱,流速为0.8 mL/min,蒸发光散射检测器雾化室温度为70 ℃,载气流速1.5 L/min,可有效分离出金线莲苷,结果见图1。图1(A、B、C、D)分别为金线莲苷对照品HPLC色谱图和三种不同基原金线莲(金线兰、台湾银线兰、滇越金线)样品溶液的HPLC色谱图。结果证明,在该色谱条件下,目标成分和其他杂质峰分离良好。

图1 金线莲苷对照品和三种植物基原金线莲样品的HPLC图Fig.1 HPLC chromatograms of kinsenoside and Jin-Xian-Lian sample from three Anoectochilus species注:1.金线莲苷;A.金线莲苷对照品;B.金线兰;C.台湾银线兰;D.滇越金线兰。
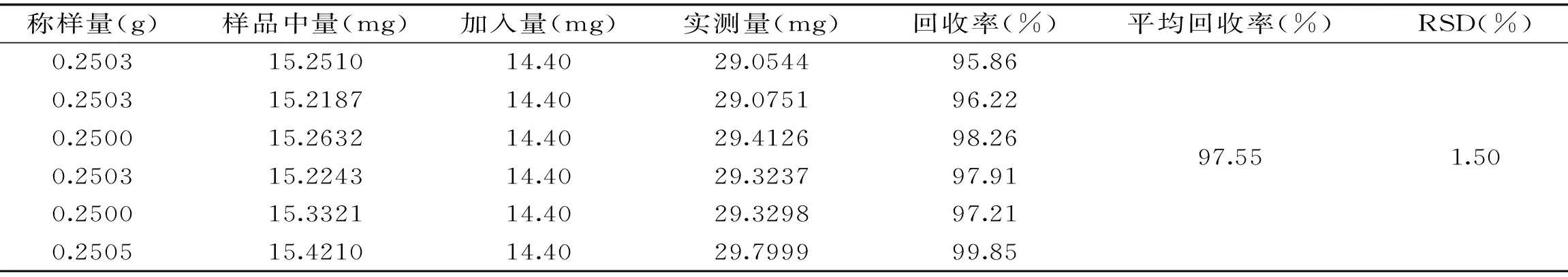
表1 加样回收实验结果(n=6)Table 1 Result of recovery tests(n=6)
本实验比较了DAD检测器和ELSD检测器对金线莲苷测定结果的影响,发现金线莲苷在较大浓度时,其紫外吸收度不强,而其他成分的吸收峰较强,用DAD检测器无法准确测定金线莲苷的含量,而采用ELSD检测器测定金线莲苷,金线莲苷的吸收峰较强,其他类成分的吸收较弱,因此选择HPLC-ELSD测定金线莲苷的含量。这与金线莲苷的结构有关,金线莲苷是葡萄糖与五元内酯环的手性碳以氧苷键形式连接形成的苷,结构中没有共轭双键,以DAD检测器检测时只有末端吸收。另外,本实验比较了不同色谱柱对金线莲苷的分离效果,考察了YMC-Pack-ODS-A(250 mm×4.6 mm,5 μm)、YMC-Triart C18(250 mm×4. 6 mm,5 μm)、phenomenex NH2(250 mm×4.6 mm,5 μm),发现采用YMC-Pack-ODS-A和YMC-Triart C18色谱柱分离金线莲苷,以5%乙腈-水进行等度洗脱,金线莲苷的出峰时间在3 min左右,而且溶剂峰和其他成分的干扰较大,无法准确定量,当采用phenomenex NH2氨基柱,以92%乙腈-水等度洗脱时,金线莲苷的出峰时间在10 min以后,其分离度比较好,避免了溶剂峰以及其他成分的干扰,故选择phenomenex NH2氨基柱进行分离。这可能是因为金线莲苷的极性偏大,以反相柱分离时,过早出峰,而以正相柱分离可以得到较好的分离效果。
2.2 线性关系考察结果
计算得到金线莲苷含量测定的回归方程:y=1.2891x+0.4179(r=0.9991),结果表明金线莲苷在76.02~2432.64 μg/mL内线性良好。
2.3 方法学考察
2.3.1 精密度实验 计算结果显示金线莲苷峰面积的RSD值为2.06%,表明该方法测定金线莲苷的含量精密度良好。
2.3.2 重复性实验 计算结果显示金线莲苷峰面积的RSD值为2.25%,表明该方法测定金线莲苷的含量重复性良好。
2.3.3 稳定性实验 计算结果显示金线莲苷峰面积的RSD值为2.79%,表明供试品溶液在48 h内稳定。
2.3.4 回收率实验 回收率结果见表1,结果显示,金线莲苷的平均回收率为97.55%,RSD为1.50%,表明金线莲苷的加样回收率良好。
2.4 样品测定结果
33批次金线莲的金线莲苷含量有较大的差异,在6.37%~22.66%之间,其中批次16的组培台湾银线兰的金线莲苷含量最高,批次24的野生金线莲的金线莲苷含量最低,结果见表2。15批次组培金线兰的金线莲苷含量在12.54%~19.99%之间,其中批次1~5的组培金线兰来自同一厂家,金线莲苷的含量差异较小,在16.21%~17.83%之间,而批次6~15的组培金线兰来自不同厂家,金线莲苷的含量差异较大,在12.54%~19.99%之间;另外,8批次不同厂家的组培台湾银线兰的金线莲苷含量也具有一定的差异,这说明不同公司生产的组培金线兰和组培台湾银线兰的外植体种源可能不一样,此外组织培养所用的培养基、光源、光照时间等可能对金线莲苷的积累也会有一定的关系。不同产地的野生金线兰的金线莲苷含量也差异悬殊,8批次野生金线兰的金线莲苷含量在6.37%~13.43%之间,2批次野生滇越金线兰的金线莲苷含量分别为12.44%和13.45%,这可能与不同的生长年限、不同生态环境等有关。
本研究所收集的组培金线兰和组培台湾银线兰的金线莲苷含量普遍高于野生金线兰和野生滇越金线兰,因此如果要从金线莲中提取分离金线莲苷,可考虑采用组培金线兰或组培台湾银线兰为原料进行提取,这样可以节约提取分离成本,也可避免该濒危珍稀植物的过度采摘。此外,组培金线莲的金线莲苷含量虽然普遍高于野生金线莲,但是组培金线莲是否能替代野生金线兰使用,这些都还有待进一步的研究。

表2 三种植物基原金线莲中金线莲苷的含量Table 2 Determination of kinsenoside in Jin-Xian-Lian from three Anoectochilus species
注:福建南靖组培金线兰1~5来自同一厂家,6~15来自不同厂家;福建南靖组培银线兰1~8来自不同厂家。
3 结论
本研究结果显示,33批次金线莲的金线莲苷含量在6.37%~22.66%之间,平均含量为15.00%,存在较大的差异(RSD=26.29%),提示不同植物基原、不同厂家、不同产地的金线莲质量可能存在较大差异。
本实验建立了不同植物基原金线莲中金线莲苷含量的HPLC-ELSD测定方法,该定量分析方法简便、快捷、准确,为综合评价金线莲的质量提供参考。
[1]黄有霖.福建中药材标准[S].福州:海风出版社,2006:154.
[2]中国科学院中国植物志编辑委员会.中国植物志[M].第17卷.北京:科学出版社,2000:204.
[3]国家中医药管理局.中华本草[M].第二十四卷.上海:上海科学技术出版社,1999:672.
[4]王国强.全国中草药汇编[M].卷二.北京:人民卫生出版社,2014:656-657.
[5]张铁,万京,沐建华.文山地区金线莲种质资源初步调查[J].文山师范高等专科学校学报,2005,18(1):26-28.
[6]张铁,李洪超,刘伟.文山野生金线莲的RAPD鉴别[J].中药材,2009,32(3):347-348.
[7]郑成凤,潘裕添,蔡文燕,等.HPLC-UV-MS/MS法对金线莲中黄酮类组分的鉴定和测定[J].天然产物研究与开发,2013,25(10):1381-1386.
[8]刘知远,沈廷明,吴仲玉.RP-HPLC法同时测定福建产金线莲中槲皮素、山柰素、异鼠李素的量[J].中草药,2015,46(3):432-434.
[9]黄丽萍,黄丽英,林守二,等.液-质联用分析金线莲中4种黄酮类化合物[J].福建医科大学学报,2015,49(2):72-77.
[10]关琛,王春兰,郭顺星,等.高效液相色谱法测定金线莲中黄酮含量[J].药物分析杂志,2008,28(1):9-11.
[11]Zhang Y,Cai J,Ruan H,et al. Antihyperglycemic activity of kinsenoside,a high yielding constituent from Anoectochilus roxburghii in streptozotocin diabetic rats[J]. J Ethnopharmacol,2007,114(2):141-145.
[12]Hsiao HB,Hsieh CC,Wu JB,et al. Kinsenoside inhibits the inflammatory mediator release in a type-II collagen induced arthritis mouse model by regulating the T cells responses[J]. BMC Complement Altern Med,2016,16(1):1-12.
[13]Hsieh WT,Tsai CT,Wu JB,et al. Kinsenoside,a high yielding constituent from Anoectochilus formosanus,inhibits carbon tetrachloride induced Kupffer cells mediated liver damage[J]. J Ethnopharmacol,2011,135(2):440-449.
[14]Hsiao HB,Lin H,Wu JB,et al. Kinsenoside prevents ovariectomy-induced bone loss and suppresses osteoclastogenesis by regulating classical NF-κB pathways[J]. Osteoporos Int,2013,24(5):1663-1676.
[15]Cheng KT,Wang YS,Chou HC,et al. Kinsenoside-mediated lipolysis through an AMPK-dependent pathway in C3H10T1/2 adipocytes:Roles of AMPK and PPARαin the lipolytic effect of kinsenoside[J]. Phytomedicine,2015,22(6):641-647.
[16]张锦文,唐菲,张小琼,等.高效液相色谱法测定金线莲中金线莲苷的含量[J].中国医院药学杂志,2011,31(4):261-263.
[17]万婷,熊富良.HPLC-ELSD 法测定金线莲提取物中金线莲苷[J].中成药,2014,36(7):1484-1488.
Content determination of kinsenoside in Jin-Xian-Lian
from threeAnoectochilusspecies by HPLC-ELSD
ZHANG Chao1,WU Jian-guo1,YI Jun2,WU Jin-zhong1,ZHENG Cheng-jian3,WU Yan-bin1,*
(1.Academy of Integrative Medicine,Fujian University of Traditional Chinese Medicine,Fuzhou 350122,China;2.Department of Chemistry and Life Science,Fujian institute of education,Fuzhou 350001,China;3.Department of Pharmacognosy,School of Pharmacy,Second Military Medical University,Shanghai 200433,China)
To establish a HPLC-ELSD method for determination of kinsenoside in Jin-Xian-Lian from threeAnoectochilusspecies,the HPLC system consisting of phenomenex NH2column(250 mm×4.6 mm,5 μm)and an isocratic elution system of acetonitrile-water(92∶8,V/V)as the mobile phase was adopted. The flow rate was set at 0.8 mL/min,the column temperature was room temperature,ELSD spray chamber temperature was 70 ℃,and the nitrogen flow rate was 1.5 L/min. The results indicated that the liner range of kinsenoside was 76.02~2432.64 μg/mL(r=0.9991);RSD of precision,stability and reproducibility tests were no more than 3%;average recovery rate was 97.55%(RSD=1.50%,n=6). The contents of kinsenoside in Jin-Xian-Lian from threeAnoectochilusspecies were in the range of 6.37%~22.66%,and the average content was 15.00%(RSD=26.29%). This method was quick,simple,accurate and reliable,and could be used to determine the content of kinsenoside in Jin-Xian-Lian.
Jin-Xian-Lian;kinsenoside;HPLC-ELSD
2016-07-05
张超(1991-),男,硕士研究生,研究方向:中药活性成分及品质评价研究,E-mail:zzcc4911@163.com。
*通讯作者:吴岩斌(1982-),男,硕士,助理研究员,研究方向:中药资源品质评价,E-mail:wxsq1@163.com。
国家自然科学基金资助项目(81603230);福州市科学技术局市校合作项目(2014-G-61);福建中医药大学校管-重点学科专项(X2014138学科)。
TS207.3
A
1002-0306(2017)02-0075-04
10.13386/j.issn1002-0306.2017.02.006

