单增李斯特菌的生长特性及其在冷藏牛奶中的预测模型
刘珊娜,赵 森,孙 涛,范志华,张陈云
(1.天津农学院食品科学与生物工程学院,天津 300384;2.天津市农副产品深加工技术工程中心,天津 300384)
单增李斯特菌的生长特性及其在冷藏牛奶中的预测模型
刘珊娜1,2,赵 森1,孙 涛1,范志华1,2,张陈云1,2
(1.天津农学院食品科学与生物工程学院,天津 300384;2.天津市农副产品深加工技术工程中心,天津 300384)
通过测定单增李斯特菌菌株在不同培养条件下菌液的OD600值,绘制生长曲线,分析培养基成分、温度、pH、NaCl浓度、接种量以及转速对单增李斯特菌生长的影响,并选取Gompertz方程、Logistic方程和Hill方程建立单增李斯特菌在冷藏牛奶中的生长模型。结果表明:菌株在TSB-YE和MRS培养基中生长良好;能够耐受0.5%~3%的NaCl浓度范围;最适生长温度为37 ℃,最适生长pH为8,对氧气的需求量表现不明显。菌株可在4 ℃冷藏的全脂牛奶中缓慢生长,达到稳定期的菌数有2 lg CFU/mL的增长,Gompertz和Logistic方程模型可用于预测其生长情况。
单增李斯特菌,牛奶,预测,生长曲线
单增李斯特菌(Listeriamonocytogenes,LM)是一种人畜共患食源性致病菌,可以使人畜患心肌炎、脑膜炎、早产、败血症等疾病,危害严重[1]。2015年就有报道美国蓝铃公司销售LM污染的冰激凌导致3人死亡[2]。我国宁夏地区2006~2013年LM污染率也高达18.38%[3]。LM广泛存在于自然界中,是食品中最常见的食源性病原菌[4],可污染的食品包括乳制品、肉制品、海产品及蔬菜制品等。由于LM能够耐受低温、低pH和高盐浓度[5],给食品的加工、运输和保藏等环节带来潜在风险。有效地控制食品中的LM已经成为食品安全的重要课题之一[6]。据报道,LM能够耐受巴氏消毒,对生鲜乳、巴氏杀菌乳等相关乳制品造成食用风险[7]。因此,研究LM在不同条件下的生长情况对保障食品安全十分必要。
预测微生物学用于描述和预测微生物在一定条件下的生长情况,对食品安全做出快速评估,目前已经应用于蔬菜、肉制品、水产品和乳制品等食品中[8]。张引成[9]、赵楠等人[10]也分别建立了LM在新鲜蔬菜和酱卤肉中的预测模型。本论文系统分析了一株LM在不同的培养基、pH、NaCl浓度、温度等条件下的生长情况,建立了LM在冷藏牛奶中的生长预测模型。对LM生长特性的认识将会为该菌的纯培养及实际防治提供参考依据,为评估食品安全带来积极的意义。
1 材料与方法
1.1 材料与仪器
菌株 单增李斯特菌CVCC1595,购于中国兽药监察中心;培养基 TSB-YE培养基、MRS培养基、TGE培养基、LB培养基,按文献进行配制[11-12];牛奶 市售全脂牛奶。
PHS-3C pH计 上海仪电科学仪器股份有限公司;722可见分光光度计 上海光谱仪器有限公司;LDZX-50KB立式压力蒸汽灭菌器 上海申安医疗器械厂;GHP-9160恒温培养箱 上海一恒科学仪器有限公司;TS-100B摇床 上海仪纯实业有限公司;NO-425-400E生物安全柜 天美(中国)科学仪器有限公司;SW-CJ-1FS超净工作台 苏州金大净化工程设备有限公司;5A2003电子天平 上海舜宇恒平科学仪器有限公司。
1.2 实验方法
1.2.1 菌株活化 用无菌接种环挑取4 ℃下保存的斜面菌种加入无菌的TSB-YE培养基试管中,置于37 ℃培养12 h后,用划线法接种于无菌的TSA-YE平板上,置于37 ℃过夜培养,挑取典型的单菌落接种于TSB-YE中,37 ℃下培养至菌液浓度达到108CFU/mL备用。
1.2.2 菌种接种量的选择 将活化的菌液做10倍梯度稀释,然后分别以105、104、103CFU/mL接种至TSB-YE液体培养基中,37 ℃恒温培养12 h,每2 h测定其OD600值绘制生长曲线。
1.2.3 培养基的选择 将活化的菌种以105CFU/mL分别接种于TSB-YE、MRS、TGE、LB四种液体培养基中,37 ℃恒温培养12 h,每2 h测定其OD600值绘制生长曲线。
1.2.4 培养温度的选择 将活化的菌种以104CFU/mL接种于TSB-YE液体培养基中,分别在25、30、35、37、40、45 ℃恒温培养12 h,每2 h测定其OD600值绘制生长曲线。
1.2.5 NaCl浓度的选择 将活化的菌种以104CFU/mL分别接种到0.5%~6% NaCl浓度的TSB-YE液体培养基中,置于37 ℃恒温箱中培养12 h,每2 h测定其OD600值绘制生长曲线。
1.2.6 pH的选择 将活化的菌种以104CFU/mL分别接种到pH4~10的TSB-YE液体培养基中,置于37 ℃恒温箱中培养12 h,每2 h测定其OD600值绘制生长曲线。
1.2.7 摇床转速(r)的选择 将活化的菌种以104CFU/mL接种于TSB-YE液体培养基中,分别于静置、100和200 r/min的转速在37 ℃摇床培养12 h,每2 h测定其OD600值绘制生长曲线。
1.2.8 冷藏牛奶中LM生长曲线的测定 将活化的菌种分别以102、103CFU/mL接种于全脂牛奶中,4 ℃静置培养15 d,每隔2 d取出试样,用平板计数法测定其菌落总数。
1.2.9 预测模型的建立 采用Gompertz方程、Logistic方程和Hill方程[13],建立相应的模型。其中上述三种方程的具体公式为:
Gompertz方程:N(t)=N0+a·exp[-exp(b-c·t)]
其中,t为时间,d;N(t)为t时的菌数,lg CFU/mL;N0为初始菌数,lg CFU/mL;a、b和c为待定系数。
Logistic方程:N(t)=N0+a/[1+exp(b-c·t)]
式中,t为时间,d;N(t)为t时的菌数,lg CFU/mL;N0为初始菌数,lg CFU/mL;a、b和c为待定系数。
Hill方程:N(t)=N0+a/[1+(t/b)c]
式中,t为时间,d;N(t)为t 时的菌数,lg CFU/mL;N0为初始菌数,lg CFU/mL;a、b和c为待定系数。
1.3 数据处理
实验数据采用SPSS进行处理和分析,通过MATLAB软件对上述三种模型进行拟合。
2 结果与分析
2.1 接种量的影响
如图1所示,105和104CFU/mL接种量在6 h后菌体数量达到稳定,而103CFU/mL接种量的菌液OD值在8 h后达到最大值。接种量的不同导致菌体生长速度的快慢,因此在食品加工或保藏中应注意控制初始带菌率。有关接种量对LM生长情况影响的研究有限,周小红等[14]研究也表明接种水平降低使菌种生长所需的延滞时间增加。
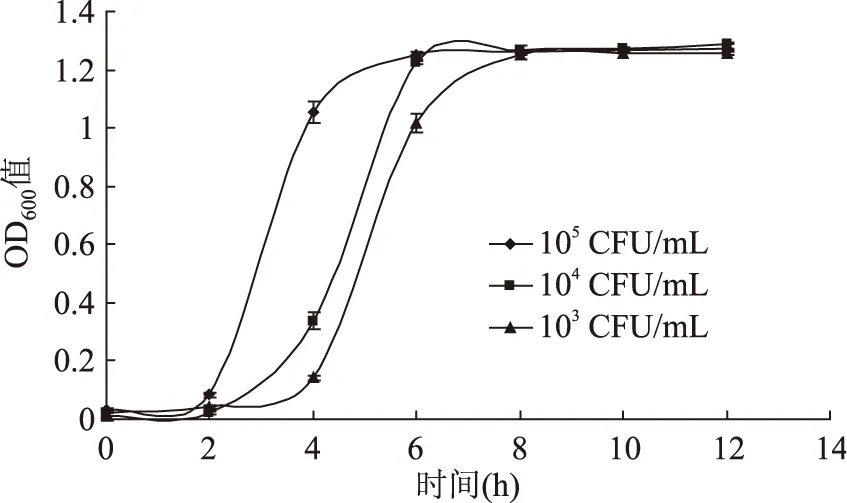
图1 LM在不同接种量下的生长曲线Fig.1 Growth curves of L. monocytogenes in different inoculation amounts
2.2 培养基对LM生长的影响
由图2可知,LB与TGE培养基中菌体的生长相对缓慢,达到稳定期后的OD值分别在0.6和1.0左右。而LM在TSB-YE与MRS培养基中的生长变化明显,到达稳定期的时间为6 h。说明LM的生长需要营养物质,这也和其易污染营养丰富的食品基质相吻合。考虑到配制简便性,研究中可选择TSB-YE培养基作为LM的基本培养基。
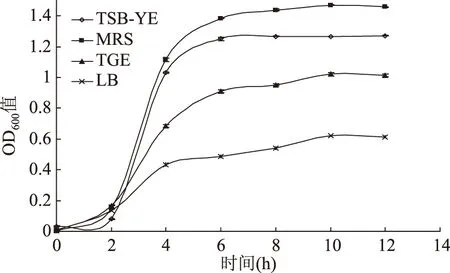
图2 LM在不同培养基中的生长曲线Fig.2 Growth curves of L. monocytogenes in different cultures
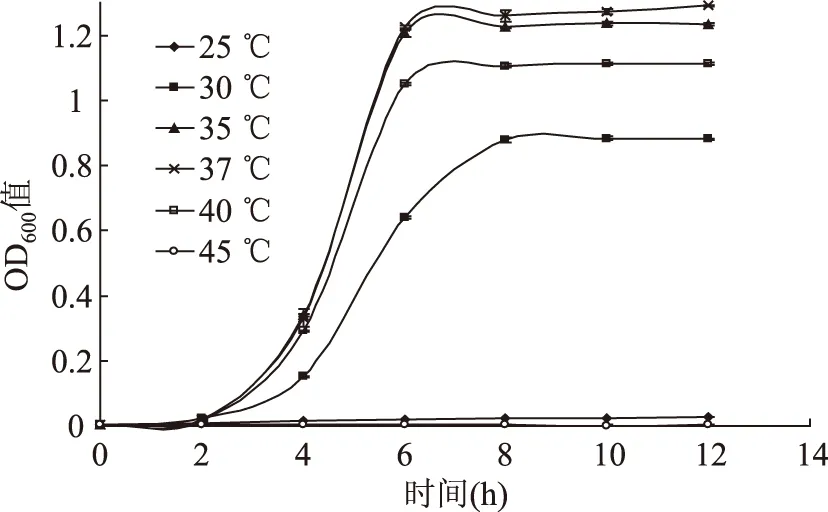
图3 LM在不同温度下的生长曲线Fig.3 Growth curves of L. monocytogenes at different temperatures
2.3 培养温度对LM生长的影响
为了抵抗外界热激作用,LM具有热休克应答机制,由细胞膜结构及胞内大分子参与,不同来源LM对温度适应性有所不同[15]。25 ℃时,菌液的OD600值变化很小;在30~40 ℃范围内,随着温度升高,菌体繁殖速度逐渐加快,在37 ℃时增至最大值;而随着温度的继续升高,菌体生长速度开始下降,至45 ℃时菌体生长处于延滞期。研究表明生长温度还依赖于pH,低pH的条件下,生长温度会上升[16]。根据LM对热的抵抗力较差,食品加工中提高处理温度或将加工时间控制在延滞期内能够有效预防污染。
2.4 NaCl浓度对LM生长的影响
LM对NaCl浓度具有一定耐受性,但在高盐浓度范围(3%~5%)生长会受到较大的抑制[17]。田霞等人[18]也发现LM对3%~6%的NaCl浓度特别敏感,7%浓度时开始缓慢死亡。当LM受到渗透压刺激时,引起细胞膨胀,膨胀压力会施加于细胞壁,引起细胞伸展及分裂,同时维持这种压力[15]。图4中,菌体的生长速度随着NaCl浓度的增加呈逐渐减缓的趋势。在0.5%~3%的NaCl浓度范围内,LM菌液在8 h内到达最大值,说明菌株能够耐受3%以下的盐浓度。但在4%~5%浓度范围内,LM菌液的OD600值达到极值所需时间在12 h左右,说明LM的生长受到一定程度抑制。而当NaCl浓度达到6%时,菌体数量增长明显放缓,说明高浓度的NaCl对LM抑制效果明显。一般食品加工中不控制NaCl浓度,给LM的生长提供了条件。
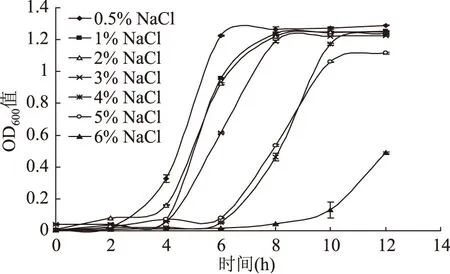
图4 LM在不同NaCl浓度下的生长曲线Fig.4 Growth curves of L. monocytogenes in different NaCl concentrations
2.5 pH对LM生长的影响
据报道,李斯特菌耐受的最低pH培养条件为4.3[19]。图5反映了最适生长pH在8左右,酸性环境较碱性环境更有利于控制菌体数量。刘洁等[20]就曾指出保加利亚乳杆菌和嗜热链球菌的发酵液在酸性条件下表现出对LM更好的抑菌效果。根据此特性,食品工业可采用有机酸或乳酸菌细菌素等作为该菌易污染食品的防腐剂。例如段效辉等[21]将乳酸应用于水产品中对LM起到了明显的抑制作用。陈晨等[22]将Nisin与柠檬酸复配用于控制鲜切黄瓜中LM的污染。对LM基因功能的研究表明,在pH=5的低酸性条件下,σB因子对其生长发挥重要的调控作用,与LM处于亚致死状态有关[23]。而加酸的处理方式导致LM亚致死损伤率很高[24]。本研究同样证实pH=5为LM的亚致死临界pH,当pH低于5时菌株生长趋于停止。
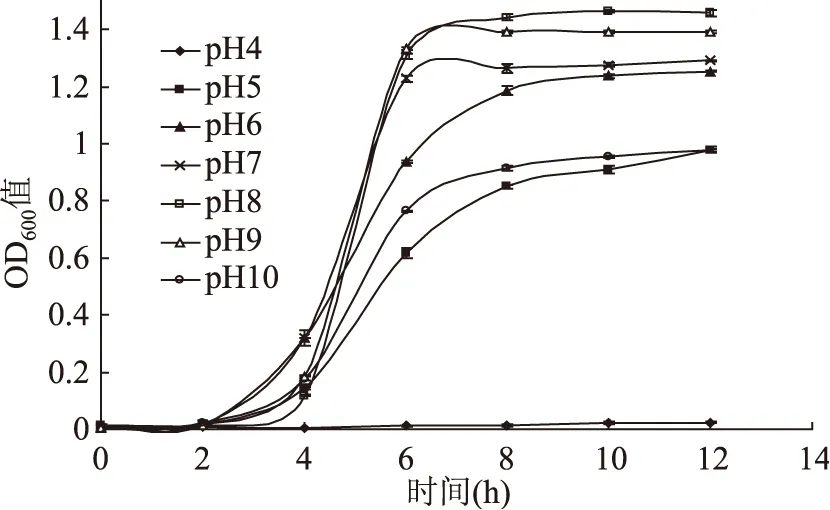
图5 LM在不同pH下的生长曲线Fig.5 Growth curves of L. monocytogenes at different pH values
2.6 摇床转速(r)对LM生长的影响
在不同的摇床转速下,LM菌株的生长延滞期几乎相同,转速对LM的生长影响不大,其对氧气的需求量没有严格的要求(图6)。而气调包装对LM生长影响的研究结果不同[25],表明氧气是作为一种非限定性因素与其他条件共同作用于菌体的生长。
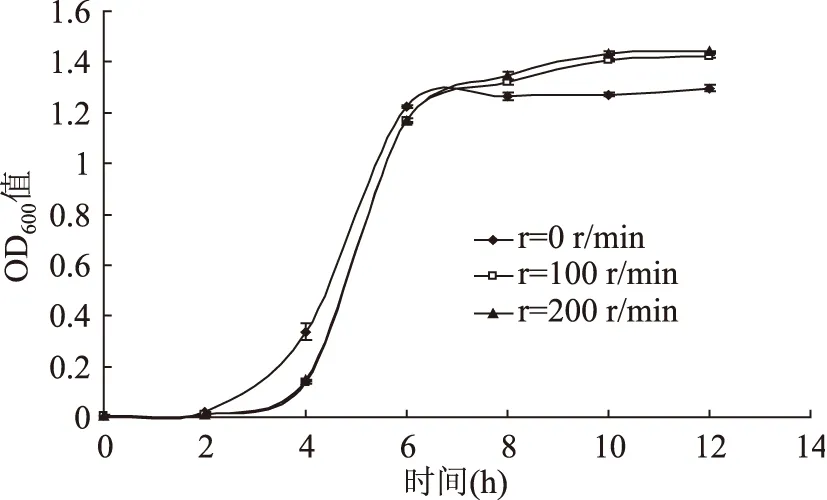
图6 LM在不同摇床转速下的生长曲线Fig.6 Growth curves of L. monocytogenes at different rotation rates

表1 LM在冷藏牛奶中的生长预测模型参数Table 1 Parameters of predicting growth models for L. monocytogenes in refrigerated milk
2.7 LM在冷藏牛奶中的生长情况
李斯特菌耐低温,在4 ℃的环境中仍可生长繁殖,极易污染食品而引起食物中毒和李斯特菌病暴发[26],且危险性随着食品冷藏时间的延长而增大[27]。乳制品不但营养丰富,水分含量高,且pH接近中性,利于微生物生长繁殖。赵金海等人[8]通过建立预测模型证实低温储存的原料乳的总菌数与嗜冷菌相关。但预测微生物学在原料乳中的研究主要集中在金黄色葡萄球菌,其他病原微生物的研究较少[28]。因此本研究将LM接种于全脂牛奶中,观察其在4 ℃的生长并考察三种模型的拟合情况。由图7可知,以102CFU/mL比例接种的LM在经过5 d左右的延滞期后,达到稳定期的菌落对数值为4.51 lg CFU/mL。当接种量为103CFU/mL时,延滞期也为5 d左右,达到稳定后菌落对数值为5.64 lg CFU/mL。丁甜等[29]选用Gompertz模型对LM在营养肉汤中的生长情况进行拟合,在初始150 h内几乎无菌体生长,与本结果相近。即使是在冷藏环境,LM的菌数在营养丰富的乳制品中增长数量约2 lg CFU/mL。因此冷藏食品中LM污染的风险很高,为保证食用安全应尽量缩短储藏时间或加热处理后食用。通过拟合得到的Gompertz模型和Logistic模型的相关系数R2>0.99,而Hill方程未获得拟合曲线(表1)。因此,Gompertz模型和Logistic模型可用于预测LM在乳制品中的生长情况。邱红玲等人[30]就曾采用修正的Gompertz模型建立了复原乳中LM的生长动力学模型。
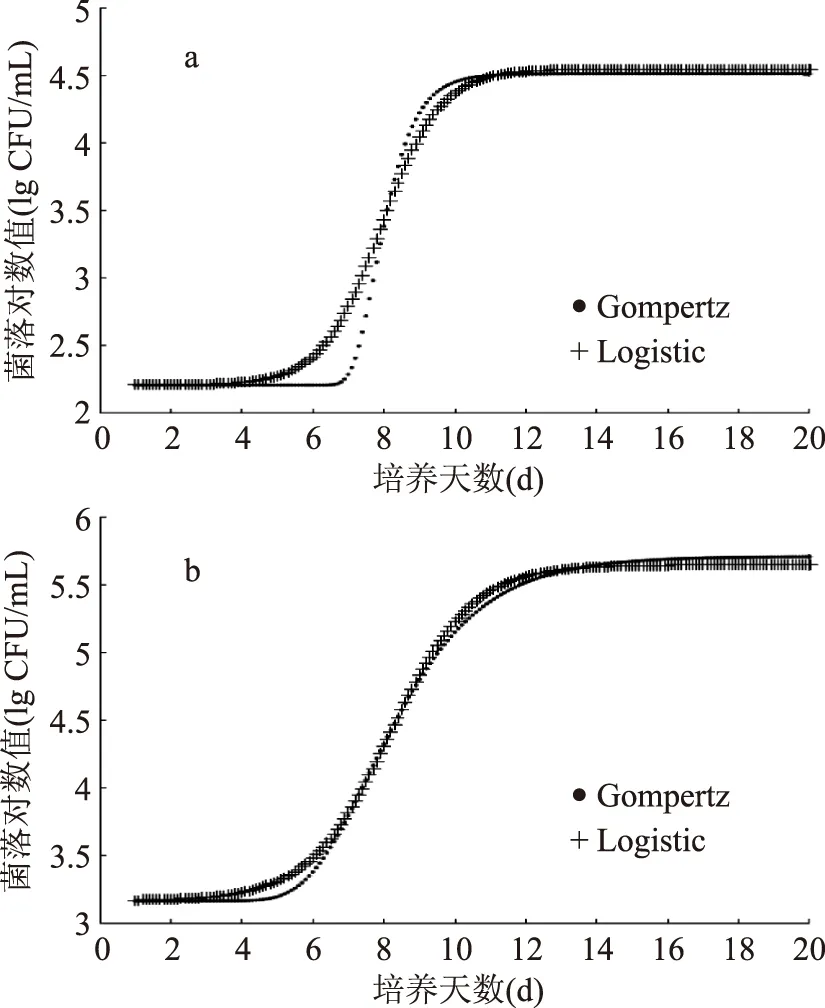
图7 LM在冷藏牛奶中的生长曲线Fig.7 Growth curves of L. monocytogenes in refrigerated milk 注:a的初始接种量为102 CFU/mL,b的初始接种量为103 CFU/mL。
3 结论
系统分析了LM在不同条件下的生长情况,LM适宜生长在TSB-YE和MRS培养基中;生长延滞期随接种量的减少而增加,可在30~40 ℃的范围内生长,最适生长温度为37 ℃;对NaCl有一定的耐受性,能够在0.5%~3%的NaCl浓度范围内生长;LM菌株的最适生长pH在8左右,酸性环境有利于控制菌体数量;对氧气的需求量不明显。LM可在4 ℃储藏的全脂牛奶中缓慢生长,并在13 d左右菌数增加2 lg CFU/mL,利用Gompertz模型和Logistic模型能够模拟其生长情况。LM生长特性的作用机制及不同因素间协同作用的影响仍需进一步研究与探索,为防治其在食品中的污染提供思路。
[1]Orsi R H,den Bakker H C,Wiedmann M.Listeriamonocytogeneslineages:genomics,evolution,ecology,and phenotypic characteristics[J]. International Journal of Medical Microbiology,2011,301(2):79-96.
[2]崔海英,周慧,宋方平,等. 丁香精油对单核细胞增生性李斯特菌的抗菌性能及杀菌机制研究[J]. 中国食品添加剂,2015(12):65-69.
[3]魏琼,沈梅,刘翔,等. 宁夏地区2006-2013年食品中食源性致病菌监测结果分析[J]. 医学动物防制,2016,32(1):31-34.
[4]Doganay M. Listeriosis:clinical presentation[J]. FEMS Immunology & Medical Microbiology,2003,35(3):173-175.
[5]闫冰,李一松,霍贵成,等. 食品中单核细胞增多李斯特菌的快速检测[J]. 食品工业科技,2006,27(10):202-205.
[6]郭桂萍,葛红梅,王匀,等. 单增李斯特菌检测技术研究进展[J]. 中国食物与营养,2011,17(3):12-15.
[7]兰欣怡,李发弟,王加启,等. 生鲜乳中单核细胞增生李斯特菌的研究进展[J]. 食品科学,2014,35(19):318-323.
[8]赵金海,段楠,常存,等. 预测微生物学在低温储存原料乳中的应用[J]. 食品研究与开发,2015,36(23):170-173.
[9]张引成. 单增李斯特菌在鲜切结球莴苣中生长和抑菌预测模型的建立[D]. 南京:南京农业大学,2012.
[10]赵楠,许晓曦,刘洋,等. 酱卤肉中沙门氏菌和单核细胞增生李斯特菌生长特性及预测模型建立[J]. 食品科学,2016,37(1):120-125.
[11]李丽. 乳酸片球菌素抑菌机理研究[D]. 天津:天津大学,2009.
[12]王培培. 乳酸片球菌素16S rRNA基因和片球菌素基因的克隆及序列分析[D]. 天津:天津大学,2007.
[13]邹宇,胡立明,胡文忠,等. 单增李斯特菌在牛奶中生长曲线的拟合和预测模型的建立[J]. 食品工业科技,2014,35(11):69-73.
[14]周小红,李学英,杨宪时,等. 接种量对单增李斯特菌生长期及生长界面的影响[J]. 食品工业科技,2014,35(18):180-184.
[15]古丽孜帕·夏热浦汗. 不同来源产单核细胞李斯特菌株对不同环境因子的抗性研究[D]. 石河子:石河子大学,2015.
[16]Valero A,Carrasco E,Pérez-Rodriguez F,et al. Growth/no growth model of Listeria monocytogenes,as a function of temperature,pH,citric acid and ascorbic acid[J]. European Food Research & Technology,2006,224(1):91-100.
[17]邵美丽,许岩,赵燕丽,等. 一多重耐药单增李斯特菌株的生长特性及毒力分析[J]. 微生物学杂志,2011,31(2):24-28.
[18]田霞,李远钊,张培正,等. 即食菜卷和肉汤中单增李斯特菌生长模型及控制研究[J]. 食品与发酵工业,2005,31(10):68-71.
[19]Phan-Thanh L,Mahouin F,Aligé S. Acid response of Listeria monocytogenes[J]. International Journal of Food Microbiology,2000,55(1-3):121-126.
[20]刘洁,史贤明. 两种乳酸菌及其发酵液对单核细胞增生李斯特菌生长的抑制作用[J]. 上海交通大学:农业科学版,2006,24(3):221-225.
[21]段效辉,许红岩,刘宁,等. 水产品中单核细胞增生李斯特氏菌的乳酸控制研究[J]. 食品研究与开发,2013(23):130-133.
[22]陈晨,胡文忠,何煜波,等. Nisin和柠檬酸对纯培养及鲜切黄瓜中单增李斯特菌的杀菌效果[J]. 食品工业科技,2014,35(5):273-276.
[23]王旭,孙晓红,潘迎捷,等. 单增李斯特菌WaX12及其sigB缺失突变株在不同pH下生长动力学的比较[J]. 食品与生物技术学报,2016(5):477-484.
[24]宣晓婷,丁甜,刘东红. 食品中亚致死损伤单增李斯特菌的研究进展[J]. 食品科学,2015,36(3):280-284.
[25]刘柳,孔保华. 温度及气调包装对冷却猪肉中单核细胞增生性李斯特菌生长的影响[J]. 食品科学,2008,29(1):334-337.
[26]Mead P S,Dunne E F,Graves L,et al. Nationwide outbreak of Listeriosis due to contaminated meat[J]. Epidemiology & Infection,2006,134(4):744-751.
[27]黄韵. 冷鲜肉中单增李斯特菌活菌分子检测技术研究[D]. 广州:华南理工大学,2014.
[28]张亚红,王娉,杨海荣,等. 预测微生物学在乳及乳制品中的应用[J]. 检验检疫学刊,2015,25(6):62-65.
[29]丁甜,董庆利,王璐,等. 单增李斯特菌在营养肉汤中最大比生长速率的预测模型[J]. 华中农业大学学报,2010,29(4):522-526.
[30]邱红玲,唐晓阳,王李伟,等. 复原乳中三种常见致病菌的生长动力学模型构建[J]. 上海预防医学,2016(5):288-293.
Growth properties ofListeriamonocytogenesand predicting models in refrigerated milk
LIU Shan-na1,2,ZHAO Sen1,SUN Tao1,FAN Zhi-hua1,2,ZHANG Chen-yun1,2
(1.College of Food Science and Bioengineering,Tianjin Agricultural University,Tianjin 300384,China;2.Tianjin Engineering and Technology Research Center of Agricultural Products Processing,Tianjin 300384,China)
Listeriamonocytogenesgrowth was evaluated by determining OD600value and analyzing growth curves of strain in different conditions including culture ingredients,temperatures,pH values,NaCl concentrations,inoculation amounts and rotation rates. The Gompertz,Logistic and Hill models were used to establish the growth models ofL.monocytogenesin refrigerated milk. Results showed that the strain was grown well in TSB-YE and MRS medium and tolerant with 0.5%~3% NaCl concentrations. The optimal temperature was 37 ℃ and the optimal pH value was about 8 for growth. The oxygen demanding was not obvious for this strain. Cells were grown slowly in whole-fat milk at 4 ℃ with 2 lg CFU/mL increasing after attaining stationary phase,which Gompertz and Logistic models could be used in prediction ofL.monocytogenesgrowth.
Listeriamonocytogenes;milk;prediction;growth curve
2016-06-28
刘珊娜(1984-),女,博士,讲师,研究方向:食品微生物,E-mail:lsn_nxy@aliyun.com。
国家自然科学基金青年项目(31501583)。
TS201.3
A
1002-0306(2017)02-0187-05
10.13386/j.issn1002-0306.2017.02.027

