鲁梅克斯叶蛋白的抗氧化肽活性及功能性质研究
李延琪,徐永清,苗 宇,蔡振学,周 晶,董佳敏,姚树宽,赵巧芩,李凤兰,*,胡宝忠,2,*
(1.东北农业大学生命科学学院,黑龙江哈尔滨 150030;2.哈尔滨学院,黑龙江哈尔滨 150086)
鲁梅克斯叶蛋白的抗氧化肽活性及功能性质研究
李延琪1,徐永清1,苗 宇1,蔡振学1,周 晶1,董佳敏1,姚树宽1,赵巧芩1,李凤兰1,*,胡宝忠1,2,*
(1.东北农业大学生命科学学院,黑龙江哈尔滨 150030;2.哈尔滨学院,黑龙江哈尔滨 150086)

鲁梅克斯,叶蛋白,抗氧化肽,功能性质
叶蛋白(leaves protein concentration,简称LPC)是指从植物的青嫩茎叶中提取,经榨汁、絮凝、干燥等工艺提取的一种富含蛋白质的浓缩物,属“功能性蛋白质”[1]。食用叶蛋白,可减少动物蛋白的食用量,减少因饱和脂肪酸、胆固醇摄入量过多带来的肥胖、动脉粥样硬化等疾病。谢正军等研究表明,叶蛋白经过酶解,可形成2到几十个氨基酸残基的肽段,这些肽段具有抗氧化的功效,可抑制生物大分子过氧化或者清除体内的多种自由基,故被称为抗氧化肽[2]。一般地,获得抗氧化肽有3种途径:从天然生物体中提取,水解蛋白产生或化学、酶法、重组DNA技术合成;但是受生产成本、技术难度、化学残留等多种因素影响,以酶法水解获得抗氧化肽的较多[3]。目前研究中,从动物胶原蛋白[4]、小麦胚[5]、花生[6]、大豆[7]、松仁[8]、螺旋藻[9]、苜蓿[1-2]中获取抗氧化肽的研究已有报道,但是从鲁梅克斯获取抗氧化肽的研究较少。
鲁梅克斯为蓼科(Polygonaceae)酸模属(RumexL.),属多年生宿根草本植物,营养丰富,蛋白质含量较高,同时还含有丰富的胡萝卜素和维生素及多种矿物质,既可作为牧草,又可作为蔬菜或食品加工原料[10]。本文研究对象为俄罗斯引种鲁梅克斯(Щавель Чемпион,冠军酸模),经本课题组研究证明,该品种鲁梅克斯干物质中蛋白质含量为18%~20%,相比以往国内品种K-1杂交酸模,其蛋白质含量高、植株矮化,耐寒耐盐碱性强;单宁含量低,仅为0.01%左右;一年可刈割3~4次,是一种极具开发价值的植物蛋白资源[11]。
1 材料与方法
1.1 材料与仪器
鲁梅克斯 俄罗斯引种,东北农业大学实验基地提供;Protein Marker 北京全式金生物技术有限公司;胰蛋白酶(3000u/mg)、胃蛋白酶(500u/mg) 北京博奥拓达科技有限公司;3500 ku透析袋 北京索莱宝科技有限公司;金龙鱼大豆油 益海嘉里哈尔滨粮油食品工业有限公司;其他试剂 均为国产分析纯。
DYY-8C 型垂直电泳仪 北京六一仪器厂;TS-A型脱色摇床 江苏金城国胜实验仪器厂;HWS28型电热恒温水浴锅、DHG-9053A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;UVmini-1240紫外可见分光光度计 岛津制作所;精密pH计 上海般特仪器有限公司;JYL-C012九阳料理机 九阳股份有限公司;sartorius分析天平 北京赛多利斯天平有限公司;飞鸽牌TDL-5台式离心机 上海安亭科学仪器厂;超声波清洗器 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 叶蛋白提取及分子量确定 依据王峰所提供的碱热法提取叶蛋白的相关工艺,并在此基础上进行优化,确定鲁梅克斯叶蛋白的提取工艺如下[12]:称取叶簇期新鲜鲁梅克斯叶片100 g,洗净切段,按1∶5的比例加入0.4% NaCl溶液搅碎制成匀浆;将匀浆以40 KHz的超声波处理30 min,促进叶蛋白的溶解,再用4层200目滤布过滤除去残渣;将滤液pH调为10,60 ℃恒温水浴30 min,使得叶蛋白充分絮凝沉淀;5000 r/min离心10 min,弃上清,将沉淀置于60 ℃恒温干燥箱中烘干至恒重。
根据王忠英所提供的叶蛋白分子量确定方法[13],进行SDS-PAGE电泳。根据电泳图,将蛋白Marker分子量的对数(lgMr)与相对迁移率(mR)进行线性回归;再以样品蛋白的mR计算其分子量。其中,相对迁移率(mR)=蛋白质样品迁移距离(cm)/染料迁移距离(cm)。
1.2.2 叶蛋白抗氧化肽活性分析
1.2.2.1 抗氧化肽的制备 配制0.6 mg/mL的叶蛋白50 mL 2份,将其90 ℃水浴处理10 min,25 ℃ 40 KHz超声30 min,促进叶蛋白的溶解,透析袋透析脱盐24 h,将叶蛋白按酶/底物为5000 u/g的比例分别加入胰蛋白酶和胃蛋白酶,37 ℃水浴加热处理2 h。胰蛋白酶处理的叶蛋白溶液pH为8.0,胃蛋白酶处理的叶蛋白溶液pH为1.8。2 h后,3000 r/min离心5 min,取上清液,将其在60 ℃烘干,制成粉末[3-4,8]。

1.2.3 叶蛋白功能性质分析 溶解性、持水性、持油性、乳化性及发泡性常被用作衡量蛋白功能性质的指标。实验中,分别配制2%、2%、2%、0.4%、5%的叶蛋白溶液,用于探究外界条件对鲁梅克斯叶蛋白的溶解性、持水性、持油性、乳化性及发泡性的影响。探究条件分别是:温度为4、20、40、60、80 ℃,pH为2、4、6、8、10,NaCl离子浓度为0%、1%、2%、3%、4%、5%。但由于持油性受pH和NaCl浓度的影响较小,在此只探究温度对其影响。其中,溶解性、持水性、乳化性依据姜传京所提供的方法进行测定[18],持油性、发泡性根据吕巧枝所提供的方法进行测定[19]。
1.2.4 数据统计分析方法 叶蛋白酶解物的抗氧化性与叶蛋白的功能性质相关数据运用SPSS软件进行方差分析和独立样本T-test。
2 结果与分析
2.1 叶蛋白提取及分子量确定
本研究采用改良丙酮提取法从鲁梅克斯叶片中提取了叶蛋白,对其进行SDS-PAGE电泳,结果如图1所示,由结果看出可以获得3个不同分子量的蛋白质条带。
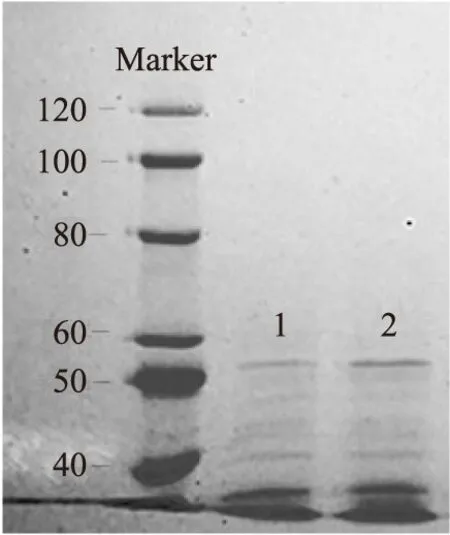
图1 叶蛋白SDS-PAGEFig.1 SDS-PAGE of leaf protein注:图1中从左至右,第1泳道为蛋白Marker(≤120 ku),第2、3泳道为样品蛋白。
根据标准蛋白lgMr-MR进行线性回归,如图2所示,可确定样品蛋白3条条带对应的蛋白分子量分别为36.47、40.54、54.10 ku。谢正军关于苜蓿叶蛋白SDS-PAGE已证明,核酮糖-1,5-二磷酸羧化酶的大亚基为苜蓿叶蛋白组分,其分子量为50~55 ku,占叶蛋白的27.31%[2]。因此,推测鲁梅克斯叶蛋白中分子量为54.10 ku蛋白分子为核酮糖-1,5-二磷酸羧化酶大亚基,而分子量为36.47、40.54 ku的蛋白组分应为叶绿体内基质蛋白或细胞质蛋白的混合物。

图2 标准蛋白lgMr-MR线性回归Fig.2 lgMr-MR linear regression of standard protein
2.2 叶蛋白抗氧化肽活性分析
2.2.1 叶蛋白抗氧化肽的还原力 还原力是衡量抗氧化物质提供电子能力的重要指标,抗氧化物质可通过提供电子使自由基变为稳定的物质,用以中断自由基的连锁反应。如图3所示,胰蛋白酶酶解肽的还原力显著高于胃蛋白酶酶解肽的还原力;且自肽浓度为0.5 mg/mL起,胰蛋白酶酶解肽还原力显著高于胃蛋白酶酶解肽的还原力(p<0.01),并且胰蛋白酶酶解肽呈持续显著增长趋势(p<0.01);但在肽浓度为1.5 mg/mL到2.0 mg/mL时,胃蛋白酶酶解肽还原力的增长幅度不显著(p>0.05),而胰蛋白酶酶解肽的还原力依然显著增长(p<0.01)。当肽浓度达到2.5 mg/mL时,胰蛋白酶酶解肽的还原力已达到胃蛋白酶酶解肽的4.5倍左右。

图3 叶蛋白酶解物的还原力Fig.3 The reducing power of leaf protein hydrolysates注:同一样品、不同浓度下的不同大、小写字母表示差异极显著(p<0.01)、显著(p<0.05);不同样品、相同浓度下的“**”表示差异极显著(p<0.01),“*”表示差异显著(p<0.05);图4~图7同。
2.2.2 叶蛋白抗氧化肽对DPPH·的清除能力 DPPH·(1,1-二苯-苦肼基),是为数不多的即使在室温条件下也能保持稳定的自由基,被广泛应用于天然有机化合物和植物提取物的抗氧化活性的考察与评价[20]。如图4所示,2种叶蛋白酶解肽自肽浓度从2 mg/mL起,随着肽浓度的升高,其对DPPH·的清除能力都呈显著增强的趋势(p<0.01)。在肽浓度为1~8 mg/mL的范围内,胰蛋白酶酶解肽对DPPH·的清除能力要显著高于胃蛋白酶酶解肽(p<0.05);当肽浓度升至15 mg/mL时,胃蛋白酶酶解肽对DPPH·的抑制率则超过了胰蛋白酶酶解肽,此时两种肽对DPPH·的抑制率均能达到80%,但二者差异不显著(p>0.05)。两种肽对DPPH·的半抑制浓度,胰蛋白酶酶解肽为4 mg/mL左右,而胃蛋白酶酶解肽则需8 mg/mL左右。
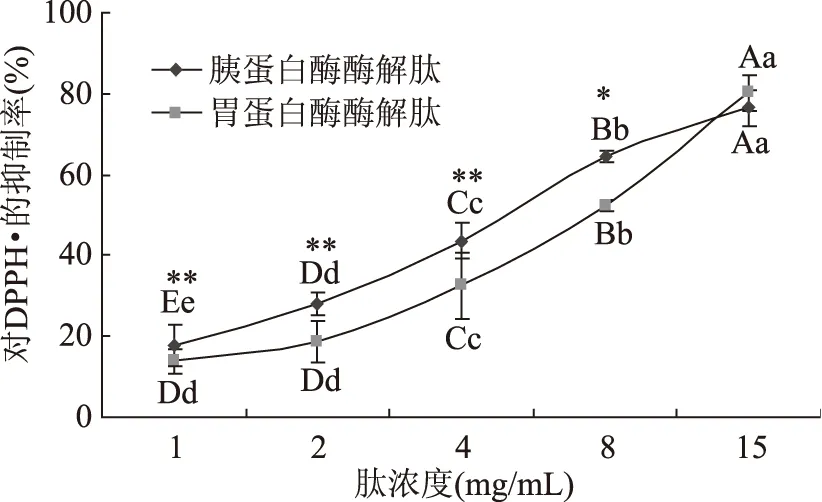
图4 叶蛋白酶解物对DPPH·的清除能力Fig.4 The scavenging ability of leafprotein hydrolysates for DPPH·

图5 叶蛋白酶解物对的清除能力Fig.5 The scavenging ability of
2.2.4 叶蛋白抗氧化肽对·OH的清除能力 ·OH是生命活动的代谢过程所产生的最活泼、氧化能力最强的自由基,几乎可与所有的生物大分子发生反应,其进攻性极强,速率常数极高,对机体造成的危害也极大。如图6所示,两种叶蛋白酶酶解肽随着肽浓度的升高,对·OH的清除率都呈逐渐增强的趋势,体现出一定的量效关系。当肽浓度为4 mg/mL以下时,两种肽对·OH的清除效果差异不显著(p<0.05);而当肽浓度升至8 mg/mL时,胰蛋白酶酶解肽的清除能力则显著高于胃蛋白酶酶解肽(p<0.01)。肽浓度为15 mg/mL时,胃蛋白酶酶解肽对·OH的清除率只有29.68%,而胰蛋白酶酶解肽则为46.34%,约是前者的1.5倍多。
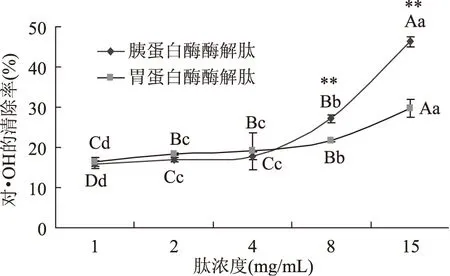
图6 叶蛋白酶解物对·OH的清除能力Fig.6 The scavenging ability of leaf protein hydrolysates for ·OH

图7 叶蛋白酶解物对Fe2+的螯合能力Fig.7 The chelating ability of leaf protein hydrolysates for Fe2+
2.3 叶蛋白功能性质分析
2.3.1 叶蛋白的溶解性 温度、pH、氯化钠浓度对鲁梅克斯叶蛋白的溶解性会产生一定影响。温度对叶蛋白溶解性的影响如图8a所示,当温度在4~80 ℃的范围内,叶蛋白的溶解性随着温度的升高呈缓慢上升的趋势,这是由于结构十分紧密的蛋白质在加热处理时因发生解离和伸展,导致原来掩蔽在内部的肤链和极性侧键转向表面外露,从而改进了蛋白质的水化能力。在80 ℃时溶解性达到最大,为46.30%。

图8 温度、pH和NaCl浓度对叶蛋白溶解性的影响Fig.8 Effect of temperature,pH and NaCl concentration on the solubility of leaf protein 注:a.温度对叶蛋白溶解性的影响;b.pH对叶蛋白溶解性的影响;c.NaCl浓度对叶蛋白溶解性的影响。不同大写字母表示差异极显著(p<0.01),不同小写字母表示差异显著(p<0.05),图9~图12同。
如图8b所示,pH对叶蛋白的溶解度呈先降低后升高的趋势。当pH为6.0时,处于叶蛋白的等电点附近,蛋白质呈兼性离子状态,缺乏静电排斥作用,疏水相互作用导致蛋白质的聚集和沉淀,溶解性最小。当pH从6.0到10.0和从6.0到2.0,叶蛋白的溶解性明显增加,说明在远离等电点的偏碱性和偏酸性环境中具有较大的溶解性。
如图8c所示,在氯化钠浓度为0~5%的范围内,叶蛋白溶解性随氯化钠浓度的增大呈逐渐减小的趋势,因为在高盐浓度时,水盐间相互作用大于水与蛋白质间的作用,蛋白质脱水产生“盐析”,从而导致蛋白的溶解性降低。
2.3.2 叶蛋白的持水性 温度、pH、氯化钠浓度对鲁梅克斯叶蛋白的持水性会产生一定影响,其结果如图9所示。其中温度的影响如图9a所示,可见在温度为4~40 ℃范围内,叶蛋白的持水能力显著增加,特别是温度从20 ℃升至40 ℃过程中,持水性增长幅度显著(p<0.05),40 ℃时达到最高值,为5.23 g/g;之后,随温度持续升高,持水能力又逐渐下降,但其趋势平缓,差异不显著(p>0.05)。此现象是由于适当的提升温度可使结构致密的蛋白质因加热而发生解离、伸展,使原来隐蔽的肽键和极性侧链暴露到表面上来,因而提高了持水能力;而随温度的持续升高持水性呈现下降的趋势,则因为过高的温度致使蛋白质的氢键作用和离子基团水合作用减弱,导致蛋白质结合水的能力随之下降。
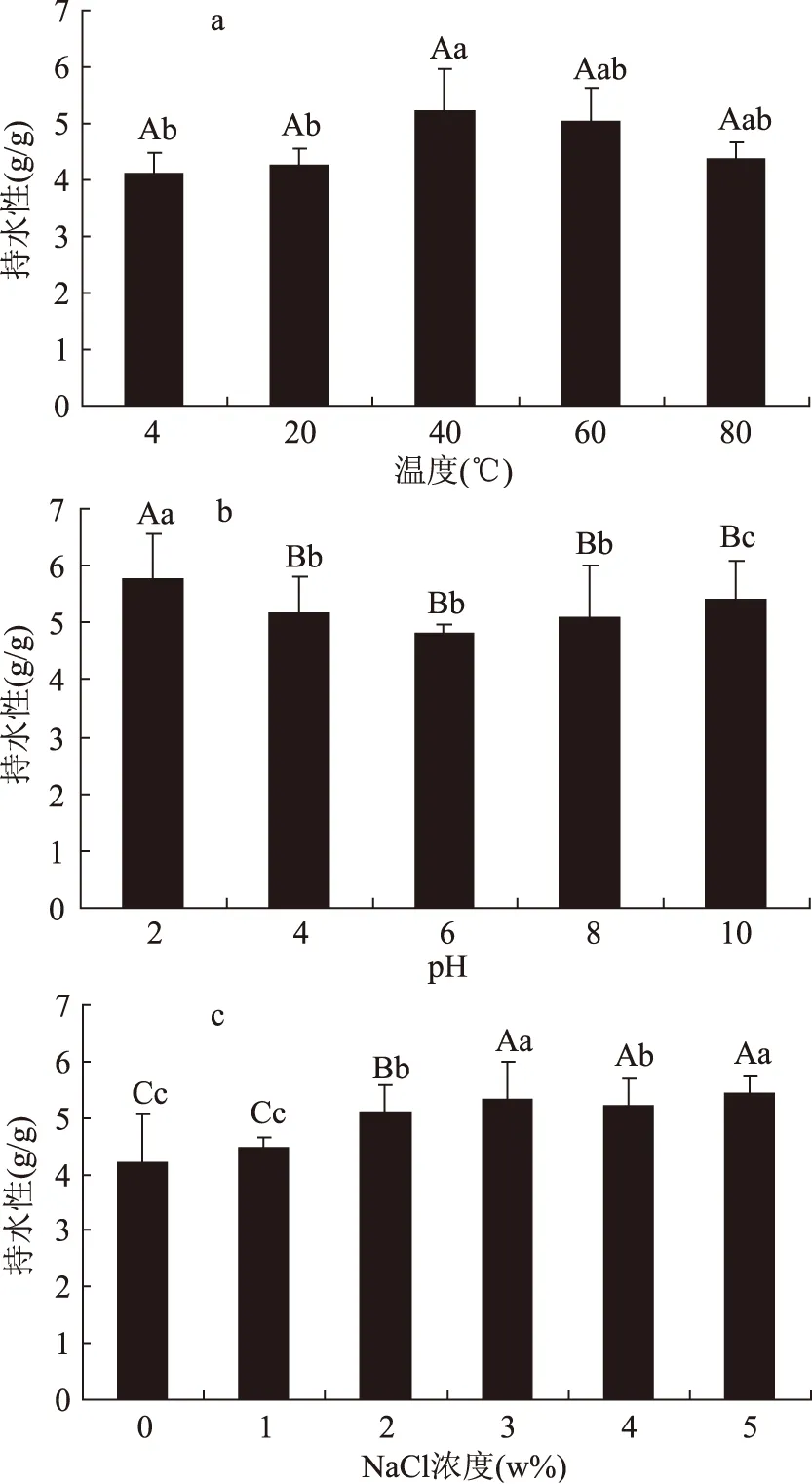
图9 温度、pH和NaCl浓度对叶蛋白持水性的影响Fig.9 Effect of temperature,pH and NaCl concentration on the water binding capacity of leaf protein注a.温度对叶蛋白持水性的影响;b.pH对叶蛋白持水性的影响;c.NaCl浓度对叶蛋白持水性的影响。
如图9b所示,在pH为6.0附近,叶蛋白的持水能力最低,远离等电点的偏酸性和偏碱性环境中持水能力逐渐变大,这是由于等电点pH时蛋白质与蛋白质间的相互作用增强,致使蛋白质与水的相互作用弱化,因此蛋白质呈现出最低的水合作用。当pH高于或低于等电点时,由于净电荷和排斥力的增加,导致蛋白质膨胀、结合水增多。
如图9c所示,NaCl 浓度在0~2%范围内,蛋白质的持水力随盐浓度增加呈上升趋势,当 NaCl 浓度大于2%之后,蛋白质的持水性趋于平稳。因为水、盐和蛋白质侧链基团之间产生竞争性结合,低盐浓度时,蛋白质水化作用较强,高盐浓度时,水盐的相互作用大于水与蛋白质的相互作用;鲁梅克斯叶蛋白在NaCl浓度大于2%时,水与蛋白质的相互作用弱于水与盐的相互作用叶蛋白形成高度聚合的微观结构,持水性达到最大水平。
2.3.3 叶蛋白的持油性 叶蛋白的持油性主要受温度影响,其结果如图10所示。从4 ℃到80 ℃的升温过程中,叶蛋白的持油性逐渐升高。其原因在于随温度的升高,叶蛋白发生变性,蛋白质分子逐渐解离、伸展,肽链伸展后与加热处理的油中小分子结合,从而增强了叶蛋白的持油性。
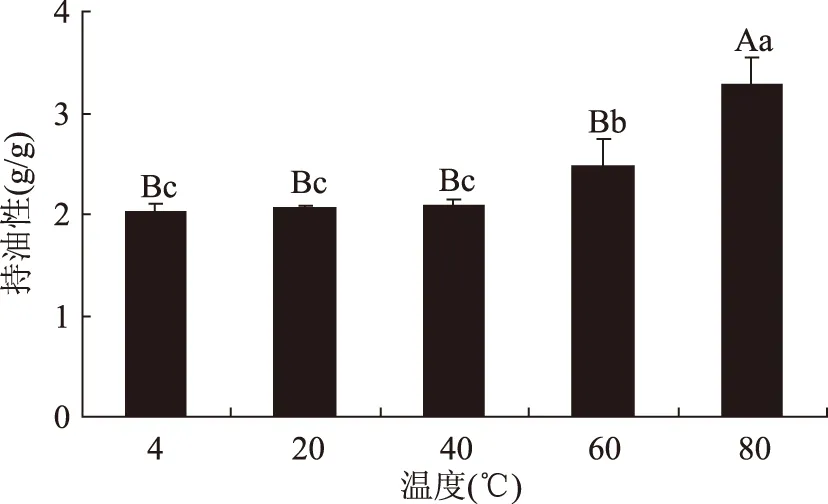
图10 温度对叶蛋白持油性的影响Fig.10 Effect of temperature on the oil binding of leaf protein
2.3.4 叶蛋白的乳化性 鲁梅克斯叶蛋白的乳化性可受温度、pH、氯化钠浓度的影响。温度对叶蛋白溶解性的影响如图11a所示,可见4~40 ℃之间,叶蛋白的乳化性基本维持不变;但在40 ℃ 升至 60 ℃时,随着温度的升高,叶蛋白的乳化性升高;在60~80 ℃之间,乳化性又随之减小。这是由于在 40~80 ℃之间,随着温度的升高,蛋白质的溶解度和伸展程度增加,蛋白质之间的排斥力减小,油滴容易吸附在蛋白质界面上,从而提高了蛋白质的乳化能力。而持续加热能降低吸附在界面上的蛋白质膜的粘度和硬度,因而乳化性及其稳定性降低,而40 ℃以下温度对油滴与蛋白质界面的吸附力影响不大。

图11 温度、pH和NaCl浓度对叶蛋白乳化性的影响Fig.11 Effect of temperature,pH and NaCl concentration on the emulsifying properties of leaf protein注a.温度对叶蛋白乳化性的影响;b.pH对叶蛋白乳化性的影响;c.NaCl浓度对叶蛋白乳化性的影响。
如图11b所示,在pH为2~10的范围内,叶蛋白的乳化性大致呈逐渐升高的趋势。在pH为6降至2时,随着pH的降低,蛋白质发生变性、聚集,使蛋白质分子疏水性/亲水性比值降低,与油表面的结合减少,影响了蛋白质的乳化性。同时蛋白质分子的柔韧性降低,不能在界面迅速展开,影响了叶蛋白的乳化性。在pH为6~10的范围内,随pH升高,叶蛋白发生羧基去质子化,电荷排布改变,有利于乳化性的提高。
如图11c所示,NaCl浓度在0~5%范围内,叶蛋白的乳化性先增大后减小,NaCl浓度为2%时乳化性最大。其原因是由于低盐浓度时蛋白质发生了“盐溶”现象,在盐溶过程中,叶蛋白分子所带的静电荷增加,蛋白质之间的排斥力减小,充分发挥了它的表面活性作用,油滴更容易吸附在蛋白质界面上;而高盐浓度时则相反。
2.3.5 叶蛋白的发泡性 温度、pH、氯化钠浓度可对叶蛋白的发泡性造成影响,其结果如图12所示。其中,温度对叶蛋白发泡性的影响如图12a所示,可见在温度为4~80 ℃的范围内,发泡性大致呈逐渐下降的趋势,这是因为持续的高温加热,会导致空气膨胀,薄膜黏度降低,气泡破裂、泡沫解体,降低发泡能力。

图12 温度、pH和NaCl浓度对叶蛋白发泡性的影响Fig.12 Effect of temperature,pH and NaCl concentration on foaminess of the leaf protein注:a.温度对叶蛋白发泡性的影响;b.pH对叶蛋白发泡性的影响;c.NaCl浓度对叶蛋白发泡性的影响。
如图12b所示,叶蛋白发泡性与溶解性密切相关,在pH2~6时,随着pH的升高,叶蛋白质溶解性下降,发泡力也下降;pH为6时,在鲁梅克斯叶蛋白的等电点附近,溶解度最低,发泡力也就最低。当pH在6~10范围内变化时,随着pH升高,溶解度增加,发泡力也明显提高。
如图12c所示,NaCl浓度在0~2.0%范围内时,叶蛋白发泡能力持续增强,浓度为2.0%时,发泡能力最强;NaCl浓度高于2.0%时,发泡力略下降,之后浓度在3.0~5.0%水平时,发泡能力基本处于稳定状态。这是因为当NaCl浓度较低时,溶解的蛋白质较少,仍有部分蛋白质以固体状态存在,这时液体经过高速搅拌,生成固、液、气三相泡沫,而固体和液膜的接触面适中,则可吸附在界面上,阻止气泡粗化,故发泡力有增加趋势;当NaCl浓度逐渐增加,发泡力随之增加,但NaCl浓度超过一定值后,溶解的蛋白质增加而使溶液中以固体形式存在的蛋白质减少,不能形成三相泡沫,故发泡力降低,直至一个相对平衡的状态。
3 结论
3.1 鲁梅克斯叶蛋白含有3种不同分子量的蛋白质,其中分子量为54.10 ku的蛋白应为核酮糖-1,5-二磷酸羧化酶大亚基,而分子量为36.47、40.54 ku的蛋白应为叶绿体基质蛋白或细胞质中的蛋白混合物。
3.3 叶蛋白的功能性质研究表明,鲁梅克斯叶蛋白具有较高的持水性(不同条件下均大于4 g/g)和发泡性(最高可达45%),二者受温度、pH和NaCl浓度的影响较小;而溶解性、持油性和乳化性受温度、pH和NaCl浓度影响,表现出规律性差异,存在一定幅度上的波动。
因此,以上研究证明,鲁梅克斯叶蛋白酶解物具有一定的抗氧化效果,食用鲁梅克斯叶蛋白经体内消化酶解后可有效清除体内的自由基,减少自由基带来的氧化损伤。依据鲁梅克斯叶蛋白的功能性质,可将叶蛋白进一步加工,使其在食品和医药保健领域得到更为充分的利用。
[1]张艺,李忠. 植物叶蛋白的开发应用[J]. 食品研究与开发,2004(5):103.
[2]谢正军. 苜蓿叶蛋白和酶法制备抗氧化肽的研究[D].无锡:江南大学,2009:68.
[3]刘洪对.五种花生抗氧化肽体外抗氧化活性比较[J].核农学报,2013,27(8):1162-1167.
[4]陈日春.鲢鱼鱼麟胶原蛋白肽的制备及其抗氧化活性的研究[D].福州:福建农林大学,2013(41):52-64.
[5]陈英,朱科学,彭伟,等.小麦胚活性肽体外抗氧化活性研究[J].中国油脂,2010,35(12):17-19.
[6]刘建超,孙荣欣,刘飏. 花生肽体外抗氧化活性的研究[J]. 三门峡职业技术学院学报,2010(4):112-114.
[7]刘文颖,谷瑞增,鲁军,等.大豆低聚肽的成分分析及体外抗氧化作用[J].食品工业,2015(4):200-203.
[8]綦蕾,王振宇.红松松仁抗氧化肽的制备及体外抗氧化活性评价[J].食品与发酵工业,2010,36(7):78-82.
[9]欧贇,乔燕燕,王维有,等.螺旋藻抗氧化肽的制备及其体外活性研究[J].食品与生物技术学报,2014,33(1):22-26.
[10]石定燧,熊军功,陈学迅,等.高产优质饲料作物-鲁梅克斯K-1[J].新疆农业大学学报,1996,19(4):54-56.
[11]赫兰保,徐永清,李凤兰,等. 盐胁迫对鲁梅克斯杂交酸模种子萌发及幼苗生理特性的影响[J]. 草业科学,2015(3):400-405.
[12]王峰.紫花苜蓿叶蛋白四种提取工艺比较研究[D].北京:北京林业大学,2005:14-15.
[13]王忠英. 茶叶中蛋白的提取及理化性质的研究[D].杭州:浙江工商大学,2006:51-54.
[14]Yen G C,Chen,H Y. Antioxidant activity of various tea extracts in relation to their antimutagenicity[J]. Journal of Agricultural and Food Chemistry,1995,43(1):27-32.
[15]乔璐.桑叶蛋白的提取与应用研究[D].金华:浙江师范大学,2014:47-48.
[16]李斌,李元甦,孟宪军,等.北五味子藤茎三萜抗氧化活性研究[J].食品工业科技,2002,33(3):122-123,128.
[17]王莉娟.大豆肽的制备及体内外抗氧化活性研究[D].无锡:江南大学,2008:10.
[18]姜传京.红萍叶蛋白提取及营养价值评价研究[D].福州:福建农林大学,2011:46-48.
[19]吕巧枝.甘薯叶可溶性蛋白的提取工艺及功能特性研究[D].北京:中国农业科学院,2007:33-35.
[20]荣建华,李小定,谢笔钧.大豆肽体外抗氧化效果的研究[J].食品科学,2002,23(11):118-120.
Study on antioxidant peptide activity and functional properties ofRumexleaf protein
LI Yan-qi1,XU Yong-qing1,MIAO Yu1,CAI Zhen-xue1,ZHOU Jing1,DONG Jia-min1,YAO Shu-kuan1,ZHAO Qiao-qin1,LI Feng-lan1,*,HU Bao-zhong1,2,*
(1.Northeast Agricultural University,College of Life Sciences,Harbin 150030,China;2.Harbin University,Harbin 150086,China)
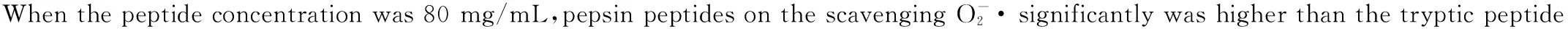
Rumex;leaf protein;antioxidant peptides;functional properties
2016-06-28
李延琪(1991-),男,硕士研究生,研究方向:生物工程,E-mail:ptfwyf@163.com。
*通讯作者:李凤兰(1973-),女,副教授,研究方向:植物学,E-mail:lifenglan@neau.edu.cn。 胡宝忠(1962-),男,教授,研究方向:植物学,E-mail:bzhu@neau.edu.cn。
国家国际科技合作项目(2013DFR30270);国家基础科学人才培养基金资助项目(J1210069)。
TS255.1
A
1002-0306(2017)02-0104-07
10.13386/j.issn1002-0306.2017.02.011

