恩诺沙星诱导施氏鲟药物性肝损伤模型的建立及复方中草药保肝作用研究
栾学斌,王荻,刘红柏
(1.南京农业大学无锡渔业学院,江苏无锡214081;2.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070)
恩诺沙星诱导施氏鲟药物性肝损伤模型的建立及复方中草药保肝作用研究
栾学斌1、2,王荻2,刘红柏1、2
(1.南京农业大学无锡渔业学院,江苏无锡214081;2.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070)
为探究复方中草药对施氏鲟Acipenser schrenckii药物性肝损伤的保护作用,通过建立恩诺沙星肝损伤模型,在水温 (15.5±1)℃下对3组自组中草药复方的保肝作用进行了筛选比较研究,试验设5组,对空白对照组及模型对照组1+龄施氏鲟以每天2%体质量投喂基础饲料,对3组复方中草药组施氏鲟投喂相应中草药药饵,试验进行至第11天时,复方中草药组及模型对照组分别口灌160 mg/kg(体质量)恩诺沙星,连续10 d,空白对照组以等量双蒸水代替,口灌期间各组仍按原方式继续投喂 (基础饲料或药饵),试验结束后,测定各组血清中与肝损伤相关的活性物质含量及酶活性,并观察肝组织病理变化情况。结果表明:与空白对照组相比,模型对照组供试鲟血清中T-AOC能力显著下降 (P<0.05),T-SOD活力极显著下降 (P<0.01),ALT、AST活力和MDA含量极显著上升 (P<0.01),肝组织切片显示,器质性病变明显,肝损伤建模成功;3组复方中草药均可升高供试鲟血清中T-SOD活力、T-AOC能力,降低MDA含量和AST、ALT活力;供试鲟血清生化指标同其肝组织病理变化趋势相吻合。研究表明,3组复方中草药均能有效减轻恩诺沙星致施氏鲟肝细胞损伤,并对肝细胞恢复起到积极作用,尤其复方三中草药效果明显。
施氏鲟;中草药;肝损伤;恩诺沙星
施氏鲟Acipenser schrenckii隶属于鲟科Acipenseridae、鲟属 Acipenser,主要分布于中国黑龙江流域[1-2],凭借其生长速度快、抗病力强、经济价值高等优势,已成为中国备受欢迎的养殖鱼品种[3-4]。然而,病害频发及养殖业者科学用药知识匮乏,导致生产实践中抗菌药物的盲目使用。恩诺沙星作为广谱抗菌、渗透性强的第三代喹诺酮类代表药物,在水生动物养殖过程中的应用极其广泛[5-6]。赵蕾等[6]、郭娇娇等[7]研究表明,恩诺沙星的不当使用可导致银鲫 Carassius auratus gibelio、鲟等鱼类肝损伤。肝脏是鱼体内最大的实质性器官,参与鱼体分泌、消化、解毒和免疫等多种生命活动[8]。鱼类经胃肠吸收的物质几乎全部进入肝脏,并于其内部进行分解、转化、合成和贮存,大幅度提高了肝脏受有毒物质感染及损伤的机率[9-10]。
中草药用于防治哺乳类动物肝脏疾病的历史悠久[11],而应用于水产动物方面的研究则起步较晚,目前仍处于摸索阶段。研究表明,部分中草药及其提取物对水产动物的肝脏具有保护作用。有报道指出,当归Angelica sinensis[11]、枸杞Lycium chinense[12]、大黄Rheum officinale Baill[13]等中草药提取物及部分中草药复方[14]对建鲤Cyprinus carpio var. Jian、团头鲂Megalobrama amblycephala Yih等水产动物的肝脏也具有较好的保护作用。但施氏鲟药物性肝损伤及适用于施氏鲟肝损伤修复的中草药组方的筛选研究仍未见报道。
本试验中,首先摸索出恩诺沙星诱导供试鲟肝损伤的最适用药时间及剂量,然后对供试鲟连续投喂拌饲中草药药饵,再加以口灌恩诺沙星,通过测定供试鲟血清中肝损伤相关的活性物质含量及酶活性,以及观察鲟肝组织病理变化情况,评价复方中草药对施氏鲟药物性肝损伤的保护作用,旨在为施氏鲟提供保肝中草药组方以及为中草药方剂在施氏鲟养殖中的科学应用奠定基础。
1 材料与方法
1.1 材料
试验供试鲟购自中国水产科学研究院鲟鱼繁育技术工程中心,为1+龄非免疫施氏鲟,体质量为(100±2)g,饲养于室内圆形水泥池 (半径为1 m)中,以充分曝气的地下水为水源,水温为(15.5±1)℃。
试验用中药饮片购自哈尔滨宝丰药店;盐酸恩诺沙星购自浙江国邦药业有限公司,批准文号浙兽药字 (2003)X087212;总超氧化物歧化酶 (TSOD)、总抗氧化能力 (T-AOC)、丙二醛(MDA)、谷草转氨酶 (AST)、谷丙转氨酶(ALT)、总蛋白 (TP)测定试剂盒均购自南京建成生物工程研究所;伊红、苏木精染色液购自珠海贝索生物技术有限公司;无水乙醇 (分析纯)、二甲苯(分析纯)购自天津市永大化学试剂有限公司。
1.2 方法
1.2.1 恩诺沙星药液的制备 准确称取盐酸恩诺沙星,参照李绍戊等[15]的方法配制成50 g/L恩诺沙星药液,避光保存备用。
1.2.2 中草药药饵的制备 中草药组方及每千克供试鲟给药量如表1所示。按配比称取3组复方中草药,参照李超等[16]的方法制得水煎剂,待其常温冷却后,按比例加入到基础饲料中搅拌均匀,置阴凉通风处晾干,制得药饵。

表1 中草药组方及给药量Tab.1 Ingredient and dose of the Chinese herbal medicines uesd in the experiment
1.2.3 药物性肝损伤模型的构建 参照赵蕾等[6]的方法,取部分供试鲟随机分为4组,每组30尾鲟。试验组分别按40、80、160 mg/kg(体质量,下同)剂量口灌恩诺沙星,连续10 d,对照组口灌等体积双蒸水 (0 mg/kg)。于试验开始后第5、7、10天,按照孙裔雷等[17]的方法取供试鲟血清及肝组织,测定血清中ALT、AST活力及TP含量,同时参照白洁[18]的方法,制作肝组织病理切片并进行H.E染色。
1.2.4 复方中草药保肝试验 将供试鲟随机分为空白对照组、模型对照组和3组复方中草药组(复方一、复方二、复方三),每组30尾鲟。停饲24 h后,空白对照组及模型对照组按每天2%体质量投喂基础饲料,3组复方中草药组投喂相应药饵,连续投喂20 d。期间于第11天,按预试验建模所得的最适损伤剂量对复方中草药组及模型对照组连续口灌恩诺沙星10 d(空白对照组以等量双蒸水代替)。试验结束后,分别从各组随机取供试鲟5尾,按照试剂盒说明书步骤,测定其血清中ALT、AST、T-SOD活力、TP、MDA含量和 TAOC能力,制作肝组织病理切片并进行H.E染色。
1.3 数据处理
试验数据用平均值±标准差表示。采用SPSS 21软件进行单因素方差分析 (One-Way ANOVA)。
2 结果与分析
2.1 恩诺沙星药物性肝损伤模型的建立
2.1.1 恩诺沙星对施氏鲟血清中ALT、AST活力及TP含量的影响 从图1可见:与对照组 (0 mg/kg)相比,以160 mg/kg剂量连续口灌恩诺沙星7~10 d可导致鲟血清ALT、AST活力极显著升高 (P<0.01),连续口灌10 d后可导致TP含量极显著降低 (P<0.01);以80 mg/kg剂量连续口灌5 d可导致鲟血清TP含量显著降低 (P<0.05),连续口灌10 d后可导致 ALT、AST活力显著升高(P<0.05)、TP含量极显著降低 (P<0.01);以40 mg/kg剂量连续口灌10 d可导致鲟血清ALT活力极显著升高 (P<0.01)、AST活力显著升高 (P<0.05)。

图1 恩诺沙星对施氏鲟血清中ALT、AST活力和TP含量的影响Fig.1 Effect of enrofloxacin on the activities of serum ALT and AST and total protein(TP)content in Amur sturgeon Acipenser schrenckii
2.1.2 恩诺沙星对施氏鲟肝组织病理变化的影响
图2为连续口灌恩诺沙星10 d各组供试鲟肝脏组织病理切片。从图2可见:0 mg/kg对照组肝细胞具有完整的肝索,肝细胞排列紧密,核近圆形,胞质饱满,组织致密 (图2-B);80 mg/kg组虽偶有血细胞浸润,但数量少、程度轻,与0 mg/kg对照组差异不明显 (图2-E);160 mg/kg组肝细胞结构稀疏,肝细胞索结构紊乱,同时伴有炎性细胞浸润及细胞核固缩 (图2-H),与0 mg/kg对照组差异明显。
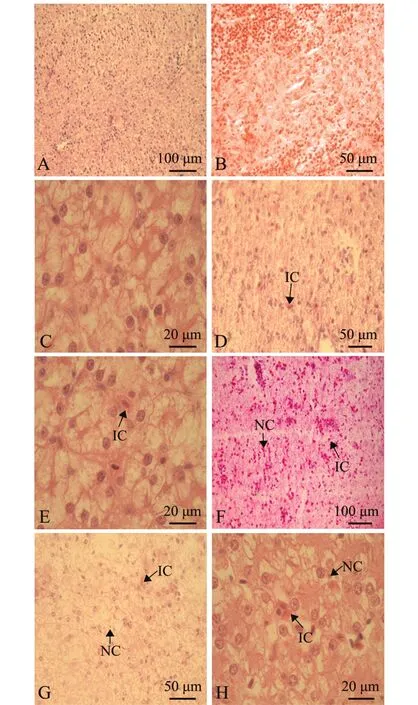
图2 剂量筛选试验中鲟肝脏组织结构观察Fig.2 Histological observation of the liver of Amur sturgeon Acipenser schrenckiiin the dose sereening experiment
综上所述,模型对照组按160 mg/kg剂量连续口灌恩诺沙星10 d,供试鲟血清中ALT、AST活力上升及TP含量降低,且其肝组织出现显著器质性损伤,恩诺沙星致施氏鲟肝损伤模型建立成功。
2.2 复方中草药预防肝损伤
2.2.1 复方中草药对施氏鲟血清中T-SOD活力、T-AOC能力和MDA含量的影响 从图3可见:与空白对照组相比,模型对照组以160 mg/kg剂量口灌恩诺沙星10 d,可导致T-SOD活力极显著降低(P<0.01)、T-AOC能力显著降低 (P<0.05)、MDA含量极显著升高 (P<0.01);与模型对照组相比,3组复方中草药均可导致T-SOD活力、TAOC能力不同程度的升高,且均对T-SOD活力影响极显著 (P<0.01),复方二、复方三对T-AOC能力影响极显著 (P<0.01),3组复方中草药均可导致MDA含量显著或极显著降低 (P<0.05或P<0.01)。
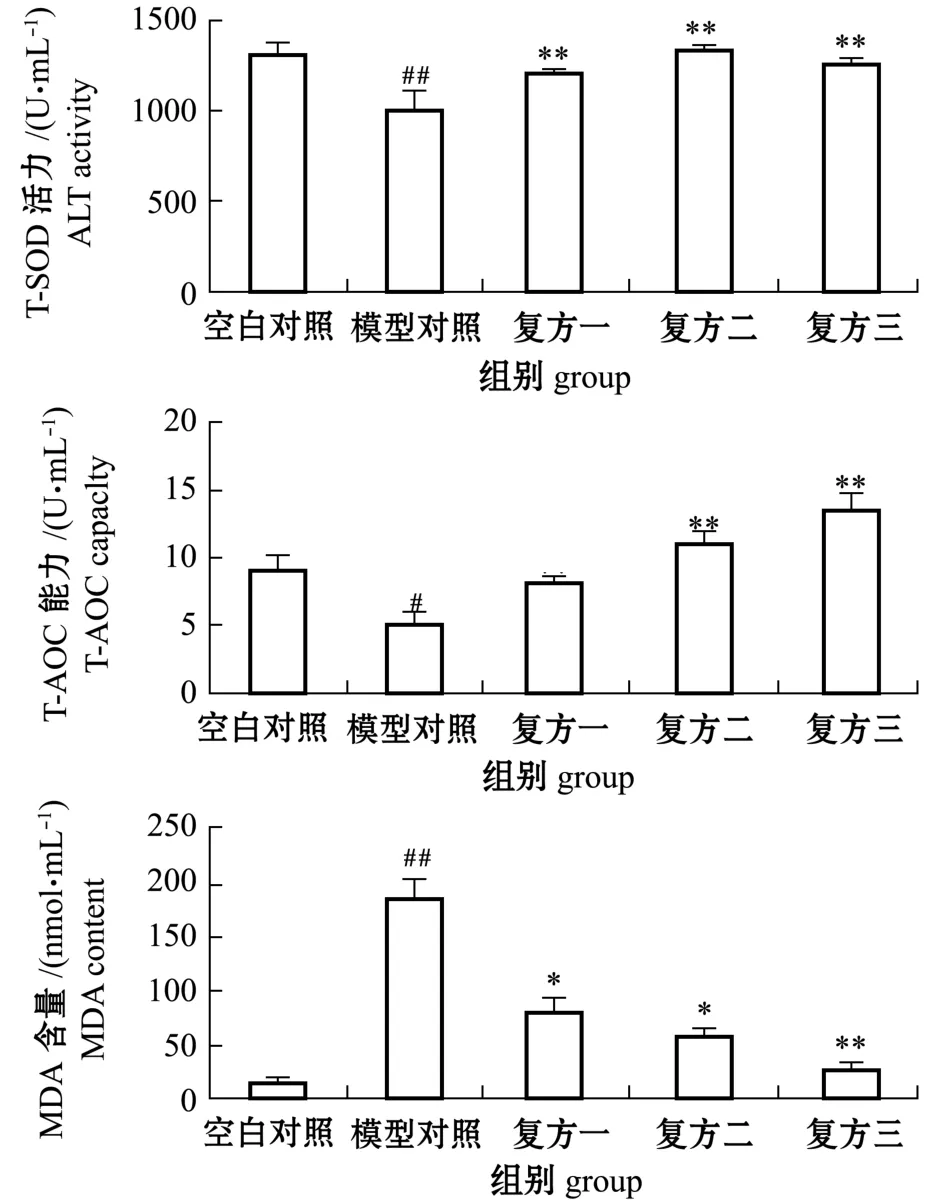
图3 复方中草药对恩诺沙星致肝损伤的施氏鲟血清中T-SOD、T-AOC和MDA含量的影响Fig.3 Effect of Chinese herb medicines on the activities of serum T-SOD and T-AOC and MDA content in hepatic injury Amur sturgeon Acipenser schrenckii
2.2.2 复方中草药对施氏鲟血清中AST、ALT活力的影响 从图4可见:与空白对照组相比,模型对照组以160 mg/kg剂量口灌恩诺沙星10 d,可导致AST、ALT活力极显著升高 (P<0.01);与模型对照组相比,3组复方中草药均可导致AST、ALT活力不同程度的降低,复方二、复方三对AST活力影响极显著 (P<0.01),对ALT活力影响显著(P<0.05)。

图4 复方中草药对恩诺沙星致肝损伤的施氏鲟血清中AST及ALT活性的影响Fig.4 Effect of Chinese herb medicines on the activities of AST and ALT in hepatic injury Amur sturgeon Acipenser schrenckii
2.2.3 复方中草药对施氏鲟肝组织病理变化的影响 从图5可见:空白对照组鲟肝细胞组织致密、结构清晰,肝细胞结构及形态正常,细胞核大而圆,核边界清晰,未见细胞肿胀及坏死;模型对照组鲟肝细胞存在炎性细胞浸润、细胞核固缩等现象,且高倍镜下观察发现,肝细胞出现内灶状坏死、变形,另有部分肝细胞萎缩凋亡;与模型对照组相比,3组复方中草药组鲟肝细胞结构均有不同程度的改善,细胞核边界清晰,细胞空泡化程度减轻、无大片内灶状坏死,偶有炎性细胞浸润,其中以复方三效果最明显。
3 讨论
3.1 恩诺沙星致施氏鲟肝损伤模型的建立
恩诺沙星广泛应用于水产动物的病害防治,具有较好的抑菌杀菌效果,但其代谢缓慢、半衰期长,且施药后于水产动物肝脏中含量高、停滞期长[19-21]。Orman等[22]研究表明,恩诺沙星于肝脏内部的主要代谢产物在医学临床上可诱发肝损伤。相关研究亦表明,恩诺沙星在杀灭细菌的同时促进了大肠杆菌释放内毒素[23],内毒素通过血液传递于肝组织,破坏肝脏细胞及线粒体,损害肝功能[24]。血浆蛋白质由肝细胞合成与分泌,肝细胞损伤削弱其合成蛋白质的能力,降低释放于血液中的TP含量[25];此外,肝脏病变可导致其生物膜通透性变大,释放出大量如AST、ALT等包浆酶,使血液中酶活力升高[26],故血液中TP含量、AST、ALT活力成为衡量机体肝损伤程度的常用指标[27]。Suk等[28]研究表明,氧自由基损伤是药物性、内毒素性肝损伤的关键机制,血清中T-SOD活力、T-AOC能力和MDA含量可反映机体内氧自由基含量及代谢速率,间接表明机体肝损伤情况。本试验结果显示,以80、160 mg/kg剂量的恩诺沙星口灌施氏鲟10 d,均可导致鲟血清中ALT、AST活力极显著升高及TP含量极显著降低;同时,160 mg/kg剂量可使鲟肝脏形成器质性损伤,破坏肝细胞结构及功能,故本试验最终确定以160 mg/kg剂量对供试鲟连续口灌10 d恩诺沙星,建立肝损伤模型。
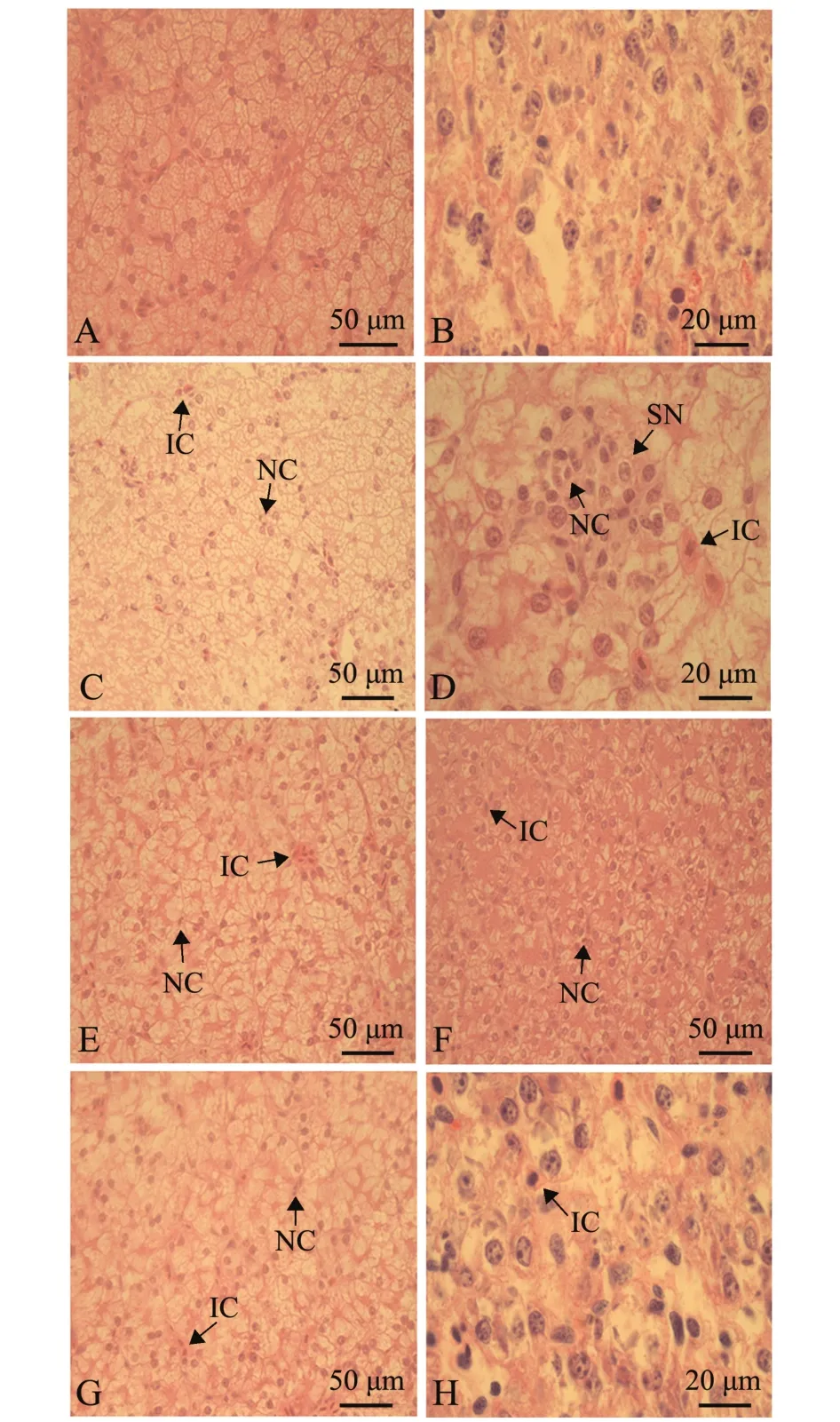
图5 保肝试验中鲟肝脏组织结构观察Fig.5 Histological observation of the liver of Amur sturgeon Acipenser schrenckii in the protection experiment
3.2 复方中草药对施氏鲟肝损伤的保护作用
T-AOC是机体抗氧化和清除自由基能力的总和[17],可间接反映机体自由基代谢状态[29]。SOD广泛存在于动物机体内,是一种重要的氧自由基清除剂,SOD通过催化O-2·歧化为氧和过氧化氢,减少机体内过高浓度的超氧阴离子自由基,提高机体免疫能力、保护细胞免受氧自由基毒害[30]。因此,T-AOC能力与T-SOD活力常被同时作为衡量机体抗氧化和清除氧自由基能力的指标。此外,具有强生物毒性的MDA为脂质过氧化反应链式终止阶段产生的小分子产物[31],是被普遍认可的能反映氧自由基产生及引发脂质过氧化反应的间接指标,其含量可以间接反映机体组织细胞的脂质过氧化程度及氧自由基的产生情况[32]。本试验结果显示,3组复方中草药均可导致供试鲟血清中T-SOD活力及T-AOC能力升高、MDA含量降低。究其原因,可能是3组复方中草药含有的黄芩、甘草等药材可以抑制机体对恩诺沙星的吸收,加速恩诺沙星的清除,同时提高机体清除自由基酶的活性,避免自由基引起脂质过氧化反应,保护肝细胞免受损伤,此结果同李素婷等[33]的研究结果相吻合。
生物体细胞膜含多种由不饱和脂肪酸构成的脂质,而脂肪酸可同氧自由基发生氧化反应,改变细胞膜结构,降低细胞膜流动性,引发细胞膜蛋白变性[32]。当肝细胞膜因脂质过氧化反应而功能受损、结构破坏时,细胞内的ALT、AST等会释放入血液[34],所以可通过检测血清中ALT、AST的活力判断药物治疗肝损伤的效果[35]。本试验结果显示, 3组复方中草药均可导致供试鲟血清中ALT、AST活力降低,究其原因,可能是3组复方中草药中含有的甘草、黄芩等药材提高了供试鲟肝脏线粒体呼吸链复合体酶活性,并通过清除机体内氧自由基来降低线粒体膜脂质过氧化,减少线粒体肿胀度,恢复了线粒体结构和功能的完整性[36-37]。相比较而言,AST的变化幅度更加明显,可能是由于ALT大多位于细胞浆中,AST多位于线粒体、少部分位于细胞浆,而甘草、黄芩等对线粒体细胞膜的修复及细胞器功能的恢复更加有效[36-37]。此外,供试鲟血清生化指标变化趋势,同供试鲟肝组织病理变化基本吻合。
4 结语
为探究复方中草药对恩诺沙星致施氏鲟肝损伤的保护作用,本试验中首先摸索出恩诺沙星诱导施氏鲟肝损伤的最佳剂量及采样时间分别为160 mg/kg、10 d,然后阶段性投喂中草药药饵,并辅以口灌恩诺沙星构建肝损伤模型。结果显示,3组复方中草药均能有效调动供试鲟机体免疫相关酶活性、清除机体超氧阴离子自由基,以减轻药物对鲟肝细胞的损伤,并对肝组织结构及功能的恢复起到积极作用,尤其复方三中草药效果最为显著,可作为保护鲟药物性肝损伤的中草药组方加以深入研究。
[1] Wei Qiwei,Ke Fuen,Zhang Jueming,et al.Biology,fisheries,and conservation of sturgeons and paddlefish in China[J].Environmental Biology of Fishes,1997,48(1-4):241-255.
[2] Zhuang P,Kynard B,Zhang L,et al.Overview of biology and aquaculture of Amur sturgeon(Acipenser schrenckii)in China[J].Journal of Applied Ichthyology,2002,18(4-6):659-664.
[3] 孙裔雷,王荻,刘红柏.复方中草药对施氏鲟非特异性免疫功能的影响[J].中国农学通报,2005,31(8):45-49.
[4] Wang Tingting,Sun Yongxin,Jin Liji,et al.Enhancement of nonspecific immune response in sea cucumber(Apostichopus japonicus)by Astragalus membranaceus and its polysaccharides[J].Fish &Shellfish Immunology,2009,27(6):757-762.
[5] 郭娇娇,宫智勇.恩诺沙星在水产养殖中的研究进展[J].江苏农业科学,2011,39(4):290-292.
[6] 赵蕾,曹海鹏,陈辉,等.恩诺沙星对银鲫急性毒性及血液生化指标的影响[J].动物学杂志,2013,48(3):446-450.
[7] 郭娇娇,杨虎,潘红艳,等.恩诺沙星对鲟鱼的急性毒性研究[J].现代农业科技,2010(20):311,315.
[8] 朱安妮.垂盆草对四氯化碳致小鼠急性肝损伤保护作用的研究[D].北京:北京中医药大学,2014:23.
[9] Amold H,Pluta H J,Braunbeck T.Sublethal effects of prolonged exposure to disulfoton in rainbow trout(Oncorhynchus mykiss):cytological alterations in the liver by a potent acetylcholine esterase inhibitor[J].Ecotoxicology and Environmental Safety,1996,34 (1):43-55.
[10] Moutouk K A,Braunbeck T,Houlihan D F.Quantitative analysis of alterations in liver ultrastructure of rainbow trout Oncorhynchus mykiss after administration of the aquaculture antibacterials oxolinic acid and flumequine[J].Diseases of Aquatic Organisms, 1997,29(1):21-34.
[11] 曹丽萍,贾睿,丁炜东,等.建鲤急性肝损伤模型的建立及当归提取物的保肝和抗氧化作用研究[J].大连海洋大学学报, 2012,27(6):551-557.
[12] 刘英娟,杜金梁,贾睿,等.枸杞多糖对四氯化碳诱导建鲤原代肝细胞损伤的保护作用研究[J].上海海洋大学学报, 2014,23(5):718-725.
[13] 明建华,谢骏,徐跑,等.大黄素、维生素C及其配伍对团头鲂感染嗜水气单胞菌后生理生化指标的影响[J].中国水产科学,2011,18(3):588-601.
[14] 李斌,唐毅,王志干,等.复方中草药制剂对草鱼肝胆综合症的防治研究[J].南方水产科学,2011,7(2):35-41.
[15] 李绍戊,王荻,马涛,等.恩诺沙星对小体鲟和史氏鲟体内SOD活力影响的比较研究[J].水产学杂志,2011,24(2):37-40.
[16] 李超,张其中,朱成科,等.增强草鱼免疫功能的复方中草药免疫增强剂筛选[J].西南师范大学学报:自然科学版,2012, 37(4):121-129.
[17] 孙裔雷,王荻,刘红柏.复方中草药对虹鳟抗氧化能力的影响[J].大连海洋大学学报,2015,30(2):170-174.
[18] 白洁.叶下珠对鱼类肝损伤保护机理的研究[D].福州:福建农林大学,2008:33.
[19] Anadón A,Matínez-Larrañaga M R,Díaz M J,et al.Pharmacokinetics and residues of enrofloxacin in chickens[J].American Journal of Veterinary Research,1995,56(4):501-506.
[20] Banholzer E,Heinritzi K,Steinhausen G.Pharmacokinetics of enroflocacin in slarghter pigs following different routes of administration[J].Journal of Vet Pharmacology Therapy,1997,20(1):48.
[21] Dosogne H,Meyer E,Sturk A,et al.Effect of enrofloxacin treatment on plasma endotoxin during bovine Escherichia coli mastitis [J].Inflammation Research,2002,51(4):201-205.
[22] Orman E S,Conjeevaram H S,Vuppalanchi R,et al.Clinical and histopathologic features of fluoroquinolone-induced liver injury [J].Clinical Gastroenterology and Hepatology,2011,9(6):517-523.
[23] Shinozuka Y,Uematsu K,Takagi M,et al.Comparison of the amounts of endotoxin released from Escherichia coli after exposure to antibiotics and ozone:an in vitro evaluation[J].Journal of Veterinary Medical Science,2008,70(4):419-422.
[24] Fan Junhua,Feng Guogang,Huang Lei,et al.Role of naofen in apoptosis of hepatocytes induced by lipopolysaccharide through mitochondrial signaling in rats[J].Hepatology Research,2012, 42(7):696-705.
[25] 贾睿.黄芪多糖对四氯化碳诱导鲤鱼肝(细胞)损伤的保护作用[D].南京:南京农业大学,2011:48.
[26] 王子锡.肝胆疾病患者血清肝酶谱变化及分析[J].现代中西医结合杂志,2011,20(24):3044-3045.
[27] 郭凡溪,钱林东,刘腾飞,等.恩诺沙星联合脂多糖致复合式鸡肝损伤模型的建立[J].江苏农业科学,2013,41(8):212-214.
[28] Suk K T,Kim D J.Drug-induced liver injury:present and future [J].Clinical and Molecular Hepatology,2012,18(3):249-257.
[29] 刘晓勇,张颖,齐茜,等.枯草芽孢杆菌对杂交鲟幼鱼生长性能、消化酶活性及非特异性免疫的影响[J].中国水产科学, 2011,18(6):1315-1320.
[30] 王吉桥,樊莹莹,徐振祥,等.饲料中β-胡萝卜素和虾青素添加量对仿刺参幼参生长及抗氧化能力的影响[J].大连海洋大学学报,2012,27(3):215-220.
[31] 刘波,何庆国,唐永凯,等.饥饿胁迫对吉富罗非鱼生长及生理生化指标的影响[J].中国水产科学,2009,16(2):230-237.
[32] 刘富萍,张琪,谷楠,等.谷胱甘肽及丙二醛在炎症中表达的研究进展[J].医学美学美容,2015,24(6):1001-1002.
[33] 李素婷,杨鹤梅,石艳华,等.黄芩茎叶总黄酮保肝作用的实验研究[J].中国中医药信息杂志,2004,11(7):593-594.
[34] 贾睿,曹丽萍,杜金梁,等.水飞蓟素对四氯化碳致鲫肝(细胞)损伤的保护和抗氧化作用[J].中国水产科学,2013,20 (3):551-560.
[35] 兰凤英,何静春,赵颖,等.郁金抗四氯化碳致小鼠急性肝损伤的作用[J].中国康复理论与实践,2007,13(5):444-445.
[36] 张改平,杨建雄.甘草提取物对鼠肝细胞线粒体氧化损伤的作用保护[J].生物加工过程,2011,9(1):50-54.
[37] 耿广琴,杨志军,杨秀娟,等.黄芩水煎液对CCl4肝损伤小鼠肝线粒体的影响[J].中国中医药科技,2015,22(6):641-643.
A model of drug-induced liver injury caused by enrofloxacin and protective effects of compound Chinese herbal medicines on livers in Amur sturgeon Acipenser schrenckii
LUAN Xue-bin1,2,WANG Di2,LIU Hong-bai1,2
(1.Wuxi Fisheries College,Nanjing Agricultural University,Wuxi 214081,China;2.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
After a trial on an inducing sturgeon liver injury model(M group)via requirement time and dose test, Amur sturgeon Acipenser schrenckii with body weight of(100±2)g were reared in a circular cement pond and fed the basal diet in the control group and diets containing Chinese herbal medicine compound(Chinese herbal medicine groups,CHM groups and drug-induced liver injury model group,M group)at daily feeding rate of 2%at water temperature of(15.5±1.0)℃ for 11 days.Then enrofloxacin was given to the Amur sturgeon in CHM groups and M group at a dose of 160 mg/kg body weight and equivalent double distilled water was given to the Amur sturgeon in control group by oral administration for 10 days to explore the protective effect of compound Chinese herbal medicines on drug-induced liver injury in Amur sturgeon.The levels of hepatic active materials and activities of enzymes in serum were detected and the hepatic histopathology was observed in the Amur sturgeon administrated above.Results showed that there were significantly lower serum level of total antioxidant capacity(T-AOC)(P<0.05)and very significantly lower total superoxide dismutase(T-SOD)activities(P<0.01),and very significantly higher activities of glutamic-pyruvic transaminase(ALT),and glutamic oxalacetic transaminase(AST)and malondialdehyde(MDA)level(P<0.01)in the Amur sturgeon in M group than those in the control group,with obvious liver histopathology under a microscope,indicating that the liver was injured obviously and the liver injury model was established successfully.The Amur sturgeon in CHM groups had higher serum level of T-AOC and activities of T-SOD,and lower serum level of MDA and activities of AST and ALT,with the same characteristics of hepatic histopathology.The findings proved that Chinese herbal medicines inhibited the physical absorption of enrofloxacin, improved the ability of scavenging free radicals,and promoted hepatocyte recovery,especially compoundⅢ.
Acipenser schrenckii;Chinese herbal medicine;liver injury;enrofloxacin
S941.8
A
10.16535/j.cnki.dlhyxb.2017.01.003
2095-1388(2017)01-0013-07
2016-06-24
国家公益性行业 (农业)科研专项 (201203085)
栾学斌 (1991—),男,硕士研究生。E-mail:luanxuebin97592@163.com
刘红柏 (1970—),女,博士,研究员。E-mail:liuhongbai@sina.com

