不同初始pH值对保加利亚乳杆菌关键蛋白酶基因表达的影响
张鸿超,逄诗玥,王海梅,韩巍巍2,姜瞻梅,杜鹏,侯俊财
(1.东北农业大学乳品科学教育部重点实验室,哈尔滨150030;2.哈尔滨丰瑞生物科技有限公司,哈尔滨150036)
不同初始pH值对保加利亚乳杆菌关键蛋白酶基因表达的影响
张鸿超1,逄诗玥1,王海梅1,韩巍巍2,姜瞻梅1,杜鹏1,侯俊财1
(1.东北农业大学乳品科学教育部重点实验室,哈尔滨150030;2.哈尔滨丰瑞生物科技有限公司,哈尔滨150036)
由于保加利亚乳杆菌自身不能直接利用外源蛋白,其必须通过蛋白水解体系外源蛋白质,生成供菌体正常生长需要的短肽和游离氨基酸。选择具有高蛋白水解活力的6株保加利亚乳杆菌作为供试菌种。将菌株接种于不同初始pH值的灭菌脱脂乳中,在mRNA转录水平上,应用实时荧光定量PCR技术,探讨保加利亚乳杆菌的蛋白水解体系中关键蛋白酶基因表达情况。结果表明:在脱脂乳体系中,初始pH值对保加利亚乳杆菌蛋白水解关键酶基因的表达存在显著影响,随着初始pH值的升高菌株KLDS 1.0501,1.9201,1.9203和1.0208的各基因表达量均上调,在pH=6.5时,部分基因表达量继续上调,且各菌株间蛋白基因表达有较大差异。
保加利亚乳杆菌;蛋白水解体系;基因表达;实时荧光定量PCR
0 引言
乳酸菌(Lactic acid bacteria,LAB)是指能够在厌氧或兼性厌氧条件下发酵产生乳酸的菌。保加利亚乳杆菌是典型的乳酸菌,是酸乳发酵过程中的产酸菌和产香菌[1]。乳酸菌的生长代谢需要利用小肽及游离氨基酸[2],并依赖自身的蛋白水解体系[3-4]。已有研究发现乳酸杆菌蛋白水解体系的结构特征和乳球菌相似[5-7]。Picon等人[8]发现很多株菌中含有两个转运系统。Henriksen等人[9]通过对蛋白水解酶基因进行基因修饰得到水解能力更强的优势菌株。目前为止对保加利亚乳杆菌的蛋白水解酶体系相关酶基因表达量的研究较少[10]。本文旨在mRNA转录水平上,应用实时荧光定量PCR技术,探讨不同发酵初始pH值条件下保加利亚乳杆菌的蛋白水解体系中关键蛋白酶基因(prtB,oppD,pepC,pepF,pepQ,pepX,pepT)表达情况。
1 实验
1.1材料与设备
菌种:由东北农业大学乳品科学教育部重点实验室分离保存的德氏乳杆菌保加利亚亚种(Lactobacillusdelbrueckiisubsp.bulgaricus)KLDS 1.0207,1.0501,1.1007,1.9201,1.9203和1.0208。
试剂:复原脱脂乳,EDTA·2Na(Amresco),邻苯二甲醛,DEPC,邻苯二甲醛,RNA prep pure培养细菌总RNA提取试剂盒,PrimerScript®RT反转录试剂盒,SYBR®Premix Ex TaqTM试剂盒。
设备:离心机,PCR仪,电泳仪,紫外分光光度计,实时定量PCR仪。
1.2验设计与方法
1.2.1 保加利亚乳杆菌蛋白水解活力的测定
蛋白水解活力的测定参照Church[11]的邻苯二甲醛(OPA)方法。将活化好的菌株按2%接种于灭菌脱脂乳中,37℃培养。每隔2 h取样品2 mL,加入4 mL浓度为0.75 mol/L三氯乙酸溶液,漩涡混匀,6 000 g离心5 min。取150 μL上清液与3 mL OPA试剂混合并开始准确计时5 min,在340 nm波长下比色[12]。
1.2.2 实时荧光定量PCR的引物设计与合成
以16S rRNA作为管家基因[13-14],根据GenBank提供的Lactobacillus delbrueckiisubsp.bulgaricusATCC 11842的 DNA序 列(GenBank accession number:NC_ 008054.1)中相应基因的序列,采用primer5.0软件设计16S rRNA,prtB,oppD,pepC,pepF,pepQ,pepX和pepT基因的引物序列进行合成(见表1)。
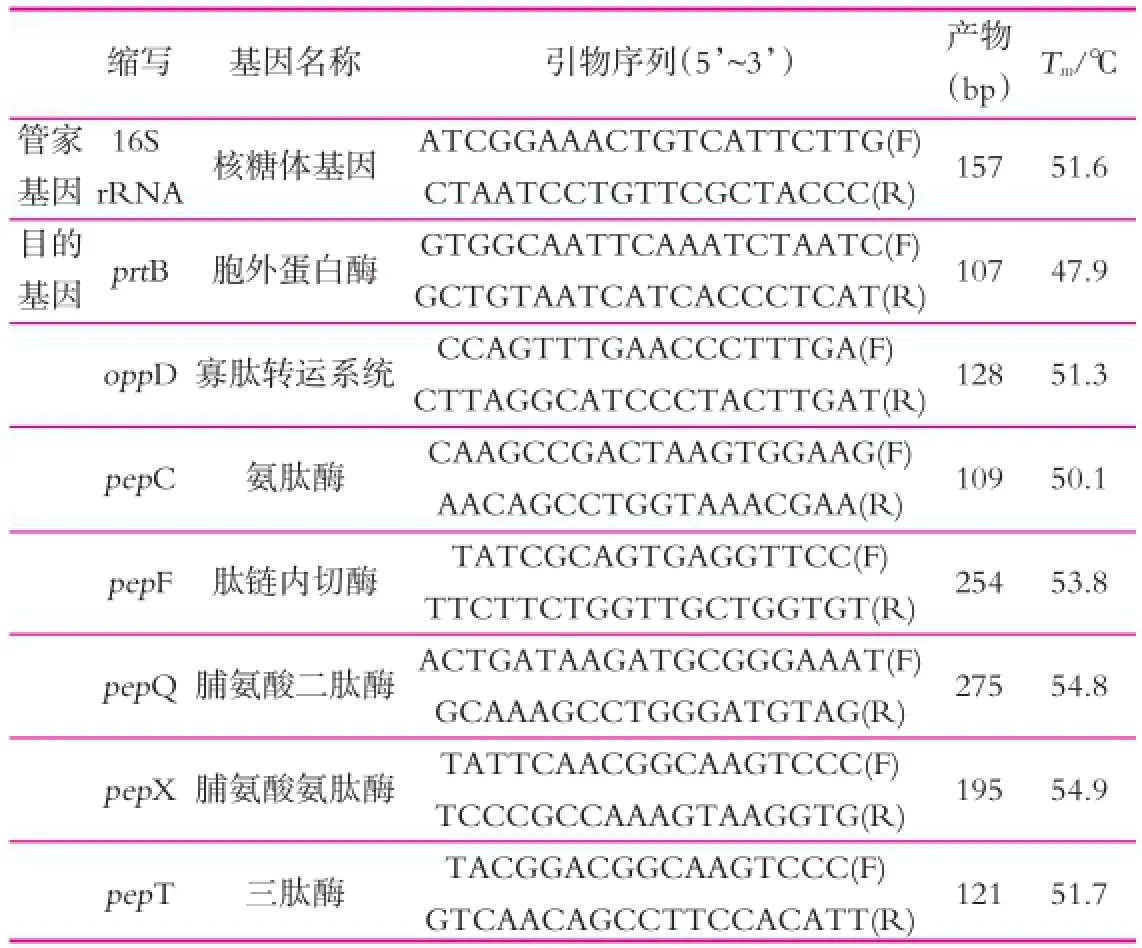
表1 实时荧光定量PCR引物
1.2.3 提取总RNA及其完整性和纯度的检测
在90 mL质量分数为2%柠檬酸三钠溶液中加入10 mL发酵乳,混合均匀后取10 mL悬浮液6 000×g离心5 min,温度为4℃,除去上清液后对菌体进行收集[15]。根据RNAprep pure培养细菌总RNA提取试剂盒操说明书立即抽取样品中的总RNA。
对样品进行溴乙锭(EB)染色后,取3 μL提取的RNA和2 μL的Loadingbuffer点样于质量分数1%琼脂糖凝胶电泳(150 V,5 min),通过CDS8000型凝胶分析系统成像后,观察电泳条带23 s和16 s的性状判断RNA的完整性。通过测定260 nm和280 nm处提取的RNA的吸光度,并计算OD260/OD280的比值来判定RNA的纯度。
1.2.4 RNA反转录合成cDNA
提取的总RNA利用PrimerScript®RT反转录试剂盒反转录成cDNA,反转录产物cDNA样本于-20℃环境下保存备用。RT反应体系如表2所示。

表2 RT反应体系
1.2.5 实时荧光定量PCR
采用SYBR®Premix Ex TaqTMⅡ试剂盒(Takara)和ABI7500 Fast Real-Time PCR System对反转录产物cDNA进行实时荧光定量PCR测定。本实验使用两步法标准PCR扩增程序,反应体系为:SYBR®Premix Ex TaqTM(2×)10 μL;ROX Reference Dye II(50×)0.4 μL;PCR Forward Primer(10 μmol/ L)0.4 μL;PCR Reverse Primer(10 μmol/L)0.4 μL;cDNA模板(稀释10倍)2 μL;RNase Free dH2O 6.8 μL,总体系20 μL。反应条件为:95℃(30 s)预变性;95℃(5 s),60℃(34 s),40次循环PCR反应。本实验在不同体系样品中重复3次。
1.2.6 不同初始pH值对基因表达的影响
在灭菌脱脂乳中接入活化后的6株菌各2%,灭菌脱脂乳的pH值分别为5.6,5.9,6.2,6.5。在37℃环境下发酵12 h后分别提取各样本菌体的RNA。对提取的RNA进行完整性和浓度检测,对样品反转录生成的cDNA进行实时荧光定量PCR检测,每组重复3次。
1.3实时荧光定量PCR数据分析
对基因的CT值进行测定,利用2-△△CT法对目的基因的表达量进行评估。反应中的每个目的基因和内参基因在不同样本重复3次,取平均值,从而计算标准差。
1.4验数据统计方法
将每个待测样品均重复3次,采用SPSS 16.0软件进行方差分析,采用Duncan方法进行多重比较,显著水平P<0.05。
2 结果与分析
2.1保加利亚乳杆菌的蛋白水解曲线
图1为保加利亚乳杆菌的蛋白水解活力变化曲线。由图1可以看出,随着培养时间的增加,保加利亚乳杆菌的蛋白水解活力极显著增强(P<0.01),且其水解曲线的线性基本一致。蛋白水解活力最强的菌种为KLDS 1.9201,蛋白水解活力最弱的为KLDS 1.0207。以L-亮氨酸标准曲线计算(相当于亮氨酸)游离氨基酸的浓度,培养12 h时菌株KLDS 1.9201,1.0208,1.0501,1.9203,1.1007和 1.0207分 别 为384.33±0.001,255.50±0.000,181.50±0.002,164.15± 0.002,155.83±0.001和(92.17±0.002)mg/L。

图1 蛋白水解活力变化曲线
2.2RNA的纯度和完整性测定分析
由于RNA的纯度和完整性关系到之后的反转录反应效率和实时荧光PCR测定,因此,本实验首先通过测定提取保加利亚乳杆菌各样本RNA的OD260和OD280值来确定其纯度,并通过1%琼脂凝胶电泳来确定其完整性。实验中测得的OD260/OD280比值均在1.8~2.0之间,这表明所提取的RNA中没有DNA和蛋白质的残留,纯度较高。质量分数为1%琼脂凝胶电泳的结果如图2所示。由图2可以看出,23S RNA和16S RNA条带清晰,5S RNA条带较暗,这一结果说明RNA样品质量完好,可用于后续试验。
为进一步验证总RNA的提取是否成功和引物特异性是否完好,对反转录产物cDNA与管家基因和目的基因引物进行了普通PCR实验和1%琼脂凝胶电泳。结果显示反转录产物cDNA未受污染,引物特异性良好(见图3)。
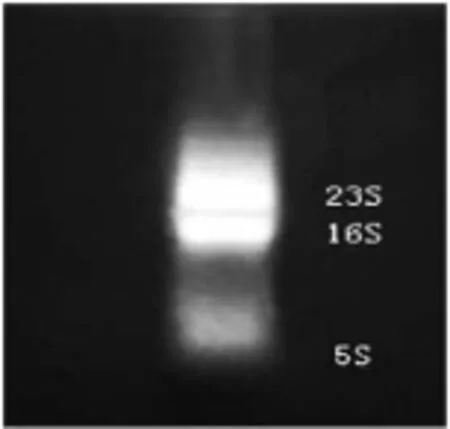
图2RNA电泳样品结果

图3 反转录产物cDNA普通PCR电泳结果
2.3不同初始pH值对蛋白水解关键酶基因表达的影响
不同初始pH值对蛋白水解体系关键酶基因表达结果如图4所示。由图4可以看出,总体上基因表达是随着初始pH值的升高且上调的,其中菌株KLDS 1.0207和KLDS 1.1007的基因表达量随着初始pH值升高的变化是先下调再上调,当初始pH值为5.6时表达量达到最高,初始pH值为6.2时表达量最低,初始pH值为6.5时表达量开始缓慢上调。在初始pH值为5.6进行培养时,菌株KLDS 1.0207和1.1007的prtB和oppD基因表达量最大;在初始pH值为5.9培养时,菌株KLDS 1.1007基因表达量最大;在初始pH值为6.2时,菌株KLDS 1.9201,1.9203和1.0208表达量最大;且与各自对照组相比分别上调18.86倍、2.22倍和6.60倍;在初始pH值为6.5时,菌株KLDS 1.0207和1.0501的pepC基因表达量和菌株KLDS 1.0501的基因表达量达到最大,且以上菌株与各自对照组(初始pH值为5.6)相比较都存在显著差异(P<0.05)。此外,菌株KLDS 1.0501,1.9201,1.9203和1.0208中pepQ和pepT基因在高初始pH值时表达量显著高于低初始pH值时的表达量(P<0.05)。
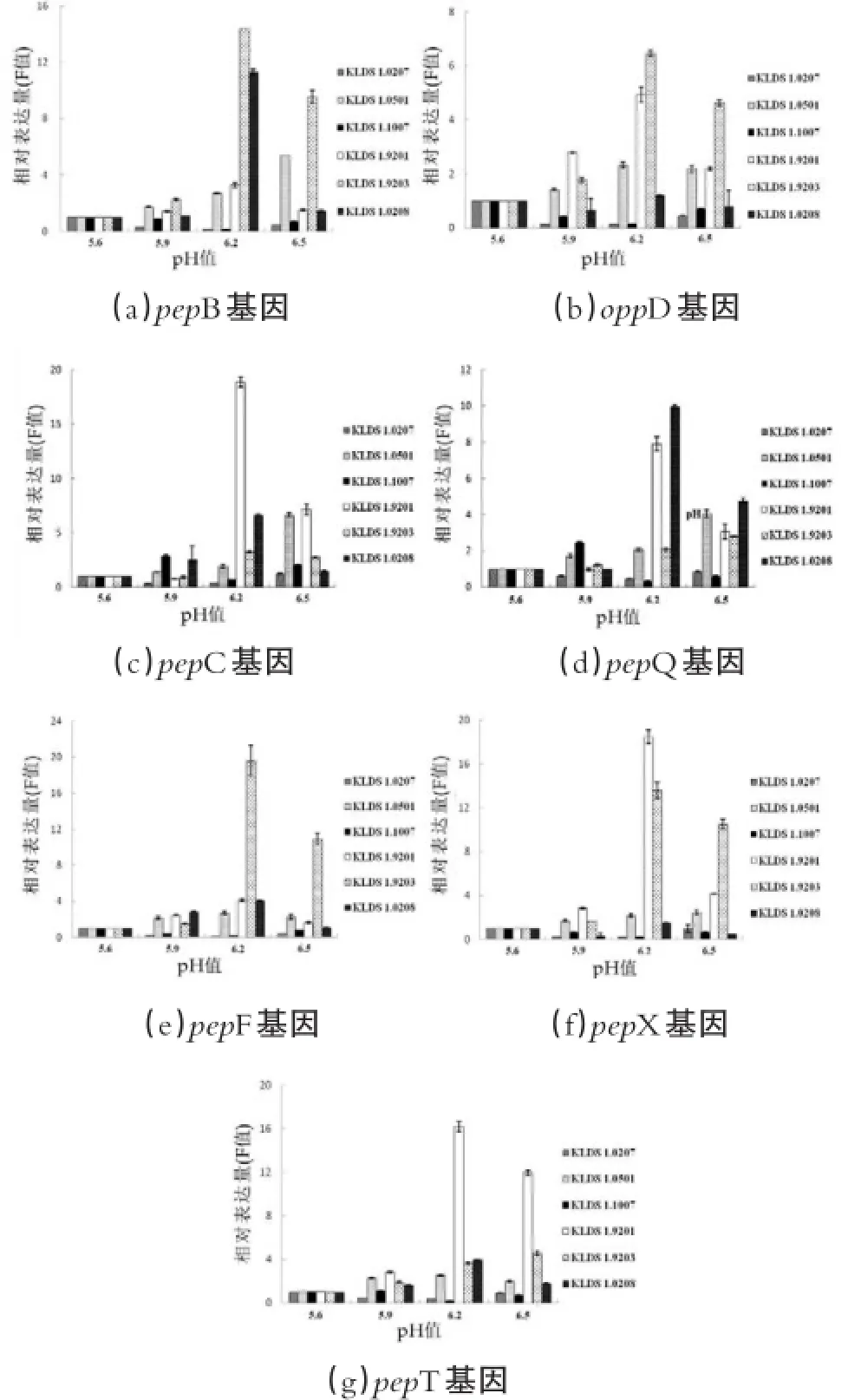
图4 不同初始pH值培养下关键酶基因的相对表达
3 讨论
虽然乳酸菌不能直接利用外源蛋白,但其自身具有高效的蛋白水解体系,能够为其生长代谢提供足够的游离氨基酸,从而改善机体对发酵乳中乳蛋白的吸收和利用,同时还赋予了发酵乳制品更高的营养价值。Gilbert等[16]研究表明乳杆菌属在脱脂乳中的生长状态更好,且乳酸杆菌的蛋白水解能力明显高于乳酸球菌;黄昌良等[17]发现单从菌落总数来说,以乳清加6%脱脂奶粉作为培养基最好;周德庆[18]发现其生长繁殖过程中需要多种维生素等生长因子,尤其是B族维生素,如吡哆酸、谷氨酸、叶酸等。Rina Wu等[19]研究发现,MRS基质的pepP基因在低pH值(2.5)时的表达水平低于高pH(6.4)的表达水平。刘桂芳等[20]在蛋白水平上研究发现,在不同pH条件下不同菌株水解酪蛋白的能力存在较大差异。本研究发现,随着初始pH值的升高,保加利亚乳杆菌KLDS 1.0501、1.9201、1.9203和1.0208的prtB、oppD、pepC、pepF、pepQ、pepX和pepT基因表达量均上调,部分基因在pH值为6.5时部分基因的表达量能够继续上调。这可能是由于初始pH值为6.2和6.5是菌体生长繁殖的最适pH值,可使菌体快速进入对数期或者稳定期;另外,初始pH值为5.6和5.9会抑制菌体生长,使菌体缓慢生长。本文研究结果与刘桂芳等的研究结果一致。Stressler等[21]研究了温度和pH值对Lactobacillus helveticusATCC 12046的pepX和pepN的活性和热稳定的影响,发现pepX在40~50℃之间和pH值为6.0~7.0之间活性较高。因此,保加利亚乳杆菌蛋白水解活力和蛋白水解体系关键酶基因的表达水平存在显著差异,这可能受生长环境pH值和自身生物学特性的影响。
另外,随着培养体系pH值降低至一定值,菌体胞内pH值的动态平衡被破坏,胞内pH值随之降低,则菌体将无法正常生长和代谢,甚至死亡,同时菌体代谢物的产量也受到影响,即菌体生长受抑制程度还与菌株的特性息息相关[22]。保加利亚乳杆菌属同型发酵性乳酸菌,马静等[23]认为pH值是影响乳酸菌胞外多糖产量的重要因素之一,培养基的初始pH值和控制培养过程中的pH值都会影响胞外多糖的最终产量。王立平[24]等认为菌株水解酪蛋白的能力受pH值的影响,在酪蛋白和菌株共培养过程中,Lactobacillus helveticus9水解酪蛋白时产生的一定量的氨基酸残基会降低酪蛋白水解液的pH值,通过滴加NaOH溶液调节酪蛋白溶液的pH值,使菌体的蛋白酶维持在较适pH值范围内,可以提高菌株蛋白水解度,这样有利于多肽的生成。
本文就初始pH对保加利亚乳杆菌蛋白水解体系相关基因表达水平的影响进行了初步探讨,但是菌体在脱脂乳中生长时,可产生乳酸及少量的醋酸、丙酸、酪酸、异戊酸、己酸、辛酸和癸酸等挥发性酸[25-28]。脱脂乳体系的pH会随着乳酸、氨基酸残基和有机酸等代谢产物的增加而变化,从而影响蛋白酶基因的表达和蛋白酶的活性。因此,在恒定pH值环境下培养菌体,其蛋白酶基因在转录水平的表达和在蛋白水平的活性有待进一步研究。
[1]许本发.酸奶和乳酸菌饮料加工[M].北京:中国轻工业出版社, 2994:13-20.
[2]CHOPIN A.Organization and regulation of genes for amino acid biosynthesis inLactic acid bacteria[J].FEMS Microbiology Reviews, 1993,12(1):21-37.
[3]TASKALIDOU E,ANASTASIOU R,VANDENBERGHE I,et al. Cell-wall-bound proteinase ofLactobacillus delbrueckiisubsp. LactisACA-DC178 characterization and specificity forβ-Casein [J]. Applied and Environmental Microbiology, 1999, 65(5): 2035-2040.
[4]JUILLARD V,LAAN H,KUNJI R,et al.The extracellular PI-type proteinase ofLactococcus lactishydrolyzes beta-casein into more than one hundred different oligopeptides[J].Journal of Bacteriology, 1995,177(12):3472-3478.
[5]ERIC G,PIERRE R,EHRLICH S D,et al.Transcriptional pattern of genes coding for the proteolytic system ofLactococcus lactisand evidence for coordinated regulation of key enzymes by peptide supply [J].Journal of Bacteriology,2001,183(12):3614-3622.
[6]CHRISTENSEN J E,DUDLEY E G,PEDERSIN J A,et al.Peptidases and amino acid catabolism inLactic acid bacteria[J].Antonie van Leeuwenhoek,1999,76:217-246.
[7]ROLAND J S.Multi-Domain,cell-envelope proteinases of lactic acid bacteria[J].Antonie van Leeuwenhoek,1999,76:139-155.
[8]PICON A,GARCIA-CASADO M A,NUNEZ M.Proteolytic activities,peptide utilization and oligopepetide transport systems of wild Lactococcus lactisstrains[J].International Dairy Journal,2010,20(3): 156-162.
[9]HENRIKSEN M E,NILSSOND.Industrial application of genetically medified microorganisms:gene technology at Chr.Hansen A/S[J].Internation Dairy Jounrnal,1999,9:17-23.
[10]MAYO B,KOK J,VENEMA K,et al.Molecular cloning and sequence analysis of the X-propyl dipeptidyl aminopeptidase gene from Lactococcus lactis subsp.Cremoris[J].Applied and Environmental Microbiology,1991,57(1):38-44.
[11]CHURCH F C,SWAISGOOD H E,PORTER D H,et al.Spectrophotometric assay using O-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J].Journal of Dairy Science,1983,66(6):1219-1227.
[12]吕加平,骆承庠,刘凤民.乳酸菌蛋白水解力的测定及研究[J].东北农业大学学报,1999,30(1):68-74.
[13]TAKLE G W,TOTH I K,BRUBERG M B.Evaluation of reference genes for real-time RT-PCR expression studies in the plant pathogen pectobacterium atrosepticum[J].BMC Plant Biology,2007, 7(1):50.
[14]BRON P A,MARCO M.HOFFER S M,et al.Genetic characterization of the bile salt response inLactobacillus plantarumand analysis of responsive promoters in vitro and in situ in the gastrointestinal tract[J].Journal of Bacteriology,2004,186(23):7829-7835.
[15]GENAY M,SADAT L,GAGNAIRE V,et al.prtH2,not prtH,is the ubiquitous cell wall proteinase gene inLactobacillus helveticus [J].Applied and EnvironmentalMicrobiology,2009,75(10): 3238-3249.
[16]GILBERT C,ATLAN D,BLANC B,et al.A new cell surface proteinase:sequencing and analysis of the prtB gene fromLactobacillus delbruekiisubsp.bulgaricus[J].Journal of Bacteriology,1996,178 (11):3059-3065.
[17]黄良昌,吕晓玲,邢晓慧.酸奶发酵剂的研究进展[J].广州食品工业科技,2002,17(3):4.
[18]周德庆.微生物学教程[M].北京:高等教育出版社,1999:169-175.
[19]WU R,ZHANG W,SUN T,et al.Proteomic analysis of responses of a new probiotic bacteriumLactobacillus caseiZhang to low acid stress[J].International Journal of Food Microbiology,2011, 147(3):181-187.
[20]刘桂芳.嗜酸乳杆菌和干酪乳杆菌β-半乳糖苷酶和蛋白水解活性的研究[D].内蒙古农业大学,2004.
[21]STRESSLER T,EISELE T,SCHLAYER M,et al.Characterization of the recombinant exopeptidases PepX and PepN fromLactobacillus helveticusATCC 12046 important for food protein hydrolysis [J].PloS One,2013,8(7):e70055.
[22]熊素玉,姚新奎,谭小海,等.不同温度及pH条件对乳酸菌生长影响的研究[J].新疆农业科学,2006,43(6):533-538.
[23]马静,裴家伟,吴荣荣,等.影响乳酸菌胞外多糖产量的因素研究[J].中国乳品工业,2003,(5):12-16.
[24]王立平,廖玲,高莉莉.Lactobacillus helveticus9的酪蛋白水解作用研究[J].食品科学,2008,29(7):286-290.
[25]孙震,张硕,谢晴.双歧杆菌免疫学检测方法的研究[J].无锡轻工大学学报,1999,18(1):28~32.
[26]周俭.保健食品设计原理及其应用[M].北京:中国轻工业出版社, 1998:114-141.
[27]MORISAKI I,MICHALEK G,MARMAN G.Effective immunity to dental caries:Enhancement of salivary anti-Streptococcus mutans antibody with oral adjuvants[J].Infect.Immum,1983,40:577.
[28]SVENNERHOLM A,LANGE S AND HOLMGREN.Intestinal immune response to cholera toxin:dependence on route and dosage of antigen for priming and boosting[J].Infect.Immum,1980,30: 337.
Effect of different initial pH on gene expressions of key proteolytic enzyme of Lactobacillus bulgaricus
ZHANG Hongchao1,PANG Shiyue1,WANG Haimei1,HAN Weiwei2,JIANG Zhanmei1,DU Peng1,HOU Juncai1
(1.Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China;2. Harbin Fengrui Shengwukeji Co.Ltd.,Harbin 150036,China)
Lactic acid bacteria(LAB)obtain all the necessary small peptides and free amino acids by their complex proteolytic system,because LAB itself can not directly use the exogenous proteins.In this study,six Lactobacillus bulgaricu strains(KLDS 1.0207,1.0501,1.1007,1.9201, 1.9203,and 1.0208)which had different initial pH values(5.6,5.9,6.2,6.5)incubated in skim milk were to analyze the dynamic changes of the genes expressions of the key proteinase(prtB,oppD,pepC,pepF,pepQ,pepX and pepT)at the mRNA transcription level using the real-time quantitative PCR technique.The effects of initial pH on key proteolytic enzyme genes expression among the six strains was significant(P<0.05),it was up-regulated that the genes expression of the key proteolytic enzyme for the strains KLDS 1.0501,1.9201,1.9203 and 1.0208 with the increase of initial pH in skim milk.Meanwhile,some genes increased continuously at the initial pH6.5,significant differences in which are also observed.
Lactobacillus bulgaricus;proteolytic system;gene expression;real-time quantitative polymerase chain reaction(PCR)
Q933
A
1001-2230(2017)02-0008-04
2016-07-01
黑龙江省新世纪人才项目资助(1253-NCEF-006)。
张鸿超(1992-),女,硕士,研究方向为食品工程。
侯俊财

