不同载体冷冻小鼠胚胎的效果比较
邵明清,邵南齐
(1.临汾市第四人民医院,山西 临汾041000 ;2.郑州澍青医学院,河南 郑州450064 )
不同载体冷冻小鼠胚胎的效果比较
邵明清1,邵南齐2
(1.临汾市第四人民医院,山西 临汾041000 ;2.郑州澍青医学院,河南 郑州450064 )
为了比较冷冻叶片(Cryoleaf)、冷冻帽(Cryotop)、自制半麦管(hemi-straw)三种冷冻载体的冻存效果,试验采用玻璃化冷冻方法冻存昆明小鼠8-cell胚胎。结果表明,Cryoleaf组、Cryotop组和hemi-straw组胚胎复苏率分别为 92.3%、89.2%和 86.2%,三组比较差异不显著(P>0.05)。Cryoleaf组、Cryotop组及hemi-straw组胚胎的囊胚形成率分别是 95.0%、91.4%和 80.4%,三组比较差异显著 (P<0.05);新鲜对照组囊胚形成率为98.5%,与Cryoleaf组、Cryotop组分别比较差异不显著 (P>0.05),与自制hemi-straw组比较差异显著(P<0.05)。结论:采用玻璃化冷冻方法冻存小鼠8-cell期胚胎,使用Cryotop和Cryoleaf作为冷冻载体,可以获得更高的复苏率和囊胚率,优于自制hemi-straw,可以很好地用来冻存人类的胚胎。
玻璃化冷冻;8-cell胚胎;小鼠;载体
近年来,玻璃化冷冻技术的飞速发展和广泛应用,已成为辅助生殖技术领域的焦点[1]。玻璃化冷冻利用含高浓度防冻剂的冷冻液,通过急速降温,使细胞内外的成分同时玻璃化而避免了冰晶的形成,大大提高了冻融后细胞的存活率[2]。影响胚胎冻存效果的关键因素是冷冻液的成分及冷冻载体.由于在冷冻液成分方面已经有很多学者做了大量研究,目前已有商品化的冷冻解冻液套装,由于各个实验室的条件不同,解冻后复苏率及囊胚率的结果相差很大。冷冻载体有很多种,现在国内大多数生殖中心应用冷冻帽(Cryotop)、冷冻叶片(Cryoleaf)和冷冻环(Cryoloop )等玻璃化冷冻载体[3]。本研究以昆明小鼠为研究对象,应用Cryoleaf、Cryotop和自制半麦管(hemi-straw)冷冻载体开展胚胎玻璃化冷冻研究,旨在分析载体对冷冻效果的影响,进而为人类胚胎玻璃化冷冻技术的改进提供相关依据。
1 材料
1.1 实验动物
昆明小白鼠购自郑州大学实验动物中心。雌性小鼠 6~8 周龄,30只;雄性小鼠 10~12 周龄,15只。适应性饲养1周,排除应激反应。
1.2 药物与试剂
孕马血清(PMSG),宁波第二激素厂生产;人绒毛膜促性腺激素(HCG),南京动物激素厂生产;培养液(受精液FM,卵裂液CM,囊胚培养液BM)及矿物油由COOK公司生产;冷冻复苏液、血清白蛋白代用品(HSA)由COOK公司生产。
1.3 耗材及仪器
培养皿及圆底试管由美国 Falcon公司生产,移液管及锥形试管由BD公司生产,培养箱由德国 Galaxy生产,倒置显微镜由日本Nikon生产,工作站由丹麦Sterile生产,Cryotop购于日本Kitazato,Cryoleap购于美国 Hampton,液氮贮存罐(美国MVE公司)。
2 方法
2.1 小鼠促排卵方案及胚胎的获取[4]
取6~8周龄昆明白种雌鼠(郑州大学实验动物中心)于当日13∶00 腹腔注射孕马血清促性腺激素10 IU/只, 48 h后再腹腔注射hCG 10 IU/只,并按雌雄1∶1 合笼,次日选出见阴栓者。注射hCG 48 h后,颈椎脱臼法处死见阴栓的雌鼠, 取输卵管, 用针划开其壶腹部, 获取胚胎, 置37℃、5% CO2培养箱培养至8-cell备用。
2.2 对第3天胚胎进行评分
参照Racowsky的胚胎分级方法[5]将胚胎分为5级。
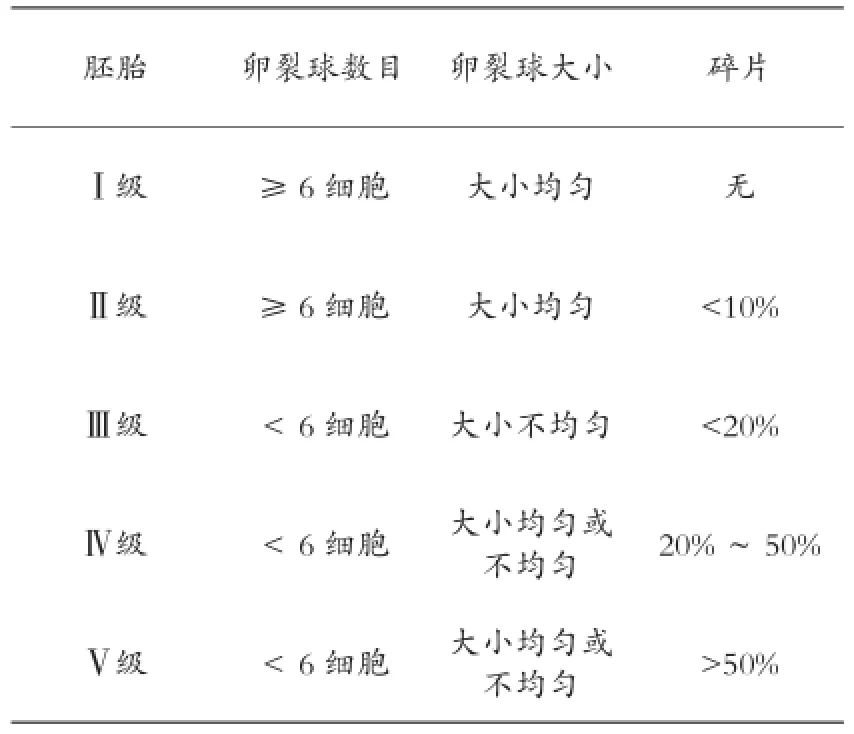
胚胎卵裂球数目卵裂球大小碎片Ⅰ级≥6细胞大小均匀无Ⅱ级≥6细胞大小均匀<10%Ⅲ级<6细胞大小不均匀<20%Ⅳ级<6细胞大小均匀或不均匀20%~50%Ⅴ级<6细胞大小均匀或不均匀>50%
Ⅰ~Ⅱ级为优质胚胎,Ⅲ~Ⅴ级为劣质胚胎,选取Ⅰ、Ⅱ级胚胎进行冷冻。
2.3 半麦管制作方法
参照 Cryotop的形状,在冷冻麦管前端1/4处切断,用刀片将长管头部削成树叶状,再将短管部分套在树叶状载体上即可。
2.4 玻璃化冷冻
冷冻试剂购买商品化生产的加藤冷冻液 ,内有平衡液 ES 和冷冻液 VS 两种液体。第1步把胚胎放在ES液中平衡5 min,然后将其转移至VS液,再把胚胎装载在冷冻载体Cryotop、Cryoleaf和hemi-straw上,该步骤必须在1 min内完成,要求迅速。
2.5 玻璃化解冻
复苏试剂购买商品化生产的加藤解冻液,内有4种液体,分别是TS、DS、WS1和WS2 。第一步把贮存有胚胎的载体从液氮中取出,迅速把尖端插到TS液内,1 min 后把胚胎转移至DS液中停留3 min,然后分别转移至WS1和WS2中停留5 min ,再将其转移至囊胚培养液液滴中培养 。
2.6 胚胎培养
将复苏后的胚胎用囊胚培养液清洗3遍,转移到囊胚培养液的培养皿中,置CO2培养箱中继续培养 ,观察囊胚的形成情况。 同时,观察未冷冻的对照组鼠胚发育情况,记下相应的数据。
2.7 统计学分析
采用 SPSS 16.0 统计学软件处理数据,组间比较采用卡方检验,P<0.05为差异有统计学意义。
3 结果
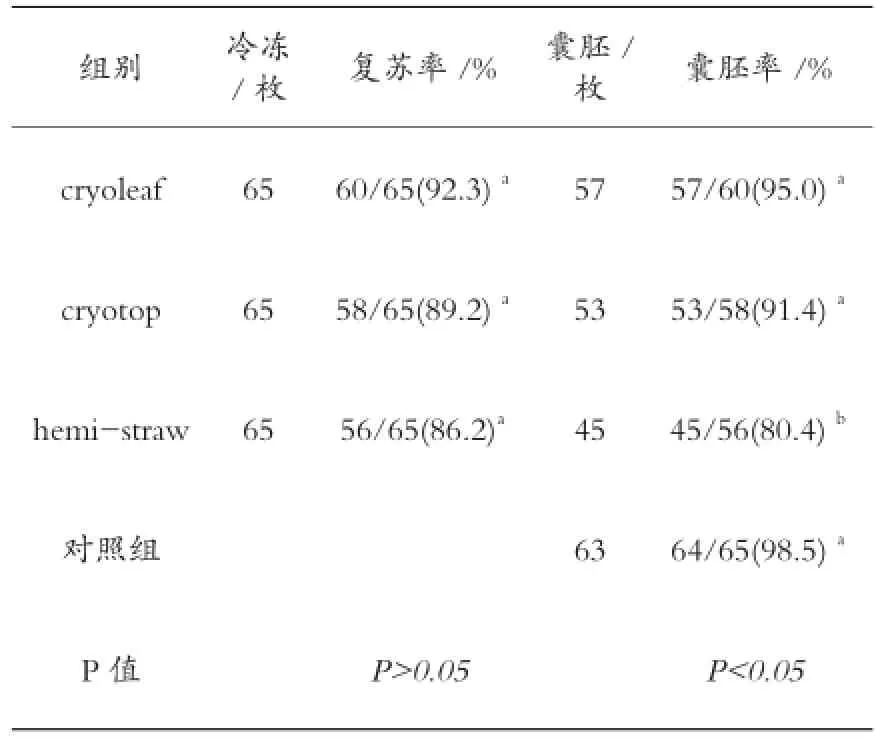
表1 不同冷冻载体玻璃化冷冻效果的比较
如表1所示:在复苏率方面,Cryoleaf组为92.3%,Cryotop为 89.2%,hemi-straw组为86.2%,三组之间比较差异不显著(P>0.05) ;在囊胚形成率方面,Cryoleaf组为95.0% 与Cryotop组91.4%比较差异不显著(P>0.05),与hemi-straw组比较差异显著 (P<0.05);新鲜对照组囊胚形成率为98.5%,与Cryoleaf组、Cryotop组比较差异不显著(P>0.05),与自制hemi-straw组比较差异显著(P<0.05)。
4 讨论
玻璃化冷冻使胚胎避免了冷冻损伤和冰晶形成[6,7],达到最佳冷冻保存的效果。本研究应用Cryoleaf、Cryotop、hemi-straw三种冷冻载体,通过玻璃化冷冻方法冻融昆明小鼠8-cell期胚胎,结果提示,3组复苏率在86.2%~92.3%,与文献报道相一致[8,9]。自制hemi-straw组的囊胚形成率与新鲜对照组相比差异显著,其余两组与新鲜对照组比较差异不显著。 原因可能为自制hemi-straw管壁较厚,在冷冻时接触液氮降温速率要慢些,这可能导致胚胎的不可逆冷冻损伤,而使胚胎的发育潜能在一定程度上受到损害[10]。Cryoleaf是一种由叶片、硬柄及外套管组成的冷冻载体,冷冻时将胚胎置于叶片上,套上外套管后投入液氮。其优点是装管方便,在投入液氮之前就可以很直观地装管,且避免了胚胎直接与液氮接触,阻止了在冷冻过程中液氮里面可能存在的各种病原体对胚胎的潜在感染[11]。Cryotop法是在2005年由kuwayama提出的通过最小化溶液体积提高冷却速率的新方法[12]。 这种载体是将一个很薄的塑料膜窄条(长20 mm,宽0.4 mm,厚0.1 mm)连接在一个塑料柄上制成的。王海松等对比几种载体后发现,Cryotop法是4种方法中最为理想的方法[13]。本研究显示,使用Cryoleaf 和Cryotop 两种载体冷冻胚胎冻融后的复苏率和囊胚率差异均不显著,表明两种冷冻载体均可应用于小鼠胚胎的冻存。
玻璃化冷冻降温速率依赖于载体材料的热传导性,因此,载体方面还有很多改进之处。根据苏风民等的研究发现,除不锈钢外,单晶硅、铝合金、铜、金、银等材料都可以作为冷冻载体的基体材料,它们导热系数的变化对冷冻载体总传热热阻影响很小[14]。因此,前端应该用散热快的金属制成,载体的持续改进将会给细胞的冷冻复苏带来更好的结果。
综上所述,使用冷冻叶片和冷冻帽作为冷冻载体具有复苏率高、囊胚形成率高的优点,优于自制半麦管。
5 结论
采用玻璃化冷冻方法冻存小鼠8-cell期胚胎 ,使用Cryotop和Cryoleaf作为冷冻载体,可以获得更高的复苏率和囊胚率,优于自制hemistraw,可以很好地用来冻存人类的胚胎。
[ 1 ]Wong JY,Wong AY. Phasing—in of vitrification into routine practice:why,how,and what[J].Hang Kong Med J,2011,17 (2:119-126 .
[ 2 ]JainJ K, Paulson R J. Oocyte cryopreservation [J].Fert Steril,2006, 86 (suppl3 ):1037 —46 .
[ 3 ]冼英杰,李付广,周秀琴,等.玻璃化冷冻方法三种冷冻载体冻存卵裂期胚胎效果的比较[J].中国临床研究,2014,27 (6):658-660 .
[ 4 ]Andras N,Marina G,Kristina V,等.小鼠胚胎实验操作手册[M].北京:化学工业出版社, 2006:156-158,420-422 .
[ 5 ]Racowsky C,Ohno-Machado L,et al.Is there an advantage in scoring early embryos on more than one day? Hum Reprod,2009,24(9):2104.
[ 6 ]Vajta G,Kuwayama M.Improving cryoproservation systems[J].Theriogenology,2006,65(1):236 -244.
[ 7 ]Mazur P.Freezing of living cells:mechansms and implications[J].Am J Physiol,1984,247 (3 Pt1):C125-142.
[ 8 ]孙迎利,张敏,常秀峰,等.人卵裂胚和囊胚的玻璃化冷冻及临床应用[J].中国优生与遗传杂志,201l,19(1):106-108.
[ 9 ]苏雁,张军强,李秀玲,等.Cryotop玻璃化冷冻人类卵裂期胚胎的临床应用[J].江苏医药,2012,38(4 ):409-411 .
[10]AbdelHafez, Faten,Jing Xu, et al.Vitrification in Open and Closed Carriers at Different Cell Stages: Assessment of Embryo Survival, Development, DNA Integrity and Stability during Vapor Phase Storage for Transport[J]. BMC Biotechnology, 2011,11(1):29
[11]Catherine M, H, Combelles S, Temel Ceyhan, et al. Maturation outcomes are improved following Cryoleaf vitrification of immature human oocytes when compared to choline-based slow-freezing [J].Journal of Assisted Reproduction and Genetics, 2011,28(12):1183-1192.
[12]Kuwayama M. Highly efficient vitrification for cryopreservation of human oocytes and embryos:the Cry otop method[J].Theriogenology,2007,67 (1):73-80 .
[13]王海松,周新丽,刘宝林,等.用于卵母细胞玻璃化冷冻的几种方法的传热分析[J].低温与超导,2011,39 (4):1-5 .
[14]苏风民,石珂玮,王朝冰,等.基于薄液膜蒸发的玻璃化冷冻方法中冷冻载体的传热优化[J].工程热物理学报,2015,36(7):1510-1514 .
Comparison of the effects of different carriers on mouse embryos
SHAO Ming-qing, SHAO Nan-qi
(1.Linfen Fourth People's Hospital, Linfen 041000; 2.Zhengzhou Shuqing Medical College,Zhengzhou 450064)
To study the effects of Cryoleaf、Cryotop and hemi-straw on the survival of 8-cell embryos in Kunming mice. The Cryoleaf, Cryotop and hemi-straw were used to cryopreserve Kunming mice 8-cell embryos by vitrification. Methods 8-cell embryos were collected and randomly divided into Cryoleaf group, Cryotop group, hemi-straw group and control group. The recovery rate and blastocyst formation rate after freezing and thawing were compared. Results Cryoleaf group, Cryotop group and Hemi-straw group is 92.3%, 89.2% and 86.2% respectively. There was no significant difference between the three groups (P> 0.05) The blastocyst formation rate of fresh control group was 98.5%, which was not significantly different from that of Cryoleaf group and Cryotop group (P> 0.05). The blastocyst formation rate was 95.0%, 91.4% and 80.4% 0.05). There was significant difference compared with selfmade hemi-straw group (P <0.05). Conclusion Cryotop and Cryoleaf can be used as cryopreservation medium for cryopreservation of mouse embryos at 8-cell stage by vitrification. The higher recovery rate and blastocyst rate can be obtained, which is better than that of homemade hemi-straw. Can be well used for cryopreservation of human embryos.
vitrification; 8-cell embryos; hemi-straw; carrier
S814.3
A
1005-2739(2017)03-0011-04
2017-03-01
安徽省科研资助计划项目(自然科学)(2006jq1128)资助
邵明清(1982-),男,河南商丘人,硕士,实验师,研究方向:胚胎工程。Email: shaomingqing@126.com

