构筑山羊卵母细胞体外成熟体系的研究
潘文平,康 浩,康 永
(1.荔浦师范学校, 广西 桂林 546600;2.南宁市第一中学,广西 南宁 530012;3.西北工业大学, 陕西 西安 710072)
构筑山羊卵母细胞体外成熟体系的研究
潘文平1,康 浩2,康 永3
(1.荔浦师范学校, 广西 桂林 546600;2.南宁市第一中学,广西 南宁 530012;3.西北工业大学, 陕西 西安 710072)
通过探讨不同浓度的FSH、LH及HMG对山羊的卵母细胞体外成熟体系影响因素,构筑山羊的卵母细胞的体外成熟体系,为山羊核移植及以后的优良育种奠定基础。
卵母细胞;FSH;LH;HMG;体外成熟;山羊
卵母细胞的发育成熟是一极其复杂和动态的过程。这一过程中除了mRNAs转录以及蛋白质合成外,还存在其他物质发生降解现象[1]。在体外进行卵母细胞成熟培养过程中,通常以排出第一极体来判断其成熟性,该过程也是核成熟的标志。除了卵母细胞的核成熟以外,其胞质的成熟也很重要,尤其是在核移植过程中,卵母细胞胞质的成熟性关系到供体核能否实现再程序化以及重构胚能否分裂发育[2]。当前使用的卵母细胞成熟体系并非完美无缺,卵母细胞的成熟和后续发展的重要物质不能完全合成。卵母细胞体外成熟使用最广泛、稳定的基本培养基为TCM199。
激素是卵母细胞成熟培养的重要成分,尤其是促性腺激素,在成熟期起着重要作用。LH和FSH是使用频率较高的促性腺激素[3]。卵泡刺激素(FSH)是调节卵泡发育的重要激素,能促进卵泡颗粒细胞加速有丝分裂和分泌卵泡液,使卵泡成熟排卵[4]。LH可以恢复卵母细胞减数分裂,成熟的卵泡分泌前列腺素[5]。另外,人们还通过添加一些生长激素、生长因子和其他添加物质,如卵泡液、非离子型表面活性剂、副甲状腺素相关蛋白(PTHrP)、成熟分裂激活物(MAS)等物质来提高卵母细胞的体外发育和成熟。
本文通过探讨山羊卵母细胞在不同FSH、LH浓度下卵母细胞的体外成熟的效果,以期建立山羊卵母细胞体外成熟培养体系,对山羊的繁殖、育种提供科学依据,同时为山羊的种质资源保护给予参考。
1 材料与方法
1.1 试验材料
山羊卵巢采集于桂林某屠宰场。TCM199,上海联硕生物科技有限公司;链霉素、青霉素,华北制药股份有限公司;表皮生长因子、转铁蛋白等三价因子(ITS)、尿嘧啶、透明质酸酶,核染色剂Hochest33342、BSA、丙酮酸钠、L-谷氨酰胺(L-Glutamine),Sigma公司;肝素钠,苏州市苏牧动物药业有限公司;LH、FSH,宁波第二激素厂;HMG,西宝生物科技(上海)股份有限公司。
1.2 主要仪器
倒置荧光显微镜:日本,OLMPUS,IX71;CO2培养箱:上海旦鼎国际贸易有限公司MM-02470-00;体视显微镜:麦克奥迪 SMZ-168;电热恒温鼓风干燥箱:上海苏达实验仪器;双重纯水蒸馏器:上海亚荣生化仪器厂;超净工作台:江苏净化仪器制造厂;恒温水浴锅:北京长安科学仪器厂;超低温冰箱:美国,FORMA SCIENTIFIC;手术器械:山东新华医疗器械股份有限公司。
1.3 试验方法
1.3.1 卵丘-卵母细胞复合体(COCs)的收集
从屠宰场刚宰杀的母羊体内剪下卵巢,保存在加有双抗(青霉素与链霉素)的30~35℃灭菌生理盐水的保温瓶中,4 h内运回实验室用于试验。用预温30~35℃的灭菌生理盐水清洗卵巢3遍,用剪刀进行修剪卵巢,减去多余的脂肪和结缔组织,以减少对实验的干扰。将处理好的卵巢放入盛有采卵液的平皿中,用无菌手术刀片切开卵巢表面2~6 mm大小的卵泡,使之释放出卵泡液和COCs。用排卵针捡取卵丘-卵母细胞复合体,检出的COCs分为A,B,C 3级:A级,卵丘细胞完整,卵母细胞胞质均匀;B级,卵丘细胞不完整,卵母细胞胞质均匀;C级,卵母细胞裸露,或胞质略有退化。选择A,B 级进行培养。
采卵液:TCM199 + 1%FBS +100 mg/mL肝素钠+100 IU/mL青霉素+100 IU/mL链霉素。
1.3.2 卵丘-卵母细胞复合体的体外成熟培养
将收集到的A、B级COCs用洗卵液清洗3~4次,然后置于预平衡2 ~3 h含1 mL成熟液的U型皿中,进行体外成熟培养。培养条件为38.5℃、5 % CO2饱和湿度,培养22~24 h。洗卵液:TCM199+2 % FBS。
收集到的卵母细胞分8组,第1组用TCM199作为空白对照组,其他7组使用不同的培养液进行体外成熟培养,同一实验组重复3次。
对照组:TCM199;基础成熟液:TCM199 + 10mg/mL BSA + 1× ITS + 50μg/mL尿嘧啶+ 2.5 mmol/L谷氨酰胺+1 mmol/L丙酮酸钠+50 μg/mL EGF+1μg/mL β-E2
OM Ⅰ:基础成熟液+100 μg/mL FSH+20 μg/mL LH;OM Ⅱ:基础成熟液+200 μg/mL FSH+40 μg/mL LH;OM Ⅲ:基础成熟液+300 μg/mL FSH+60 μg/mL LH;OM Ⅳ:基础成熟液+0.05 IU/mL HMG;OM Ⅴ:基础成熟液+0.1 IU/mL HMG;OM Ⅵ:基础成熟液+0.15 IU/mL HMG;OM Ⅶ:基础成熟液+0.2 IU/mL HMG。
1.3.3 卵母细胞体外成熟效果判断
将成熟培养后的COCs放置在含有0.3%的透明质酸酶杜氏磷酸盐缓冲盐水轻轻将用移液管从表面去除卵丘细胞的卵母细胞。在体视显微镜下,以异物针拨动卵母细胞进行观察,观察第1极体是否排出,或使用含有Hochest 33342的洗卵液染色,通过荧光显微镜观察是否有发光的极体分布于卵母细胞透明带以内。以排出第1极体的定为成熟,否则定为不成熟。
2 结果与讨论
2.1 FSH和LH对山羊卵母细胞体外成熟的影响
研究了不同浓度FSH和LH对山羊卵母细胞体外成熟的影响。观察COCs在体外培养22 h的卵丘细胞,发现有增殖现象(图1)。随着激素浓度的增加,卵丘细胞增殖速度加快,扩散直径增大,空白对照(图1-A)

图1 FSH与LH对山羊卵丘-卵母细胞复合体扩散度的影响(100×)
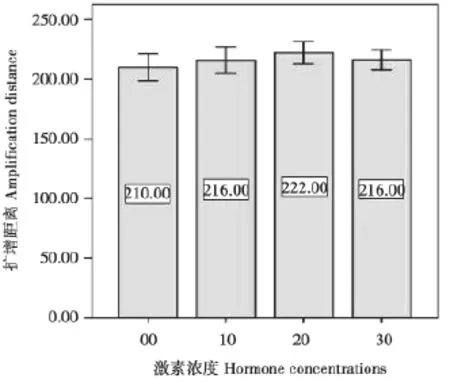
图2 不同FSH和LH激素浓度卵母细胞的扩增距离
在山羊卵母细胞成熟培养液中添加不同浓度的FSH和LH对卵母细胞成熟率影响不同。成熟培养液分别加入100 μg/mL FSH和20 μg/ mL LH后,卵母细胞成熟率为57.9%,与参照组的成熟率有较大差异。成熟培养液分别加入200 μg/mL FSH、40 μg/mL LH的OMⅡ成熟率为68.8%,与参照组的成熟率有较大差异。添加300 μg/mL FSH和60 μg/mL LH的OM Ⅲ成熟率54.6%,与对照组差异显著(表1)。OMⅡ的成熟率与OMⅠ和OM Ⅲ的成熟率差异显著。结果表明,成熟液中FSH和LH浓度适中对山羊卵母细胞体外成熟有重要影响,高浓度激素对卵母细胞成熟有抑制作用。
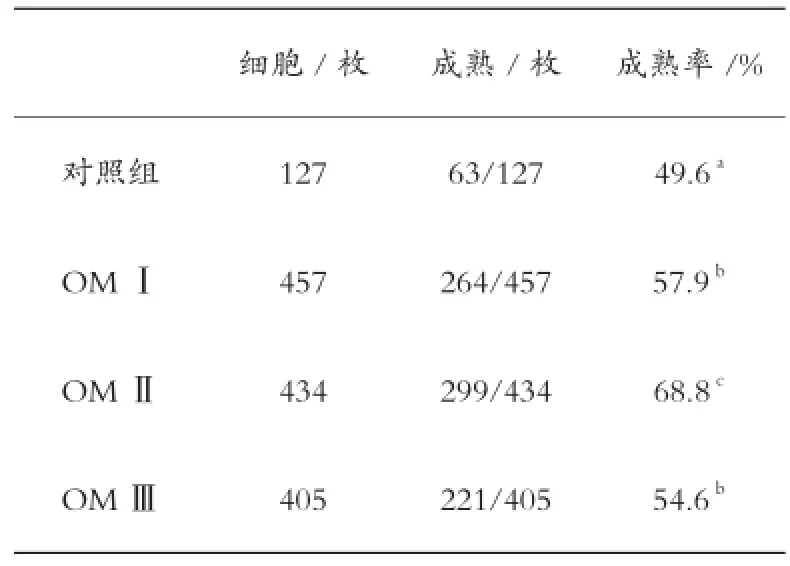
表1 不同FSH和LH浓度对山羊卵母细胞体外成熟的影响
2.2 HMG对卵母细胞体外成熟的影响
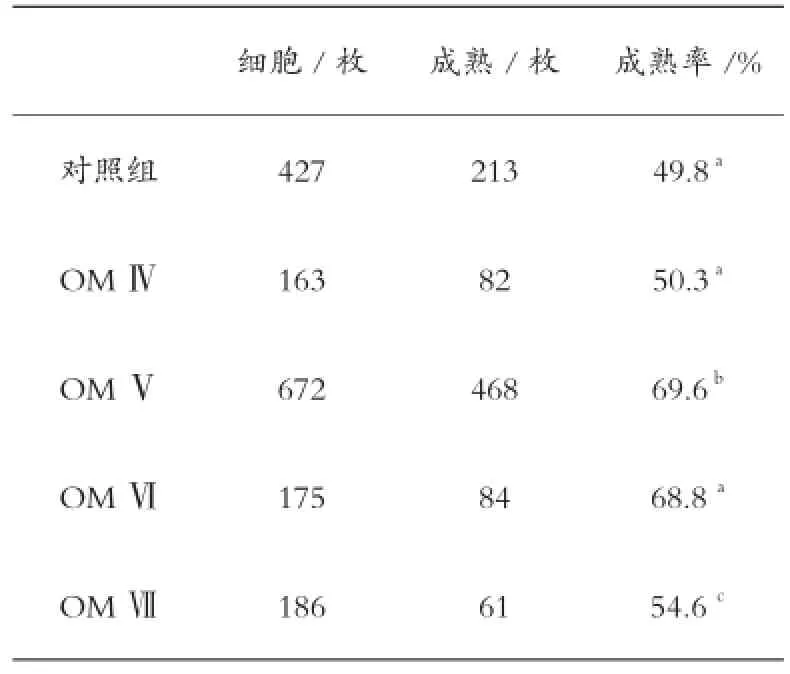
HMG(FSH∶LH≈1∶1)可以在卵母细胞成熟中取代FSH和LH激素添加。HMG可促进卵母细胞的增殖(图3)。经过22 h的培养,卵丘细胞扩散直径表现为对照组(图3A) 图3 HMG对卵丘-卵母细胞复合体(COCs)扩散的影响(100×) 在成熟培养液中添加不同浓度的HMG,卵母细胞的成熟率不同见表2。 表2显示,添加0.1 IU/mL HMG的成熟率为69.6%,与对照组差异性显著。这表明 0.1 IU/ mL HMG添加培养液中有利于卵母细胞的成熟。而随着浓度不断增加成熟率降低,说明过多的HMG对山羊卵母细胞的成熟有抑制作用。 表2 HMG浓度对山羊卵母细胞体外成熟的影响 (1) 成熟液Ⅰ、成熟液Ⅱ、成熟液Ⅲ中卵母细胞成熟率在68.8%~54.6%。在成熟液Ⅰ、成熟液Ⅱ中,随着激素浓度的增加,成熟率与浓度呈正相关。在成熟液Ⅱ、成熟液Ⅲ中,随着激素浓度的增大,卵母细胞的成熟率有着较大差异。成熟率为(73.0~53.6)%的卵母细胞,其HMG的浓度在0.1 IU/mL~0.2 IU/mL。 (2) 随着激素浓度的增加,成熟率下降。HMG含有1∶1的 FSH和LH,已被证明是用来代替FSH和LH的成熟培养山羊和牛卵母细胞。本研究比较了FSH和LH对山羊卵母细胞成熟的影响。结果表明,200 μg/L FSH和40 μg/L LH对卵母细胞成熟的影响略低于0.1 IU/mL HMG,这与其他研究结果稍微不同,可能是由于激素的不同生产厂家造成的。笔者认为该差异有可能是因为激素来源不同引起的。 (3) 山羊卵母细胞以同样的方式不添加激素也会获得一定的成熟率。在成熟培养过程中,山羊卵母细胞第1极体的排出受FSH和LH和HMG的浓度影响较大,但浓度过高也会对山羊卵母细胞成熟率有抑制作用。 [ 1 ]孙晓萍, 郎侠, 杨博辉, 等. 提高山羊繁殖性能的几种方法[J]. 畜牧与饲料科学, 2010, 31(3): 91-92. [ 2 ]Edwards R G. Maturation in vitro of mouse, sheep, cow, pig, rhesus, monkey and human ovarian oocytes[J]. Nature, 1965, 208: 349-351. [ 3 ]武浩.小鼠、山羊交互异种核移植研究[D]. 杨凌: 西北农林科技大学, 2004. [ 4 ]石德顺, 卢克焕. 牛卵泡液对牛卵母细胞体外成熟的影响[J]. 广西农业大学学报,1994, (13): 1-5. [ 5 ]徐建祥, 周木清, 陈小武, 等. 不同条件对牛卵母细胞体外成熟的影响[J]. 黑龙江动物繁殖, 1996, 4(2): 13-14. S826.3 A 1005-2739(2017)03-0015-05 2017-02-15 潘文平(1983-), 女,广西桂林人,本科,从事生物教学及新型生物材料应用研究工作。 康永, 男,陕西富平人,博士。 E-mail:kangyong_1204@163.com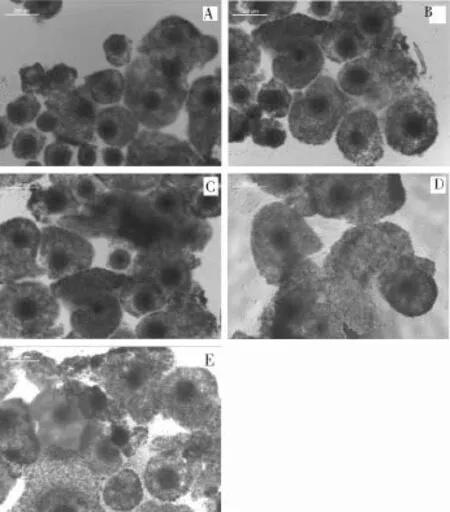

3 结论

