CpG ODN对水貂免疫增强效果的研究
冷雪,董鹏,胡桂学,李建明,刘 艺,孙志博,张姗姗,杜锐
(吉林农业大学中药材学院,长春 130118)
CpG ODN对水貂免疫增强效果的研究
冷雪,董鹏,胡桂学,李建明,刘 艺,孙志博,张姗姗,杜锐*
(吉林农业大学中药材学院,长春 130118)
为获得对水貂具有免疫刺激活性的CpG ODN序列,设计合成了45种含不同CpG基序的DNA序列,应用MTS比色法测定合成CpG ODNs刺激水貂PBMC增殖的能力,结果有11条CpG ODN对水貂PBMC有刺激活性(SI>2);应用SI值大于5的6种CpG ODN分别与水貂伪狂犬灭活疫苗联合免疫水貂,免疫后经水貂血清抗伪狂犬中和抗体效价测定和水貂PBMC非特异性增殖效应检测,结果有3个CpG ODN序列对水貂具有较好免疫增强作用,分别是CpG-21(ATCGATTTGTCGTTATCGAT)、CpG-23(ATCGATGAACGTTAACGTTTC)和CpG-24(AACGTTCATCGA ̄TATCGATGT)。本研究获得3条对水貂具有较好免疫刺激活性的CpG ODN序列,可为水貂新型CpG佐剂的研究提供参考。
CpG ODN;佐剂;水貂;细胞增殖
含非甲基化CpG基序的寡聚脱氧核苷酸(CpG ODN)通过与细胞中的TLR9结合,能刺激人及哺乳动物的天然免疫系统,诱导产生以Th1型为主的天然免疫应答[1-2],在作为佐剂方面显示出巨大的应用潜力。根据CpG ODN的结构和对人外周血单个核细胞(peripheral blood mononuclear cell, PBMC)作用的不同,可将其分为3种类型:A型(或D型)、B型(或K型)和C型。A型CpG ODN能够直接刺激pDC分泌高水平IFN-α/β。同时,通过Ⅰ型IFN的作用,A型CpG ODN还能够促进单核细胞向DC发展,促进其CD80、CD86、MHCII分子表达的上调;间接活化NK细胞,刺激IFN-γ诱导蛋白(IFN-γ inducible protein-10, IP-10)的产生,进而诱导IFN-γ的产生。B型CpG ODN能刺激B细胞增殖和活化,刺激IgM和IL-6的分泌增加;C型CpG ODN兼有A型和B型CpG ODN的免疫刺激活性,既能诱导pDC分泌高水平的IFN-α,又能刺激B细胞活化增殖[3-5]。3种类型的CpG ODN中,由于B型具有强大的促进体液免疫和细胞免疫应答的作用,因此,近年来已被作为新型佐剂用于多种疫苗的研究[6-8]。
目前,针对于动物用新型佐剂CpG ODN的研究主要集中于牛、猪、鸡和犬等,而对水貂具有免疫刺激活性的CpG ODN序列的研究尚未报道,因此,本研究以对不同种类动物具有免疫刺激活性的CpG基序为核心,设计合成多条CpG ODN序列,分析其对水貂的免疫刺激活性,获得了3条对水貂具有较好免疫刺激活性的CpG ODN序列,为水貂用新型CpG佐剂的研究提供依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 IMDM细胞培养液和MEM细胞培养液均购自Gibco公司;胎牛血清、外周血单个核细胞分离试剂盒均购自天津市灏洋生物制品科技有限责任公司;ConA购自上海研生实业有限公司;MTS购自Promega公司。
1.1.2 细胞和病毒 猪睾丸细胞由本实验室保存。伪狂犬病毒JL1株,由本实验室分离鉴定。
1.1.3 疫苗和实验动物 伪狂犬灭活疫苗由实验室应用分离的伪狂犬病毒JL1株经灭活后与ISA206佐剂混合制备,每毫升病毒含量为107.0TCID50。新生2月龄健康水貂,体重约600 g,均为雌性水貂,未进行疫苗接种,购自黑龙江帽儿山水貂养殖场。
1.2 方法
1.2.1 CpG ODN的设计合成 根据文献报道的分别对人、猪、犬和猫有效的CpG基序,包括GTCGTT、GACGTT、GACGAT、ATCGAT、AACGTT,设计合成45条CpG ODN序列;GC-ODN为不含CpG基序的阴性序列;全部CpG ODN的核酸骨架进行硫代修饰,由生工生物工程(上海)股份有限公司合成。
1.2.2 水貂外周血PBMC的分离和培养 水貂心脏采血,用含肝素的无菌真空采血管收集血液,将血液于室温以250 r/min离心10 min,弃去血浆。按照外周血单个核细胞分离试剂盒使用说明,加入弃去血浆体积1.5倍的稀释液,轻轻混匀。将经稀释处理的血液缓慢加入等量的分离液液面上,400 r/min室温离心20 min。吸弃分离液上层0.5 cm以上的上清液,吸取剩余分离液层及单个核细胞层,加入10 mL细胞洗涤液,混匀。250 r/min室温离心10 min,弃上清,加入5 mL细胞洗涤液重悬细胞,250 r/min室温离心10 min,弃上清。重复洗涤一次,加入5 mL含10%胎牛血清的IMDM营养液重悬细胞,吹打均匀,取出部分细胞计数待用。
1.2.3 CpG ODN刺激水貂PBMC增殖能力检测将水貂PBMC浓度调至4.0×106个/mL,接种于96孔细胞培养板,每孔100 μL。分别加入阴性对照GC-ODN和设计合成的45条CpG ODN,CpG ODN的终浓度为10 μg/mL;阳性对照孔加入ConA溶液,终浓度为10 μg/mL;空白组加入与CpG ODN等体积的PBS,每组3个复孔。将96孔细胞培养板置于37 ℃、5% CO2培养箱中培养48 h。培养结束前4 h每孔加入20 μL MTS溶液,培养结束后立即用酶标仪检测各孔波长490 nm的OD值,计算刺激指数: SI=(OD样品-OD空白)/(OD阴性-OD空白)。
1.2.4 动物分组及免疫 将试验水貂随机分成8组,每组5只。疫苗组,每只注射伪狂犬灭活疫苗1 mL;疫苗+CpG ODNs组,每只注射1 mL伪狂犬灭活疫苗和80 μg CpG ODNs,所使用CpG ODNs为对水貂PBMC具有刺激活性,且SI值大于5的CpG-2、CpG-7、CpG-10、CpG-21、CpG-23和CpG-24,分别与疫苗联合免疫;对照组,每只注射1 mL灭菌PBS液;注射部位均为后腿部肌肉。各组水貂均于初次免疫后2 周加强免疫1 次,注射部位及剂量与初次免疫相同。首次免疫当日,免疫后7、14、21和28 d分别采血,分离血清,使用Spearman-Karber法计算中和抗体效价,中和抗体效价大于1︰2为阳性,中和试验中使用伪狂犬病毒滴度范围为500~3000 TCID50/mL。
1.2.5 免疫后水貂PBMC非特异性增殖效应1.2.4中水貂二次免疫后14 d,心脏采血,用含肝素的无菌真空采血管收集血液,按照1.2.2中方法分离水貂PBMC,按照1.2.3中方法将水貂PBMC接种于96孔细胞培养板,每个样品设3个重复,每孔加入终浓度为10 μg/mL的ConA,同时每个样品设不加ConA的自然增殖孔作为对照。将96孔细胞培养板置于37 ℃、5% CO2培养箱中培养48 h。培养结束前4 h每孔加入20 μL MTS溶液,培养结束后立即用酶标仪检测各孔波长490 nm的OD值。
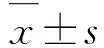
2 结 果
2.1 CpG ODN刺激水貂PBMC增殖能力检测
由表1可知,淋巴细胞转化方法测定45条CpG ODN刺激水貂PBMC增殖能力,有11个CpG ODN序列对水貂PBMC具有刺激活性(SI>2)(表1),其所含CpG基序分别为ATCGAT、AACGTT、GTCGTT,其中CpG-2(TCAACGTTGAACGTTTAACGTTA)、CpG-7(ATCGATATCGATATCGAT)、CpG-10(TCAACGTTCCAACGTTT)和CpG-21(ATCGATTTGTCGTTATCGAT)四条序列的SI值均大于5,CpG-23(ATCGATGAACGTTAACGTTTC)和CpG-24(AACGTTCATCGATATCGATGT)二条序列的SI值均大于10。
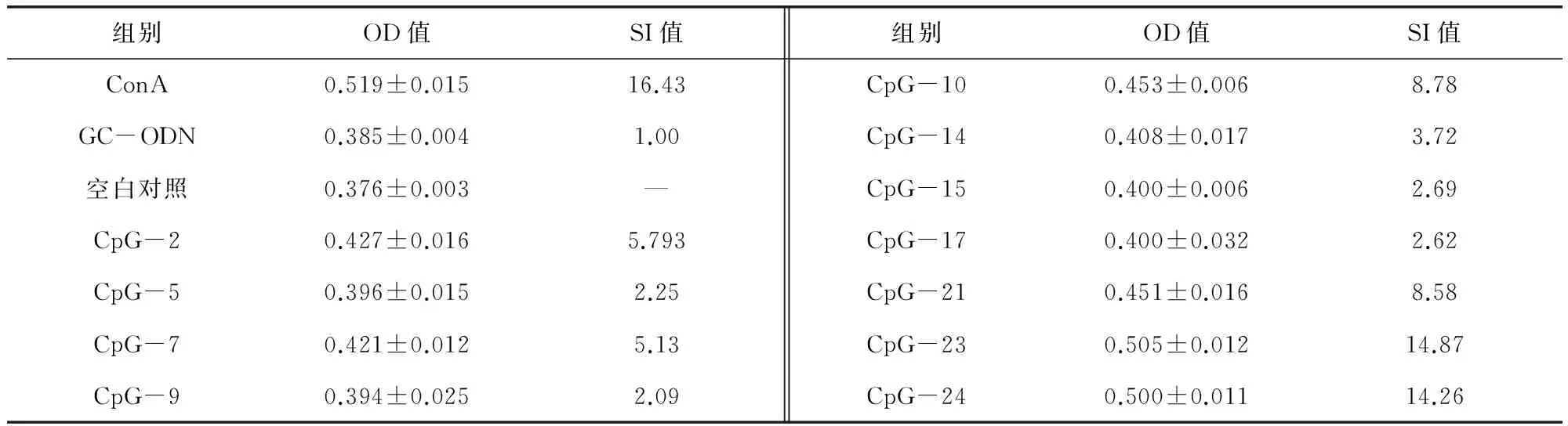
表1 对水貂PBMC具有刺激活性的CpG ODN序列Tab 1 CpG ODN sequence with stimulatory activity to mink PBMC
2.2 CpG ODN序列对水貂伪狂犬灭活疫苗中和抗体效价的影响 由图1可知,将伪狂犬灭活疫苗分别与CpG-2、CpG-7、CpG-10、CpG-21、CpG-23和CpG-24联合免疫水貂,免疫前各组水貂抗伪狂犬病毒中和抗体水平均小于1︰2,初次免疫后第14 d,疫苗组和疫苗+CpG ODNs组水貂血清中开始产生抗伪狂犬病毒中和抗体,初次免疫后第21 d和28 d各免疫组中和抗体水平均明显高于对应组第14 d的中和抗体水平(图1)。其中疫苗+CpG-23组血清中和抗体效价高于疫苗单独接种组和其他疫苗+CpG ODNs组,且差异显著(P<0.05);疫苗+CpG-24组血清中和抗体效价高于疫苗单独接种组和疫苗+CpG-2组、疫苗+CpG-7组和疫苗+CpG-10组;疫苗+CpG-21组与疫苗+CpG-10组血清中和抗体效价无明显差异,但明显高于疫苗组和疫苗+CpG-2组、疫苗+CpG-7;疫苗组、疫苗+CpG-2组、疫苗+CpG-7组和疫苗+CpG-10组间血清中和抗体效价无明显差异(P>0.05)。试验期内,空白对照组水貂血清始终未检测到抗伪狂犬病毒中和抗体。

同一时间点各组抗体水平标注不相同字母者为差异显著(P<0.05);免疫0 d各组水貂抗伪狂犬病毒中和抗体均为阴性,因此未在图中显示At the same time point, each group of antibody levels are marked with different letters show the difference was significant (P<0.05) .Immunization 0 d each group of mink anti-pseudorabies virus neutralizing antibody were negative, so not shown in the figure图1 不同CpG ODN序列与疫苗联合免疫后水貂血清中和抗体水平Fig 1 Neutralizing antibody level of mink serum after immunization with different CpG ODN sequences and vaccine
2.3 水貂PBMC非特异性增殖效应 由表2可知,与对照组相比,疫苗组、疫苗+CpG ODNs组水貂PBMC经ConA诱导的增殖反应均明显增强,且差异显著(P<0.05);疫苗+CpG-23组、疫苗+CpG-24组水貂PBMC经ConA诱导的增殖反应高于疫苗组和其它疫苗+CpG ODNs组,且差异显著(P<0.05);疫苗+CpG-10组和疫苗+CpG-21组间无显著差异,高于疫苗组、疫苗+CpG-2组和疫苗+CpG-7,且差异显著(P<0.05);疫苗+CpG-2组、疫苗+CpG-7和疫苗组间无显著差异(P>0.05)。
3 讨 论
CpG ODN作为新型佐剂,其作用机理主要为通过与细胞中的TLR9结合,激活机体的天然免疫应答,促进抗病毒细胞因子及抗体的产生,从而增强疫苗的免疫保护效果。CpG ODN作为疫苗佐剂在人用乙肝疫苗已进入临床阶段。在与动物疫苗,如鸡新城疫疫苗、猪繁殖障碍与呼吸道综合征疫苗和犬瘟热疫苗等联合使用中也表现出较好的增强作用[9-11]。不同类型CpG ODN佐剂效应存在很大差异,在影响CpG ODN免疫刺激活性的各种因素中起到最关键作用的是以CpG为核心的六核苷酸基序,研究表明CpG基序GTCGTT对人及多种哺乳动物敏感,CpG基序GACGTT对鼠敏感,CpG基序GTCGTT和ATCGAT对猪敏感,CpG基序AACGTT对犬敏感[12-14]。由于目前还没有水貂敏感基序方面的报道,本研究参考多种CpG六核苷酸基序设计合成CpG ODN序列,经体外淋巴细胞转化试验和动物免疫试验,结果表明,CpG-21、CpG-23和CpG-24对水貂具有较好的免疫刺激活性,其所含CpG基序分别为GTCGTT、ATCGAT和AACGTT,其中CpG-21所含CpG基序为ATCGAT和GTCGTT,CpG-23和CpG-24所含CpG基序均为AACGTT和ATCGAT,而CpG-23和CpG-24对水貂的免疫增强作用更为明显,说明AACGTT基序和ATCGAT基序组合可能对水貂具有更好的刺激活性。对于CpG基序的研究多集中于单个CpG六核苷酸基序的重复,本研究将不同CpG基序进行组合,并取得了较好的刺激效果,为CpG ODN的设计提供参考。近年来,水貂感染伪狂犬病毒的病例不断增加,而目前尚无用于水貂伪狂犬病防控的疫苗,因此,本研究选择伪狂犬病毒作为试验毒株,为进一步水貂伪狂犬病疫苗的研究奠定基础。
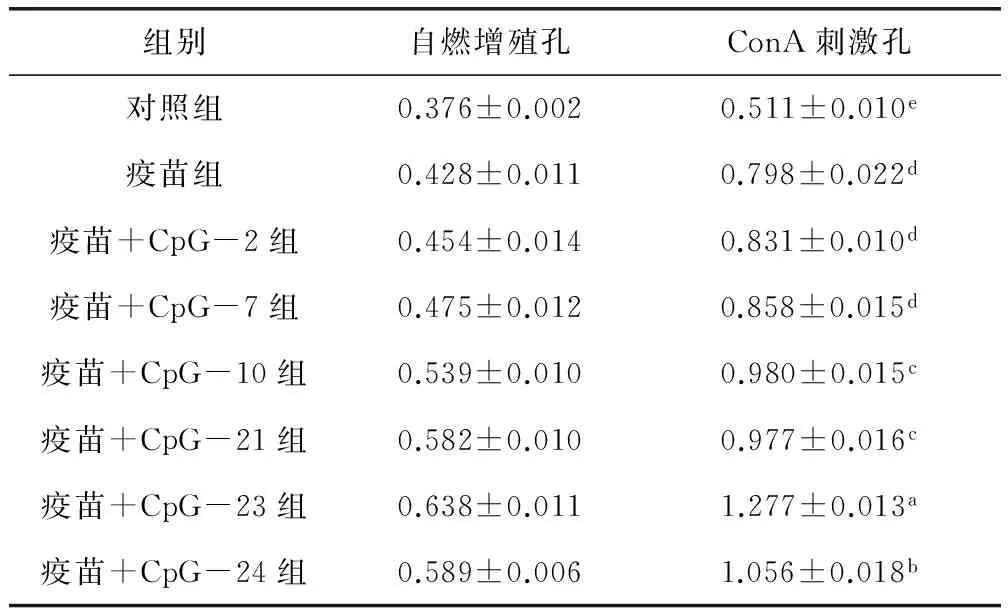
表2 各组水貂PBMC非特异性增殖效应Tab 2 Non-specific proliferation of mink PBMC in various groups
同一行中含有不相同字母者为差异显著(P<0.05)
The same column contains different letters show the difference was significant (P<0.05)
综上所述,本研究获得3条对水貂具有较好免疫刺激活性的CpG ODN序列,为进一步开发适用于水貂的新型CpG ODN佐剂提供重要依据。
[1] Lahoud M H, Ahmet F, Zhang J G,etal. DEC-205 is a cell surface receptor for CpG oligonucleotides [J].Oncoimmunolody, 2013, 2(3): 16270-16275.
[2] Jassiesvan der L A, Rutten V, Spiering R,etal. The immunostimulatory effect of CpG oligodeoxynucleotides on peripheral blood mononuclear cells of healthy dogs and dogs with atopic dermatitis[J]. Vet J, 2014, 200(1): 103-108.
[3] Verthelyi D, Ishii, K J, Gursel M,etal. Human peripheral blood cells differentially recognize and respond to two distinct CpG motifs[J].J Immunol,2001,166(4):2372-2377.
[4] Marshall J D, Fearon K, Abbate C,etal. Identification of a novel CpG DNA class and motif that optimally stimulate B cell and plasmacytoid dendritic cell functions[J]. J Leukoc Biol, 2003, 73(6):781-792.
[5] Hartmann G, Battiany J, Poeck H,etal. Rational design of new CpG oligonucleotides that combine B cell activation with high IFN-alpha induction in plasmacytoid dendritic cells[J]. Eur J Immunol, 2003,33(6):1633-1641.
[6] Angel J B, Cooper C L, Clinch J,etal. CpG increases vaccine antigen-specific cell-mediated immunity when administered with hepatitis B vaccine in HIV infection[J].J Immune Based Ther Vaccines, 2008, 6(1):1-7.
[7] Mutwiri G, Benjamin P, Soita H,etal. Co-administration of polyphosphazenes with CpG oligodeoxynucleotides strongly enhances immune responses in mice immunized with Hepatitis B virus surface antigen[J]. Vaccine, 2008, 26(22):2680-2688.
[8] Moura-Costa L F, Bahia R C, Carminati R,etal. Evaluation of the humoral and cellular immune response to different antigens of Corynebacterium pseudotuberculosis in Caninde goats and their potential protection against caseous lymphadenitis[J]. Vet Immunol Immunopathol,2008,126(1/2):131-141.
[9] 李杰,杨汉春,郭鑫,等. CpG ODN对鸡新城疫LaSota活疫苗的免疫增强效应[J].畜牧兽医学报,2006,37(1):44-49.
Li J, Yang H C, Guo X,etal. Immune enhancement of GpG ODN on LaSota lived vaccine against Newcastle disease in chickens[J]. Chinese Journal of Animal and Veterinary Sciences, 2006, 371(1):44-49.
[10]徐 文,程 尧,温建新,等. CpG-ODN免疫增强序列的筛选[J]. 青岛农业大学学报,2008,25(2):105-108.
Xu W, Cheng R, Wen J X,etal. Screening of the Immuno-potetiation sequence of CpG-ODN[J]. Journal of Qingdao Agricul ̄tural University, 2008, 25(2):105-108.
[11]张玲华,郭勇,田兴山,等. CpG ODN对猪繁殖障碍与呼吸道综合征疫苗免疫影响的研究[J]. 中国畜牧兽医,2005,32(8):47-49.
Zhang L H, Guo Y, Tian X S,etal. Effect of CpG ODN on vaccine immunity of porcine reproductive disorders and respiratory syndrome[J].China Animal Husbandry and Veterinary Medicine, 2005, 32(8):47-49.
[12]郭爱珍, 唐泰山,陆承平. 细菌CpG-DNA对犬免疫增强效果的研究[J]. 中国兽医科学,2001,31(12):6-8.
Guo A Z, Tang T S, Lu C P. Adjuvanticity of bacterial CpG-DNA as a novel immune enhancer in dogs[J].Chinese Journal of Veterinary Science and Technology, 2001,31(12):6-8.
[13]Krieg A M, Hartmann G, Yi A K. Mechanism of action of CpG DNA[J].Curr Top Microbiol Immunol, 2000, 247: l-21.
[14]Kamstrup S, Verthelyi D, Klinman D M. Response of porcine peripheral blood mononuclear cells to CpG-containing oligodeoxynucleotides[J].Vet Microbiol, 2001, 78(4): 353-362.
(编辑:李文平)
Study on Immune Enhancement Effect of CpG ODN on Mink
LENG Xue, DONG Peng, HU Gui-xue, LI Jian-ming, LIU Yi, SUN Zhi-bo, ZHANG Shan-shan, DU Rui*
(College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China)
DU Rui, E-mail: durui71@126.com
Forty-five DNA sequences containing different CpG motifs were designed and synthesized to obtain the CpG ODN sequence with immunostimulatory activity against mink. MTS colorimetric assay was used to determine the ability of CpG ODNs to stimulate the proliferation of mink PBMC. The result showed that eleven CpG ODN has the stimulation activity to the PBMC of mink (SI>2). Six CpG ODNs with SI values more than 5 were used to immunize minks with mink pseudorabies inactivated vaccine respectively. Post immunization, the neutralizing antibody titer of anti-pseudorabies antibodies in mink serum was determined and the non-specific proliferation of mink PBMC was tested. The result showed that the CpG-21 (ATCGATTTGTCGTTATCGAT), CpG-23 (ATCGATGAACGTTAACG ̄TTTC), and CpG-24 (AACGTTCATCGATATCGATGT), respectively, which showed a good immunopotentiating effect on mink. In this study, three CpG ODN sequences with good immunostimulatory activity against mink were obtained, which can be used as a reference for the study of new CpG adjuvants in mink.
CpG ODN; adjuvants; mink; proliferation
10.11751/ISSN.1002-1280.2017.5.02
吉林省科技发展计划项目(20140307008NY,20140412009XH)
冷雪,博士,从事动物病毒学与生物制品学方向研究。
杜锐。E-mail:durui71@126.com
2016-11-29
A
1002-1280 (2017) 05-0007-05
S858.92

