ABCG2和ALDH1在卵巢子宫内膜异位症恶变中的表达和影响研究*
刘颂平,田 鑫,温 坚,殷新明
(江苏大学第四附属医院妇产科,江苏镇江 212000)
ABCG2和ALDH1在卵巢子宫内膜异位症恶变中的表达和影响研究*
刘颂平,田 鑫,温 坚,殷新明
(江苏大学第四附属医院妇产科,江苏镇江 212000)
目的 探讨三磷酸腺苷结合盒超家族G家族成员2(ABCG2)、乙醛脱氢酶1(ALDH1)在卵巢子宫内膜异位症恶变中的表达和意义。方法 采用免疫组织化学法检测38例卵巢子宫内膜异位症恶变患者(EMs恶变组),35例卵巢子宫内膜异位囊肿患者(EMs组),30例正常子宫内膜患者(对照组)中ABCG2、ALDH1蛋白的表达。结果 ABCG2、ALDH1在EMs恶变组中的阳性表达率明显高于EMs组及对照组,比较差异有统计学意义(P<0.05)。EMs恶变组中ABCG2、ALDH1的表达与患者年龄、痛经史及病理学类型无明显相关性,与血清CA125水平、病理分化程度及分期呈明显相关性(P<0.05);ABCG2的表达与ALDH1的表达无明显相关性(P>0.05)。结论 ABCG2、ALDH1可能与卵巢子宫内膜异位症恶变的发生、发展有关。
卵巢囊肿;子宫内膜异位症;变态反应和免疫学;干细胞;三磷酸腺苷结合盒超家族G家族成员2;乙醛脱氢酶1
子宫内膜异位症(endometriosis,EMs)是妇科的常见病和多发病,其恶变率约为1%,最常见于卵巢。恶变的卵巢EMs病理类型多为卵巢透明细胞癌及卵巢子宫内膜样癌,被称为EMs相关性卵巢癌(endometriosis associated ovarian carcinoma,EAOC)[1],目前恶变的具体机制不明。近年来,干细胞与卵巢癌发生、发展、复发、耐药等方面的相关性受到学者的广泛关注[2-3]。三磷酸腺苷结合盒超家族G家族成员2(ABCG2)、乙醛脱氢酶1(ALDH1)是常见的干细胞标志物,本课题组在前期研究中发现,ABCG2、ALDH1在EMs中存在异常表达,其可能与EMs的发生、发展有关[4-5]。本研究进一步探讨两者在卵巢EMs恶变组织中的表达,了解其在EMs恶变过程中的作用。
1 资料与方法
1.1 一般资料 收集2005年1月至2015年1月本院病理科存档蜡块。EMS恶变组为38例卵巢EMs恶变患者的病理切片,包括20例卵巢子宫内膜样癌,18例卵巢透明细胞癌。诊断标准[6-7]:(1)癌组织与EMs并存于同一病变;(2)二者具有组织相关性;(3)排除其他相关肿瘤的存在;(4)镜下可见EMs向恶性移行的依据。EMs组为同期手术的35例卵巢子宫内膜异位囊肿患者的病理切片。对照组为同期30例因宫颈上皮内瘤变Ⅲ级行子宫切除患者的正常子宫内膜的病理切片。标本采集经患者本人或家属知情同意,研究内容经医院伦理委员会评估并批准(批准号2015-34)。病理专家再次切片确认后,收集完整临床资料,所有患者术前半年内均未接受放化疗或激素治疗,无内分泌、免疫或代谢性疾病。
1.2 方法 采用免疫组织化学法检测组织中ABCG2、ALDH1的表达,试验严格按照试剂盒说明书操作。以试剂公司提供的已知阳性切片作为阳性对照,磷酸盐缓冲液(PBS)代替一抗作为阴性对照。ABCG2主要定位于细胞膜及细胞质中,ALDH1蛋白主要定位于细胞质中,出现棕黄色颗粒状染色为阳性。按照文献[8]中的半定量方法综合染色强度和阳性细胞百分率确定表达水平。每个切片观察5个高倍视野,阳性细胞:≤6%记0分,>6%~25%记1分,>25%~50%记2分,>50%记3分;观察染色程度:不着色记0分,阳性颗粒淡黄色记1分,棕黄色记2分,棕褐色记3分;两项指标评分相乘,0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中度阳性(++),7~9分为强阳性(+++)。0~1分判为阴性组,2~9分判为阳性组。
1.3 统计学处理 采用SPSS17.0统计软件对数据进行处理,计数资料用率表示,组间采用χ2检验或Fisher精确概率法,相关性采用Spearman等级相关分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 3组中ABCG2、ALDH1蛋白表达情况 EMs恶变组阳性表达率明显高于EMs组及对照组,差异有统计学意义(χ2=8.461、21.820,P<0.05)。EMs恶变组阳性表达率明显高于EMs组及对照组,差异有统计学意义(χ2=7.216、21.286,P<0.05),见表1。
a:P<0.05,与EMs恶变组比较。
2.2 EMs恶变组ABCG2、ALDH1表达与临床、病理资料的相关性 ABCG2、ALDH1的表达均与患者年龄、痛经史及病理学类型无明显相关性,但与血清CA125水平、病理分化程度及分期呈明显相关性(P<0.05),见表2。
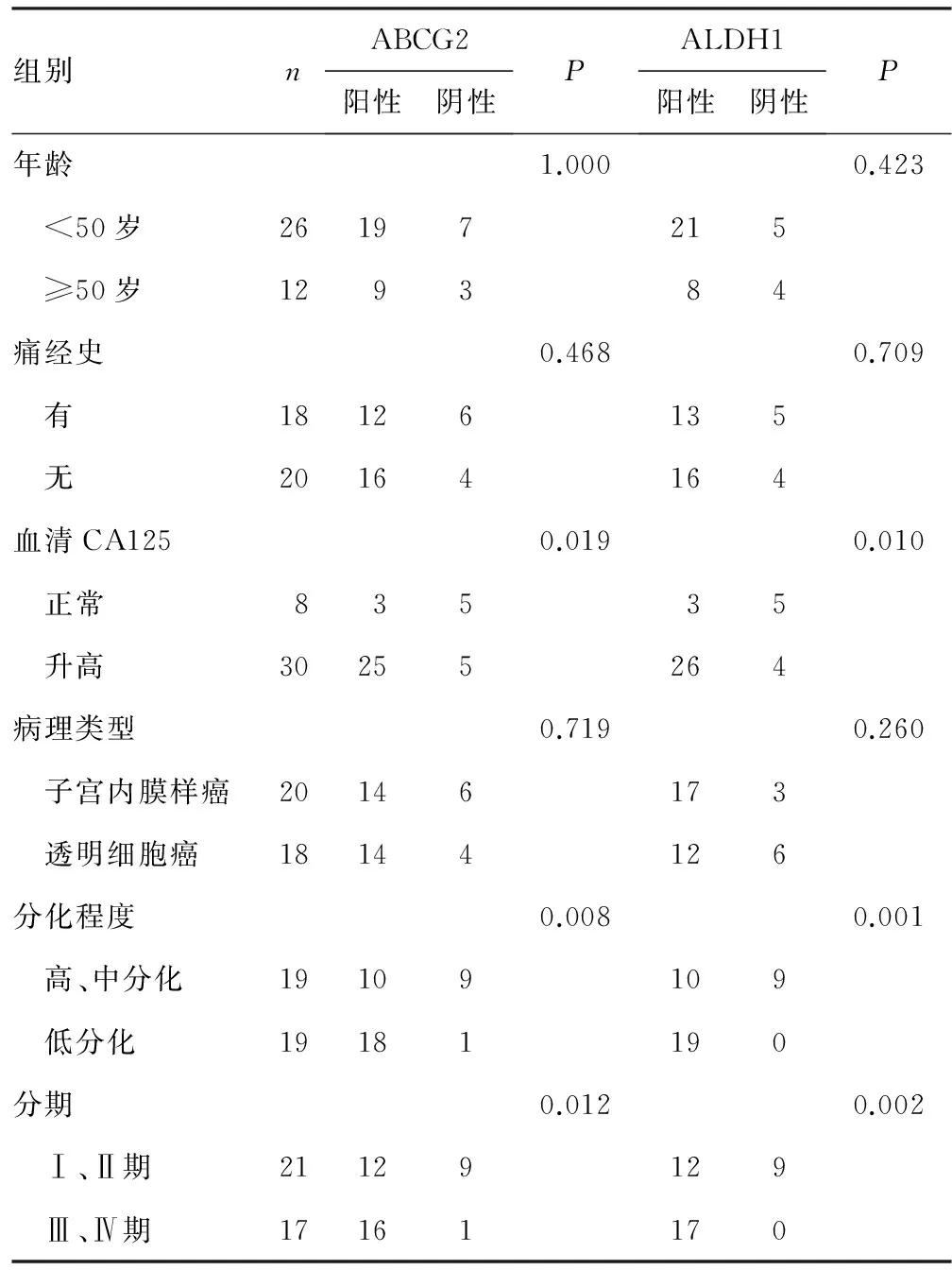
表2 ABCG2、ALDH1的表达与卵巢EMs恶变临床病理参数的关系(n)
2.3 EMs恶变组ABCG2与ALDH1表达的关系 28例ABCG2阳性表达的内异症相关卵巢癌组织中,23例ALDH1蛋白表达阳性;而10例ABCG2蛋白表达阴性的内异症相关卵巢癌组织中,6例ALDH1蛋白表达阳性,两者之间无明显相关性(P>0.05),见表3。
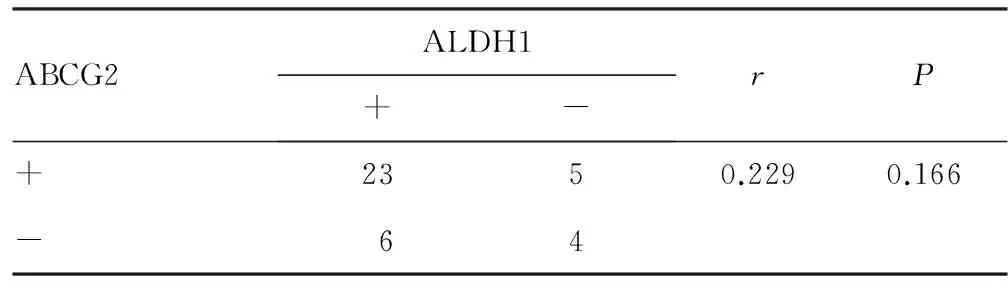
表3 卵巢EMs恶变组织中ABCG2、ALDH1表达的相关性(n)
3 讨 论
EMS恶变机制迄今不明。肿瘤干细胞(CSC)是一类具有无限增生潜能、高致瘤性、高耐药性,在肿瘤的发生、发展中起决定性作用并与肿瘤的转移和复发密切相关的细胞,是近年来肿瘤研究领域的热点,为阐明恶性肿瘤的发病机制提供了有效途径。ABCG2、ALDH1近年来已被证实为多种恶性肿瘤的干细胞标志物,并且与肿瘤的预后密切相关[9-10],但两者在卵巢EMs恶变中的研究少见报道。
ABCG2是ABC转运蛋白家族成员之一,最初被发现可以主动地把具有不同化学结构和作用于细胞内不同靶位点的化疗药物泵出胞外,引起多药耐药。最近的研究显示,ABCG2还是一种潜在的干细胞分子标记,并在多种恶性肿瘤细胞株中都分离培养出ABCG2表达阳性的CSC[9-10]。王任晓[11]发现宫颈癌组织中ABCG2表达阳性率显著高于宫颈上皮内瘤变组织与正常组织,且随着阳性程度增加,远期生存率降低,认为ABCG2作为CSC标记物能够在一定程度上对宫颈癌的预后进行预测。张春妤等[12]发现化疗耐药卵巢癌组织中ABCG2蛋白的表达明显高于化疗敏感者。而Zhang等[13]证实,卵巢癌侧群细胞中表达ABCG2的细胞同时也表达其他的干细胞标记物,如CD144、CD44等,说明ABCG2可能也是卵巢癌干细胞的标记物之一。
ALDH1是乙醛脱氢酶家族的重要成员,催化细胞内乙醛氧化为乙酸的细胞溶质酶,参与多种组织的分化与基因表达,也是组织中正常干细胞与CSC生长、分化的必需物质,可以作为正常干细胞与CSC的标志物之一。于慧玲等[14]研究发现,ALDH1在子宫内膜癌组织中的表达较正常子宫内膜组织明显升高,并且随组织病理分级和手术病理分期的升高而升高。她认为ALDH1作为一种新的CSC标志物,可能成为诊断子宫内膜癌的新的生物学标志物,为判断子宫内膜癌的生物学行为,预测转移趋势及预后提供新靶点。范秀丽等[15]研究显示含生长因子的无血清培养基培养卵巢癌SKOV3细胞能够形成CSC球及高表达ALDH1,ALDH1可能是卵巢癌干细胞的标志物之一。
本研究显示ABCG2、ALDH1在EMs恶变组织的表达明显高于EMs组织及正常子宫内膜,鉴于ABCG2、ALDH1为常见的CSC标记物,推测EMs恶变组织表达ABCG2、ALDH1的细胞可能就是CSC;低分化、晚期患者肿瘤组织中ABCG2、ALDH1的表达水平高于中高分化、早期患者肿瘤组织中的表达水平,提示低分化、晚期患者肿瘤组织中存在更多的CSC,更易发生肿瘤的侵袭、转移、耐药及复发。研究中还发现,ABCG2、ALDH1在EMs恶变组织中的表达并无明显相关性,推测两者可能具有不同的生物学功能,通过不同的途径参与卵巢EMs的恶变过程,具体机制还有待进一步深入探讨。
[1]孙蓬然.卵巢子宫内膜异位症恶变研究的新进展[J].现代妇产科进展,2012,21(4):316-318.
[2]Nozawa-Suzuki N,Nagasawa H,Ohnishi K,et al.The inhibitory effect of hypoxic cytotoxin on the expansion of cancer stem cells in ovarian cancer[J].Biochem Biophys Res Commun,2015,457(4):706-711.
[3]Yan HC,Fang LS,Xu J,et al.The identification of the biological characteristics of human ovarian cancer stem cells[J].Eur Rev Med Pharmacol Sci,2014,18(22):3497-3503.
[4]刘颂平,温坚,殷新明.子宫内膜异位症患者腹腔冲洗液及血清CD133、ABCG2的表达[J].中国医药导报,2013,10(24):45-47.
[5]温坚,刘颂平,殷新明.乙醛脱氢酶1与子宫内膜异位症的相关性研究[J].中国妇幼保健,2013,28(35):5878-5881.
[6]Guo SW.Endometriosis and ovarian cancer:potential benefits and harms of screening and risk-reducing surgery[J].Fertil Steril,2015,104(4):813-830.
[7]Scott RB.Malignant changes in endometriosis[J].Obstet Gynecol,1953,2(3):283-289.
[8]吕昕,王悦红,周建英.TTF-1,SPA表达与Ⅱ期肺腺癌患者术后复发及生存关系的研究[J].浙江医学,2015,37(2):117-123.
[9]Szepesi A,Matula Z,Szigeti A,et al.ABCG2 is a selectable marker for enhanced multilineage differentiation potential in periodontal ligament stem cells[J].Stem Cells Dev,2015,24(2):244-252.
[10]Kim N,Choung HK,Lee MJ,et al.Cancer stem cell markers in eyelid sebaceous gland carcinoma:high expression of ALDH1,CD133,and ABCG2 correlates with poor prognosis[J].Invest Ophthalmol Vis Sci,2015,56(3):1813-1819.
[11]王任晓.宫颈癌组织中 ABCG2与 CD133的表达对预后的影响分析[J].实用癌症杂志,2014,29(6):614-616.
[12]张春妤,郭红燕,韩劲松,等.三磷酸腺苷结合盒转运蛋白G2、F2在卵巢上皮性癌组织中的表达与意义[J].中华妇产科杂志,2014,49(3):224-225.
[13]Zhang QH,Dou HT,Xu P,et al.Tumor recurrence and drug resistance properties of side population cells in high grade ovary cancer[J].Drug Res (Stuttg),2015,65(3):153-157.
[14]于慧玲,李冬梅,吴罡,等.子宫内膜癌组织中ALDH1、p53和CyclinE蛋白的表达及意义[J].中国妇幼保健,2014,29(25):4165-4167.
[15]范秀丽,卞翠翠,董怡,等.ALDH1作为卵巢癌干细胞标志物的实验研究[J].中国老年学杂志,2015,35(12):3266-3268.
Expression and significance of ABCG2 and ALDH1 in malignant transformation of ovarian endometriosis*
LiuSongping,TianXin,WenJian,YinXinming
(DepartmentofObstetricsandGynecology,theFourthAffiliatedHospitalofJiangsuUniversity,Zhenjiang,Jiangsu212000,China)
Objective To investigate the expression and significance of ABCG2 and ALDH1 in malignant transformation of ovarian endometriosis.Methods The protein expressions of ABCG2 and ALDH1 were detected with immunohistochemistry in 38 cases of malignant transformation of ovarian endometriosis(EMs malignant transformation group),35 cases of endometriosis(EMs group)and 30 cases of normal endometrium(control group).Results The positive rates of ABCG2 and ALDH1 expressions in EMs malignant transformation group were significantly higher than those in EMs group and control group(P<0.05).The expressions of ABCG2 and ALDH1 were significantly associated with the serum CA125 level,differentiation and clinical stage of malignant transformation of ovarian endometriosis (P<0.05),but were not related to the patient′s age,dysmenorrhea history and pathology type(P>0.05).There was no correlation between the expression of ABCG2 and ALDH1 in malignant transformation of ovarian endometriosis(P>0.05).Conclusion The expressions of ABCG2 and ALDH1 might be involved in malignant transformation of ovarian endometriosis.
ovarian cysts;endometriosis;allergy and immunology;stem cells;ABCG2;ALDH1
10.3969/j.issn.1671-8348.2017.14.013
江苏省自然科学基金资助项目(BK20140502);江苏省“六大人才高峰”资助项目(2015-WSW-088);吴阶平医学基金资助项目(320.6755.15023)。 作者简介:刘颂平 (1979-),副主任医师,硕士,主要从事子宫内膜异位症方面研究。
R711.71
A
1671-8348(2017)14-1912-03
2016-11-18
2017-01-06)

