人类免疫缺陷病毒感染合并肾脏病载脂蛋白L1基因突变检测
张 尧,张正秀,何洪斌,刘婷婷,李贵森,王 莉(.四川省医学科学院·四川省人民医院肾脏内科暨肾脏病研究所,四川 成都 6007;.四川省攀枝花市中心医院肾内科,四川 攀枝花 67067)
人类免疫缺陷病毒感染合并肾脏病载脂蛋白L1基因突变检测
张 尧1,张正秀2,何洪斌2,刘婷婷2,李贵森1,王 莉1
(1.四川省医学科学院·四川省人民医院肾脏内科暨肾脏病研究所,四川 成都 610072;2.四川省攀枝花市中心医院肾内科,四川 攀枝花 617067)
目的 检测我国人类免疫缺陷病毒(HIV)感染合并或未合并肾损害个体进行载脂蛋白L1(apolipoprotein-L1,APOL1)基因突变。方法 分析6例HIV感染合并肾脏病患者临床特点,并收集外周血DNA,进行APOL1调控区、编码区基因测序,与4例HIV感染非肾脏病患者、60例地域匹配正常对照、千人基因组测序,进行突变基因频率比较。结果 6例患者均有不同程度血尿、蛋白尿、血白蛋白降低,2例患者血肌酐升高,2例患者有血脂紊乱,1例患者合并乙肝感染,1例患者合并丙肝感染。全血DNA测序显示1例患者携带APOL1基因DNA调控区A-565G杂合子突变;6例患者均携带APOL1基因DNA编码区G496A(Glu166Lys)、C702A(同义突变)、G732A(Met244Lle)、G812A(Arg271Lys)、G1008A(同义突变)突变。与4例HIV感染非肾脏病患者、60例地域匹配正常对照、千人基因组测序相比,未发现新的突变,且突变基因频率分布差异无统计学意义。结论 未发现非洲裔美国人HIV相关肾病常见的APOL1基因G1/G2突变,并且APOL1基因调控区、编码区未发现其他特殊变异,提示我国HIV相关肾病可能存在其他危险因素。
HIV感染;肾脏病;载脂蛋白L1;基因突变
人体感染人类免疫缺陷病毒(human immunodeficiency virus,HIV)后可导致机体多个器官受累,严重危害健康。其中肾脏是HIV感染最常受累的器官之一,最具特征的是HIV相关肾病(HIV-associated nephropathy,HIVAN)[1,2]。HIVAN以蛋白尿、短期内肾功能迅速减退为主要临床表现,治疗效果差,是导致HIV感染患者终末期肾病(end stage renal disease,ESRD)的主要原因[3]。研究显示,遗传背景在HIVAN发病中起重要作用,通过混合连锁不平衡绘图鉴定出染色体22q13.1区域载脂蛋白L1(APOL1)基因变异与非洲裔个体HIVAN发病密切相关,G1和G2变异携带者HIVAN发病风险显著增加[4]。之前的研究在我国普通人群中未检测到APOL1基因的G1和G2变异,是否APOL1基因的其他变异参与了我国HIVAN的发病还不清楚。本研究对我国HIV感染合并或未合并肾脏病患者进行临床特点分析,同时对APOL1基因调控区、编码区进行序列分析,了解有无其他特殊变异参与我国HIVAN的发病。
1 对象与方法
1.1 研究对象 选取2016年1~5月四川省人民医院肾内科6例来自不同家族的HIV感染合并肾脏病患者,男4例,女2例,中位年龄43岁(23~70岁)。同时收集患者高血压、糖尿病病史,尿常规、24小时尿蛋白定量,血生化结果。纳入HIV感染无肾脏病患者4例,均为男性,中位年龄72岁(32~77岁);以及地域匹配的汉族健康对照60例,均无肾脏疾病史。本研究方案获得我院伦理委员会批准,所有患者均签署知情同意书。
1.2 研究方法 外周血基因组DNA提取:按照天根血液基因组DNA提取系统说明书进行。基因组DNA100 ng,10 μM上下游引物各1 μl,2×Taq Master Mix 12.5 μl(上海生工公司),双蒸水补足体系至25 μl,进行APOL1上游基因调控区1Kb、外显子PCR扩增。扩增产物直接Sanger测序(北京诺赛公司)。PCR扩增引物(北京诺赛公司合成)见表1。测序结果使用Chormas对比分析。将患者APOL1基因的测序结果与HIV感染无肾脏损害患者、正常对照,以及1000 genome数据(www.1000 genomes.org)进行对比。

表1 PCR引物序列
1.3 统计学方法 采用SPSS 21.0软件进行数据处理。计量资料用中位数表示,计数资料比较采用卡方检验。P< 0.05为差异有统计学意义。
2 结果
2.1 HIV合并/未合并肾脏病患者的临床表现 6例HIV合并肾脏病患者,男4例,女2例,中位年龄43岁(23~70岁),既往均无糖尿病、高血压、肾脏疾病史,均有不同程度血尿、蛋白尿、血白蛋白降低,2例患者血肌酐升高,2例患者有血脂紊乱,1例患者合并乙型肝炎(HBV)感染,1例患者合并丙型肝炎(HCV)感染。平均血压120/77 mmHg[(96~150)/(60~96)mmHg],平均尿红细胞60.95个/HP(7.70~951.50个/HP),尿蛋白+(-~+),平均血白蛋白31.05 g/L(20.20~38.00 g/L),平均血肌酐74.50 μmol/L (56.00~114.00 μmol/L),平均胆固醇3.10 mmol/L (1.87~30.20 mmol/L),平均甘油三酯1.02 mmol/L (0.96~4.76 mmol/L),平均低密度脂蛋白胆固醇1.90 mmol/L (0.38~2.92 mmol/L),平均高密度脂蛋白胆固醇0.72 mmol/L (0.64~2.92 mmol/L)。4例HIV感染无肾脏损害的患者,1例有高血压病史,4例均无血尿实验室异常,无HBV、HCV合并感染。
2.2 APOL1基因测序结果 6例HIV感染合并肾脏病患者测序结果显示:共发现6个基因突变位点,1个位于APOL1基因调控区A(-565)G突变,5个位于外显子区G496A、C702A、G732A、G812A、G1008A突变。其中1例患者携带A-565G杂合子突变;6例患者均携带APOL1基因DNA编码区G496A、C702A、G732A、G812A、G1008A点突变,分别对应氨基酸改变:Glu166Lys(错义突变)、Ala234Ala(同义突变)、Met244Lle(错义突变)、Arg271Lys(错义突变)、Arg336Arg(同义突变),其中4例患者上述5个突变位点全部为纯合子突变,另外2例患者为上述位点杂合子突变。4例HIV感染无肾脏损害的患者,发现同样的6个基因突变位点。其中2例患者携带A-565G的杂合子突变;2例患者携带G496A、C702A、G732A、G812A、G1008A的纯合子突变、另外2例患者携带G496A、C702A、G732A、G812A、G1008A的杂合子突变。
2.3 APOL1基因突变的频率分布差异比较 本研究发现的APOL1基因6个变异位点,除G496A、C702A、G732A及G812A四个位点等位基因频率与非洲裔个体有明显差异外,与4例HIV感染无肾脏病对照、60例无HIV感染正常对照、千人基因组中亚裔对照、千人基因组所有数据进行比较,突变基因频率分布差异均无统计学意义(P> 0.05)。见表2。
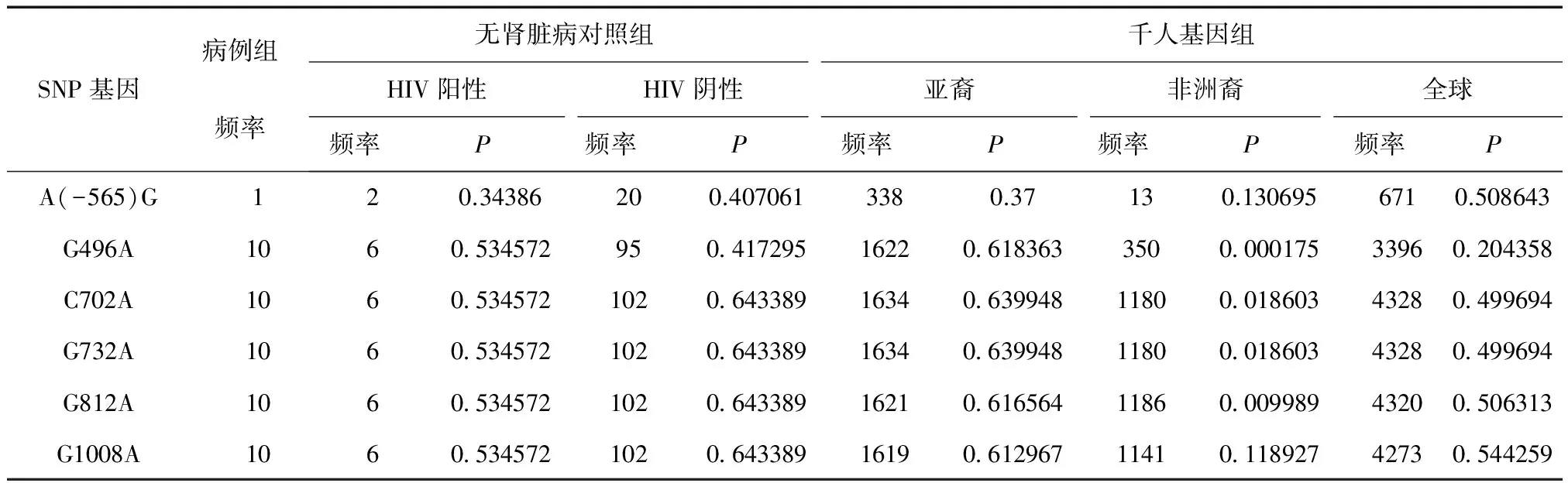
表2 APOL1基因多态性位点突变基因频率分布
3 讨论
慢性肾脏病(chronic kidney disease,CKD)目前已成为全球性威胁健康的公共问题[5]。非洲裔美国人CKD发病率较高,且容易发展为ESRD,与欧洲裔美国人相比,ESRD发病率高出4倍,提示存在强烈遗传差异[6]。非洲裔黑人中,HIVAN比例较高,常常表现为不可逆的慢性肾脏损害,ESRD发生率及死亡率较高。非洲HIV患者CKD发病率6.0%~48.5%,其中南非24%~83%是典型的HIVAN[7]。本研究中,10例HIV感染患者中,6例有肾脏损害,其中2例已经出现血肌酐升高,提示其肾脏损害预后不良。
1999年Freedman等报道HIVAN是非洲裔美国人的ESRD家族聚集性的重要因素,并提出遗传背景差异是非洲裔美国人HIVAN和其他肾脏疾病的重要发病机制[8]。2008年Kao等报道MYH9基因多态性与非洲裔美国人ESRD的发病相关[9],同时Kopp等发现该基因的变异与局灶节段肾小球硬化发病相关[10]。后来Genovese 等发现与非洲裔美国人CKD发病相关可能主要为MYH9相邻的APOL1基因变异[11]。APOL1中G1、G2突变常见于非洲人、非洲裔美国人,但欧洲人、亚洲人是缺乏的[12]。隐形遗传模型下,携带APOL1风险等位基因,局灶节段性肾小球硬化(FSGS)风险增加17倍,HIVAN风险增加29倍[13]。但并不增加合并糖尿病的肾脏病、IgA肾病的患病风险[14]。有研究显示,携带APOL1两个风险等位基因的非洲裔美国人HIV患者,若不治疗,50%将发展为HIVAN[15]。APOL1基因突变破坏细胞保护性自噬,可为其导致肾脏病变的发病机制之一[16]。然而我国目前尚未有HIVAN患者APOL1基因变异的研究报道。
本研究纳入HIV感染合并及未合并肾脏损害的两类患者,均进行上游调控区和外显子测序,结果所发现的突变在正常对照及千人基因组中均有报道,且突变频率相似,提示可能不是特异的致病性突变。这一结果有以下两种可能,一是我国HIVAN患者存在低频率APOL1突变的可能;另一个可能性是这些患者存在其他基因变异导致其易发生HIVAN的可能性,均需要进行更大样本的研究。但不论是患者还是对照组个体,均未检测出APOL1基因G1、G2突变,提示我国人群APOL1基因变异与非洲裔个体存在明显差异。本研究发现两例患者分别合并HBV感染和HCV感染,既往报道,亚洲HIV患者,HIV/HBV合并感染患病率达到20%~30%,研究证实HIV/HBV合并感染可促进HBV复制、减低其自发分解,既往感染再燃风险增加,肝硬化、肝癌等合并症进展加速[17]。HIV/HCV合并感染增加肾小球滤过率降低、蛋白尿的风险[18]。APOL1基因 G1、G2突变是非洲裔个体CKD的易感因素,而此突变为功能获得性,获得抗锥虫能力,但增加肾脏病风险[19]。APOL1溶解锥虫的能力为非洲人群面对这种病原体的进化适应性选择,这个选择性优势改变了非洲地区的人群携带APOL1基因突变频率的分布[20]。这也解释了亚洲及欧洲无APOL1基因G1、G2突变原因。我们的研究显示与非洲裔个体有差异,但与其他亚裔无差异。
综上所述,我国目前未发现非洲裔美国人HIVAN发病中常见的APOL1基因G1和G2突变,并且APOL1基因调控区、编码区未发现其他特殊变异,提示我国HIVAN可能存在其他遗传变异背景。
[1] Klag MJ,Whelton PK,Randall BL,et al.End-stage renal disease in African-American and white men.16-year MRFIT findings[J].JAMA,1997,277(16):1293-1298.
[2] Fabian J,Naicker S.HIV and kidney disease in sub-Saharan Africa[J].Nat Rev Nephrol,2009,5(10):591-598.
[3] Rao TK.Human immunodeficiency virus infection and renal failure[J].Infect Dis Clin North Am,2001,15(3):833-850.
[4] Kruzel-Davila E,Wasser WG,Aviram S,et al.APOL1 nephropathy:from gene to mechanisms of kidney injury[J].Nephrol Dial Transplant,2016,31(3):349-358.
[5] Ojo A.Addressing the global burden of chronic kidney disease through clinical and translational research[J].Trans Am Clin Climatol Assoc,2014,125:229-226.
[6] Collins AJ,Foley RN,Chavers B,et al.’United States Renal Data System 2011 Annual Data Report:Atlas of chronic kidney disease & end-stage renal disease in the United States[J].Am J Kidney Dis,2012,59(Suppl 1):420.
[7] Kasembeli AN,Duarte R,Ramsay M,et al.African origins and chronic kidney disease susceptibility in the human immunodeficiency virus era[J].World J Nephrol,2015,4(2):295-306.
[8] Freedman BI,Soucie JM,Stone SM,et al.Familial clustering of end-stage renal disease in blacks with HIV-associated nephropathy[J].American Journal of Kidney Diseases,1999,34(2):254-258.
[9] Kao WH,Klag MJ,Meoni LA,et al.MYH9 is associated with nondiabetic end-stage renal disease in African Americans[J].Nature Genetics,2008,40(10):1185-1192.
[10]Kopp JB,Smith MW,Nelson GW,et al.MYH9 is a major-effect risk gene for focal segmental glom-erulosclerosis.Nat Genet[J].Nature Genetics,2008,40:1175-1184.
[11]Genovese G,Friedman DJ,Ross MD,et al.Association of trypanolytic ApoL1 variants with kidney disease in African Americans[J].Science,2010,329(5993):841-845.
[12]Pollak MR,Genovese G,Friedman DJ.APOL1 and kidney disease[J].Curr Opin Nephrol Hypertens,2012,21(2):179-182.
[13]Kopp JB,Nelson GW,Sampath K,et al.APOL1 genetic variants in focal segmental glomerulosclerosis and HIV-associated nephropathy[J].J Am Soc Nephrol,2011,22(11):2129-2137.
[14]Papeta N,Kiryluk K,Patel A,et al.APOL1 variants increase risk for FSGS and HIVAN but not IgA nephropathy[J].J Am Soc Nephrol,2011,22(11):1991-1996.
[15]Naicker S,Rahmanian S,Kopp JB.HIV and chronic kidney disease[J].Clin Nephrol,2015,83(7 Suppl 1):32-38.
[16]Kimura T,Takabatake Y,Takahashi A,et al.Autophagy protects the proximal tubule from degeneration and acute ischemic injury[J].J Am Soc Nephrol,2011,22(5):902-913.
[17]Genovese G,Friedman DJ,Ross MD,et al.Association of trypanolytic ApoL1 variants with kidney disease in African Americans[J].Science,2010,329(5993):841-845.
[18]di Belgiojoso GB,Ferrario F,Landriani N.Virus-related glomerular diseases:histological and clinical aspects[J].J Nephrol,2002,15(5):469-479.
[19]Friedman DJ,Kozlitina J,Genovese G,et al.Population-based risk assessment of APOL1 on renal disease[J].J Am Soc Nephrol,2011,22(11):2098-2105.
[20]Fabrizi F,Dixit V,Martin P,et al.Hepatitis C virus increases the risk of kidney disease among HIV-positive patients:Systematic review and meta-analysis[J].J Med Virol,2016,88(3):487-497.
Detection of APOL1 gene mutation in HIV infection complicated with kidney disease
ZHANGYao1,ZHANGZheng-xiu2,HEHong-bin2,LIUTing-ting2,LIGui-sen1,WANGLi1
(1.DepartmentofNephrology&NephrologyInstitute,SichuanAcademyofMedicalSciences&SichuanProvincialPeople’sHospital,Chengdu610072,China;2.DepartmentofNephrology,PanzhihuaCityCentralHospital,Panzhihua617067,China)
LIGui-sen
Objective To detect the mutation of apolipoprotein-L1 (APOL1) in HIV patients complicated with kidney disease.Methods We analyzed the clinical characteristics of six HIV patients complicated with kidney disease.Then,we collected peripheral blood cell DNA and performed sequence analysis of the regulatory and coding regions in APOL1 gene.Finally,we compared the frequencies of the mutant alleles of the six patients with four HIV-infected patients without kidney disease and 60 matched normal controls as well as 1000 genomes project data.Results All the six cases presented different degrees of microscopic hematuria,proteinuria,serum albumin reduction.There were two patients with increased serum creatinine level,two with dyslipidemia,one with concomitant hepatitis B virus infection and one with concomitant hepatitis C virus infection.The whole blood DNA sequence analysis showed that there was a patient with a heterozygous mutation in the regulatory region (A-565G).Five mutations in coding region at G496A (Glu166Lys),C702A (synonymous mutation),G732A (Met244Lle),G812A (Arg271Lys),and G1008A (synonymous mutation) were found in all the six cases.Compared to the four HIV-infected patients without kidney disease,60 matched normal controls,and 1000 genomes project data,the frequencies of these variants were not statistically different.Conclusion No APOL1 G1/G2 mutations that were common in African Americans with HIV infection complicated with kidney disease are found in this study.There is also no other special variation of APOL1 gene in these patients.It may suggest that there could be other risk factors for the disease in our country.
Human immunodeficiency virus;Kidney disease;Apolipoprotein L1;Mutation
李贵森
R692;R512.91
A
1672-6170(2017)02-0025-04
2016-09-23;
2016-11-24)

