高温、低盐对菲律宾蛤仔免疫能力的影响
杨东敏,张艳丽,丁鉴锋,杨凤,霍忠明,聂鸿涛,闫喜武(大连海洋大学水产与生命学院,辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
高温、低盐对菲律宾蛤仔免疫能力的影响
杨东敏,张艳丽,丁鉴锋,杨凤,霍忠明,聂鸿涛,闫喜武
(大连海洋大学水产与生命学院,辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
为查明温度(21、30益)和盐度(7、15、32)互作对菲律宾蛤仔Ruditapes philippinarum免疫能力的影响,对不同温度和盐度条件下试验0、3、6、12、24、48、72 h时,体质量为(14.8依0.731)g蛤仔的血细胞数、血淋巴吞噬能力和渗透压,以及血清中溶菌酶(LZM)、碱性磷酸酶(AKP)活性的变化进行了研究。结果表明:以各指标0 h水平为对照,常温常盐组(21益,32)蛤仔各指标在0~72 h内虽有波动,但变化并不显著(P>0.05);各试验组蛤仔血细胞数有不同的变化趋势,72 h时,常温低盐组(21益,7)蛤仔恢复初始水平,而常温中盐组(21益,15)、高温中盐组(30益,15)和高温常盐组(30益,32)蛤仔血细胞数最终仍未恢复,高温低盐组(30益,7)蛤仔虽在24 h时恢复初始水平,但在48 h时全部死亡;高温常盐组蛤仔吞噬能力先升高后降低在72 h时仍低于初始水平(P<0.05),2个中盐组和常温低盐组蛤仔吞噬活性最终恢复,而高温低盐组蛤仔吞噬活性在24 h时仍处于较高水平(P<0.05);各试验组蛤仔LZM活性在72 h时均显著高于初始水平(P<0.05);常温中盐组蛤仔AKP活性在3 h出现最大值,最终所有试验组AKP在72 h时恢复初始水平;2个中盐组和2个低盐组蛤仔渗透压均逐渐降低,而高温常盐组蛤仔渗透压逐渐升高,在72 h时均未恢复初始水平。研究表明,温度升高的同时降低盐度,将会对贝类免疫能力造成严重的影响,这可能是夏季滩涂贝类死亡率较高的一个重要原因。
菲律宾蛤仔;高温;低盐;免疫能力
菲律宾蛤仔Ruditapes philippinarum(以下简称蛤仔)隶属于双壳纲、帘蛤科、缀锦亚科、蛤仔属,是一种广温、广盐性贝类[1],主要栖息于内湾、河口和沿海滩涂等地[2],具有生长周期短和适应性强等优点,适合人工高密度养殖,是中国四大养殖贝类之一[3]。
贝类养殖场通常位于浅滩、海湾或河口处,养殖在近海的贝类,其生活环境易受陆源淡水、降雨等影响,盐度急剧降低的现象时有发生。温度和盐度是影响水生生物生长的重要环境因子,许多研究表明,盐度急剧降低能够导致鸡帘蛤Chamelea gallina[4]和魁蚶稚贝Anadara broughtonii[5]血淋巴吞噬能力、溶菌酶活性和渗透压下降,个体死亡率大大增加。Castagna等[6]也发现,生活于盐度过低的浅海区或近岸的双壳贝类表现出极高的死亡率。夏季高温也是导致养殖贝类死亡的一个重要诱因, Malham等[7]对长牡蛎Crassostrea gigas研究发现,温度升高导致牡蛎血细胞数减少,血淋巴细胞吞噬活性和免疫能力降低,是长牡蛎夏季死亡率高的主要原因之一。李文姬等[8]研究发现,夏季高温期水环境会急剧恶化,虾夷扇贝Patinopecten yessoen-sis因代谢强度增加而消耗大量能量,导致其死亡率极高。上述研究表明,温度和盐度的急剧变化均能影响贝类的免疫防御机能,使贝类免疫机能受到抑制,从而导致疾病的发生[8-10]。夏季是贝类死亡的高发季节,高温和暴雨导致的盐度降低是否会产生协同胁迫效果尚不清楚。目前,国内关于温度与盐度共同作用对蛤仔免疫机制影响的相关研究较少,为此,本研究中探究了高温和低盐交互胁迫条件下蛤仔免疫相关指标的变化以及对蛤仔免疫调节的影响机制,旨在为蛤仔健康养殖提供参考。
1 材料与方法
1.1 材料
试验用蛤仔购自大连市水产品市场,选用体质量为(14.8依0.73)g,壳长为(4.5依0.35)cm,壳型完整且活力强的个体作为研究对象。将购买的蛤仔置于水槽中暂养7 d,暂养期间海水盐度为32,温度为(21依0.5)益,连续充气,每天定时换水1次,并投喂螺旋藻粉2次。
1.2 方法
1.2.1 试验设计试验设置2个温度水平,分别为30益和21益;每个温度条件下设置3个盐度水平,分别为7、15、32,共计6种组合,分别记为常温常盐组(21益,32)、常温中盐组(21益, 15)、常温低盐组(21益,7)、高温常盐组(30益,32)、高温中盐组(30益,15)和高温低盐组(30益,7),每组设置两个平行,每个平行放30枚蛤仔。在试验的第0、3、6、12、24、48、72 h,从每组随机选取4枚样品进行指标的测定。
1.2.2 血淋巴细胞样品的制备使用1 mL无菌注射器从蛤仔围心腔抽取800滋L血淋巴。取200滋L分别用于血细胞计数、血细胞吞噬活性和渗透压的检测,其余血淋巴经7000 r/min离心后取上清放入冰箱(-80益)中冷冻保存,用于溶菌酶(LZM)、碱性磷酸酶(AKP)活性的检测。
1.2.3 血细胞总数的测定取30滋L血淋巴样品加入到等量BFC固定液(NaCl 2%、乙酸钙1%、甲醛4%)中,充分混匀后吸取8滋L加到血球计数板上,在100倍光镜下观察并计数。
1.2.4 血细胞吞噬活性的测定采用Hannam等[11]的方法,取血淋巴和灭菌海水,将1颐1的混合样品50滋L加入到96孔酶标板中,4益下孵育1 h;甩去混合样品,再向每孔加入100滋L灭菌海水,甩干,重复此过程1次,洗去未黏附血细胞;向每孔加入50滋L中性红染过的酵母悬浮液(50伊107cells/mL);20益下孵育30 min,加入100滋L BFC固定液终止反应;甩去混合液,向每孔加入灭菌海水100滋L,甩干,重复此过程1次,洗去多余酵母颗粒;再向每孔加入100滋L酸化酒精(醋酸1%、酒精20%)溶解血细胞吞噬的酵母细胞中中性红,将酶标板置于酶标仪中,在550 nm处读取吸光度值。活性单位定义:每毫克蛋白所吞噬的酵母颗粒数,即驻OD550nm/mg蛋白质。
取50滋L酵母颗粒[浓度分别为(6.25、12.50、25.00、50.00、100.00)伊107cells/mL],加入等量酸化酒精,在550 nm处读取吸光度值,制作酵母浓度与吸光度值标准曲线。
1.2.5 血淋巴渗透压的测定取血淋巴样品50滋L,经300目纱绢过滤后,使用OSMOMAT襆030渗透压仪(德国)进行检测。
1.2.6LZM、AKP酶活力和血浆蛋白浓度的检测按照相关试剂盒(购自南京建成生物有限公司)说明书进行操作,酶活力单位均为每毫克血清蛋白所含的酶活性,采用考马斯亮蓝法测定蛋白浓度。
1.3 数据处理
试验结果用平均值依标准差(means依S.D.)表示,采用数据用SPSS 19.0软件进行双因素方差分析(Two-way ANOVA),用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同温度和盐度条件下蛤仔血细胞数的变化
从图1可见:21益条件下,随着试验时间的延长,32盐度组蛤仔血细胞数无显著性变化(P> 0.05);15盐度组蛤仔整体呈降低趋势,72 h时仍显著低于初始(0 h)水平(P<0.05);7盐度组蛤仔在经过降低、升高的过程后,最终恢复至初始水平。30益条件下,3个试验组蛤仔血细胞数均经历3 h时升高、6 h时降低和24 h时恢复的过程,而7盐度组蛤仔在24 h恢复初始水平之后,48 h时全部死亡,在72 h时,除(21益,7)组外其他试验组均未恢复初始水平(P<0.05)。
同一时间下,以每个时间点的(21益,32)组为对照,3 h时,(30益,32)和(30益,7)组血细胞数出现最高值;6 h时,3个高温组显著低于对照组(P<0.05);12 h时,2个低盐组显著升高(P<0.05);24 h时,(21益,7)组血细胞数显著升高(P<0.05);48、72 h时,(30益,15)组蛤仔血细胞数显著下降且出现最低值(P<0.05)。
2.2 不同温度和盐度条件下蛤仔血淋巴吞噬能力的变化
从图2可见:21益条件下,随着试验时间的延长,32盐度组蛤仔血细胞吞噬能力无显著性变化(P>0.05);15、7盐度组血细胞吞噬能力经历了波动变化后在72 h时均恢复至初始水平。30益条件下,3个试验组蛤仔血细胞吞噬活性在12 h均显著高于初始水平(P<0.05);7盐度组在24 h时仍显著高于初始水平(P<0.05),48 h时全部死亡;72 h时,32盐度组显著低于初始水平(P< 0.05),15盐度组已恢复初始水平。
同一时间下,以每个时间点的(21益,32)组为对照,3 h时,高温组显著降低(P<0.05);12 h时,(30益,15)组血细胞吞噬能力出现最高值;48 h时,(21益,7)组出现最低值;72 h时,除(30益,32)组显著低于对照组(P<0.05)外,其他组均恢复至对照组水平。
2.3 不同温度和盐度条件下蛤仔血清LZM活性的变化
从图3可见:随着试验时间的延长,(21益, 32)组LZM酶活性无显著性变化(P>0.05),其他试验组LZM酶活性经历一系列不同的波动变化后,在72 h时均显著高于初始水平(P<0.05)。
同一时间下,以每个时间点的(21益,32)组为对照,3 h时,(21益,7)组LZM活性出现最低值(P<0.05),在24~72 h时显著高于对照组(P<0.05);各试验组在72 h时均显著高于对照组(P<0.05)。
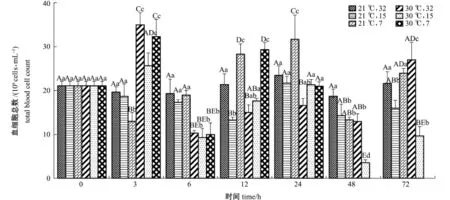
图1 不同温度和盐度条件下蛤仔的血细胞总数Fig.1Total blood cell count of Manila clam Ruditapes philippinarum under different temperature and salinity conditions
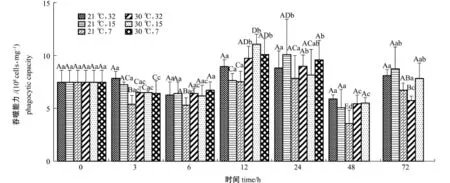
图2 不同温度和盐度条件下蛤仔血细胞的吞噬能力Fig.2Phagocytic capacity of M anila clam Ruditapes philippinarum under different tem perature and salinity conditions
2.4 不同温度和盐度条件下蛤仔血清AKP活性的变化
从图4可见:21益条件下,随着试验时间的延长,32盐度组蛤仔AKP活性无显著性变化(P> 0.05);15、7盐度组AKP活性经历先升高后降低的变化后,在72 h时均恢复初始水平。30益条件下,3个试验组蛤仔AKP活性均出现升高、降低的不同波动过程,在72 h时32、15盐度组均恢复至初始水平。
同一时间下,以每个时间点的(21益,32)组为对照,3 h时,(21益,15)组蛤仔AKP活性出现最高值;6~24 h时,高温组呈降低趋势;48 h时,(30益,32)组显著高于对照组(P<0.05); 72 h时,各组均恢复至对照组水平。
2.5 不同温度和盐度下蛤仔血淋巴渗透压的变化
从图5可见:随着试验时间的延长,(21益, 32)组蛤仔渗透压无显著性变化(P>0.05);(30益,32)组血淋巴渗透压在3~72 h时始终显著高于初始水平(P<0.05);2个中盐组(盐度15)和2个低盐组(盐度7)均表现出逐渐降低的趋势,在24~72 h时显著低于初始水平(P<0.05)。
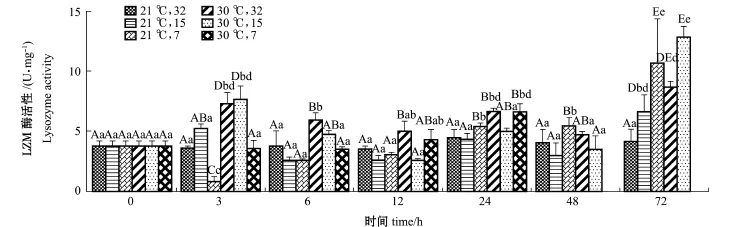
图3 不同温度和盐度条件下蛤仔的LZM活性Fig.3LZM activities of M anila clam Ruditapes philippinarum under different tem perature and salinity conditions
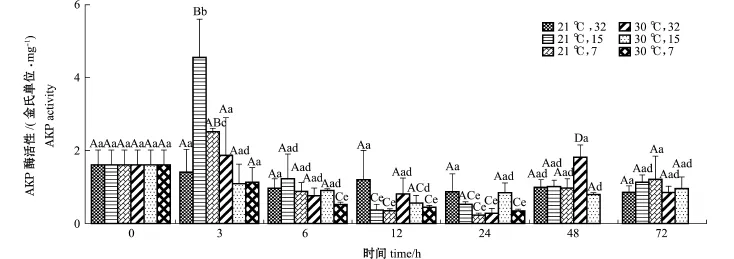
图4 不同温度和盐度条件下蛤仔的AKP活性Fig.4AKP activities of M anila clam Ruditapes philippinarum under different tem perature and salinity conditions
同一时间下,以每个时间点的(21益,32)组为对照,3~72 h时,(30益,32)组蛤仔渗透压均显著高于其他组(P<0.05);24~72 h时,2个中盐组和2个低盐组蛤渗透压均显著低于对照组
(P<0.05)。
3 讨论
3.1 温度与盐度互作对蛤仔血细胞数的影响
贝类的血细胞具有免疫应答功能,可抵御外来病原微生物侵袭,起到炎症消除、伤口修复、呼吸爆发、吞噬和包囊等作用,血细胞数是反映无脊椎动物细胞免疫能力变化的一个重要指标,温度和盐度等环境因子变化均会对血淋巴细胞产生重要影响[12-13]。研究发现,温度骤升和长时间的高温胁迫均能导致包括鸡帘蛤[8]、菲律宾蛤仔[12]、海湾扇贝Argopecten irradians、栉孔扇贝Chlamys farre-ri[14]和牡蛎[15]在内的贝类血细胞数增加。贝类血细胞数量的变化与其开放式循环系统有关,血淋巴细胞分布在循环系统和组织中,当组织中血细胞进入循环系统可导致血淋巴中血细胞数量增加,而血细胞的凋亡或者进入组织的数量增加则会导致血淋巴中血细胞数量减少[16]。本研究中,蛤仔血细胞数在高温胁迫时都呈增加的趋势,但(30益,15)和(30益,7)组在后期则呈减少的趋势,这种变化可能与盐度的变化有关。研究认为,盐度降低可导致蛤仔、九孔鲍Haliotis diversicolor supertexta、翡翠贻贝Perna viridis等血细胞总数减少[17-20],其原因可能是盐度降低促使血细胞进入组织中,导致血淋巴中血细胞数量减少[16,21];此外,盐度降低引起的血细胞凋亡也是一个重要的原因[22]。本研究中,(30益,15)和(30益,7)组的血细胞数在6 h时显著低于(21益,15)和(21益,7)组,此后又表现出了不同的波动变化,这种高温和低盐度条件下血细胞数量的变化,可能与温度或盐度值临近机体极限值时所表现出的一种互作效应[6,23-25]有关,也可能是高温导致贝类血细胞血氧含量降低[26],引起其对低盐耐受能力下降所致。
3.2 温度与盐度互作对蛤仔吞噬能力的影响
吞噬作用是贝类一种重要的免疫防御机制,是衡量血细胞防御机能的一个重要指标,在贝类免疫防御系统中扮演着极其重要的角色[8,27-29]。研究发现,吞噬能力受到温度和盐度等环境因子的影响较大[30-32]。温度升高会导致贝类血细胞的吞噬活性降低[8,10,15,33]。本研究中,蛤仔血细胞的吞噬能力随着温度的升高均表现出升高的过程;在胁迫后期高温组蛤仔又表现出降低或恢复的过程,这可能与蛤仔适宜生活的温度环境有关,在对九孔鲍、紫贻贝Mytilus galloprovincialis的研究中也发现,温度变化时其吞噬能力会发生变化,在最适温度时,其吞噬能力最高[29,32]。相关研究显示,盐度骤降和长时间低盐胁迫时,九孔鲍[19]、黑鲍Haliotis crach-erodii[34]等血细胞的吞噬活性随盐度降低而降低。这可能是由于双壳类动物在应激时会合成去甲肾上腺素,抑制了其吞噬活性[35-37]。本研究中,以常温常盐组为对照,常温组蛤仔血细胞的吞噬能力整体上呈先下降后升高的状态,在胁迫72 h时,蛤仔血细胞的吞噬活性几乎恢复至对照组水平,表明在正常温度条件下,随着蛤仔对低盐条件的适应,其血细胞的吞噬活性也能随之恢复。在对黑鲍的低盐胁迫研究中也得到了同样的结果[34]。(30益, 15)和(30益,7)低盐胁迫组蛤仔血细胞的吞噬能力均出现活性升高的趋势,且在12 h时,与常温低盐组相比出现了显著升高的趋势,这可能与高温低盐刺激导致机体代谢加快有关;但持续的刺激造成机体耗氧量增大,甚至出现生理功能紊乱,代谢失衡,也可能是低盐组(盐度7)蛤仔后期死亡的主要原因[38]。
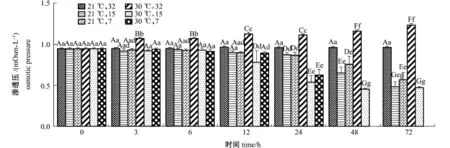
图5 不同温度和盐度条件下蛤仔的血淋巴渗透压Fig.5Osmotic pressure of M anila clam Ruditapes philippinarum under different temperature and salinity conditions
3.3 温度与盐度互作对蛤仔LZM活性的影响
LZM作为非特异性生物防御因子能对某些细菌发挥先天抵抗作用,并能诱导合成和分泌其他免疫因子[39]。LZM的活性和表达容易受温度、盐度、溶解氧和污染物等的影响[8]。在对河蚬Corbicula fluminea[40]、鸡帘蛤[8]、大西洋鲽Hippoglossus hip-poglossus[41]、史氏鲟Acipenser schrencki[42]等的研究中发现,当温度升高时,LZM活性也会增加。本研究中发现,随着温度升高蛤仔LZM活性呈上升趋势。研究表明,LZM活性升高与对高温的应激反应有关,温度升高使溶酶体崩溃导致LZM向血淋巴中释放量增加[43]。盐度变化也会引起LZM活性的改变,研究发现,鸡帘蛤[4]、虾夷扇贝[44]、近江牡蛎Ostrea rivularis[45]等LZM活性会随盐度的降低而降低。本研究中,(21益,7)组蛤仔在短时间低盐胁迫时,LZM活性也呈降低的趋势;但在胁迫后期,两个低盐组均表现出升高的趋势。这可能与LZM从血细胞向血淋巴中分泌增多导致蛤仔LZM活性增加有关[4]。另外,本研究中,(30益,15)和(30益,7)组蛤仔LZM活性均呈升高趋势。这可能与温度升高促进机体生理代谢加快有关;盐度降低导致细胞内溶酶体酶和免疫相关的细胞器功能受损,LZM向血淋巴中释放增加,当两者共同作用于蛤仔时,使其LZM活性升高[38]。
3.4 温度与盐度互作对蛤仔AKP活性的影响
AKP是细胞内一种重要的溶酶体酶类,在细胞的吞噬作用中,通过脱颗粒作用释放到血清中,可以通过改变细菌表面的结构来增强其异己性,从而增强吞噬细胞的吞噬作用[46]。研究发现,海湾扇贝、栉孔扇贝[14]、施氏獭蛤Lutraria sieboldii Reeve[38]在急性温度胁迫下AKP活性升高,随着胁迫时间的延长,AKP活性逐渐降低,这可能与温度骤升抑制了免疫酶活性有关[47]。本研究中发现,在高温胁迫条件下AKP出现了降低的趋势,但最终恢复至常温常盐组水平,产生不同结果的原因可能是不同物种对高温耐受力不同所致。同样,盐度的变化通常也会影响到动物体内AKP的活性,研究表明,低盐胁迫条件下近江牡蛎[45]和中国血蛤Sanguinolaria[46]血淋巴内AKP的活性表现出先升高后降低的趋势。在本研究中,蛤仔AKP活性随盐度降低亦出现先升高后降低的趋势,在胁迫后期,AKP恢复正常值。有研究表明,在低盐胁迫时,贝类体内会产生大量氧离子自由基,可通过提高磷酸酶活力清除体内过量的自由基,避免体内细胞受到氧化损伤,但长时间低盐胁迫导致机体能量消耗过度以及血细胞大量凋亡,最终导致细胞内溶酶体中AKP活性降低[48];蛤仔AKP在胁迫后期表现出活性恢复过程,其原因可能是随着蛤仔渗透压逐渐与外界环境平衡,机体内环境趋于稳定,使其AKP活性亦逐渐恢复[49]。
3.5 温度与盐度互作对蛤仔渗透压的影响
当外界环境盐度发生改变时,贝类可以通过调节体内Na+和Cl-的浓度,或者改变血淋巴中的蛋白质和游离脂肪酸等来维持细胞内外的渗透压平衡[50]。有研究表明,温度升高会导致贝类体内血细胞数量增加,免疫酶活性升高[8,12,14-15,38,47]。本研究中也发现,温度升高会导致贝类血细胞数量增加,AKP活性增加;当温度持续升高时会造成生物体内蛋白质变性,发生氧化应激并出现细胞损伤,使细胞凋亡数量增加[40,51],此时血细胞中的免疫因子释放到血淋巴中,会导致蛤仔渗透压随温度的升高而升高。通常情况下,盐度降低时机体渗透压也会降低,在对魁蚶稚贝[5]、紫贻贝[52]、九孔鲍[53]的研究中得到了类似的结论。本研究中也发现,随着盐度的降低蛤仔渗透压逐渐下降,但不同低盐胁迫的蛤仔渗透压降低的幅度不同。蔡星媛等[5]对魁蚶稚贝的研究发现,其机体渗透压随盐度的降低而降低,但盐度为25时魁蚶稚贝的渗透压低于盐度为15时,通过观察发现,魁蚶稚贝在盐度15时,闭壳时间最长且频率最低,从而导致渗透压降低的幅度低于盐度25时。在本试验中,高温中盐、低盐组与常温中盐、低盐组相比,24 h后前者渗透压降低的速度加快,原因可能是在短时间低盐胁迫时贝类会通过关闭贝壳与外界环境隔离,而后逐渐通过改变体内的渗透压来适应外界的环境[5];但是关闭贝壳必然会影响贝类与外界环境的气体交换过程,同时高温胁迫导致贝类体内能量代谢增强,氧气消耗加快[38],因此,闭壳时间变短,导致体内渗透压变化速度快于正常温度组。孟宪亮等[54]对刺参Apostichopus japonicu s研究时也发现,温度升高时,盐度变化更容易引起刺参体腔液渗透压的改变。
[1]王如才,王昭萍.海水贝类养殖学[M].青岛:中国海洋大学出版社,2008.
[2]林笔水,吴天明,黄炳章.温度和盐度对菲律宾蛤仔稚贝生长及发育的影响[J].水产学报,1983,7(1):15-24.
[3]宋晓楠,马峻峰,秦艳杰,等.盐度骤降对菲律宾蛤仔抗氧化酶活力及组织结构的影响[J].农学学报,2013,3(1):50-56,70.
[4]Matozzo V,MonariM,Foschi J,etal.Effects of salinity on the clam Chamelea gallina:part I:alterations in immune responses[J].Ma-rine Biology,2007,151(3):1051-1058.
[5]蔡星媛,张秀梅,田璐,等.盐度胁迫对魁蚶稚贝血淋巴渗透压及鳃Na+/K+-ATP酶活力的影响[J].南方水产科学,2015,11 (2):12-19.
[6]Castagna M,Chanley P.Salinity tolerance of some marine bivalves from inshore and estuarine environments in Virginia waters on the western mid-Atlantic coast[J].Malacologia,1973,12(1):47-96.
[7]Malham S K,Cotter E,O蒺Keeffe S,et al.Summer mortality of the Pacific oyster,Crassostrea gigas,in the Irish Sea:the influence of temperature and nutrients on health and survival[J].Aquaculture, 2009,287(1-2):128-138.
[8]李文姬,谭克非.日本解决虾夷扇贝大规模死亡的启示[J].水产科学,2009,28(10):609-612.
[9]Monari M,Matozzo V,Foschi J,et al.Effects of high temperatures on functional responses of haemocytes in the clam Chamelea galli-na[J].Fish&Shellfish Immunology,2007,22(1-2):98-114.
[10]Yu Jinhua,Song JH,ChoiM C,etal.Effects ofwater temperature change on immune function in surf clams,Mactra veneriformis(Bi-valvia:Mactridae)[J].Journal of Invertebrate Pathology,2009, 102(1):30-35.
[11]Hannam M L,Bamber SD,Moody JA,et al.Immune function in the Arctic scallop,Chlamys islandica,following dispersed oil ex-posure[J].Aquatic Toxicology,2009,92(3):187-194.
[12]Paillard C,Allam B,Oubella R.Effect of temperature on defense parameters in Manila clam Ruditapes philippinarum challenged with Vibrio tapetis[J].Diseases of Aquatic Organisms,2004,59 (3):249-262.
[13]Allam B,Ford SE.Effects of the pathogenic Vibrio tapetis on de-fence factors of susceptible and non-susceptible bivalve species: I.haemocyte changes following in vitro challenge[J].Fish& Shellfish Immunology,2006,20(3):374-383.
[14]Liu Shiliang,Jiang Xiaolu,Hu Xiaoke,et al.Effects of tempera-ture on non-specific immune parameters in two scallop species: Argopecten irradians(Lamarck 1819)and Chlamys farreri(Jones &Preston 1904)[J].Aquaculture Research,2004,35(7):678-682.
[15]H佴garet H,Wikfors G H,Soudant P.Flow cytometric analysis of haemocytes from eastern oysters,Crassostrea virginica,subjected to a sudden temperature elevation:II.haemocyte functions:aggre-gation,viability,phagocytosis,and respiratory burst[J].Journal of Experimental Marine Biology and Ecology,2003,293(2):249-265. [16]Pipe R K,Coles JA.Environmental contaminants influencing im-mune function in marine bivalve molluscs[J].Fish&Shellfish Immunology,1995,5(8):581-595.
[17]Reid H I,Soudant P,Lambert C,et al.Salinity effects on immune parameters of Ruditapes philippinarum challenged with Vibrio tapetis[J].Diseases of Aquatic Organisms,2003,56(3):249-258. [18]Munari M,Matozzo V,Marin M G.Combined effects of tempera-ture and salinity on functional responses of haemocytes and sur-vival in air of the clam Ruditapesphilippinarum[J].Fish&Shell-fish Immunology,2011,30(4-5):1024-1030.
[19]ChengW,Juang FM,Chen JC.The immune response of Taiwan abalone Haliotis diversicolor supertexta and its susceptibility to Vibrio parahaemolyticus at different salinity levels[J].Fish& Shellfish Immunology,2004,16(3):295-306.
[20]Wang Youji,Hu Menghong,Cheung SG,etal.Immune parameter changes of hemocytes in green-lipped mussel Perna viridis expo-sure to hypoxia and hyposalinity[J].Aquaculture,2012,356-357:22-29.
[21]Cajaraville M P,Olabarrieta I,Marigomez I.In vitro activities in mussel hemocytes as biomarkers of environmental quality:a case study in the Abra estuary(Biscay Bay)[J].Ecotoxicology and Environmental Safety,1996,35(3):253-260.
[22]Gagnaire B,Frouin H,Moreau K,et al.Effects of temperature and salinity on haemocyte activities of the Pacific oyster,Crassostrea gigas(Thunberg)[J].Fish&Shellfish Immunology,2006,20 (4):536-547.
[23]Mercaldo R S,Rhodes EW.Influence of reduced salinity on the Atlantic bay scallop Argopecten irradians(Lamarck)at various temperatures[J].Journal of Shellfish Research,1982,2(2): 177-181.
[24]Paul JD.Salinity-temperature relationships in the queen scallop Chalamys opercularis[J].Marine Biology,1980,56(4):295-300.
[25]何义朝,张福绥.墨西哥湾扇贝稚贝对盐度的耐受力[J].海洋学报,1999,21(4):87-91.
[26]Peck L S,P觟rtner H O,Hardewig I.Metabolic demand,oxygen supply,and critical temperatures in the Antarctic bivalve Laternu-la elliptica[J].Physiological and Biochemical Zoology,2002,75 (2):123-133.
[27]Feng SY.Pinocytosis of proteins by oyster leucocytes[J].Biolog-ical Bulletin,1965,129(1):95-105.
[28]孙虎山,李光友.栉孔扇贝血细胞的吞噬作用及其扫描电镜研究[J].高技术通讯,2001,11(4):16-19,5.
[29]饶小珍,陈寅山,林岗,等.九孔鲍血细胞吞噬能力的研究[J].海洋水产研究,2007,28(2):56-62.
[30]刘志鸿,张士璀,杨爱国,等.毛蚶血细胞的形态观察及吞噬性能研究[J].高技术通讯,2003,13(10):94-96.
[31]张维翥,吴信忠,李登峰,等.栉孔扇贝血液细胞的免疫功能[J].动物学报,2005,51(4):669-677.
[32]Carballal M J,L佼pez C,Azevedo C,et al.In vitro study of phago-cytic ability of Mytilus galloprovincialis Lmk.haemocytes[J]. Fish&Shellfish Immunology,1997,7(6):403-416.
[33]Chen Muyan,Yang Hongsheng,DelaporteM,etal.Immune condi-tion of Chlamysfarreri in response to acute temperature challenge [J].Aquaculture,2007,271(1-4):479-487.
[34]Martello L B,Friedman C S,Tjeerdema R S.Combined effects of pentachlorophenol and salinity stress on phagocytic and chemotac-tic function in two species of abalone[J].Aquatic Toxicology, 2000,49(3):213-225.
[35]Lacoste A,Malham SK,Cueff A,etal.Evidence for a form of ad-renergic response to stress in the mollusc Crassostrea gigas[J]. Journal of Experimental Biology,2001,204(Pt7):1247-1255.
[36]Lacoste A,Malham S K,Cueff A,et al.Stress-induced cate-cholamine changes in the hemolymph of the oyster Crassostrea gigas[J].General and Comparative Endocrinology,2001,122 (2):181-188.
[37]Lacoste A,Malham S K,Cueff A,et al.Noradrenaline modulates oyster hemocyte phagocytosis via a茁-adrenergic receptor-cAMP signaling pathway[J].General and Comparative Endocrinology, 2001,122(3):252-259.
[38]刘敏.不同温度和盐度对施氏獭蛤消化酶和免疫酶活力的影响[D].湛江:广东海洋大学,2015.
[39]Mori K,Nakanishi T,Suzuki T,et al.Defensemechanisms in in-vertebrates and fish[J].Tanpakushitsu Kakusan Koso Protein, Nucleic Acid,Enzyme,1989,34(3):214-223.
[40]徐钢春,顾若波,闻海波,等.环境胁迫对河蚬溶菌酶和超氧化物歧化酶活性的影响[J].安徽农业大学学报,2007,34 (1):74-78.
[41]Langston A L,Hoare R,Stefansson M,etal.The effectof tempera-ture on non-specific defence parameters of three strains of juven-ile Atlantic halibut(Hippoglossus hippoglossus L.)[J].Fish& Shellfish Immunology,2002,12(1):61-76.
[42]华育平,刘红柏,张颖.温度、疾病感染对史氏鲟血清和各组织中溶菌酶水平的影响[J].东北林业大学学报,2005,33 (3):63-66.
[43]FisherW S,Oliver LM,Edwards P E.Hematologic and serologic variability of eastern oysters from Apalachicola Bay,Florida[J]. Journal of Shellfish Research,1996,15(3):555-564.
[44]刘美剑,常亚青,杨芸霏,等.盐度渐变对虾夷扇贝(Patin-opecten yessoensis)免疫指标的影响[J].中国农业科技导报, 2011,13(3):129-135.
[45]时少坤.环境因子对贝类几种免疫因子影响的研究[D].上海:上海海洋大学,2013.
[46]王帅,高如承,温扬敏,等.盐度突变对中国血蛤非特异性免疫酶活性的影响[J].江苏农业科学,2008,36(5):213-215.
[47]李晓英,董志国,薛洋,等.温度骤升和窒息条件对青蛤酸性磷酸酶和溶菌酶的影响[J].水产科学,2009,28(6):321-324.
[48]郑艺杰.西施舌非特异性免疫研究[D].福州:福建农林大学,2006.
[49]栗志民,钱佳慧,劳翠英,等.温度和盐度对华贵栉孔扇贝免疫相关酶的联合效应[J].海洋科学进展,2015,33(2):227-238.
[50]Natochin Y V,Berger V Y,Khlebovich V V,et al.The participa-tion of electrolytes in adaptation mechanisms of intertidal molluscs蒺cells to altered salinity[J].Comparative Biochemistry and Physiology Part A:Physiology,1979,63(1):115-119.
[51]杜丽,张巍,陆逵,等.贝类免疫机制研究进展[J].动物医学进展,2008,29(3):77-81.
[52]Livingstone D R,Widdows J,Fieth P.Aspects of nitrogenmetabo-lism of the common mussel Mytilus edulis:adaptation to abrupt and fluctuating changes in salinity[J].Marine Biology,1979,53 (1):41-55.
[53]Cheng W,Yeh S P,Wang Chenshu,et al.Osmotic and ionic changes in Taiwan abalone Haliotis diversicolor supertexta at dif-ferent salinity levels[J].Aquaculture,2002,203(3-4):349-357.
[54]孟宪亮.刺参和潮间带螺类对温度和盐度胁迫的生理响应[D].青岛:中国海洋大学,2012.
Synergistic effects of high tem perature and low salinity on immunity of M anila clam Ruditapes philippinarum
YANG Dong-min,ZHANG Yan-li,DING Jian-feng,YANG Feng, HUO Zhong-ming,NIE Hong-tao,YAN Xi-wu
(College of Fisheries and Life Science,Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province,Dalian Ocean University, Dalian 116023,China)
The changes in blood cell count,phagocytosis ability,osmotic pressure,and activities of lysozyme (LZM),and alkaline phosphatase(AKP)in serum were monitored in Manila clam Ruditapes philippinarum with body weight of(14.8依0.73)g exposed to temperatures(21益,and 30益)and a salinity of7,15,and 32 for 0, 3,6,12,24,48,and 72 h in order to investigate the synergistic effects of temperatures and salinity on the immuni-ty of Manila clam.The results showed that therewere some fluctuations in blood parameters and activities of serum LZM and AKP in the experimental groups at water temperature of 21益and a salinity of 32,without significant differences(P>0.05)in 0-72 h compared with initial level in the control group.The blood cells countswere re-covered to the initial level in the clam in the 21益and low salinity of7 group in 72 h,while the blood cells counts were not returned to the initial level in the clam in the 30益,32益and salinity 32 groups in 72 h.The clam in high temperature 30益and low salinity 7 group died in 48 h,although they had recovery blood cell count in 24 h. The clam in high temperature 30益and low salinity 7 showed elevated phagocytosis firstand then decrease in hago-cytosisd,even lower than the initial level in 72 h(P<0.05),while the clam inmedium salinity 15 and 7 and 21益groups had recovery phagocytic activities,with higher phagocytosis in high temperature 30益and low salinity 7 groups in 24 h(P<0.05).There were significantly higher LZM activities than the initial level in the clam among experimental groups in 72 h(P<0.05),with themaximal AKP activity in 3 h and recovery initial levels in 72 h. The gradual decrease in osmotic pressure was observed in medium and low salinity groups,while the gradual in-crease in osmotic pressure in the high temperature 30益and salinity 32 group,without recovery initial level in 72 h.The findings indicate that the interaction of temperatures increase and salinity decrease will have amore serious effect on the immunity of shellfish,which may be involved in the high mortality ofmudflat shellfish in summer.
Ruditapes philippinarum;high-temperature;low salinity;immunity
S968.31
A
10.16535/j.cnki.dlhyxb.2017.03.008
2095-1388(2017)03-0302-08
2016-12-05
国家现代农业产业技术体系建设项目(CARS-48);辽宁省教育厅科研项目(L2014276)
杨东敏(1990—),女,硕士研究生。E-mail:ydm9110@163.com
闫喜武(1962—),男,博士,教授。E-mail:yanxiwu@dlou.edu.cn
——2017年渗透压相关高考真题赏析

