大段异体骨重建骨肿瘤切除后的骨干缺损
牛晓辉 邓志平 张清 郝林 鱼锋 李远
. 骨肿瘤 Bone neoplasms .
大段异体骨重建骨肿瘤切除后的骨干缺损
牛晓辉 邓志平 张清 郝林 鱼锋 李远
目的探讨应用大段异体骨重建骨肿瘤切除后骨干缺损的疗效及并发症。方法回顾分析我院 1998 年 12 月至 2015 年 12 月期间使用大段异体骨重建骨干缺损的患者 67 例,其中股骨干 32 例,胫骨干23 例,肱骨干 12 例。重建所用的异体骨为深低温冷藏,平均长度为 16.5 ( 8~30 ) cm,使用钢板螺丝钉、髓内针或髓内针加短钢板复合固定。随访 12~182 个月,平均 50.2 个月,观察异体骨愈合情况及并发症。结果随访结束时,5 例死亡,发生严重并发症而取出异体骨 7 例,异体骨的 5 年生存率为 86%。大段异体骨的骨端总愈合率为 68.8%,愈合时间为 6~48 个月,平均 16.8 个月,异体骨与宿主骨接触端位于干骺端者愈合率为86.2%,接触端位于皮质者愈合率为 63.6%,二者差异有统计学意义。不愈合的患者中有 9 例接受再次手术,均取得愈合。随访结束时 MSTS 评分为 17~30 分,平均 24.3 分,其中上肢患者 MSTS 评分为 18~28 分,平均24.1 分,下肢患者 MSTS 评分为 17~30 分,平均 24.4 分。结论使用大段异体骨对骨肿瘤切除骨干缺损进行重建并完成骨愈合后,患者可长期使用,从而获得良好的功能,接触端不愈合的患者通过再次手术干预仍能达到满意的愈合率。
骨肿瘤;骨重建;骨干
骨肿瘤的保肢手术目前已广泛开展,行瘤段切除后的骨缺损重建方法包括人工假体、同种异体骨、灭活再植等,位于骨干的骨肿瘤进行广泛切除后往往能保留自身的关节,因此骨干的重建有自身的特点。随着化疗等综合治疗的进步,恶性骨肿瘤的生存率得到提高,坚强而耐用的重建显得更加重要。近年来间置型人工假体开始使用,这种人工假体用于骨干缺损的重建,两端为髓针,插入到骨缺损两端正常的髓腔中,但其应用仍有自身的适应证,仍有较多的并发症[1-2]。生物固定在骨愈合后能够让患者获得长期的良好功能,同种异体骨是经常应用的生物固定方式[3]。本研究现就我科应用大段异体骨重建骨干缺损的病例报道如下。
资料与方法
一、一般资料
本研究为回顾性研究,从我院骨肿瘤数据库中检索因骨干部位肿瘤切除后缺损而行大段异体骨重建的患者,纳入标准为肿瘤切除后仅为骨干缺损,自身关节仍可保留,异体骨与宿主骨之间可进行坚强固定,排除标准为肿瘤距离关节近无法保留自身关节者。1998 年 12 月至 2015 年 12 月,我科应用大段异体骨重建骨干缺损 78 例,其中资料完整者 67 例,男 41 例,女 26 例,中位年龄 23 ( 7~77 ) 岁,主要诊断为骨肉瘤、尤文肉瘤及造釉细胞瘤等,病种详见表 1。64 例为恶性肿瘤,3 例为良性或侵袭性肿瘤。其中位于股骨干 32 例,胫骨干23 例,肱骨干 12 例。
二、治疗方法
本组中的骨肉瘤、尤文肉瘤、未分化多形性肉瘤等均行术前化疗,手术及术后化疗,其余肿瘤均为手术治疗。手术前根据 CT 及 MRI 对肿瘤切除进行设计,术后对切除标本进行评估,恶性肿瘤按照术前设计均达到广泛外科边界,良性及侵袭性肿瘤均达到边缘或广泛边界。
所用异体骨为北京积水潭医院创伤骨科研究所骨库或山西奥瑞生物材料有限公司骨库提供,均为深低温冷冻保存异体骨,在零下 80 ℃ 深低温冰箱中保存,使用时按流程逐步复温,根据骨干缺损长度截取异体骨进行重建,与宿主骨接触面平整,使用髓内针或钢板或髓内针加短钢板进行固定,宿主骨与异体骨接触面植入碎的自体骨或异体骨。为了提高愈合率,后期有 6 例加用了带血管蒂腓骨插入宿主骨及异体骨中。
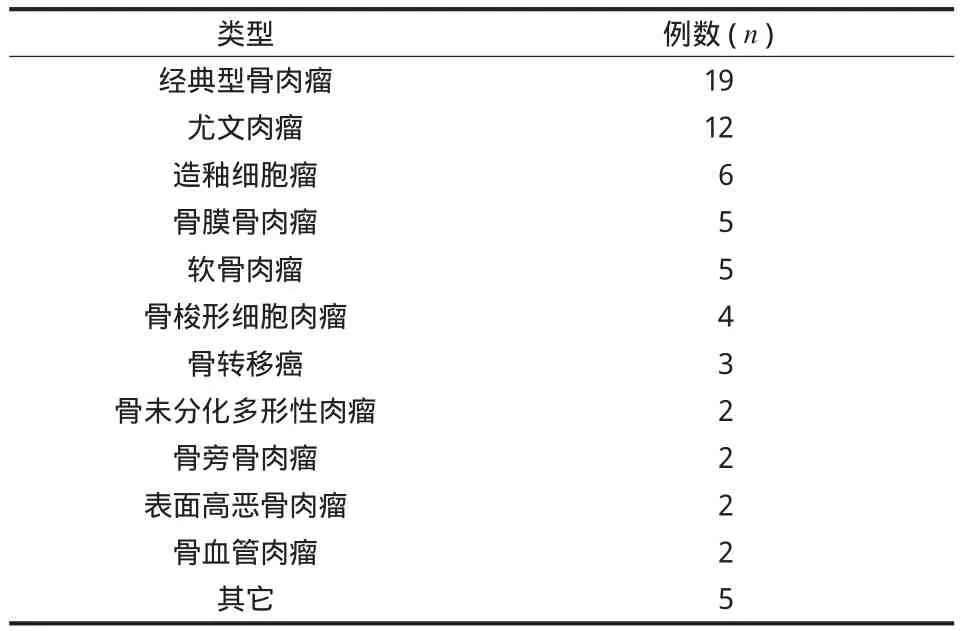
表 1 病种详情Tab.1 The diagnosis of this group of patients
本组患者所用异体骨长度为 8~30 cm,平均16.5 cm。早期病例多选择髓内针固定,后期病例采用钢板或髓内针加短钢板复合固定,单纯钢板固定 40 例,单纯髓内针固定 14 例,髓内针加短钢板13 例,为增加异体骨强度,对使用钢板固定的患者中有 17 例在异体骨髓腔中填充了骨水泥。
患者术后即开始肌肉等长收缩训练,术后 3~4 周开始邻近关节的屈伸锻炼,下肢患者 6~8 周拄拐免负重下地活动,视愈合情况决定负重,待复查显示骨愈合后才能完全弃拐负重活动。上肢患者骨愈合前避免持重。术后 2 年内患者每 3 个月拍 X 线片复查 1 次,X 线片上显示宿主骨与异体骨结合端全部或部分骨缝隙模糊或消失,新生骨纹理穿过骨缝时认为出现骨愈合。
三、统计学处理
采用 SPSS 19.0 软件进行统计分析,采用描述性统计,χ2检验及 Kaplan-Meier 生存分析,P<0.05 为差异有统计学意义。
结 果
本组 78 例,术后随访 12~182 个月,平均50.2 个月。随访结束时 5 例死亡。7 例因发生严重并发症而取出异体骨,其中 3 例为严重异体骨感染,感染后 2 例行截肢术,1 例行异体骨取出旷置术;2 例因局部肿瘤复发而行截肢术;1 例因异体骨骨折而取出异体骨行人工关节置换术;1 例股骨干重建患者因股骨近端转移而取出异体骨行人工全股骨置换。计算异体骨生存率的终点为异体骨取出,异体骨生存曲线见图 1,异体骨的 5 年生存率为86%。最终 63 例得到保肢,保肢率为 94%。
其它并发症包括伤口感染及异体骨不愈合。2 例术后伤口感染不愈合,行清创术及皮瓣转移覆盖后愈合良好。除去 3 例因感染取出异体骨,其余 64 例共有 128 个接触端,其中 88 个 ( 68.8% ) 接触端自行愈合,40 个 ( 31.2% ) 接触端未自行愈合。88 个愈合端愈合时间为 6~46 个月,平均 16.8 个月。其中 29 个端位于干骺端,25 个端得到愈合,愈合率为 86.2%,99 个端位于皮质内,63 个端得到愈合,愈合率为63.6%,P=0.023,二者差异有统计学意义,位于干骺端更容易愈合。接触端位于皮质愈合时间为平均17.8 ( 6~46 ) 个月,接触端位于干骺端愈合时间为平均 14.1 ( 6~36 ) 个月。
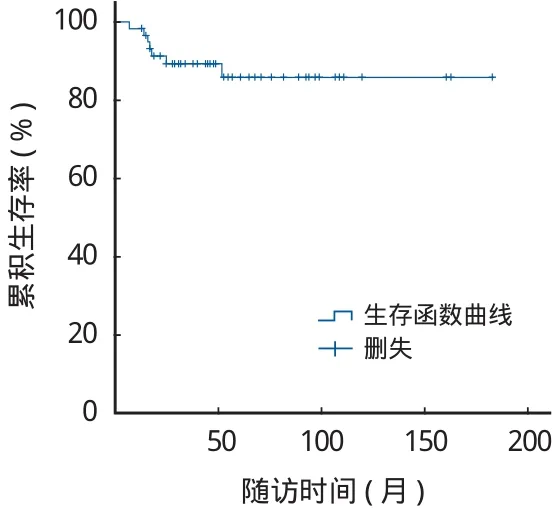
图 1 异体骨生存曲线Fig.1 The survival curve of the allograft
29 例两端均自然愈合 ( 图 2 ),5 例为两端未愈合,其中 2 例已经因疾病死亡,1 例因肿瘤复发行截肢,另外 2 例均为股骨干缺损重建,患者扶拐行走,不愿接受手术。另外 30 例为 1 个接触端未愈合,4 个接触端再次手术行带血管蒂腓骨或髂骨移植,其中 3 例为带血管蒂腓骨,1 例为带血管蒂髂骨,经过 7~12 个月得到愈合,5 个接触端通过植自体髂骨得到愈合,愈合时间为 8~23 个月,其余患者均仍在等待愈合或对生活影响不大未行手术。
初次行异体骨手术时同时行带血管蒂腓骨移植6 例,4 例两端愈合,另 2 例一端已愈合,因随访时间尚短,未愈合的端仍在等待愈合。17 例在异体骨髓腔中加入骨水泥的单纯钢板固定患者未发生异体骨骨折。
随访结束时,异体骨仍存留的 60 例 MSTS 评分为 17~30 分,平均为 24.3 分,其中上肢患者 MSTS评分为 18~28 分,平均 24.1 分,下肢患者 MSTS 评分为 17~30 分,平均 24.4 分。
讨 论
一、骨干缺损重建方式的选择
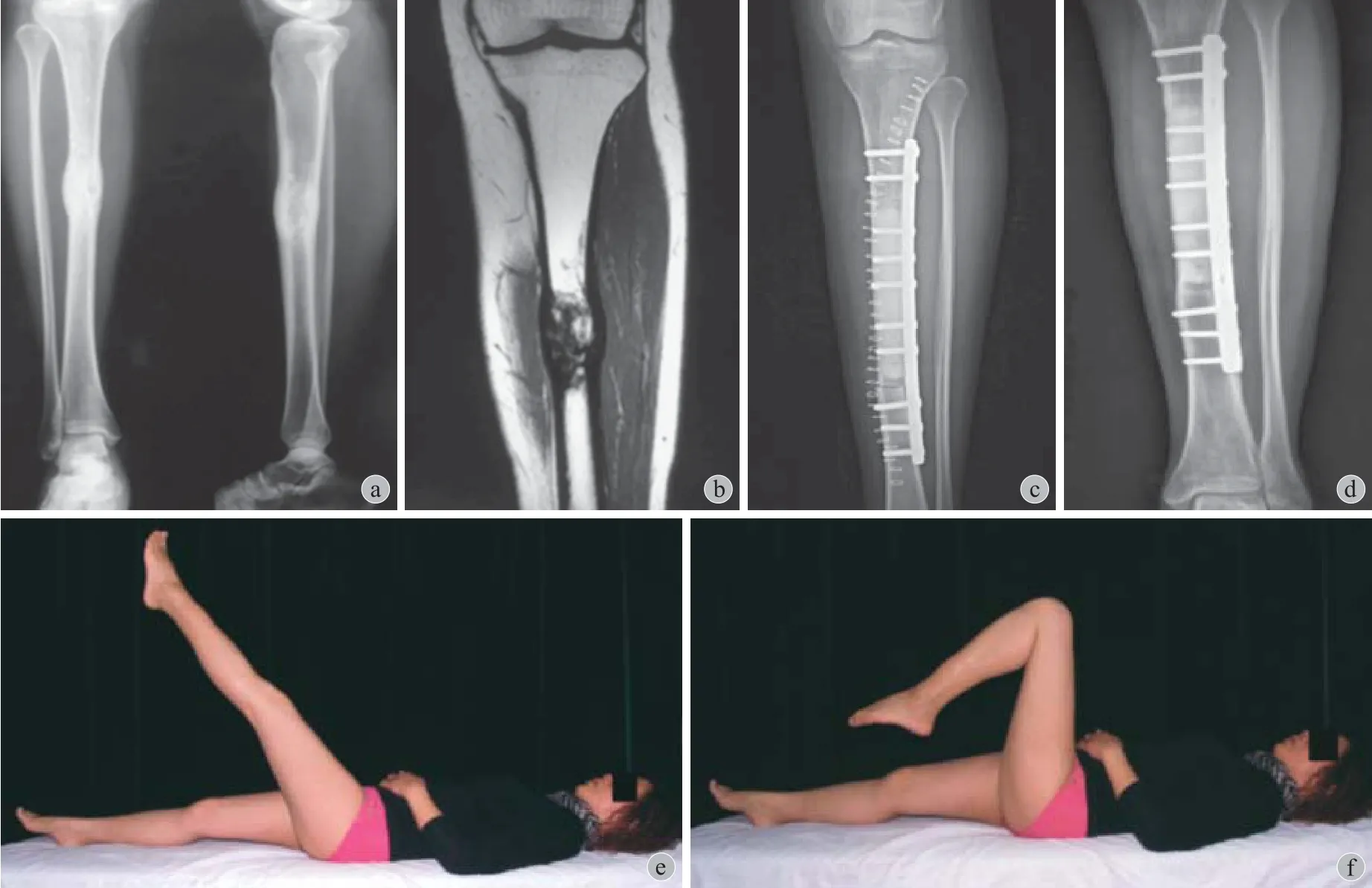
图 2 患者,女,38 岁,胫骨造釉细胞瘤,行瘤段截除大段异体骨重建 a:术前 X 线片;b:术前 MRI;c:术后 X 线片;d:术后 4 年半 X 线片;e~f:术后 4 年半功能相Fig.2 Female, 38 years old, adamantinoma of the tibia. She received the segmental resection and allograft reconstruction a: The preoperative X-ray; b: The preoperative MRI; c: The postoperative X-ray; d: The X-ray taken at 4 and half years after operation; e - f: The functional pictures taken at 4 and half years after operation
骨干部位肿瘤切除后的可能重建方式包括大段异体骨、人工假体、带血管蒂腓骨、自体骨灭活再植、骨搬运等[4],进行重建方式选择时需要考虑到患者的年龄、功能需求及可能的并发症等因素。人工假体为机械重建,短期效果好,但远期的并发症仍然较多,大段异体骨、自体腓骨、灭活再植及骨搬运均为生物重建,如果骨愈合则远期效果好。骨干的间置型人工假体可以使患者获得即刻的骨干稳定性,因为手术中邻近关节得到保留,患者的近期功能往往很好,Benevenia 等[2]研究 41 例进行的44 次骨干假体手术,经过 1~51 个月随访,MSTS评分为 77%,这组患者中骨转移癌患者较多,术后的即刻稳定性让这些患者获益,但人工关节的长期并发症仍较多,包括松动、感染等,笔者还发现股骨的间置型假体并发症发生率很高,远高于胫骨干及肱骨干的间置型假体。灭活再植不需要骨库,具有取材方便、形状合适等优点,但灭活技术需要熟练掌握才能进行应用[5]。单纯带血管蒂腓骨重建骨干缺损主要应用于儿童,许多报道往往将带血管蒂腓骨重建与大段异体骨或自体灭活骨一起使用[6],也可以在异体骨不愈合时使用以促进异体骨的愈合,本组 3 例不愈合患者再次手术时使用了带血管蒂腓骨移植,均在 12 个月内得到愈合。骨搬运重建骨干缺损应用较少,如果搬运成功可以使患者获得稳定的强度,但整个过程持续时间较长,感染的发生风险高,临床中选择此重建方式较少[7]。大段异体骨重建骨干缺损是广泛应用的方法,随着骨库的发展,异体骨的获得更加容易,在内固定的帮助下如果骨愈合则患者可长期使用甚至可望终身使用。本组患者使用异体骨重建骨干缺损愈合后能获得良好的功能,因此提高异体骨的愈合率即可提高患者的术后功能。
二、大段异体骨的生存率及严重并发症
大段异体骨重建后如果出现严重并发症则有取出异体骨的风险,包括严重感染、肿瘤局部复发及异体骨骨折等都可能会取出异体骨。Muscolo 等[8]报道 59 例骨干缺损异体骨重建患者,经过平均 5 年的随访,Kaplan-Meier 生存分析显示其异体骨 5 年生存率为 79%,共有 9 例异体骨取出。Mankin 等[3]研究认为异体骨手术后的第 1 年容易发生深部感染,术后 3 年内容易发生异体骨骨折,这都会影响到异体骨的生存及患者功能,3 年之后异体骨如果愈合则功能将会稳定。Capanna 等[9]报道了 90 例使用大段异体骨同时使用带血管蒂腓骨的病例,最终有6 例 ( 6.5% ) 异体骨取出,4 例因为感染,2 例因为异体骨骨折。Aponte-Tinao 等[10]报道了 83 例大段异体骨重建股骨骨干缺损的病例,异体骨的 5 年生存率为 85%,15 例 ( 18.8% ) 异体骨因为严重并发症取出,1 例因为感染,1 例因为局部复发,13 例为异体骨骨折。本组病例中异体骨的 5 年存活率为 86%,与文献报道类似,7 例异体骨取出,占10.1%,其中 6 例均发生在术后 3 年内,因此异体骨的早期并发症可能会影响到异体骨的生存,一旦骨愈合则患者可长期使用。
三、不愈合的发生及处理
大段异体骨的愈合指移植骨与宿主骨骨端的愈合,大段异体骨本身不能全部成活,宿主骨往移植骨方向产生骨痂,包绕并把持异体骨,最终完成爬行替代[11]。因为异体骨的这种愈合机制,其愈合较慢,发生不愈合的几率比较高,文献报道大段异体骨重建骨干缺损的不愈合率为 9%~63%[12],平均为 34%。有学者认为术后 1 年无愈合迹象即为不愈合[13],但许多病例实际愈合的时间比 1 年要长。Donati 等[12]报道了大段异体骨重建骨干缺损的不愈合率达 63%,而 Muscolo 等[8]的研究则显示愈合率更高,118 个结合端中有 11 端 ( 9% ) 未自行愈合,结合端位于骨干的不愈合率更高,为 15%,而结合端位于干骺端仅 1% 发生不愈合。Aponte-Tinao等[10]的研究显示 166 个结合端中,22 端 ( 13% ) 未自行愈合,结合端位于骨干的不愈合率为 20%,而结合端位于干骺端其不愈合率仅为 1%。Capanna等[9]的研究中使用大段异体骨同时采用带血管蒂腓骨,73% 的患者仅经过一次手术即获得成功愈合,患者能长久使用异体骨。本组不愈合率为 31.2%,与文献中平均不愈合率类似,同时也再次证实结合端位于干骺端比位于骨干更容易愈合,二者差异有统计学意义。有研究显示固定方式可能影响不愈合率,采用髓内针固定的患者比采用钢板固定的不愈合率高,但差异无统计学意义[8,10]。也有研究显示化疗不利于异体骨愈合[14]。异体骨与宿主骨不愈合发生后可以再次进行手术干预,在接触端植入自体松质骨或进行带血管蒂腓骨移植均可取得较好效果[10]。本研究的不愈合病例中,4 个接触端再次手术行带血管蒂腓骨或髂骨移植,经过 7~12 个月得到愈合,5 个接触端通过植自体髂骨得到愈合,愈合时间为 8~23 个月。
综上所述,使用大段异体骨对骨肿瘤切除后骨干缺损进行重建是常用的手术方式,完成骨愈合后患者可长期使用,获得良好的功能,接触端不愈合的患者通过再次手术干预仍能获得较高的愈合率,不断改进方法促进接触端的愈合是以后使用大段异体骨需要重点考虑的内容。
[1] Ahlmann ER, Menendez LR. Intercalary endoprosthetic reconstruction for diaphyseal bone tumours[J]. J Bone Joint Surg Br, 2006, 88(11):1487-1491.
[2] Benevenia J, Kirchner R, Patterson F, et al. Outcomes of a modular intercalary endoprosthesis as treatment for segmental defects of the femur, tibia, and humerus[J]. Clin Orthop Relat Res, 2016, 474(2):539-548.
[3] Mankin HJ, Gebhardt MC, Jennings LC, et al. Long-term results of allograft replacement in the management of bone tumors[J]. Clin Orthop Relat Res, 1996, (324):86-97.
[4] Chen TH, Chen WM, Huang CK. Reconstruction after intercalary resection of malignant bone tumours: comparison between segmental allograft and extracorporeally-irradiated autograft[J]. J Bone Joint Surg Br, 2005, 87(5):704-709.
[5] Sugiura H, Takahashi M, Nakanishi K, et al. Pasteurized intercalary autogenous bone graft combined with vascularized fi bula[J]. Clin Orthop Relat Res, 2007, 456:196-202.
[6] Chang DW, Weber KL. Use of a vascularized fi bula bone fl ap and intercalary allograft for diaphyseal reconstruction after resection of primary extremity bone sarcomas[J]. Plast Reconstr Surg, 2005, 116(7):1918-1925.
[7] Tsuchiya H, Tomita K, Minematsu K, et al. Limb salvage using distraction osteogenesis: a classification of the technique[J]. J Bone Joint Surg Br, 1997, 79(3):403-411.
[8] Muscolo DL, Ayerza MA, Aponte-Tinao L, et al. Intercalary femur and tibia segmental allografts provide an acceptable alternative in reconstructing tumor resections[J]. Clin Orthop Relat Res, 2004, (426):97-102.
[9] Capanna R, Campanacci DA, Belot N, et al. A new reconstructive technique for intercalary defects of long bones: the association of massive allograft with vascularized fibular autograft. Long-term results and comparison with alternative techniques[J]. Orthop Clin North Am, 2007, 38(1):51-60.
[10] Aponte-Tinao L, Farfalli GL, Ritacco LE, et al. Intercalary femur allografts are an acceptable alternative after tumor resection[J]. Clin Orthop Relat Res, 2012, 470(3):728-734.
[11] Enneking WF, Campanacci DA. Retrieved human allografts: a clinicopathological study[J]. J Bone Joint Surg Am, 2001, 83-A(7):971-986.
[12] Donati D, Capanna R, Campanacci D, et al. The use of massive bone allografts for intercalary reconstruction and arthrodeses after tumor resection. A multicentric European study[J]. Chir Organi Mov, 1993, 78(2):81-94.
[13] Sorger JI, Hornicek FJ, Zavatta M, et al. Allograft fractures revisited[J]. Clin Orthop Relat Res, 2001, (382):66-74.
[14] Frisoni T, Cevolani L, Giorgini A, et al. Factors affecting outcome of massive intercalary bone allografts in the treatment of tumours of the femur[J]. J Bone Joint Surg Br, 2012, 94(6): 836-841.
( 本文编辑:裴艳宏 )
Segmental allograft reconstruction for diaphyseal bone defect after tumor resection
NIU Xiao-hui, DENG Zhiping, ZHANG Qing, HAO Lin, YU Feng, LI Yuan. Department of Orthopedic Oncology Surgery, Beijing Jishuitan Hospital, Beijing, 100035, China
NIU Xiao-hui, Email: niuxiaohui@263.net
ObjectiveTo evaluate the clinical outcomes and complications of segmental allograft reconstruction for diaphyseal defects after tumor resection.MethodsWe retrospectively analyzed 67 cases with diaphyseal defects who underwent segmental allograft reconstruction, including 32 cases located at the femur, 23 cases at the tibia and 12 cases at the humerus. Segmental allografts were preserved by deep fresh freezing, and the average length was 16.5 cm ( range: 8 - 30 cm ). The allografts were fi xed by plates and screws, or interlocking intramedullary nails, or by both. We followed up the patients for a mean period of 50.2 months ( range: 12 - 182 months ) and analyzed the union of the allografts and complications.ResultsAt the end of the follow-up, 5 patients died of the diseases. The allografts were removed out in 7 cases with severe complications. The 5-year survival rate was 86%. The bone union rate was 68.8%. The average union time was 16.8 months ( range: 6 - 48 months ). The union rate was 86.2% when the junction was located at the metaphyseal region, which was higher than 63.6% when the junction at the diaphyseal region. There were statistically signif i cant differences between them. Nine of the nonunion cases
surgery again and bone union was achieved at last. At the end of the follow-up, the mean MSTS score was 24.3 ( range: 17 - 30 ), 24.1 ( range: 18 - 28 ) for upper limbs and 24.4 ( range: 17 - 30 ) for lower limbs.ConclusionsSegmental allograft is one of the main reconstruction methods for diaphyseal defects after tumor resection. It could be used for a long time with good function when bone union is achieved. For those patients with nonunion, bone union could also be gained after surgical intervention.
Bone neoplasms; Bone remodeling; Diaphyses
10.3969/j.issn.2095-252X.2017.06.002
R738.1, R687.3
作者单位:100035 北京积水潭医院骨肿瘤科
牛晓辉,Email: niuxiaohui@263.net
2017-03-01 )

