山东省芋花叶病毒病的田间调查及鉴定
高利利 姜珊珊 吴 斌 张 眉 王升吉 辛相启(山东省农业科学院植物保护研究所,山东济南 250100)
山东省芋花叶病毒病的田间调查及鉴定
高利利 姜珊珊 吴 斌 张 眉 王升吉 辛相启*
(山东省农业科学院植物保护研究所,山东济南 250100)
为明确芋花叶病毒(Dasheen mosaic virus,DsMV)在山东芋种植区的发生和遗传进化,在山东潍坊、青岛、烟台、日照和临沂等5个芋主栽区进行调查,对采集样品进行病毒病病原鉴定、序列分析和遗传进化分析。结果显示,芋花叶病毒的检出率为55.9%,在5个地区皆有分布。5个DsMV分离物cp基因的核苷酸序列相似性为88.5%~91.9%,氨基酸序列相似性为93.4%~97.5%;与国内外已报道代表性DsMV分离物cp基因的核苷酸与氨基酸的序列相似性分别为74.8%~99.4%、79.7%~99.1%。遗传进化分析显示,DsMV山东分离物与日本分离物(Ds23)、中国分离物(ND和ZAN)和美国分离物(DsMV-U2)亲缘关系较近,聚在同一分支。综上,DsMV在山东省芋主栽区发生普遍,其cp基因序列之间变异相对较大。关键词:芋花叶病毒;外壳蛋白基因;序列分析
芋(Colocasia esculenta Schott)又名芋头、芋艿,为天南星科芋属多年生宿根草本植物,因其球茎肉质细腻、营养丰富、高产、耐贮运,在世界各地广泛栽培(宋春凤和徐坤,2004)。近年来,芋市场需求大大增加,特别是沿海地区芋及其加工品出口量迅速增加,已成为胶东半岛重要的出口创汇蔬菜(沈镝 等,2011)。但由于长期采用无性繁殖极易导致病毒积累,引起种性退化,产量及商品价值受到严重威胁。目前,芋花叶病毒(Dasheen mosaic virus,DsMV)几乎在我国芋产区皆有分布(刘文洪等,2004)。芋受侵染后产量降低,品质变劣,久煮不烂,给生产带来巨大的经济损失(韦传宝 等,2009)。
DsMV为马铃薯Y病毒属(Potyvirus)的成员,最早于1970年在美国发现(Zettler et al.,1970),随后巴西、中国、印度、尼加拉瓜等国家相继报道(Chagas et al.,1993;陈集双和李德葆,1996;Pandit et al.,2001;Castro,2006)。我国广东、福建、湖北、浙江、上海等地均有DsMV发生(范怀忠和孙芥菲,1984;陈集双和李德葆,1996;杜红梅和黄丹枫,2002)。DsMV一般通过3种方式传播,在自然条件下主要通过多种介体昆虫(蚜虫)传播,还可通过无性繁殖材料以及机械汁液摩擦传播,其侵染的栽培植物和观赏植物达16个属以上(Chen et al.,2001)。感染DsMV的芋植株通常表现为叶片产生羽状花叶或斑驳,皱缩向上卷曲,叶脉黄化和茎坏死等症状,可造成产量损失60%以上(Zettler et al.,1987)。
山东省是芋的主要生产地,为了了解DsMV在山东芋种植区的发生分布及遗传进化情况,本试验对山东省5个芋主栽区进行调查,采集芋病毒病疑似样品,进行病原鉴定、序列分析和遗传进化树构建,旨在明确DsMV在山东栽培芋上的侵染及为害状况,以期为该病毒的早期预警提供技术支持,为生产中该病害的防治奠定基础。
1 材料与方法
1.1 试验材料
2016年8月在山东潍坊(昌邑、安丘)、青岛(平度、即墨)、烟台莱阳、日照莒县、临沂(莒南、沂水、沂南、兰山区)等地区共采集芋病毒病样品161份,同时采集大田中健康芋叶片作为阴性对照。
1.2 菌株、载体和生化试剂
TransZolTMPlant、Taq DNA聚合酶、dNTPs均购自TransGen Biotech公司;凝胶回收试剂盒购自GeneMark公司;HiScript II 1st Strand cDNA Synthesis Kit购自Vazyme Biotech公司;DH5α、pMD18-T、DL2000 DNA Marker购自TaKaRa公司。
1.3 植物总RNA的提取及病毒基因扩增
称取采集的植物叶片0.1~0.2 g,严格按照TransZolTMPlant试剂盒说明书提取总RNA,利用随机引物按照反转录试剂盒说明反转录成cDNA。利用DsMV cp基因的引物(P2F/P2R:5′-AGGTTGTATTGCAGGCAGATG-3′/5′-GCCAATA ACTGTGGCCTGTT-3′)进行PCR扩增及cp基因克隆,扩增片段为1 034 bp(Reyes et al.,2009)。引物由生工生物工程(上海)有限公司合成。
PCR反应体系:cDNA 1 μL,上下游引物各0.5 μL,10×buffer 5 μL,2.5 mmol·L-1dNTPs 2.5 μL,Taq DNA聚合酶0.5 μL,加ddH2O至25 μL。PCR扩增条件:预变性94 ℃,3 min;变性94 ℃,30 s,退火55 ℃,30 s,延伸72 ℃,1 min,共35个循环;终延伸72 ℃,10 min。取5 μL PCR扩增产物于1%琼脂糖凝胶上检测。回收目的条带并连接到pMD18-T载体上,阳性克隆经检测后,送往青岛擎科梓熙生物技术有限公司测序。

表1 用于序列比对和系统进化分析的DsMV分离物
1.4 序列比对分析
对所得DsMV分离物的cp基因序列进行BLAST分析,选取NCBI上已发表的有代表性分离物的cp基因序列,利用DNAstar软件中的Megalign进行序列相似性比对,利用Mega 5.05软件的Clustal W法进行多序列比对以及利用邻接法(Neighbor-Joining,NJ)构建系统进化树,设Bootstrap 1 000次重复进行各分支置信度分析。所用序列信息详见表1。
2 结果与分析
2.1 芋花叶病毒病的田间症状
对山东潍坊、青岛、烟台、日照、临沂等芋栽培区的调查发现,田间芋植株花叶病毒病发生普遍,初步统计显症率在35%~55%之间,严重的地块病株率在60%以上。症状主要为脉间褪绿黄化、叶片皱缩、叶脉褪绿、羽状花叶、褪绿斑驳、叶片畸形向上卷曲和叶片上产生明亮褪绿黄斑等典型病毒病症状(图1)。

图1 芋花叶病毒病田间症状类型a,脉间褪绿黄化;b,叶片皱缩、叶脉褪绿;c,羽状花叶;d,褪绿斑驳;e,叶片畸形向上卷曲;f,叶片上产生明亮褪绿黄斑。彩色图版见《中国蔬菜》网站:www.cnveg.org。
2.2 山东芋花叶病毒的RT-PCR检测
为了明确田间芋花叶病毒病的病原,在潍坊、青岛、烟台、日照及临沂5个地(市)采集了161份病毒病疑似样品,分别进行RNA提取及RT-PCR检测。结果显示,在90份样品中检测到DsMV cp基因(图2)。各地区DsMV检出率不同,平均检出率为55.9%;其中烟台莱阳检出率最高,为92.3%;临沂兰山区检出率最低,为30.0%(表2)。

2.3 山东DsMV cp基因的序列分析
对5个地区的DsMV分离物(烟台:SD YT,临沂:SD LY,青岛:SD QD,日照:SD RZ,潍坊:SD WF)的cp基因进行克隆和序列分析。5个分离物的cp基因全长均为942 bp。序列相似性分析显示,5个分离物cp基因的核苷酸序列相似性为88.5%~91.9%,氨基酸序列相似性为93.4%~97.5%(表3),与国内外已报道代表性DSMV分离物cp基因的核苷酸序列相似性为74.8%~99.4%,氨基酸序列相似性为79.7%~99.1%。本试验所得分离物SD YT、SD LY、SD QD、SD RZ和SD WF与已报道的DsMV分离物cp基因的核苷酸序列相似性分别为75.3%~92.2%、76.4%~90.6%、76.3%~89.8%、76.0%~90.1%和74.8%~99.4%,氨基酸序列相似性分别为80.1%~96.5%、80.4%~98.4%、80.1%~96.5%、79.7%~96.5%和79.7%~99.1%。

表2 山东不同地区芋样品DsMV RT-PCR检测结果
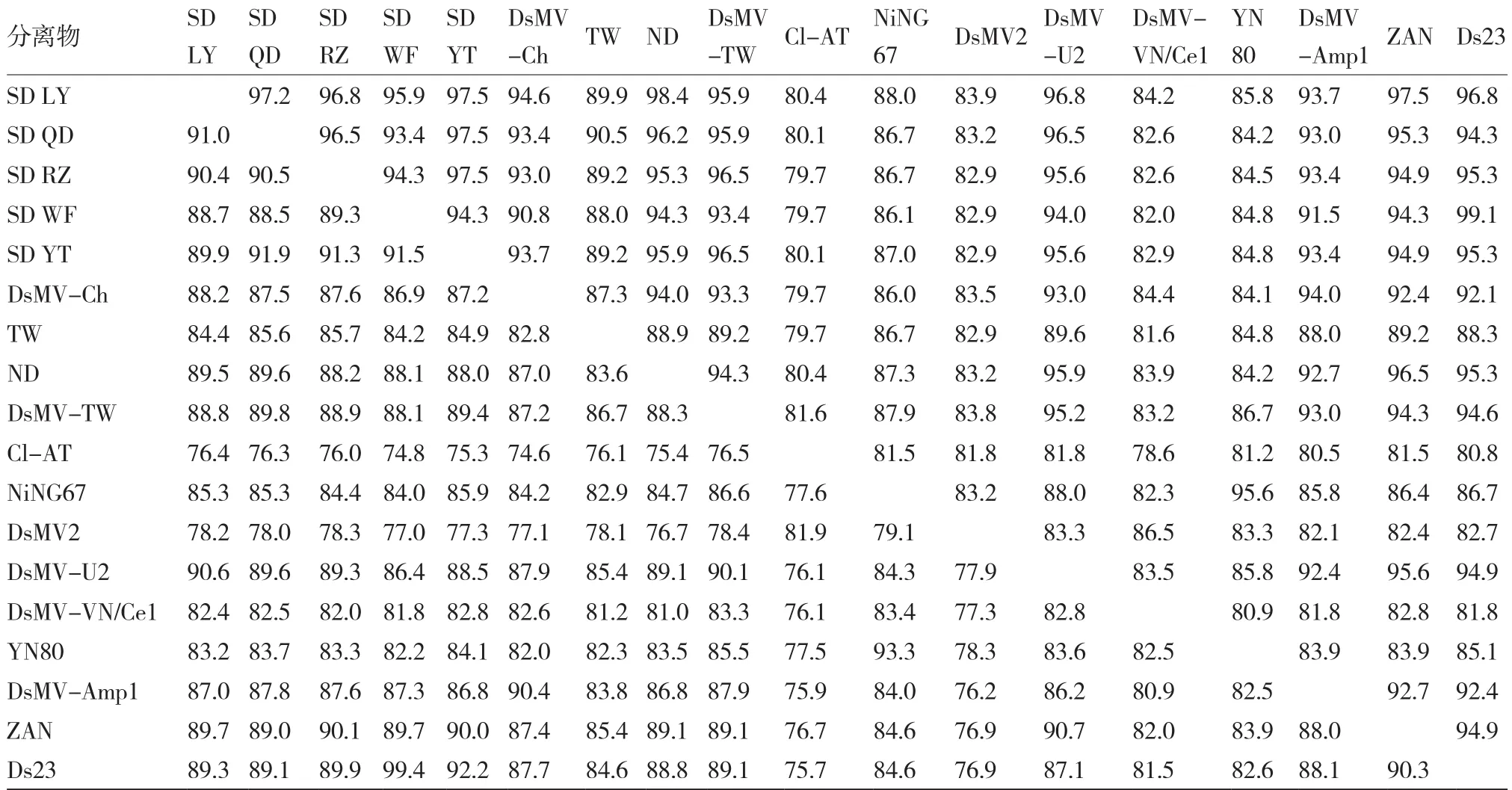
表3 DsMV 不同分离物 cp的核苷酸(左下)和氨基酸(右上)序列相似性比较
对山东DsMV分离物的系统进化关系进行分析,选取国内外有代表性的DsMV分离物的cp基因分别构建核苷酸序列和氨基酸序列系统进化树(图3、4)。从核苷酸序列系统进化树结果来看,DsMV分离物可分为2簇,其中山东分离物与日本分离物(Ds23)、中国分离物(ND和ZAN)和美国分离物(DsMV-U2)亲缘关系较近,聚集为较大的1簇,与库克群岛分离物(CI-AT)、新西兰分离物(DsMV2)和越南分离物(DsMV-VN/Ce1)等距离较远(图3)。氨基酸序列系统进化树结果显示,山东5个分离物中,SD QD、SD YT、SD RZ亲缘关系相近,与SDLY、SDWF亲缘关系相对较远(图4)。

图3 DsMV分离物cp基因核苷酸序列系统进化树

图4 DsMV分离物cp基因氨基酸序列系统进化树
3 结论与讨论
芋花叶病毒病在我国主要芋产区发生普遍,严重制约了我国芋产业的发展,造成了巨大的经济损失。本试验调查了山东省芋花叶病毒病的发生情况,并对该病毒进行了分子鉴定。当前国内报道的可侵染芋的病毒仅有DsMV、黄瓜花叶病毒(Cucumber mosaic virus,CMV)和芋杆状病毒(Taro bacilliform virus,TaBV)(陈集双和李德葆,1996;施世明 等,2013)。本试验对采集的161个芋样品进行病原检测,仅检出DsMV,未检测到其他病毒(结果未提供),由此表明山东省内芋病毒病的病原为DsMV。161个样品中DsMV检出率为55.9%,调查采样点5个地(市)皆能检测到DsMV,表明DsMV已在山东省内芋主栽区广泛侵染,且不同地区、不同地块田间发病率存在一定差异。所检出的DsMV阳性样品中症状表现多样,主要为叶片脉间黄化、叶片皱缩叶脉褪绿、羽状花叶、褪绿斑驳、叶片畸形上卷和叶片产生明亮褪绿黄斑等,与王彦芬等(2012)的报道一致。
研究表明,DsMV的不同分离物之间存在着高度的变异,且变异相对较大区域主要集中在DsMV的cp基因上。本试验对山东5个地区的DsMV分离物cp基因进行序列分析及遗传进化分析。结果表明,5个山东分离物cp基因的核苷酸序列相似性为88.5%~91.9%,氨基酸序列相似性为93.4%~97.5%;与国内外已报道的代表性DsMV分离物cp基因的核苷酸序列相似性为74.8%~99.4%,氨基酸序列相似性为79.7%~99.1%,表明DsMV的cp基因序列之间变异率较大,保守性相对较差,与Chen等(2001)的研究结果一致。通过比对发现,DsMV山东分离物与日本分离物(Ds23)、中国分离物(ND和ZAN)和美国分离物(DsMV-U2)同源性较高,且在系统进化树中属于同一分支,不同寄主种类或地理来源的分离物分别聚在不同的分支或亚分支中。

由于DsMV可以通过无性繁殖材料传播,由此可以推断,山东地区DsMV的发生可能是由于引种及种质资源的调运等造成的。此外,山东地区蚜虫发生严重,作为DsMV重要的传毒介体(Abo El-Nil et al.,1977),该病也有可能随蚜虫传入并传播蔓延。因此,阻断DsMV的传播途径、选用脱毒种苗和研发培育高抗品种等是防控芋病毒病的有效手段。由于DsMV分离物存在较高的分子变异,因此,应正确理清山东DsMV分离物的分子结构及基因变异情况,为该病害的流行分析及抗病育种工作奠定坚实的理论基础。由于其症状多样,容易混淆,及时高效准确的鉴定已成为DsMV研究的一大重点。
陈集双,李德葆.1996.我国13种天南星科作物上的芋花叶病毒.微生物学报,36(2):126-131.
杜红梅,黄丹枫.2002.芋艿品种退化的原因及其解决途径.中国蔬菜,(6):58-60.
范怀忠,孙芥菲.1984.广州芋花叶病及其病原病毒的初步研究简报.华南农学院学报,5(l):101-106.
刘文洪,陈集双,李永伟.2004.侵染天南星科植物病毒的分子鉴定及其生态学研究.应用生态学报,15(4):566-570.
沈镝,李颖,蒋小满,邹日.2011.山东芋头生产和加工现状与存在的主要问题.长江蔬菜,(16):11-13.
施世明,王彦芬,王国平,王利平,徐文兴,洪霓.2013.侵染我国芋的杆状DNA病毒分子鉴定及特异性检测.植物病理学报,43(6):590-595.
宋春凤,徐坤.2004.芋的研究进展.中国蔬菜,(3):58-61.
王彦芬,Kazmi S A,曲林宁,王国平,刘玉平,洪霓.2012.芋病毒病田间调查及毒氟磷对芋病毒病的防治效果.长江蔬菜,(16):108-110.
韦传宝,贾玉成,杜宇.2009.芋花叶病毒检测试剂盒的研制.安徽大学学报:自然科学版,33(4):85-89.
Abo El-Nil M M,Zettler F W,Hiebert E.1977.Purification,serology and some physical properties of Dasheen mosaic virus.Phytopathology,77(12):1445-1450.
Castro G R.2006.Studies on cocoyam(Xanthosoma spp.)in Nicaragua,with emphasis on Dasheen mosaic virus〔Doctoral thesis〕.Umeå:Swedish University of Agricultural Sciences.
Chagas C M,Colariccio A,Galleti S R,Kitajima E W.1993.Natural infection of Amorphophallus konjac with Dasheen mosaic virus in Brazil.Fitopatologia Brasileira,18(4):551-554.
Chen J,Chen J,Chen J,Adams M J.2001.Molecular characterisation of an isolate of Dasheen mosaic virus from Zantedeschia aethiopica in China and comparisons in the genus potyvirus.Archives of Virology,146(9):1821-1829.
Pandit M K,Nath P S,Mukhopadhyay S,Devonshire B J,Jones P.2001.First report of Dasheen mosaic virus in elephant foot yam in India.Plant Pathology,50(6):802.
Reyes G,Ramsell J N,Nyman M,Kvarnheden A.2009.Sequence characterization of Dasheen mosaic virus isolates from cocoyam in nicaragua.Archives of Virology,154(1):159-162.
Zettler F W,Foxe M J,Hartman R D,Edwardson J R,Christie R G.1970.Filamentous viruses infecting Dasheen and other Araceous plants.Journal Phytopathology,60(6):983-987.
Zettler F W,Tsai J H,Faan H C,Ke C,Lu K C.1987.Dasheen mosaic virus infecting taro in People’s Republic of China.Plant Disease,71(9):837-839.
Field Investigation and Identification of Dasheen mosaic virus on Taro in Shandong Province
GAO Li-li,JIANG Shan-shan,WU Bin,ZHANG Mei,WANG Sheng-ji,XIN Xiang-qi*
(Institute of Plant Protection,Shandong Academy of Agricultural Sciences,Jinan 250100,Shandong,China)
In order to identify the occurrence and genetic evolution of Dasheen mosaic virus(DsMV)in taro planting area of Shandong Province,this paper investigated major taro planting areas including Weifang,Qingdao,Yantai,Rizhao and Linyi and carried out identification on pathogen of virus disease,made sequence analysis and genetic evolution analysis on the collected samples. The results showed that DsMV was the main pathogen and its detection rate was 55.9%. It was distributed in the above mentioned 5 regions. The nucleotide sequence similarities of cp gene between 5 DsMV isolates were 88.5%-91.9%,and amino acid sequence similarities were 93.4%-97.5%. The nucleotide and amino acid sequences similarities of cp gene between isolates from at home and abroad were 74.8%-99.4%,79.7%-99.1%,respectively. The analysis of phylogenetic relationships showed that DsMV Shandong isolates shared closer relation with that from Japan(Ds23),China(ND and ZAN)and America(DsMV-U2). In conclusion,DsMV has occurred widely on taro in Shandong Province and has relatively large variation between cp qene sequences.
Dasheen mosaic virus;Coat protein gene;Sequence analysis
高利利,女,硕士研究生,专业方向:植物保护,E-mail:1196855876@ qq.com
*通讯作者(Corresponding author):辛相启,男,副研究员,专业方向:植物病理,E-mail:xinxiangqi@126.com
2016-12-21;接受日期:2017-05-15
国家公益性行业(农业)科研专项(201303028),山东省农业科学院农业科技创新工程项目(CXGC2016A09),山东省重点研发计划项目(2016GNC111003)

