PEG模拟干旱胁迫下硅对紫花苜蓿萌发及生理 特性的影响
吴 淼, 刘信宝, 丁立人, 李志华*
(1. 南京农业大学草业学院, 江苏 南京 210095; 2. 南京农业大学动物科技学院, 江苏 南京 210095)
紫花苜蓿(Medicagosativa)作为牧草之王,其生产实践运用最广,种植面积最大,营养丰富,种植历史悠久。苜蓿大多种植在我国干旱和半干旱地区,干旱环境很大程度影响紫花苜蓿生长和生产,而且由于我国水资源分布不均且短缺,干旱和半干旱面积占我国面积一半以上,水分条件成为紫花苜蓿栽培重要限制因素。种子萌发和幼苗生长是植物生长的关键阶段,水分对于种子萌发和苗期生长尤为重要,并且萌发期间种子耐旱性在一定程度反映植物抗旱性[1]。硅是植物生长必不可少的元素,虽然土壤中硅含量丰富,但其中能被植物有效吸收的硅含量很低。研究表明外源性硅能够提高植物渗透调节能力和有助于启动抗氧化机制[2],并且能通过表皮组织里形成角质—硅质双层结构,抑制蒸腾和沉积在细胞壁和角质间,降低水分散失,达到提高植物抗旱性的目的[3-5]。目前国内外对硅的研究多集中于水稻(Oryza.sativaL)、小麦(Triticumaestivum)、瓜果蔬菜等[6],而对豆科植物影响的研究仅限于作物大豆[7]和木本植物豇豆[8]。
聚乙二醇-6000(polyethylene glycol,PEG-6000)溶于水后有很大的渗透压,常被用作渗透调节剂来模拟干旱,用其研究紫花苜蓿抗旱性,操作方便、重复性好。目前,有关硅对紫花苜蓿抗旱性研究报道甚少[9],尚缺乏系统研究。本研究利用聚乙二醇6000进行干旱模拟,探讨不同浓度的硅肥对干旱胁迫条件下紫花苜蓿种子萌发及生理特性的影响,筛选出适宜的硅肥用量,初步探讨硅肥调控紫花苜蓿抗旱性的机理,为硅肥调控紫花苜蓿抗旱性的深入研究奠定基础,亦为硅肥应用于干旱地区紫花苜蓿生产提供理论参考。
1 材料与方法
1.1 试验材料与试验设计
1.1.1试验材料 供试草种为紫花苜蓿的赛迪品种(MedicagosatiavaL.‘Sadie7’),种子由百绿集团提供。硅酸钾与聚乙二醇购于南京寿德试验器材有限公司,硅酸钾试剂为化学纯。
1.1.2试验设计 试验于2016年4月11日开始于南京农业大学草业学院实验室进行。采用培养皿砂培的方法。设0%,5%,10%,15%共4个聚乙二醇(PEG)处理浓度模拟干旱条件,其分别对应的溶液水势依次为0.00 MPa,-0.10 MPa,-0.20 MPa,-0.40 MPa。硅肥采用化学纯水合硅酸钾(K2SiO3·nH2O),分别设置0,1.0,2.0,2.5 mmol·L-1的4个浓度处理,依次用Si 0.0,Si 1.0,Si 2.0,Si 2.5表示,用含有相同浓度的KC1溶液来平衡K2SiO3溶液中的K+,消除其影响。每个处理4次重复,共64个处理。选用φ90 mm的培养皿,用蒸馏水清洗石英砂作为基质,以一定浓度的K2SiO3或KCl混合溶液湿润至饱和。选取籽粒饱满,大小均匀的紫花苜蓿种子于5%次氯酸钠溶液中浸种消毒15 min[10],用蒸馏水冲洗干净,用滤纸吸干多余水分,每皿播100粒种子。置于25℃恒温,12 h光照,12 h暗培养,相对湿度为70%的人工气候箱(RXZ智能型)内培养。釆用称重法每日补充蒸散的水分以维持溶液渗透势的恒定,将培养皿每日按一定的空间顺序上下交换位置。
1.2 测定指标及方法
1.2.1生长指标的测定 从种子置床次日起开始观察,当胚芽长度为种子一半时,认为已经发芽。
发芽势(%)=第4天统计发芽种子数/供试种子数×100
发芽率(%)=第10天统计全部发芽种子数/供试种子数×100
胚根长:每个培养皿中随机选取发芽幼苗各10株进行胚根长测定。
1.2.2生理指标的测定 酶液的提取:参照Xue等[11]的方法,研磨幼苗后提取酶液并置于4℃冰箱保存。用于过氧化物酶(peroxidase, POD)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)活性、丙二醛(malondialdehyde, MDA)含量和可溶性蛋白含量的测定。
POD、SOD、CAT活性均参照李合生[12]的方法:POD活性采用愈创木酚法测定,SOD活性采用氮蓝四唑(NBT)法测定,CAT活性采用过氧化氢分解测定,MDA含量采用硫代巴比妥酸显色法测定。
1.3 数据分析
所有数据均应用SPSS 18.0统计分析各项指标进行差异显著性分析,用Excel统计并制图。
2 结果与分析
2.1 PEG干旱胁迫下硅对紫花苜蓿发芽及生长的影响
2.1.1发芽势 不同干旱胁迫下不同浓度硅肥对发芽势的影响不同(表1)。同一PEG浓度干旱胁迫下,发芽势随硅浓度增加呈先升高后降低的趋势。在PEG浓度为0%的非干旱胁迫条件下,Si 1.0和Si 2.0处理的紫花苜蓿发芽势明显高于未施硅肥的对照Si 0.0,且Si 2.0处理明显高于Si 0.0和其他2个硅处理(P<0.05);PEG浓度分别在5%和10%处理下,Si 2.5的发芽势均显著低于对照Si 0.0。当PEG为15%浓度时,Si 1.0及Si 2.0发芽势显著高于对照Si 0.0(P<0.05)。同一硅肥水平下,发芽势随PEG浓度变化而变化。在未施硅肥Si 0.0水平下,10%PEG显著高于0%,5%和15%PEG处理,且3个处理之间差异不显著;在Si 1.0处理,5%和10%PEG浓度下,紫花苜蓿发芽势均显著高于0%PEG和15%PEG处理(P<0.05)。在Si 2.5水平,3个PEG处理与对照差异不显著;Si 2.5水平,在各PEG胁迫处理发芽势显著高于对照(P<0.05)。可见,在干旱胁迫下,适宜浓度的硅肥可提高紫花苜蓿的发芽势。

表1 不同PEG胁迫下硅酸钾对萌发的影响Table 1 Effects of sicicon on germination under different PEG stress
注:同行不同小写字母表示同一硅酸钾浓度下不同PEG浓度处理间差异显著(P<0.05);同列不同大写字母表示同一PEG浓度下不同硅酸钾浓度处理间差异显著(P<0.05)
Note: Different lowercase letters in the same row indicate sigificant difference within the same potassium silicate concentration under different PEG concentration treatment , different capital letters in the same column indicate significantly different within the same PEG concentration of different potassium silicate concentration treatment at the 0.05 level
2.1.2发芽率 不同干旱胁迫下不同浓度硅肥对发芽率的影响存在差异(表1)。同一PEG浓度干旱胁迫下,分别在0%,5%和10% PEG下,Si 2.5发芽率均显著低于对照Si 0.0和其他2个硅处理(P<0.05),且Si 1.0,Si 2.0和对照Si 0.0之间差异不显著。PEG为15%浓度时,各硅处理间以及与对照Si 0.0间差异均不显著。同一硅浓度水平下,在未施硅肥Si 0.0水平下,10%PEG处理显著高于0%和15%PEG处理(P<0.05),而与5%PEG处理间差异不显著;在Si 1.0水平下,10%PEG处理明显高于0%,5%和15%PEG处理(P<0.05),且3个PEG处理之间差异不显著。在Si 2.0水平下,3个PEG处理均与对照0%PEG差异不显著,10%PEG明显高于5%PEG处理(P<0.05);在Si 2.5水平下,3个PEG处理间存在显著差异,均使紫花苜蓿的发芽率明显高于对照(P<0.05)。说明在干旱胁迫下,适宜浓度的硅肥处理促进了紫花苜蓿的发芽。
2.1.3胚根长 不同干旱胁迫下不同浓度硅肥对紫花苜蓿胚根生长产生明显的影响(表1)。同一PEG浓度下,分别在0%PEG和10%PEG下,3种硅肥处理与对照Si 0.0差异不显著,对紫花苜蓿胚根生长影响不大;在5%PEG水平下,Si 1.0处理明显低于对照Si 0.0和Si 2.5处理(P<0.05),与Si 2.0差异不显著;在15%PEG水平下,Si 1.0与对照Si 0.0差异不显著,明显高于Si 2.0和Si 2.5处理(P<0.05),后两者之间差异不显著。同一硅肥水平下,随PEG浓度提高,胚根呈增长的趋势。Si 0.0水平下,3个PEG处理存在显著差异,且明显高于0%PEG处理(P<0.05);分别在Si 1.0和Si 2.0水平,10%和15%PEG处理与5%PEG处理差异显著,均明显高于0%和5%PEG处理(P<0.05)。在Si 2.5水平下,3个PEG处理明显高于0%PEG处理(P<0.05),对紫花苜蓿胚根伸长生长具有促进作用。
2.2 PEG干旱胁迫下硅对紫花苜蓿生理特性的影响
2.2.1POD活性 不同干旱胁迫下不同浓度硅肥对POD活性的影响不同(图1)。同一PEG浓度下,不同硅肥处理紫花苜蓿POD活性不同。5%PEG浓度下,POD活性在各硅酸钾处理均显著高于对照Si 0.0(P<0.05);10%PEG浓度下,Si 1.0及Si 2.0处理均显著高于对照Si 0.0(P<0.05);15%PEG浓度下,Si 2.0和Si 2.5处理差异不显著,使紫花苜蓿POD活性明显高于对照Si 0.0和Si 1.0。由此可见,同一适宜的硅肥浓度和水分条件处理,通过提高紫花苜蓿POD活性,在一定的浓度范围内,硅酸钾促进了幼苗POD含量。同一硅肥水平,POD含量随PEG浓度升高而显著提高。Si 0.0水平下,3个PEG处理存在显著差异,且明显高于0%PEG处理(P<0.05);在Si 1.0水平,10%和15%PEG处理差异不显著,均明显高于5%PEG处理和0%PEG处理(P<0.05);分别在Si 2.0和Si2.5水平,3个PEG处理间及与对照0%PEG紫花苜蓿POD活性均存在显著差异(P<0.05)。

图1 不同PEG干旱胁迫下硅肥对POD活性的影响Fig.1 Effect of potassium silicate on POD under different PEG stress注:不同小写字母表示同一硅酸钾浓度下不同PEG浓度处理间差异显著(P<0.05); 不同大写字母表示同一PEG浓度下不同硅酸钾浓度处理间差异显著(P<0.05),下同Note: Different lowercase letters indicate significant difference within the same potassium silicate concentration under different PEG concentration treatment at the 0.05 level, different capital letters indicate significant different within the same PEG concentration of different potassium silicate concentration treatment at the 0.05 level, the same as below
2.2.2SOD活性 不同干旱胁迫下不同浓度硅肥对SOD活性的影响不同(图2)同一PEG浓度下,紫花苜蓿SOD活性随硅肥浓度升高而呈先升高后下降的趋势。各PEG胁迫下,Si 1.0,Si 2.0和Si 2.5的SOD活性都显著高于对照Si 0.0(P<0.05)。分别在10%和15%PEG胁迫下,Si 2.0处理显著高于Si 0.0和Si 1.0,但与Si 2.5差异不显著。说明硅肥对紫花苜蓿SOD活性有积极影响。比较同一硅肥水平,不同PEG胁迫下SOD活性的变化。在Si 0.0水平下,10%PEG处理显著高于对照,而15%PEG处理显著低于对照(P<0.05)。在Si 1.0水平下,10%PEG处理显著高于对照及其他PEG胁迫。在Si 2.0水平下,5%和10%PEG处理显著高于对照(P<0.05),且两个处理间差异不显著。在Si 2.5水平下,10%PEG处理显著高于对照,且与其他胁迫处理差异不显著。

图2 不同PEG干旱胁迫下硅肥对SOD活性的影响Fig.2 Effect of potassium silicate on SOD aceivity under different PEG stress
2.2.3CAT活性 不同干旱胁迫下不同浓度硅肥对CAT活性的影响不同(图3),同一PEG浓度下,整体紫花苜蓿CAT活性随硅肥增加而有所增加。在0%PEG浓度下,Si 1.0,Si 2.0和Si 2.5处理都显著高于对照Si 0.0,且各处理间差异显著(P<0.05)。分别在5%,10%和15%胁迫下,Si 2.0及Si 2.5处理CAT活性均显著高于对照(P<0.05),而与Si 1.0差异不显著。硅肥可以提高紫花苜蓿植物体内CAT活性。比较同一硅肥下,不同干旱胁迫对紫花苜蓿CAT活性影响。在Si 0.0水平下,各处理胁迫都显著高于对照(P<0.05)。在Si 1.0和Si 2.0水平下,5%PEG胁迫下CAT活性显著高于对照(P<0.05),而与其他胁迫差异不显著。在Si 2.5水平下,15%PEG处理显著高于对照而与其他胁迫处理差异不显著。说明硅肥对紫花苜蓿干旱条件下CAT活性有正面促进作用。
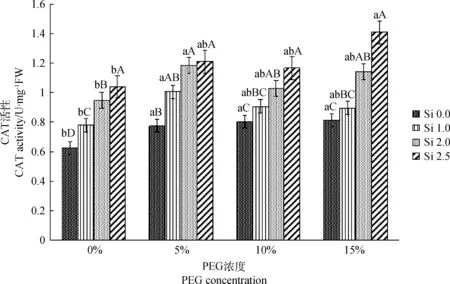
图3 不同PEG干旱胁迫下硅肥对CAT活性的影响Fig.3 Effect of potassium silicate on CAT activity under different PEG stress
2.2.4MDA含量 不同干旱胁迫下不同浓度的硅肥对紫花苜蓿MDA含量的影响不同(图4)。同一PEG浓度条件下,MDA含量随硅肥浓度变化而变化。0%PEG浓度下,3种硅肥处理下紫花苜蓿MDA含量均明显低于对照Si 0.0,3个硅肥处理间差异显著(P<0.05);5%PEG浓度下,Si 1.0处理显著低于对照Si 0.0,Si 2.0处理MDA含量显著高于对照Si 0.0(P<0.05),Si 2.5处理与对照Si 0.0差异不显著;10%PEG浓度下,Si 1.0和Si 2.5处理MDA含量显著低于对照Si 0.0,Si 2.0处理与对照Si 0.0差异不显著;15%PEG浓度下,Si 2.0和Si 2.5显著低于对照Si 0.0和Si 1.0处理(P<0.05),Si 1.0处理与对照Si 0.0差异不显著。在同一硅肥水平下,MDA含量随干旱胁迫的增加有升高趋势。Si 0.0水平,15%PEG处理紫花苜蓿MDA含量最高,明显高于对照0%PEG,5%PEG和10%PEG处理(P<0.05);在Si 1.0水平,10%PEG和15%PEG处理MDA显著高于对照0%PEG和5%PEG处理(P<0.05),5%PEG处理与对照0%PEG差异不显著;分别在Si 2.0和Si 2.5水平,3个PEG处理使紫花苜蓿的MDA含量显著高于对照0%PEG(P<0.05)。可见,干旱胁迫对紫花苜蓿幼苗的MDA含量产生了影响。

图4 不同PEG干旱胁迫下硅肥对MDA含量的影响Fig.4 Effect of potassium silicate on MDA content under different PEG stress
3 讨论
3.1 不同干旱胁迫下硅肥对紫花苜蓿萌发的影响
种子萌发是植物对干旱胁迫的最初反应,也是对水分要求最敏感的时期,水分胁迫一定程度扰乱种子萌发代谢。但也有研究表明[13],一定干旱程度会刺激植物产生反馈效应,从而提高植物发芽率。本研究发现10%PEG胁迫反而促使种子发芽势和发芽率提高。但当胁迫强度增加时,种子胚根长减少,植物发芽率降低,产量降低。刘慧霞等[9]采用水培法,研究了硅对紫花苜蓿种子萌发和幼苗生长发育的影响,表明硅直接参与种子萌发和幼苗生长,表明硅对紫花苜蓿生长生理的影响是客观存在的。本试验结果表明,10%PEG胁迫下,施用1.00 mmol·L-1硅酸钾,种子发芽势和发芽率最高。余群[14]研究硅肥对早熟禾(PoapratensisL.)萌发的影响发现,硅肥能显著提高早熟禾发芽率、发芽势,尤其以1.5 mmol·L-1效果最好。已有研究表明15%PEG溶液处理能使紫花苜蓿萌发降至最低[15],但本试验中紫花苜蓿种子发芽势和发芽率并没有因为干旱胁迫的加强而降低,说明添加适量硅酸钾在种子萌发过程中起到了一定的作用,从而维护和保持了紫花苜蓿种子的萌发。但在2.50 mmol·L-1硅酸钾处理时,显著降低了种子发芽势和发芽率,说明过高浓度硅酸钾会抑制其发芽。合理控制硅酸钾浓度,可以提高紫花苜蓿种子逆境下萌发能力,一定程度解决干旱地区紫花苜蓿栽培障碍,并起到节水作用。
3.2 不同程度PEG干旱胁迫下硅对紫花苜蓿生理的影响
在正常生长环境下,植物体内活性氧的产生和清除保持动态平衡,但当植物遭受渗透胁迫时,细胞中活性氧的积累可以造成细胞伤害甚至死亡,而POD、SOD和CAT等保护酶能清除活性氧,使细胞免于伤害或抗性增强[16]。周秀杰[17]研究表明,硅提高了黄瓜(CucumissativusL.)幼苗POD、SOD和CAT的活性,增强了活性氧清除能力和抗膜质过氧化能力,这是硅提高黄瓜幼苗抗旱性的重要生理学基础之一。本研究中,施用硅肥后,SOD活性均显著高于对照。SOD能使O2ˉ发生歧化转化成H2O2,再由CAT和POD分解进行后续工作[18],从而防止膜质过氧化作用而破坏。丁燕芳[19]在硅提高小麦抗旱性的机理研究中也得到同样结论。因此,外源硅可以提高紫花苜蓿在PEG胁迫下的SOD活性。
曹逼力等[20]证实硅能在干旱胁迫下提高番茄植株根系POD活性,提高活性氧清除酶活性,减轻膜脂过氧化程度,对幼苗抗旱性有积极的促进作用。这与本试验结果一致,本试验中,当施用2.00 mmol·L-1硅酸钾后,幼苗POD活性在渗透胁迫下增加幅度提高,减轻了幼苗在渗透胁迫下因活性氧积累过多而造成的损伤。
本研究中,紫花苜蓿幼苗CAT活性随硅肥浓度增加而呈现增加趋势。分别在5%、10%和15%PEG胁迫下,2.50 mmol·L-1硅肥处理使CAT活性显著高于对照未施硅肥。这与明东风[21]在水分胁迫下硅对水稻生理影响的研究结果一致,同时指出外源硅可以改善膜结构,使其在干旱胁迫下,降低活性氧产生。说明适宜的硅肥可以提高紫花苜蓿的CAT活性,从而维持一定的抗旱性。
MDA是植物在逆境下产生的一种膜脂过氧化产物,积累过高会不同程度破坏植物细胞膜和酶,丙二酸含量越低,抗旱能力越强[16]。本研究得到,在15%PEG浓度下,2.00 mmol·L-1和2.50 mmol·L-1硅处理显著降低了幼苗MDA含量。这与刘慧霞[22]研究结果一致,即在一定干旱胁迫下,外源性硅能降低紫花苜蓿MDA含量。5%和10%PEG模拟干旱胁迫下,硅处理后其MDA含量相比对照减少不显著。说明需达到一定程度干旱胁迫,硅对紫花苜蓿抗旱性作用才会加强,这与余群[14]研究结果一致,即干旱胁迫下硅肥对草地早熟禾苗期生长发育的影响中,MDA含量随着干旱胁迫的加剧与对照间差异越发显著一致。同时也符合硅对生长在干旱逆境中的紫花苜蓿的影响作用要比生长在湿润条件下的作用大[22]。不同程度干旱胁迫下,过高或过低硅酸钾含量都会影响其MDA含量。
4 结论
在干旱胁迫下,施硅肥可以一定程度提高紫花苜蓿抗旱性,控制硅酸钾浓度在1.00~2.00 mmol·L-1可以有效提高紫花苜蓿抗旱性。施用2.00 mmol·L-1硅酸钾可以提高紫花苜蓿幼苗POD、SOD活性,施用2.50 mmol·L-1硅酸钾可以提高CAT活性。在15%PEG浓度下,2.00 mmol·L-1和2.50 mmol·L-1硅处理显著降低了幼苗MDA含量,减少细胞膜膜脂氧化程度,维持细胞膜稳定性。硅肥使紫花苜蓿种子在干旱胁迫下维持一定发芽率、发芽势和胚根长,并且维护细胞膜稳定性和抗氧化酶活性,使其在逆环境下还能保持萌发,这对农业生产有积极的意义。

