住院患者药源性肝损伤的信息化自动监测研究与实践Δ
郭代红,苏 畅,王啸宇,朱 曼,田晓燕,胡鹏洲,贾王平,赵粟裕,寇 炜
(1.解放军总医院药学部,北京 100853;2.重庆医科大学药学院,重庆 401331)
住院患者药源性肝损伤的信息化自动监测研究与实践Δ
郭代红1*,苏 畅2,王啸宇1,朱 曼1,田晓燕2,胡鹏洲2,贾王平1,赵粟裕1,寇 炜1
(1.解放军总医院药学部,北京 100853;2.重庆医科大学药学院,重庆 401331)
目的:探讨围绕医院信息系统中的住院患者数据信息,开展重点品种的药源性肝损伤自动监测的实践及效果。方法:利用解放军总医院(以下简称“我院”)自行研发的自动监测系统中基于触发器原理的药源性肝损伤模块,针对多个重点监测品种分别进行大样本量用药人群的自动监测,并对其报警病例进行人工甄别,获得药源性肝损伤准确发生率。结果:近年来,我院先后利用系统开展药源性肝损伤主动监测的用药总例次数为1 215~11 665例次,纳入监测的样本量为233~10 605例次;目标药物分别有阿托伐他汀钙、头孢哌酮舒巴坦钠、左氧氟沙星、莫西沙星、紫杉醇(白蛋白)、桂哌齐特,其致药源性肝损伤的发生率分别为7.30%(17/233)、6.26%(38/607)、1.93%(34/1 763)、4.7%(84/1 788)、14.53%(192/1 321)、7.11%(15/211)、0.87%(92/10 605)。结论:自动监测专用软件可高效快捷地获取重点监测品种在真实世界的药品不良反应准确发生率,其病例纳入率与阳性预测率呈负相关,可根据研究需要适当权衡;也可用于实时监测,追踪并预警临床用药风险。
药品不良反应; 医疗信息系统; 药源性肝损伤; 自动监测
近年来,开展大样本量上市后药物安全性再评价的真实世界研究(real world study,RWS)日益受到重视,美国食品药品监督管理局也认可将“真实世界证据”用于药品的审评与审批。药源性肝损伤(drug induced liver injury,DILI)是常见且易致严重后果的药品不良反应/事件(adverse drug reaction/event,ADR/ADE),也是很多药物被撤市的原因。解放军总医院(以下简称“我院”)借助自行研发的“医疗机构ADE主动监测与智能评估警示系统”(以下简称“系统”)[1],先后针对多个重点监测品种分别开展了数千至上万用药人群样本量的、真实世界DILI发生情况的主动监测研究,同时将系统在多个军队哨点医院进行推广,获得了多种重点监测药物的DILI风险准确数据,形成了高效快捷的信息化药物安全性评价新模式[2]。
1 资料与方法
1.1 资料来源
资料主要来源于我院使用目标药物的住院患者的相关信息;部分来源于军队哨点医院。
1.2 方法
采用RWS方法,按照预试验确定实验条件配置,利用系统,回顾性自动监测选定时间段内监测医院所有使用目标药物的住院患者。系统筛查出的报警病例分别由2名研究人员参照国家ADR监测中心分类评价方法逐一盲评,并给出正确的关联性评价结果。“可能”及以上病例记为阳性病例。同一患者不同住院次数出现相同目标ADR算作1个阳性例次,出现不同ADR则分别计算。ADR发生率=(阳性例次数/纳入监测例次数)×100%。患者一次住院期间用药间隔>72 h计为2个用药例次。应用Excel 2010、SPSS 17.0软件进行数据汇总及统计学分析。
1.3 DILI判定标准
参照国家ADR监测中心《ADR术语使用指南》,DILI判定标准为:(1)用药后,连续2次检测,丙氨酸氨基转移酶(ALT)>40 U/L,或(和)总胆红素(TBIL)>21 μmol/L;(1)用药后,单次检测ALT>80 U/L或TBIL>42 μmol/L。
1.4 病例排除条件
实施自动监测的前期工作,是通过以病区、诊断、合用药物、基值异常、指标缺失和临时医嘱等条件筛选程序,将混杂因素较多、临床难以鉴别的病例预先进行排除条件设定,见表1。其他纳入病例由系统根据报警条件进行判定,符合判定标准的标记为报警病例供人工关联性评价。通常会影响ADR关联性评价的考虑因素有临时用药医嘱、相关指标无用药前检验值或用药前基值异常、因原患疾病或合用药品等,其可导致相关分析指标异常。

表1 系统的病例排除条件设置Tab 1 Settlement of condition of systematical excluded cases
2 结果
我院先后利用系统开展DILI主动监测的目标药物分别有阿托伐他汀、头孢哌酮舒巴坦、左氧氟沙星、莫西沙星、紫杉醇(白蛋白)、伏立康唑、桂哌齐特,监测用药例次数1 215~11 665例次,纳入监测样本量233~10 605例次[3-11]。我院各个目标药物致DILI的系统主动监测及评价结果见表2。不同药物不同医院DILI自动监测数据及结果见表3。
3 讨论
DILI发病机制复杂,往往是多种机制先后或共同作用的结果,迄今尚未被充分阐明。不同药物导致DILI的机制各有差异,适应性免疫攻击是DILI的最后共同事件。以自发报告收集为主的ADR被动监测模式,因其用药人群分母缺失无法获知ADR的准确发生率。而由于上市前研究存在的局限性,开展上市后药物安全性再评价的大样本量RWS以获取药品风险准确发生率已日趋受到重视。表2是我院多年研究所获得的各个监测品种的DILI量化发生率,有助于医护人员掌握相关药品的肝损伤发生风险、加强警戒意识。其与药品说明书所列发生率比较可见,系统监测结果与药品说明书所载为“常见”及以上(>10%)者较为一致,而“偶见”(0.1%~1%)则存在较大波动,应是上市前研究病例数有限所致,也验证了开展上市后大样本用药人群的真实世界安全性再评价的必要性。
系统排除条件选项与设置对获取精确可信的研究结果极有必要。通常需要考虑到原患疾病、合用药品等混杂因素的影响、病历中相关指标的质量影响,以及1次临时用药与发生相关ADR可能性的临时医嘱病例评价意义。排除条件严苛会导致部分阳性预警病例漏报,放宽又会使阳性报警率降低、人工甄别量增加。表1—2显示,随着DILI自动监测的排除条件放宽,系统阳性报警率也由65.38%降至25.12%,但病例纳入率明显升高,由19.18%升至90.91%,结果更具代表性。经多年实践优化,我院对于监测条件选择的经验已经日趋成熟,能够结合研究目的和要求进行个性化取舍;具体到每一目标药物,还需结合临床具体用药情况反复摸索细化,确定最佳的系统设置条件。
本研究所用自动监测系统能够分别与医院信息系统(hospital information system,HIS)的在用数据库、历史数据库对接,提升了系统的实用范围。所获取ADR数据可靠、发生率精准,较传统人工回顾性研究极大地缩短了研究周期、降低了研究成本。形成了信号挖掘确定重点品种、本院HIS实施信号验证、军队哨点医院多中心集中监测的工作模式。表3为开展军队哨点医院多中心集中监测的尝试结果,不同医院之间、不同样本量之间虽然可能因用药习惯和用药人群特点而存在差别,且早期监测中有个别药物的纳入病例少,参考价值较小,但大多数药物在不同医院监测的DILI发生率较为一致,波动不大。
由于传统队列研究模式的大样本量医疗数据分析,较多依赖人工、消耗成本高、数据质量不一、处理周期长,导致深化研究受限。目前国内医疗机构普遍实现的电子病历信息数据库,使利用计算机技术开展自动监测、实现智能风险评估成为可能。我院自行研发的“医疗机构ADE主动监测与智能评估警示系统”,能够围绕医院HIS中信息开展低成本、高速度的大样本量用药人群主动监测。而我院可用的HIS信息资源长达十余年的积累,病例基数大、资料详实,所获的真实世界DILI准确发生率可以提供临床用药风险的预警预测。涉及DILI监测的实践已经由早期的1年数据增至多年数据,单品种用药人群纳入样本由233例升至10 605例,且可以更多。
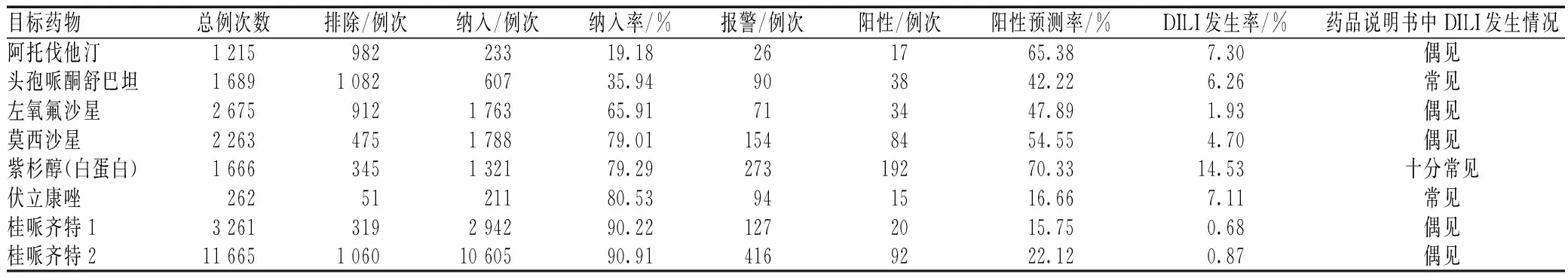
表2 我院各个目标药物致DILI发生情况的系统主动监测及评价结果Tab 2 Monitoring and evaluation results of incidence of DILI induced by various target drugs
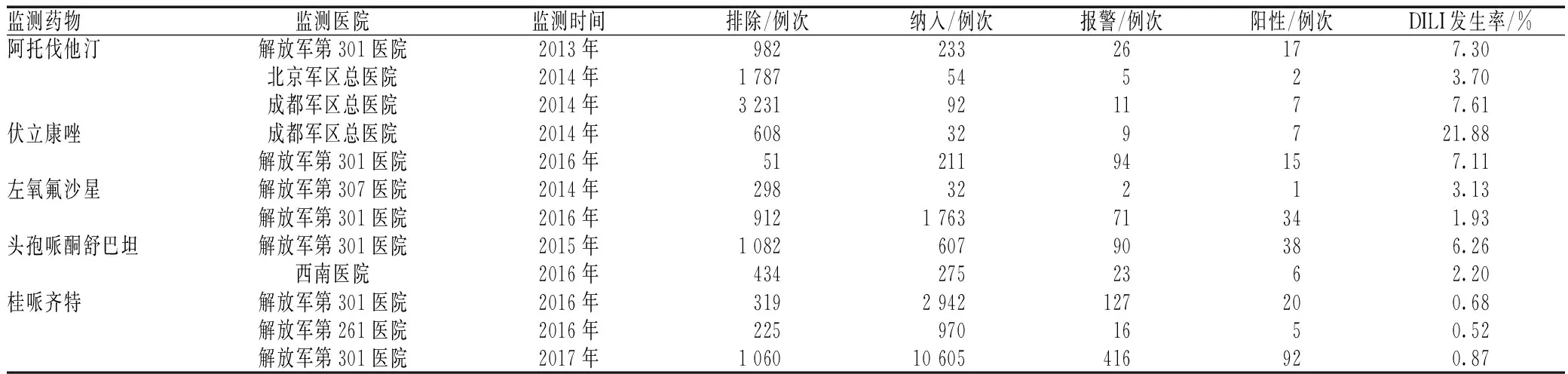
表3 不同药物不同医院DILI自动监测数据及结果Tab 3 Monitoring data and results of DILI induced by various drugs from different hospitals
[1]陈超,郭代红,薛万国,等.住院患者药品不良事件主动监测与评估警示系统的研发[J].中国药物警戒,2013,10(7):411-414,418.
[2]王啸宇,郭代红,陈超,等.基于电子医疗挡案的ADR自动监测规范化操作流程[J].中国药物应用与监测,2016,13(5):302-305.
[3]裴斐,陈超,郭代红.阿托伐他汀致转氨酶异常升高的主动监测研究[J].中国药物应用与监测,2014,11(1):31-33.
[4]郭代红,陈超,马亮,等.5所医院住院患者ADE警示系统主动监测数据分析与评价[J].中国药物应用与监测,2014,11(6):368-371.
[5]赵粟裕,郭代红,徐元杰.等.头孢哌酮/舒巴坦致血小板减少的主动监测系统应用与评价[J].药物流行病学杂志,2016,25(1):17-20.
[6]贾王平,郭代红,朱曼,等.莫西沙星相关性肝损害及血细胞减少的自动监测研究[J].中国药物应用与监测,2016,13(5):306-309.
[7]郭代红,胡鹏洲,马亮,等.马来酸桂哌齐特关联性肝肾损害的自动监测研究[J].药物流行病学杂志,2017,26(1):33-36.
[8]贾王平,郭代红,朱曼,等.左氧氟沙星相关性肝损害及血细胞减少的自动监测研究[J].药物流行病学杂志,2017,26(1):37-39,45.
[9]寇伟,郭代红,王伟兰,等.白蛋白结合型紫杉醇相关药品不良反应的自动监测研究[J].药物流行病学杂志,2017,26(2):111-114.
[10]朱曼,郭茂文,郭代红,等.三唑类抗真菌药物的药源性肝损伤自动监测研究[J].中国药物应用与监测,2017,14(1):45-47.
[11]胡鹏洲,王啸宇,郭代红,等.11 665例次马来酸桂哌齐特用药人群肝肾损害自动监测研究[J].中国药物应用与监测,2017,14(2):99-101.
Research and Practice of Informationalized Automatic Monitoring on Inpatients with Drug-induced Liver InjuryΔ
GUO Daihong1,SU Chang2,WANG Xiaoyu1,ZHU Man1,TIAN Xiaoyan2,HU Pengzhou2,JIA Wangping1,ZHAO Suyu1,KOU Wei1
(1.Dept.of Pharmacy,PLA General Hospital,Beijing 100853,China; 2.Pharmacy College,Chongqing Medical University,Chongqing 401331,China)
OBJECTIVE: To probe into the practice and effects of informationalized automatic monitoring on liver injury inpatients induced by key drugs based on the data in hospital information system. METHODS: With the utilization ofdrug-induced liver injury module based on the trigger principle of the self-made automatic monitoring system,automatic monitoring on key drugs was conducted on a larger samples,and the suspected cases submitted by the system were manually reviewed,the acurate incidence of drug-induced liver injury were obtained. RESULTS: In recently years,the total cases of inpatients with drug-induced liver injury monitored by informationalized automatic monitoring system were 1 215-11 665 cases. The target drugs were respectively atorvastatin calcium,cefoperazone sulbactam sodium,levofloxacin,moxifloxacin,taxol(albumin) and cinepazide; the incidence of drug-induced liver injury were respectively 7.30%(17/233),6.26%(38/607),1.93%(34/1 763),4.7%(84/1 788),14.53%(192/1 321),7.11%(15/211) and 0.87%(92/10 605). CONCLUSIONS: Automatic monitoring software can effectively and rapidly obtain the accurate incidence of adverse drug reactions of key drugs in reality,the included rate negatively correlated with the positive predictive rate; in addition,it can be appropriately adjusted according to research needs and can be used for real-time monitoring and help to predict the risk of clinical medication.KEYWORDS Adverse drug reactions; Hospital information system; Drug induced liver injury; Automatic monitoring
2014年全军后勤科研重点项目(No.BWS14R039)
R97
A
1672-2124(2017)08-1019-03
DOI 10.14009/j.issn.1672-2124.2017.08.005
2017-04-10)
*主任药师,硕士生导师。研究方向:临床药学及药物警戒。E-mail:guodh301@163.com

