慢病毒介导SIRT1基因表达降低的ATDC5细胞模型建立*
于斐 曾晖翁鉴 林健静 解笑宸 孙军营 肖德明
(北京大学深圳医院骨科,广东深圳518036)
慢病毒介导SIRT1基因表达降低的ATDC5细胞模型建立*
于斐 曾晖**翁鉴 林健静 解笑宸 孙军营 肖德明
(北京大学深圳医院骨科,广东深圳518036)
背景:沉默信息调节因子1(silent information regulator 1,SIRT1)基因是一个与衰老关系密切的基因,可以通过调节PI3K/AKT、NF-κB等信号通路影响到组织及机体的衰老过程,并参与骨科相关疾病的发生发展。建立慢病毒介导的SIRT1基因表达降低的ATDC5细胞模型,可以为研究SIRT1基因相关的骨科系统疾病如骨关节炎、骨质疏松症等提供实验基础。目的:构建携带小鼠SIRT1基因的RNAi慢病毒载体,将其转染ATDC5细胞系,建立SIRT1基因表达降低的ATDC5细胞模型。方法:根据RNAi序列设计原则设计并合成SIRT1基因的RNAi靶点序列,连接GV248(框架结构:hU6-MCS-Ubiquitin-EGFP-IRES-puromycin)载体,转化后经阳性克隆测序及PCR鉴定,质粒抽提后导入293T细胞,包装慢病毒,取上清检测滴度。将含有小鼠SIRT1基因RNAi的病毒颗粒转染ATDC5细胞系,并于荧光显微镜下进行观察,行RT-PCR检测ATDC5细胞中SIRT1 mRNA的表达情况。结果:经测序、PCR检测可知,SIRT1基因的RNAi靶点序列与GV248载体连接成功,并包装成高滴度的慢病毒。携带小鼠SIRT1基因的RNAi慢病毒感染ATDC5细胞后,荧光显微镜下观察显示感染率较高,RT-PCR检测发现,携带SIRT1基因的慢病毒感染组SIRT1基因mRNA的相对表达量为0.386±0.117,与阴性对照病毒感染组相比有统计学差异(P<0.05),敲减效率为61.4%。结论:成功建立SIRT1基因表达降低的ATDC5细胞模型,为研究SIRT1基因相关骨科系统疾病提供实验基础。
基因;细胞;细胞模型;慢病毒属
沉默信息调节因子1(silent information regulator 1,SIRT1)基因是一个与衰老关系密切的基因[1],位于10号染色体,编码的蛋白质由500个氨基酸残基构成,通过去乙酰化的方式参与到下游基因及蛋白的调控过程中,并通过控制新陈代谢[2]、调节细胞周期[3]、预防病毒感染[4]等多种作用参与到机体衰老进程。该基因具有高度保守的核心序列,可以通过多条信号通路,如AKT/PI3K[5]、NF-κB[6]等的作用参与到骨科系统相关疾病的发生发展中,在调节机体正常功能方面起到重要的作用。
ATDC5细胞是一种小鼠源性的细胞系,是由胚胎瘤细胞AT805衍生而来,与原代软骨细胞的性状相似,该细胞在受到相关因子的刺激后可以在增殖、分化等阶段增强或加速特征性软骨基质的表达,从而分化为不同阶段的软骨细胞[7]。常用于骨科系统相关疾病的研究,如骨关节炎[8]、骨质疏松症[9]等。
目前,SIRT1基因相关的ATDC5细胞模型鲜有报道,本研究利用慢病毒介导的RNAi技术建立了SIRT1基因干扰后的ATDC5细胞模型,从而为基础及临床利用该细胞研究骨科系统相关疾病提供实验基础。
1 材料与方法
1.1 材料
ATDC5细胞(南京科佰生物科技有限公司提供),293T细胞(上海细胞所提供),GeneRuler 1 kb DNA Ladder(Thermo Scientific公司提供),Normal-RunTM 250 bp-II DNA Ladder(GeneRay公司提供),限制性核酸内切酶(NEB公司提供),Taq Plus DNA聚合酶(Vazyme公司提供),T4 DNA连接酶(Thermo Scientific公司提供),引物(GeneRay、上海吉凯基因科技有限公提供),TOP10感受态细胞(Genechem公司提供),质粒提取试剂盒(TIANGEN公司提供),台盼兰(Sigma公司提供),胎牛血清(上海微科生化试剂有限公司、Ausbian公司提供),DMSO(上海试一化学试剂有限公司提供),DMEM培养基(Hyclone、Corning公司提供),吉凯转染试剂(上海吉凯基因科技有限公司提供),嘌呤霉素(Sigma、Clontech公司提供),HIV-1 p24 AntigenELISA 2.0试剂盒(北京达科为生物技术有限公司提供),胰酶(生工生物工程(上海)股份有限公司提供),D-Hanks(上海吉凯基因科技有限公司提供),Trizol试剂盒(上海普飞公司提供),M-MLV试剂盒(Promega公司提供),三磷酸碱基脱氧核苷酸(Promega公司提供),RNA酶抑制剂(Promega公司提供),T重复寡核苷酸(上海生工提供),Bulge-LoopTM miRNA qPCR Primer Set(广州锐博提供),SYBR Master Mixture(TAKARA公司提供),GV248载体(上海吉凯基因科技有限公司提供)。
1.2 RNA i i慢病毒载体构建
针对目的基因序列,根据RNAi序列设计原则,设计SIRT1基因的RNAi靶点序列,其序列为5'-CCAACACCTCTTCATATTT-3',GC含量36.84%,采用GV248载体(框架结构:hU6-MCS-Ubiquitin-EGFP-IRES-puromycin),构建病毒载体GV248-Sirt1-RNAi-a和GV248-Sirt1-RNAi-b,构建框架见表1。引入酶切位点AgeⅠ、EcoRⅠ酶切载体,合成单链引物,引物退火形成双链DNA,通过T4 DNA连接酶将双酶切线性化的载体和退火双链DNA连接,转化感受态细胞,挑选阳性克隆的菌落进行PCR鉴定,引物见表2。测序后进行质粒抽提,抽提合格的质粒进入下游流程。
1.3 RNA i i慢病毒包装
转染前24 h处理293T细胞,调整细胞密度约5× 106个/15 ml,接种于10 cm细胞培养皿,37℃、5%CO2培养箱内培养,待细胞密度达到70%~80%用于转染;转染前2 h更换为无血清培养基;离心管中加入所制备的各DNA溶液(GV载体质粒20µg、pHelper 1.0载体质粒15µg、pHelper 2.0载体质粒10µg),与相应体积的吉凯转染试剂混合均匀,调整总体积为1 ml,在室温下温育15 min;滴加至293T细胞培养液中培养6 h;弃去含有转染混和物的培养基;10 ml PBS清洗;加入含10%血清的细胞培养基20 ml,培养48~72 h;收集转染后的293T细胞上清液;4℃、4000 g离心10 min;0.45µm滤器过滤40 ml超速离心管中上清液;4℃、25000 rpm离心2 h;弃去上清,加入病毒保存液(可用PBS或细胞培养基),重悬;10000 rpm离心5 min,取上清分装。293T细胞铺96孔板(4×104个/孔,100µl);将梯度稀释后的病毒颗粒加入;培养24 h,加入完全培养基;4 d后观察荧光表达情况,计算病毒滴度。
1.4 细胞感染
将ATDC5细胞复苏铺6 cm细胞培养皿,细胞汇合度达80%左右传代培养;将细胞制成3×104~5×104个/ml细胞悬液,铺12孔板,每孔1 ml;待细胞达到20%左右密度时进行转染试验,分为空白组、阴性对照病毒感染组、携带SIRT1基因的慢病毒感染组。感染复数(multiplicity of infection,MOI)为10,在感染增强液Eni.S和polybrene辅助下进行感染,感染后16 h换液,感染后72 h进行荧光拍照。收集细胞抽提RNA进行RT-PCR检测实验。

表1 iRNAi构建框架

表2 阳性克隆菌落PCR鉴定引物
1.5 荧光定量PCR反应检测ATDC 5细胞中慢病毒转染后SIRT 1基因mRNA的表达情况
SIRT1及GAPDH基因引物序列见表3。总RNA提抽使用Trizol试剂盒,cDNA合成使用M-MLV试剂盒。按照各目的基因退火温度选择二步法完成扩增,总共循环45次。根据熔解曲线判断扩增产物的特异性,采用2-ΔΔCt法开展数据分析。

表3 SIRT 1及GAPDH基因引物序列
1.6 统计学方法
采用SPSS 21.0软件进行统计学分析,计量资料采用平均值±标准差表示,两组样本之间进行t检验,P<0.05为有统计学差异。
2 结果
2.1 SIRT 1基因RNA i i慢病毒载体的制备及鉴定
SIRT1基因短发卡RNA(short hairpin RNA,shRNA)核苷酸序列经过退火形成双链DNA,引入酶切位点AgeⅠ、EcoRⅠ酶切载体,通过T4 DNA连接酶将双酶切线性化的载体和退火双链DNA连接,转化感受态细胞,挑选阳性克隆的菌落进行PCR鉴定,电泳图见图1。连接入慢病毒短发夹状RNA(vshRNA)片段的阳性克隆PCR片段大小为542 bp,没有连接入vshRNA片段的空载体克隆PCR片段大小为508 bp。测序结果表明合成的SIRT1 shRNA序列插入正确。
2.2 携带SIRT 1基因的慢病毒包装及滴度鉴定
重组慢病毒质粒和转染试剂混合均匀,缓慢滴加至293T细胞中,正常培养24 h后,在倒置荧光显微镜下观察,观察各孔中绿色荧光蛋白的表达情况,细胞生长状态较好,无细菌及真菌生长,培养基澄清透明,证明病毒包装成功(图2)。病毒滴度=荧光细胞数/病毒原液量,可知该病毒的滴度为1E+9 TU/ml。
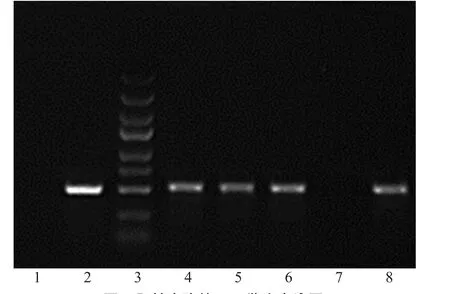
图1 阳性克隆的PCR鉴定电泳图
2.3 携带SIRT 1基因的慢病毒感染ATDC 5细胞
2.4 携带SIRT 1基因的慢病毒感染ATDC 5细胞后细胞中SIRT 1基因mRNA的表达情况
收集ATDC5细胞,抽提总RNA,通过RT-PCR反应检测ATDC5细胞中SIRT1基因mRNA的表达情况。分别感染3次,阴性对照病毒感染组SIRT1基因mRNA的表达情况为(1.002±0.083)、(1.000±0.015)、(1.001±0.040),携带SIRT1基因的慢病毒感染组SIRT1基因mRNA的表达情况为(0.255±0.012)、(0.482±0.025)、(0.420±0.009),3次感染均有统计学差异(P<0.01,图4)。感染3次后,ATDC5细胞中SIRT1基因mRNA的相对表达量,阴性对照病毒感染组为(1.001±0.001),携带SIRT1基因的慢病毒感染组为(0.386±0.117),敲减效率为61.4%,差异有统计学意义(P<0.05)。由此可知,该靶点是一个有效的靶点,SIRT1基因表达降低的ATDC5细胞模型构建成功。
将ATDC5细胞制成3×104~5×104个/ml细胞悬液,铺于12孔板中正常培养,待细胞密度为20%时,用5E+8 TU/ml滴度的携带SIRT1基因的慢病毒及阴性对照病毒2.00 μl进行感染,感染增强液Eni.S和polybrene辅助感染,MOI为10。感染后16 h换液,感染后72 h在倒置荧光显微镜下观察各孔中绿色荧光蛋白的表达情况。发现细胞生长状态较好,未出现大量死亡现象,细胞感染效率高,无细菌及真菌生长,培养基澄清透明,可用于PCR鉴定(图3)。
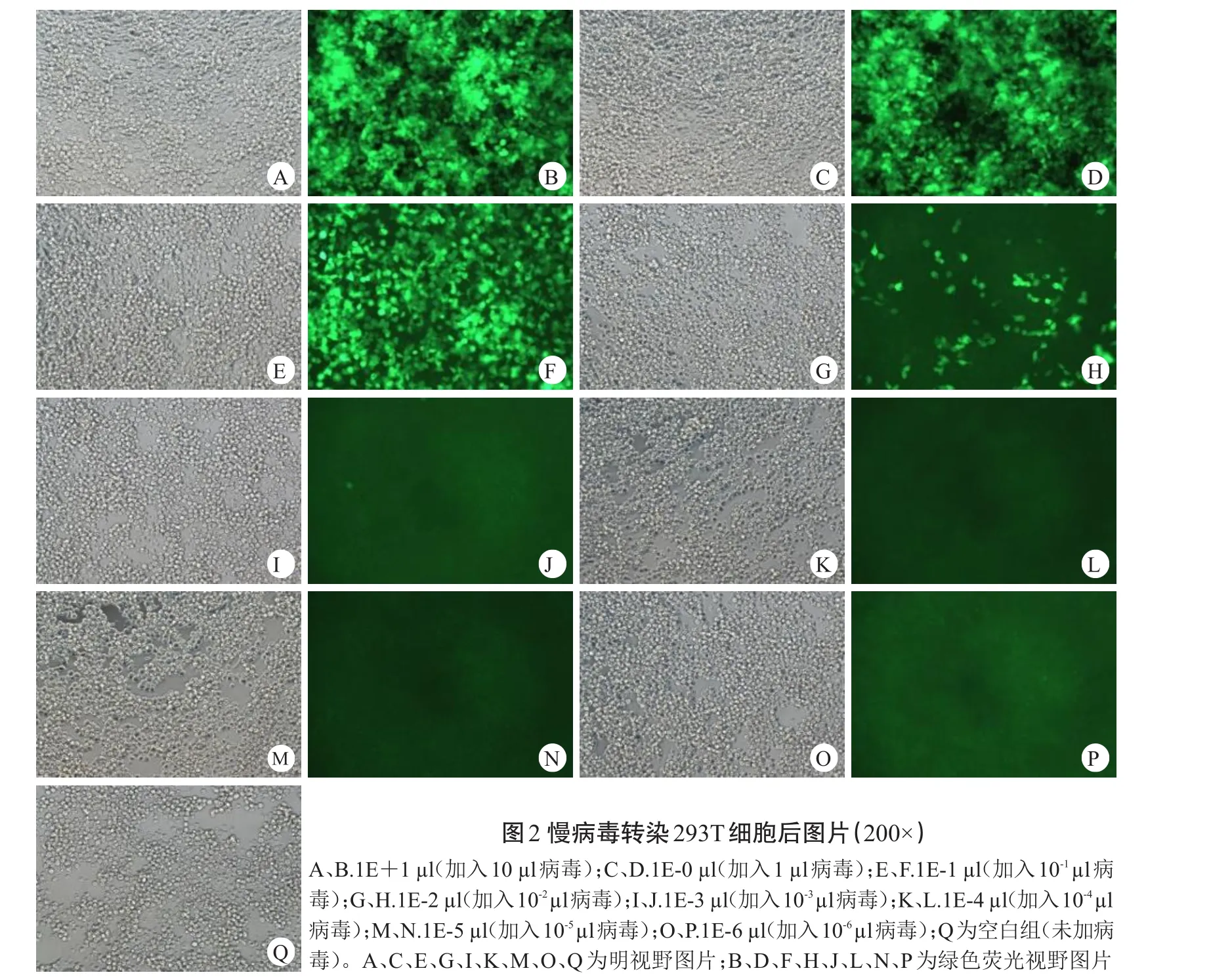
图2 慢病毒转染293T细胞后图片(200×)
3 讨论
SIRT1基因是存在于哺乳动物中酵母染色质Sir2的同源体,经烟酰胺腺嘌呤二核苷酸调控许多下游基因转录,主要通过催化蛋白质赖氨酸s位去乙酰化而移除该基团,以去乙酰化的方式在翻译后水平中调节靶分子的活性和功能。从而影响到靶分子的表达,参与到机体功能及疾病发生发展的过程中,对于调控机体的物质代谢[2]、DNA损伤修复[10]、衰老进程[11]等作用较大。并可以通过AKT/PI3K[5]、NF-κB[6]、Wnt/β-catenin[12]等信号通路的作用调节软骨细胞的代谢,进而参与到骨科疾病如骨关节炎[13]、骨质疏松[14]等的发生发展中,在各种生理及病理过程中起到重要作用。本研究利用慢病毒转染的技术对SIRT1基因的表达进行干扰,从而降低细胞中SIRT1基因的表达,建立SIRT1基因表达降低的细胞模型。
ATDC5细胞的功能与软骨细胞类似,为软骨细胞的祖系,由于来源于胚胎瘤细胞,从而可以进行多次传代,避免了使用原代软骨细胞进行研究时传代次数的限制以及慢病毒转染原代细胞成功率较低的不利影响。ATDC5细胞可以在胰岛素等因子的诱导下模拟软骨的形成过程[15],为研究软骨发育提供了良好的体外细胞模型[16],并在软骨相关的疾病中起到重要的作用。在本课题组研究中,软骨缺损及修复是一个重要的领域,通过查阅文献发现,ATDC5细胞中SIRT1基因表达改变的细胞模型鲜有报道,而该模型在骨关节炎、骨质疏松等疾病的研究中作用重大,建立ATDC5细胞相关的细胞模型十分必要,因此通过本研究建立SIRT1基因表达降低的ATDC5细胞模型。
RNAi技术是近些年来比较热门的一种降低基因表达的技术[17],该技术是一种在生物体细胞内由双链RNA引起同源mRNA的特异性降解,因而抑制相应基因表达的过程,是一种转录后水平的基因沉默[18],在生物体内普遍存在,同时是一种可以抵御外在感染的重要保护机制,常用于功能基因组学和细胞信号传导通路分析。慢病毒可以感染分裂期及非分裂期的细胞,宿主范围广泛,对于包括原代细胞在内的难感染细胞的感染效率高,能将外源基因随机整合到宿主细胞的基因组中,使之在宿主细胞中稳定存在[19],并且不对宿主细胞产生毒性或激发免疫反应,不容易发生突变,从而实现稳定的基因变化。慢病毒与腺病毒等其他病毒载体相比优势明显[20],被越来越多地应用到相关的研究中[21]。小发卡状RNA(shRNA)导入细胞后可以持久性的转录生成shRNA,从而发挥稳定的抑制作用,比早期的小干扰RNA(siRNA)效果好[22]。本研究使用目前比较认可的技术,采用慢病毒作为转入载体,将shRNA导入细胞,因此,所获得的结果可信度较高。
本研究中首先设计了1条针对小鼠SIRT1基因的RNAi特异性序列,并将其构建成表达SIRT1的shRNA的慢病毒载体。阳性克隆PCR鉴定及测序结果表明合成的SIRT1 shRNA序列与设计的序列一致,插入正确。与此同时,所选择的慢病毒载体能够表达绿色荧光蛋白,导入细胞后在荧光显微镜下可以激发绿色荧光,从而便于观察。当干扰载体感染293T细胞后,通过荧光显微镜的观察计算出该病毒的滴度为1E+9 TU/ml。将其感染ATDC5细胞后发现ATDC5细胞生长状态良好,无大量死亡现象,细胞感染效率高。行RT-PCR检测发现,携带SIRT1基因的慢病毒感染组与阴性对照病毒感染组相比,SIRT1基因mRNA的表达量明显降低,敲减效率达到61.4%,建立RNAi慢病毒稳定感染的SIRT1基因表达量降低的ATDC5细胞模型。
综上,本研究通过慢病毒干扰技术,降低了ATDC5细胞中SIRT1基因的表达,成功建立SIRT1基因表达降低的ATDC5细胞模型,为基础及临床研究SIRT1基因相关的骨科系统相关疾病及其分子机制提供了实验基础。
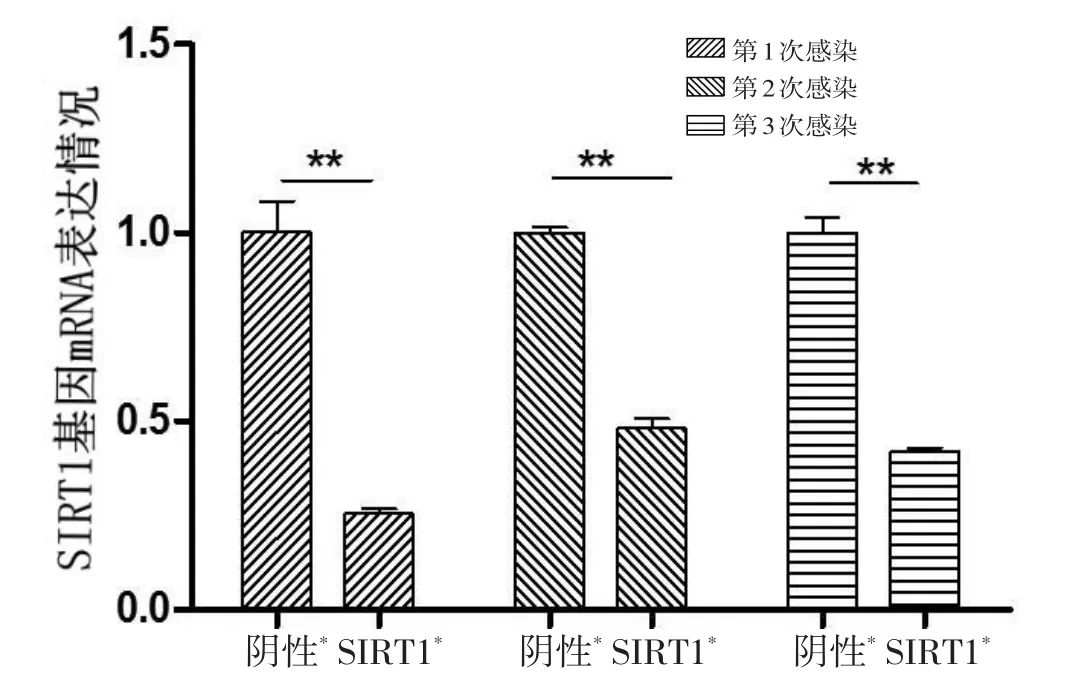
图4 3次感染后不同组别ATDC5细胞SIRT1基因mRNA表达
[1]Terauchi K,Kobayashi H,Yatabe K,et al.The NAD-Dependent Deacetylase Sirtuin-1 Regulates the Expression of Osteogenic Transcriptional Activator Runt-Related Transcription Factor 2(Runx2)and Production of Matrix Metalloproteinase(MMP)-13 in Chondrocytes in Osteoarthritis.Int J Mol Sci,2016,17(7).
[2]Shah SA,Yoon GH,Chung SS,et al.Novel osmotin inhibits SREBP2 via the AdipoR1/AMPK/SIRT1 pathway to improve Alzheimer's disease neuropathological deficits.Mol Psychiatry,2017,22(3):407-416.
[3]Park EJ,Sang-Ngern M,Chang LC,et al.Induction of cell cycle arrest and apoptosis with downregulation of Hsp90 client proteins and histone modification by 4β-hydroxywithanolide E isolated from Physalis peruviana.Mol Nutr Food Res,2016,60(6):1482-1500.
[4]Zainal N,Chang CP,Cheng YL,et al.Resveratrol treatment reveals a novelrole for HMGB1 in regulation ofthe type 1 interferon response in dengue virus infection.Sci Rep,2017,7: 42998.
[5]Yu F,Zeng H,Lei M,et al.The Effects of SIRT1 Gene Knock-Out Through the Activation of SREBP2 Protein Mediated PI3K/AKT Signal Pathway on Osteoarthritis in Mice.J Huazhong Univ Sci Technolog Med Sci,2016,36 (5):683-690.
[6]Liu B,Lei M,Hu T,et al.Inhibitory effects of SRT1720 on the apoptosis of rabbit chondrocytes by activating SIRT1 via p53/bax andNF-κB/PGC-1α pathways.J Huazhong Univ Sci Technolog Med Sci,2016,36(3):350-355.
[7]冯其帅,高丽娜,崔元璐.ATDC5:一株反映软骨形成完整过程的细胞系.天津中医药大学学报,2015,34(6):379-384.
[8]Snelling SJ,Davidson RK,Swingler TE,et al.Dickkopf-3 is upregulated in osteoarthritis and has a chondroprotective role.Osteoarthritis Cartilage,2016,24(5):883-891.
[9]Zhang Y,Yang T,Li X,et al.Functional analyses reveal the essential role of SOX6 and RUNX2 in the communication of chondrocyte and osteoblast.Osteoporos Int,2015,26(2): 553-561.
[10]Paget S,Dubuissez M,Dehennaut V,et al.HIC1(hypermethylated in cancer 1)SUMOylation is dispensable for DNA repair but is essential for the apoptotic DNA damage response(DDR)to irreparable DNA double-strand breaks (DSBs).Oncotarget,2017,8(2):2916-2935.
[11]Rehan L,Laszki-Szcząchor K,Sobieszczańska M,et al. SIRT1 and NAD as regulators of ageing.Life Sci,2014,105 (1-2):1-6.
[12]Abed É,Couchourel D,Delalandre A,et al.Low sirtuin 1 levels in human osteoarthritis subchondral osteoblasts lead to abnormal sclerostin expression which decreases Wnt/βcatenin activity.Bone,2014,59:28-36.
[13]Zheng W,Feng Z,You S,et al.Fisetin inhibits IL-1β-induced inflammatory response in human osteoarthritis chondrocytes through activating SIRT1 and attenuates the progression of osteoarthritis in mice.Int Immunopharmacol,2017,45:135-147.
[14]Gong K,Qu B,Liao D,et al.MiR-132 regulates osteogenic differentiation via downregulating Sirtuin1 in a peroxisome proliferator-activated receptor β/δ-dependent manner.Biochem Biophys Res Commun,2016,478(1):260-267.
[15]Shukunami C,Ishizeki K,Atsumi T,et al.Cellular hypertrophy and calcification of embryonal carcinoma-derived ehondrogenic cell line ATDC5 in vitro.J Bone Miner Res, 1997,12(8):1174-1188.
[16]金曼,戚华兵,苏楠,等.小鼠胚胎瘤来源细胞系ATDC5的体外软骨分化诱导研究.中国骨质疏松杂志,2009,15 (10):737-740.
[17]Yu H,Zhao Z,Yu X,et al.Bovine lipid metabolism related gene GPAM:Molecular characterization,function identification,and association analysis with fat deposition traits. Gene,2017,609:9-18.
[18]Brummelkamp TR,Bernards R,Agami R.A system for stable expression of short interfering RNAs in mammalian cells.Science,2002,296(5567):550-553.
[19]Lasek AW,Azouaou N.Virus-delivered RNA interference in mouse brain to study addiction-related behaviors.Methods Mol Biol,2010,602:283-298.
[20]马晓生,姜建元,吕飞舟,等.腺病毒和慢病毒载体感染骨髓间质充质干细胞的比较.中华医学杂志,2006,86(47): 1207-1210.
[21]Xiong YD,Rong LX,Pan C.Regulation of Postoperative Ileus by Lentivirus-Mediated HuR RNA Interference via the p38/MK2 Signaling Pathway.J Gastrointest Surg,2017,21 (2):389-397.
[22]李芳,闫琰,张茜,等.慢病毒介导的犬WRD细胞p53基因沉默及稳定感染细胞系的建立.南方医科大学学报, 2014,34(12):1721-1727.
Establishment of an ATDC5 cell model with lentivirus-mediated SIRT1 gene knockdown*
YU Fei,ZENG Hui**,WENG Jian,LIN Jianjing,XIE Xiaochen,SUN Junying,XIAO Deming
(Department of Orthopedics,Peking University Shenzhen Hospital,Shenzhen 518036,Guangdong,China)
Background:Silent information regulator 1(SIRT1)gene has a close relationship with aging.It can affect the aging process of tissue and organism through regulating PI3K/AKT,NF-κB signaling pathways and participate in the development of orthopedic diseases.An ATDC5 cell model with lentivirus-mediated SIRT1 gene knockdown can provide experimental basis for the study of SIRT1 gene related orthopedic diseases such as osteoarthritis and osteoporosis.Objec:tive:To construct a lentiviral vector for RNA interference(RNAi)of mouse SIRT1 gene which was transfected into ATDC5 cell line to establish an ATDC5 cell model with SIRT1 gene knockdown.Methods:According to the design principle of the RNAi target sequence,RNAi target sequence of SIRT1 gene was designed and synthesized.And then the sequence was connected with GV248(hU6-MCS-Ubiquitin-EGFP-IRES-puromycin)vector.After PCR identification and clone sequencing,the plasmid was extracted and transfected into 293T cells.The lentiviruses were packed and the supernatant was collected to detect titer.The lentiviruses containing mouse SIRT1 gene RNAi sequence were transfected into ATDC5 cell line which was observed under fluorescence microscope.RT-PCR was used to detect the expression of SIRT1 mRNA in ATDC5 cells.Res ults: SIRT1 gene RNAi sequence was successfully connected with GV248 vector through PCR and sequence analysis and packaged into high titer lentivirus.After the lentivirus containing mouse SIRT1 gene RNAi sequence were transfected into ATDC5 cells,the high infection rate was found under fluorescence microscope.RT-PCR showed that the expression of SIRT1 mRNA was 0.386±0.117,which was significantly different from the negative control group(P<0.05).The knockdown efficiency was 61.4%.Conclusions:An ATDC5 cell model with lentivirus-mediated SIRT1 gene knockdown has been successfully established.It can provide experimental basis for the study of SIRT1 gene related orthopedics diseases.
Genes;Cells;Models;Lentivirus
2095-9958(2017)04-0154-05
10.3969/j.issn.2095-9958.2017.02-15
深圳市科创委资助项目(JCYJ20150403091443275);广东省自然科学基金-博士启动项目(2016A030310070)**
曾晖,E-mail:zenghui_36@163.com

