短柱金丝桃中多酚类化学成分的研究
张小飞,李小年,叶岩松,江泓,许刚,陈胡兰
短柱金丝桃中多酚类化学成分的研究
张小飞1,李小年2,叶岩松2,江泓1,许刚2,陈胡兰1
目的:对金丝桃属(Hypericum)植物短柱金丝桃(H. hookerianum Wight et Arn)中多酚类化学成分进行研究。方法:采用反复硅胶柱色谱、MCI、Sephades LH-20、制备型和半制备型高效液相色谱等分离手段对其进行分离和纯化,并运用质谱和核磁共振等现代波谱技术对得到的化合物进行结构鉴定。结果:该植物中共分离纯化得到7个多酚类化合物,分别鉴定为槲皮素(1)、原儿茶酸(2)、2-丙基苯-β-D-吡喃葡萄糖苷(3)、肉桂基-O-β-D-吡喃葡萄糖苷(4)、咖啡酸(5)、1,3,5,7-四羟基口山酮(6)、3,8''-Biapigenin (7)。结论:化合物2~7为首次从该植物中分离得到。
短柱金丝桃;化学成分;结构鉴定
金丝桃属植物系藤黄科(Guttiferae),为多年生草本或者灌木。除南北两极地或荒漠地及大部分热带低地外,全世界都有分布,约有400余种。我国约有55种8亚种,全国各地都有分布,主要集中在我国西南地区,仅云南地区就有27种4亚种,具有丰富的植物资源[1]。该属多种植物在国内外民间都具有悠久的药用历史,如元宝草(H. samposonii)、地耳草(H. japonicum)、贯叶连翘(H. perforatum)等,民间主要用于止血、抗菌消炎、抗风湿及利尿等[2]。金丝桃属植物的特征性次生代谢产物中最有代表性的两类化合物分别为黄酮类和多环多异戊烯基取代的间苯三酚类(polycyclic polyprenylated acylphloroglucinol,PPAP),此外也还含有萜类、脂肪酸及挥发油等[3]。该属植物资源丰富、次生代谢产物结构的多样性吸引了越来越多学者的目光。
短柱金丝桃(H. hookerianumWight et Arn)为藤黄科(Guttiferae)金丝桃属(Hypericum)植物,收载于《云南植物志》;又名金丝海棠,苦连翘,金丝桃桃,过路黄等;灌木,高0.3~2.1米;产于云南西部、西藏东南部,生于山坡灌丛中或林缘边,海拔2500~3400米。尼泊尔、锡金、不丹、印度(东北部)、孟加拉、缅甸及泰国也有分布[4]。该植物在印度民间被广泛用于伤口治愈、消炎、抗菌等,一些印度学者研究报道短柱金丝桃的甲醇提取物具有很好抗菌、抗癌、抗抑郁、抗氧化等活性[5~8];甲醇提取物的浸膏制成膏药用于伤口治愈[9]。2005年,云南师范大学罗蕾等人从采自滇东北地区的短柱金丝桃中分离得到5个黄酮和2个螺内酯成分[10];2014~2015年,本研究组叶烨硕士对采自云南丽江老君山的短柱金丝桃地上部分PPAP类成分进行定向深入研究,共分离得到69个PPAPS类化合物[11]。除以上两位作者研究报道外,未见其他有关短柱金桃化学成分研究报道。
本课题组长期致力于金丝桃属植物中的PPAP类化学成分的系统研究,目前,完成了10余种金丝桃属植物中PPAP类化学成分研究,并得到了一系列结构新颖的天然产物[11~17]。而一些存在于极性较大部位的天然产物,如苯丙素及黄酮类等成分,我们尚未对其进行深入研究,并且前期得到的PPAPS类化合物活性并不显著。为了能够发掘活性较好的天然产物,能够更加系统、深入的了解该属植物中多酚类化学成分,丰富该属植物多酚类化学成分数据库,以及为进一步开发、利用短柱金丝桃的植物资源提供一定的物质基础,我们对采自云南丽江老君山的短柱金丝桃地上部分乙酸乙酯部位多酚类化学成分进行深入研究,得到7个多酚类化合物。并结合MS和NMR等波谱技术将这些化合物分别鉴定为槲皮素(1)[18]、原儿茶酸(2)[19]、2-丙基苯-β-D-吡喃葡萄糖苷(3)[20]、肉桂基-O-β-D-吡喃葡萄糖苷(4)[21]、咖啡酸(5)[22]、1,3,5,-四羟基口山酮[23]、3,8''-Biapigenin (7)[24]。
1 仪器及材料
AV III-600MHz 超导核磁共振仪,TMS作内标;API Qstar time-of-flight质谱仪;分析和半制备HPLC:Agilent 1100,Zorbax SB-C18,5 μm,4.6×250 mm和9.4×250 mm;制备HPLC:Waters 1525;Sephadex LH-20葡聚糖凝胶,粒径为40~70 μm,为瑞典Amersham Pharmaciz Biotech 公司生产;柱层析用硅胶为100~200目(青岛海洋化工);MCI为75~150 μm(日本三菱);显色剂为10%的H2SO4乙醇溶液,喷洒后适当加热,所用溶剂均为重蒸后使用。
样品于2013年8月采于云南丽江老君山,并由中科院昆明植物研究所刘恩德老师鉴定为藤黄科(Guttiferae)金丝桃属(Hypericum)植物短柱金丝(H.hookerianumWight et Arm)。标本存放于中国科学院昆明植物研究所植物化学与西部资源持续利用国家重点实验室,标本号为:H. hookerianum-20130829。
2 方法与结果
2.1 提取与分离
短柱金丝桃地上部分干重20.0 kg,以95%甲醇冷浸提取3次,每次1天,减压浓缩得浸膏5.0 kg。5.0 kg浸膏用硅胶6.0 kg (100~200目)拌样,10.0 kg硅胶(100~200目)进行硅胶柱层析,氯仿洗脱,得A段288 g,B段580 g。前期,A段已由本课题组叶烨硕士完成该段化学成分分离及结构鉴定。B段25.0 g用25.0 g硅胶(100~200目)拌样,150 g硅胶(100~200目)进行硅胶柱层析,氯仿:甲醇(9:1→0:1)梯度洗脱,粗分得到B1 (1.5 g)、B2 (2.8 g)、B3 (3.0 g)、B4 (11.0 g)。经HPLC分析得知多酚类化学成分主要集中在B2、B3段。B2段2.8 g经过反相MCI柱及正相硅胶柱层析分离,再经制备和半制备HPLC纯化,最终得到化合物1 (12.8 mg)、2 (76.3 mg)、3 (5.8 mg)和4 (11.3 mg)。运用类似的方法,从B3段3.0 g得到化合物5 (28.4.0 mg)、6 (58.1 mg)、7 (18.2 mg)。化合物的结构式如图1所示
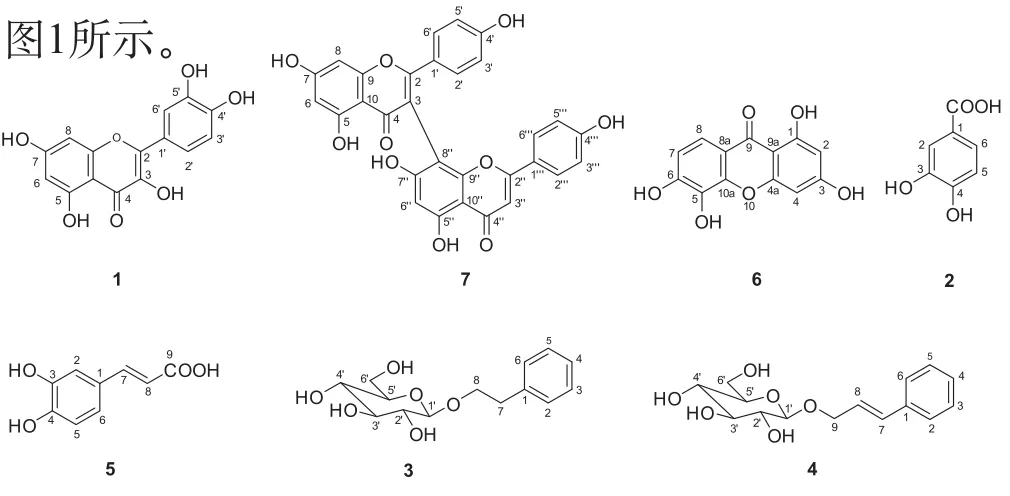
图1 化合物1~7的化学结构
2.2 结构鉴定
化合物1 黄色粉末,分子式为:C15H10O7;ESI-MS m/z 301 [M-H]-; 1H NMR (methanol-d4, 600 MHz) δ: 6.17 (1H, d, J = 1.8 Hz, H-6), 6.37 (1H, s, H-8),6.87 (1H, d, J = 8.4 Hz, H-3´), 7.62 (1H, dd, J = 9.0 Hz,1.8 Hz, H-2´), 7.72 (1H, d, J = 2.4 Hz, H-6´);13C NMR(methanol-d4, 150 MHz) δ: 94.4 (C-8), 99.2 (C-6), 104.5(C-10), 116.0 (C-6´), 116.2 (C-3´), 121.7 (C-2´), 124.1(C-1´), 137.2 (C-3), 146.2 (C-5´), 148.0 (C-2), 148.8(C-4´), 158.2 (C-9), 162.5 (C-5), 165.6 (C-7), 177.3(C-4)。以上波谱数据与文献对照[18],数据一致,故确定化合物1为槲皮素(quercetin)。
化合物2 淡紫色粉末,分子式为C7H6O4; ESIMS m/s 153 [M-H]-;1H NMR (actone-d6, 600 MHz) δ:6.88 (1H, d, J = 7.8 Hz, H-5), 7.45 (1H, dd, J = 7.8 Hz,1.8 Hz, H-6), 7.51 (1H, d, J = 1.8 Hz, H-2), 13C NMR(actone-d6, 150 MHz) δ: 115.0 (C-5), 116.8 (C-2), 122.4(C-1), 122.9 (C-6), 144.9 (C-3), 150.0 (C-4), 167.0(-COOH)。以上数据与文献对照[19],数据一致,故确定化合物2为原儿茶酸(protocatechuic acid)。
化合物3 淡紫色油状,分子式为C14H20O6; ESIMS m/s 283 [M-H]-;1H NMR (methanol-d6, 600 MHz)δ: 2.93 (2H, m, H-6´), 3.24 (2H, m, H-8), 3.34 (2H, t, J= 7.8 Hz, H-7), 3.65 (1H, dd, J = 11.4 Hz, 4.8 Hz, H-3´),3.76 (1H, dd, J = 15.0 Hz, 7.2 Hz, H-4´), 3.85 (1H, dd,J = 12 Hz, 1.8 Hz, H-5´), 4.09 (1H, m, H-2´), 4.29 (1H,d, J = 7.8Hz, H-1´), 7.16 (1H, m, H-4), 7.24 (4H, d, J =9.0 Hz, 4.2 Hz, H-2, 3, 5, 6), 13C NMR (actone-d6, 150 MHz) δ: 37.2 (C-8), 62.9 (C-6´), 71.6 (C-4´), 71.7 (C-7),75.1 (C-1´), 78.0 (C-3´), 78.1 (C-5´), 104.4 (C-1´), 127.2(C-4), 129.3 (C-2, C-6), 130.0 (C-3, C-5), 140.1 (C-1)。以上数据与文献对照[20],数据一致,故确定化合物3为2-丙基苯-β-D-吡喃葡萄糖苷(2-propylbenzene-β-D-glucopyranoside)。
化合物4 淡紫色油状,分子式为C15H20O6;ESI-MS m/s 295 [M-H]-;1H NMR (methanol-d6, 600 MHz) δ: 3.23 (1H, m, H-3´), 3.28 (2H, m, H-6´), 3.68(1H, dd, J = 12.0 Hz, 5.4 Hz, H-4´), 3.88 (1H, dd, J =12.0 Hz, 2.4 Hz, H-5´), 4.30 (1H, m, H-2´), 4.35 (1H, d,J = 7.8 Hz, H-1´), 4.54, (1H, m, H-7), 6.37 (1H, m, H-8),6.67 (1H, d, J = 16.1 Hz, H-4), 7.22 (2H, m, H-9), 7.29(2H, t, J = 7.2 Hz, H-3, 5), 7.40 (2H, d, J = 7.8 Hz), 13C NMR (actone-d6, 150 MHz) δ: 62.8 (C-6´), 70.7 (C-9),71.7 (C-4´), 75.1 (C-2´), 78.0 (C-3´), 78.1 (C-5´), 103(C-1´), 126.7 (C-8), 127.5 (C-4), 128.7 (C-2, C-6), 129.6(C-3, C-5), 133.8 (C-7), 138.2 (C-1)。以上数据与文献对照[21],数据一致,故确定化合物4为肉桂基-O-β-D-吡喃葡萄糖苷(cinnamyl-O-β-D-glucopyranoside)。
化合物5 淡黄色粉末,分子式为C9H8O4; ESIMS m/s 179 [M-H]-;1H NMR (actone-d6, 600 MHz) δ:6.26(1H, d, J = 15.6 Hz, H-8), 6.86 (1H, d, J = 7.8 Hz,H-5), 7.03 (1H, dd, J = 7.8 Hz, 1.8 Hz, H-6), 7.45(1H,1H, d, J = 1.8 Hz, H-2), 7.53 (1H, d, J = 15.6 Hz, H-7),13C NMR (actone-d6, 150 MHz) δ: 115.1 (C-8), 115.6(C-2), 116.2 (C-5), 122.2 (C-6), 127.5 (C-1), 145.7 (C-7),146.1 (C-3), 148.5 (C-4), 167.9 (C-9)。以上波谱数据与文献对照[22],数据一致,故确定化合物5为咖啡酸(caffeic acid)。
化合物6 淡黄色粉末,分子式为C13H8O6; ESIMS m/s 259 [M-H]-;1H NMR (methanol -d6, 600 MHz)δ: 6.16 (1H, d, J = 1.8 Hz, H-2), 6.43 (1H, s, H-4), 6.87(1H, d, J = 8.4 Hz, H-7), 7.57 (1H, d, J = 8.4 Hz, H-8),13C NMR (actone-d6, 150 MHz) δ: 95.1 (C-4), 99.0(C-2), 103.1, (C-4a), 113.7 (C-8), 114.9 (C-10a), 117.5(C-7), 113.7 (C-5), 147.7 (C-6), 153.2 (C-8a), 159.4(C-9a), 164.8 (C-1), 166.9 (C-3), 181.8 (C-9)。以上波谱数据与文献对照[23],数据一致,故确定化合物6为1,3,5,7四羟基口山酮(3,4,5,7-tetrahydroxyxanthone)。
化合物7 黄色油状,分子式为:C30H18O10;ESIMS m/s 537 [M-H]-;1H NMR (actone-d6, 600 MHz) δ:6.32 (2H, d, J = 1.8 Hz, H-6, H-6´´), 6.56 (1H, d, J = 1.8 Hz, H-8), 6.60 (1H, s, H-3´´), 6.76 (2H, dd, J = 6.6 Hz, 1.8 Hz, H-3´, H-5´), 6.86 (2H, dd, J = 7.2 Hz, 2.4 Hz, H-3´´´,H-5´´´), 7.49 (2H, dd, J = 6.6 Hz, 1.8 Hz, H-2´, H-6´),7.67 ( 2H, dd, J = 6.6Hz, 1.8 Hz, H-2´´´, H-6´´´); 13C NMR (acetone-d6, 150 MHz,) δ: 93.7 (C-8), 98.7 (C-6),98.9 (C-6´´), 99.5 (C-8´´), 103.1 (C-3´´), 103.8 (C-10),104.6 (C-10´´), 110. 3 (C-3), 115.1 (C-3´), 115.1 (C-5´),115.5 (C-3´´´), 115.5 (C-5´´´), 122.3 (C-1´´´), 123. 9(C-1´), 128.1 (C-6´´´), 128.1 (C-2´´´), 130.0 (C-2´),130.0 (C-6´), 155.5(C-9´´), 158.0 (C-9), 159.9 (C-5´´),160. 9 (C-5), 162. 2 (C-4´), 162.3 (C-4´´´), 162.6 (C-7´´),164.2 (C-7), 164. 3 (C-2), 164.3 (C-2´´), 181.2 (C-4´´),182.4 (C-4)。以上波谱数据以文献对照[24],数据一致,故确定化合物7为3,8''-Biapigenin。
3 结果与讨论
短柱金丝桃在我国为民间用药,分布范围广。在国外民间也是被广泛使用的一种中草药,但对该植物的化学成分研究较少,在一定程度上限制了短柱金丝桃的进一步开发和应用。本次从短柱金丝桃植物中共分离得到7个化合物,其中,化合物2~7为首次从该植物中分离得到。有关研究报道表明化合物1和2具有较好的抗菌活性[25~26],而化合物1和6具有一定的抗氧化活性,尤其是化合物1,抗氧化活性较为显著[23,27]。由此可见,这些化合物抗菌、抗氧化方面的活性可能与短柱金丝桃的抗菌、抗氧化功效具有一定的相关性,这些化合物更深入的活性研究本课题组将在后续的工作中陆续展开。本文关于云南丽江老君山产地短柱金丝桃活性成分的研究结果进一步丰富了短柱金丝桃的化学成分,为日后更深入研究该植物提供了一定的物质基础,同时为推动该植物的资源开发和利用提供了重要依据。
[1] Vajs V, Vugdelija S, Trifunovic S, et al. Further Degradation Product of Hyperforin from Hypericum perforatum (St. John's Wort) [J]. Fitoterapia, 2003, 74: 439.
[2] Christian OE, Henry GE, Jacobs H, et al. Prenylated Benzophenone Derivatives from Clusia havetiodes var.stenocarpa [J], J Nat Prod, 2001, 64 (1): 23.
[3] 肖志勇,穆青.金丝桃属植物化学成分研究进展[J].天然产物研究与开发,2007,19:344.
[4] 中国科学院昆明植物研究所编著.云南植物志[M].云南:科学出版社,1006,21:143.
[5] Mukherjee PK, Saritha GS, Suresh B. Antibacterial spectrum of Hypericum hookerianum [J]. Fitoterapia, 2001, 72: 558.
[6] Dongre SH, Badami S, Natesan S, et al. Antitumor Activity of the Methanol Extract of Hypericum hookerianum Stem Against Ehrlich Ascites Carcinoma in Swiss Albino Mice [J].Journal of Pharmacological Sciences, 2007, 103: 354.
[7] Dongre SH, Badami S, Godavarthi A. Antitumor Activity of Hypericum hookerianum against DLA induced Tumor in Mice and its Possible Mechanism of Action [J]. Phytother, 2008, 22: 23.
[8] Sooriamuthu S, Varghese RJ, Bayyapureddy A, et al. Lightinduced production of antidepressant compounds in etiolated shoot cultures of Hypericum hookerianum Wight & Arn.(Hypericaceae) [J]. Plant Cell Tiss Organ Cult, 2013, 115: 169.
[9] Mukherjee PK, D. Ph, Suresh B, et al. The Evalution of Wound-Healing Potential of Hypericum hookerianum Leaf and Stem Extracts [J]. The Journal of Alternative and complementary medicine, 2000, 6(1): 61.
[10] 罗蕾,李祖强,马国义.短柱金丝桃中的黄酮及螺内酯成分[J].中草药, 2005, 36(1):17.
[11] Ye Y, Yang XW, Xu G. Unusual adamantine type polyprenylated acylphloroglucinols with an oxirane unit and their structural transformation from Hypericum kookerianum[J]. Tetrahedron, 2016, 72: 3057.
[12] Liao Y, Liu X, Yang J, et al. Hypersubones A and B, New Polycyclic Acylphloroglucinols with Intriguing Adamantane Type Cores from Hypericum subsessile.Org Lett,2015,17: 1172.
[13] Zhang JJ,Yang J, Liao Y, et al. Hyperuralones A and B, New Acylphloroglucinol Derivatives with Intricately Caged Cores from Hypericum uralum. Org Lett,2014,16: 4912.
[14] Yang XW, Ding YQ, Zhang JJ, et al. New Acylphoroglucinol Derivatives with Diverse Architectures from Hypericum henryi. Org Lett, 2014,16:2434.
[15] Yang XW,Deng X,Liu X,et al. Hypercohin A,a new polycylic polyprenylated acylphloroglucinol possessing an unusual bicycle [5.3.] hendecane core from Hypericum cohaerens†.Chem Commun, 2012, 48: 5998.
[16] Liu X,Yang XW,Chen CQ,et al. Bioactive Polyprenylated Acylphloroglucinol Derivatives from Hypericum cohaerens.J Nat Prod, 2013, 76: 1612.
[17] Zhang JJ,Yang XW,Ma JZ,et al. Cytotoxic polyprenylated acylphloroglucinol derivatives from Hypericum henryi.Tetrahedron,2015,71: 8315.
[18] 项光亚,杨瑜,阮金兰,等.金丝桃化学成分研究[J].同济医科大学学报,2001,30 (5):431.
[19] 颜朦朦,肖世基,陈放,等.黄海棠化学成分的研究[J].天然产物研究与开发,2014,26: 1785.
[20] Piao MS, Kim MR, Lee DG, et al. Antioxidative Constituents from Buddleia of fi cinalis [J]. Arch Pharm Res, 2003, 26, (6): 453.
[21] Tolonen A, Gyorgy Z, Jalonen J, et al. LC/MS/MS identification of glycosides produced by biotransformation of cinnamyl alcohol in Rhodiola rosea compact callus aggregates [J]. Biomed Chromatogr, 2004, 18: 550.
[22] 毕越峰,郑晓珂,冯卫生,等.卷柏中化学成分的分离与结构鉴定[J].药学学报,2004, 39 (1):41.
[23] Tisdale EJ, Slobodov I, Eheodorakis E. Biomimetic total synthesis of forbesione and desoxymorellin utilizing a tandem Claisen/Diels-Alder/Claisen rearrangement[J]. Org Biomol Chem, 2003, 1:4418.
[24] Berghofer R, Holzl J. Biflavonoids in Hypericum perforatum1; Part 1.Isolation of Ⅰ3, Ⅱ8-Biapigenin [J].Planta medica, 1987, 216.
[25] Salami M, Rahimmalek M, Ehtemam MH. Inhibitory effect of different fennel (Foeniculum vulgare) samples and their phenolic compounds on formation of advanced glycation products and comparison of antimicrobial and antioxidant activities [J]. Food Chem, 2016, 213: 196.
[26] Mashhadi SMA, Yunus U, Bhatti MH, et al. Synthesis,characterization, solubility and stability studies of hydrate cocrystal of antitubercular Isoniazid with antioxidant and antibacterial Protocatechuic acid [J]. J Mol Struct, 2016, 1117: 17.
[27] Achat S, Rakotomanomana N, Madani K, et al. Antioxidant activity of olive phenols and other dietary phenols in model gastric conditions: Scavenging of the free radical DPPH and inhibition of the haem-induced peroxidation of linoleic acid[J]. Food Chem, 2016, 213: 135.
(责任编辑:何瑶)
Polyphenol chemical constituents from Hypericum hookerianum Wight et Arm/
ZHANG Xiao-fei1,2, LI Xiao-nian2, YE Yansong2, JIANG Hong1, XU Gang2, CHEN Hu-lan1//(1. School of Pharmacy, Chengdu University of Traditional Chinese Medicine;Key Laboratory of Standardization for Chinese Herbal Medicine, Ministry of Education; National Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Chengdu 611137, Sichuan; 2. State Key Laboratory of Phytochemistry and Plant Resources in West China, Kunming institute of Botany, Academy of Sciences, Kunming 650201, Yunnan)
Objective:To research the polyphenol chemical constituents of H. hookerianum Wight et Arm.Method:Polyphenol compounds from this plant were separated and puri fi ed by silica gel column chromatogram, MCI, Sephades LH-20,preparative and semi- preparative HPLC. Then, their structures were elucidated on the basis of comprehensive spectroscopic data,such as1H NMR,13C NMR and MS.Result:Seven polyphenol compounds were obtained from H. hookerianum Wight et Arm.Their structures were identi fi ed as quercetin (1), protocatechuic acid (2), 2-propylbenzene-β-D-glucopyranoside (3), cinnamyl-O-β-D-glucopyranoside (4), caffeic acid (5), 3,4,5,7-tetrahydroxyxanthone (6), 3,8''-Biapigenin (7), respectively.Conclusion:Compounds 2-7 are reported from this plant for the fi rst time.
H. hookerianum Wight et Arm; chemical constituents; structure identi fi cation
R 284.1
A
1674-926X(2017)03-005-04
云南省自然科学基金总项目(2015FA032);四川省青年科技创新研究团队专项计划项目(2016TD0006)
1.成都中医药大学药学院,中药材标准化教育部重点实验室,四川省中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都611137;2.中国科学院昆明植物研究所植物化学与西部植物资源国家重点实验室,云南 昆明 650201
张小飞(1990-),女,在读硕士研究生;研究方向:药物分析
Tel:17053643717 Email:17053643717@163.com
1.许刚(1976-),男,医学博士,研究员;研究方向:金丝桃属植物的化学成分研究Tel:0871-65217971
Email: xugang008@mail.kib.ac.cn;
2.陈胡兰(1974-),女,医学博士,教授;研究方向:中药及其复方药效物质基础及质量控制
Tel:15828388570 Email:hlan999@126.com
2017-03-20

