基于超高效液相色谱的清开灵注射液多指标成分定量指纹图谱研究
胡晓妹,谢媛媛,刘明颖,王义明,梁琼麟,罗国安
基于超高效液相色谱的清开灵注射液多指标成分定量指纹图谱研究
胡晓妹,谢媛媛,刘明颖,王义明,梁琼麟,罗国安
本研究在清开灵注射液高效液相色谱指纹图谱分析方法基础上,基于超高效液相色谱,建立清开灵注射液多波长多指标成分定量指纹图谱分析方法。遵循Lc/dp(色谱柱柱长/填料粒径)相近以获取与HPLC相近的柱效和分离效果的原则选择色谱柱,并以分离度、理论塔板数和拖尾因子等系统适用性参数为指标,优化调整流速、柱温、进样体积、梯度时间、梯度陡度和采样频率等色谱条件,同时测定了清开灵注射液中尿苷、鸟苷、腺苷、色氨酸、绿原酸、栀子苷、京尼平龙胆二糖苷和咖啡酸等成分含量。实验结果表明,经方法转换建立的清开灵注射液超高效液相色谱分析方法可用于其化学成分的全息定量表征,方法快速、准确、灵敏度高。本研究为其他中药复杂物质体系HPLC和UHPLC分析条件相互转换提供理论和实验依据。
清开灵注射液;高效液相色谱;超高效液相色谱;指纹图谱;多指标成分定量
清开灵注射液是由《温病条辩》中传统名方安宫牛黄丸拆方改制而成的现代中药制剂,具有清热解毒,化痰通络,醒神开窍的功效。对急、慢性肝炎,乙型肝炎,上呼吸道感染,肺炎,高烧,以及脑卒中、脑血栓形成、脑出血等临床病症疗效确切,为国家基本药物、国家医保目录药品,被国家中医药管理局定为中医临床急诊科必备药,亦为国家卫生和计划生育委员会列入治疗人禽流感诊疗方案治疗用药[1]。清开灵注射液由金银花、板蓝根、栀子、水牛角、珍珠母、胆酸、猪去氧胆酸和黄芩苷等药材或提取物组成,是目前市售组方最为复杂的中药注射剂。自1999年起本课题组在清开灵注射液化学物质基础表征方面进行了大量研究,采用高效液相色谱-蒸发光散射技术、高效液相色谱-二极管阵列检测及高效液相色谱-二极管阵列检测-蒸发光散射联用技术等建立了清开灵注射液多指标成分定量指纹图谱,并利用液相-质谱联用在线分析鉴定结合植物化学分离等手段对清开灵注射液中尽可能多的化学成分,通过多种分析表征方法,共鉴定了清开灵注射液中40多种有机化合物的结构,基本阐明了清开灵注射液的化学组成[2~7]。
超高效液相色谱(UHPLC:Ultra High Performance Liquid Chromatography)是使用超高效填料(例如亚二微米填料)的技术,是近年发展最迅速的液相色谱(HPLC:High Performance Liquid Chromatography)领域之一。UHPLC越来越多地在中药分析领域得到了广泛应用,其更高的分离度、更快的分析速度为中药分析,特别是为成分极其复杂的药材及中成药分析带来了更好的解决方案。本研究以清开灵注射液为研究对象,将其HPLC指纹图谱分析方法转换为UHPLC指纹图谱分析方法,同时测定清开灵注射液中8种主要代表性化合物——尿苷、腺苷、鸟苷、绿原酸、栀子苷、京尼平龙胆二糖苷、咖啡酸和色氨酸的含量,探讨中药复杂物质体系HPLC指纹图谱分析方法与UHPLC分析条件相互转换时需遵循的原则和规律,以及需重点关注和调整的参数,以期为其他中药复杂物质体系UHPLC分析条件的建立提供参考。
1 仪器与试药
1.1 仪器
液相色谱系统(HPLC系统):Agilent1200高效液相色谱仪:包括在线真空脱气机(G1322A)、低压二元梯度泵(G 1 3 1 2 A)、自动进样器(G1329A)、柱温箱(G1316A)、二极管阵列检测器(G1315D)和Agilent化学工作站(美国Agilent);超高效液相系统:Agilent1290高效液相色谱仪(UHPLC系统),包括高压二元梯度泵(G4220A)、自动进样器(G4226A)、柱温箱(G1316C)、二极管阵列检测器(G4212A)和安捷伦OpenLAB CDS ChemStation工作站;色谱柱:Agilent Zorbax StableBond-C18色谱分析柱(4.6×250 mm, 5μm);Agilent Zorbax StableBond-C18 RRHD色谱分析柱(2.1×100 mm, 1.8μm);Milli-Q Synthesis超纯水纯化系统(美国密理博公司);XS105 型电子天平(瑞士梅特勒-托利多公司)。
1.2 对照品
尿苷(含量测定用,纯度大于98%,批号:887-200202)、腺苷(含量测定用,纯度大于98%,批号:110879-200202)、绿原酸(含量测定用,纯度大于98%,批号:110753-200413)、栀子苷(含量测定用,纯度大于98%,批号:110749-200714)购于中国食品药品检定研究院;(R,S)-告依春(含量测定用,纯度大于98%,批号:1072-93-1)、京尼平龙胆二糖苷(含量测定用,纯度大于98%,批号:110427)和咖啡酸(含量测定用,纯度大于98%,批号:110807)购于四川维克奇生物科技有限公司;鸟苷(含量测定用,纯度大于98%,批号:0193);色氨酸(含量测定用,纯度大于98%,批号:091103001)购于日本和光纯药株式会社。
1.3 试剂
乙腈和甲醇均为色谱纯,购自德国Merck公司,甲酸(99%)购自美国J.T. Baker公司;其他试剂均为分析纯,购自国药化学试剂公司;超纯水(18Ω)由Milli-Q系统制备。
1.4 样品
清开灵注射液为来源于3个不同生产企业的市售产品,共计45批,批号见表1。
2 方法
2.1 色谱条件
HPLC指纹图谱分析条件 以十八烷基硅烷键合硅胶为填充剂;色谱柱:Agilent Zorbax StableBond-C18色谱柱(250 × 4.6 mm,5 μm);流动相A相为含0.1%甲酸的水溶液,B相为乙腈;梯度洗脱(0~42 min, 1-12%B; 42~65min, 12-19%; 65~75min,19-100B%);流速为0.8 mL.min-1;柱温为25 ℃;进样量为10 μL,HPLC色谱指纹图谱见图1-A所示。
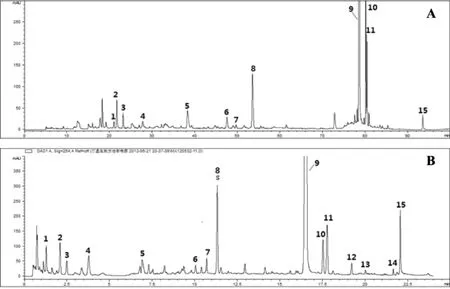
图 1 254nm下清开灵注射液HPLC –UV指纹图谱(A)和UHPLC-UV指纹图谱(B).
UHPLC指纹图谱分析条件 由HPLC分析方法向UHPLC转换过程中,遵循Lc/dp(色谱柱柱长/填料粒径)相近以获取与HPLC相近的柱效和分离效果的原则,选取了粒径为1.8μm相同类型填料的色谱柱,规格为2. 1×100mm(Lc/dp=55.6)。并在参照Agilent Method Translator and Cost Savings Calculator软件和文献[8]中相关公式计算的基础上,对流速、进样体积、梯度时间和梯度坡度等进行适当优化。色谱柱:Agilent Zorbax StableBond-C18色谱柱(2.1×100 mm,1.8μm);流动相:A 0. 1%甲酸-水,B 乙腈;梯度洗脱(0~10. 5min, 1-12%B; 10. 5~16. 5min, 12-19%; 16.5~20 min, 19-60B%);流速:0.4 mL.min-1;柱温:25℃;检测波长:254 nm,采样频率:80 Hz,进样量为0.5 μl,HPLC色谱指纹图谱见图1-B所示。
2.2 对照品溶液制备方法
取尿苷、腺苷、鸟苷、绿原酸、栀子苷、京尼平龙胆二糖苷、咖啡酸和色氨酸对照品适量,精密称定,置棕色量瓶中,加甲醇制成每1mL 含0. 176 4 mg鸟苷,0. 290 4 mg腺苷,0. 300 1 mg尿苷,0. 080 2 mg绿原酸,1. 279 6 mg栀子苷,0. 291 1 mg京尼平龙胆二糖苷,0. 095 68 mg咖啡酸和0. 756 mg色氨酸的溶液,即得。
2.3 供试品溶液制备方法
清开灵注射液用0.45μm滤膜过滤后,直接进样。
2.4 测定方法
精密吸取各对照品溶液和供试品溶液进样分析,获取清开灵注射液指纹图谱,以栀子苷的色谱峰为标准峰,其余峰的保留时间和峰面积与之比值分别为相对保留时间和相对峰面积;并以外标法计算尿苷、腺苷、鸟苷、绿原酸、栀子苷、京尼平龙胆二糖苷、咖啡酸和色氨酸的含量。
3 结果
3.1 UHPLC指纹图谱分析
中药指纹图谱分析方法的精密度、重复性及稳定性的建立方法与常规分析测定相似。但在中药指纹图谱的应用中,这三者认定分为整体和部分两个方面,前者包括测定图谱之间的整体相似性考察;后者为指标成分或共有峰的相对保留时间与相对积分面积的考察。本研究分析了37批清开灵注射液,确定其中12个峰为清开灵注射液指纹图谱共有峰,占总峰面积的95%以上。通过对指纹图谱精密度、重复性、稳定性考察,证明此方法稳定、可信,可作为清开灵注射液指纹图谱分析方法。
3.1.1 精密度试验 主要考察仪器的精密度。取MX120532批号的清开灵注射液供试品,连续进样6次,记录各共有色谱峰的保留时间和积分面积,以栀子苷峰(11号峰)的保留时间与积分面积为参照,换算出各共有峰的相对保留时间和相对积分面积,以考察色谱峰的相对保留时间、相对峰面积比值的一致性。各共有峰的相对保留时间的 RSD 为0.02% ~ 0.62%,相对峰面积的 RSD 值为0.25% ~3.92%,相对保留时间和相对峰面积RSD值均小于5.0%,表明方法采用的UHPLC仪器及整体系统精密度良好,分析结果稳定、可信。
3.1.2 重现性试验 主要考察实验方法的重现性。取MX120532批号的清开灵注射液供试品6批,记录各共有色谱峰的保留时间和峰面积,以栀子苷峰(11号峰)的保留时间与峰面积为参照,换算出各共有峰的相对保留时间和相对峰面积,以考察色谱峰的相对保留时间、峰面积比值的一致性。各共有峰的相对保留时间的 RSD 为 0. 02% ~ 0. 52%,相对峰面积的 RSD 值为 0. 51% ~ 4. 92%,相对保留时间和相对峰面积RSD值均小于5. 0%,表明方法重现性良好,利于推广。
3.1.3 稳定性试验 主要考察供试品溶液的稳定性。取MX120532批号的清开灵注射液供试品,分别在8小时之内不同时间连续进样检测,记录各共有色谱峰的保留时间和积分面积,以栀子苷峰(11号峰)的保留时间与峰面积为参照,换算出各共有峰的相对保留时间和相对峰面积,考察色谱峰的相对保留时间、峰面积比值的一致性。各共有峰的相对保留时间的 RSD 为 0. 03% ~ 0. 65%,相对峰面积的RSD 值为 0. 24% ~ 3. 54%,相对保留时间和相对峰面积RSD值均小于5. 0%,结果表明,经制备的样品在常温实验条件下稳定性较好,在8h时间能保证实验结果的科学可靠。
3.1.4 UHPLC指纹图谱相似度评价 典型指纹图谱的生成是通过一系列样品的指纹图谱研究,从中选择一个具有典型意义或有代表性的指纹图谱作为对照谱,或是把指纹图谱的共有峰的相对保留值作为对照,还可以采用数据(平均矢量或中位数矢量)综合所有样品信息的方法模拟生成的对照指纹图谱。清开灵注射液的对照指纹图谱采用多样本中位数矢量综合作为共有模式矢量,避免了多样本中超常样本的不良影响,使实验结果更加稳健可行。采用色谱图相似度(similarity)作为指纹图谱评价指标。数据生成采用药典委指定的《中药色谱指纹图谱相似度评价系统》。45批不同批次清开灵注射液提取液以药典委指纹图谱软件为评价工具采用中位数的原则拟合生成对照指纹图谱。利用上述指纹图谱测定方法,测定了37批次清开灵注射液,用《中药色谱指纹图谱相似度评价系统》生成的对照指纹图谱作为参照,计算每个样品指纹图谱的相似度,结果如表1所示。
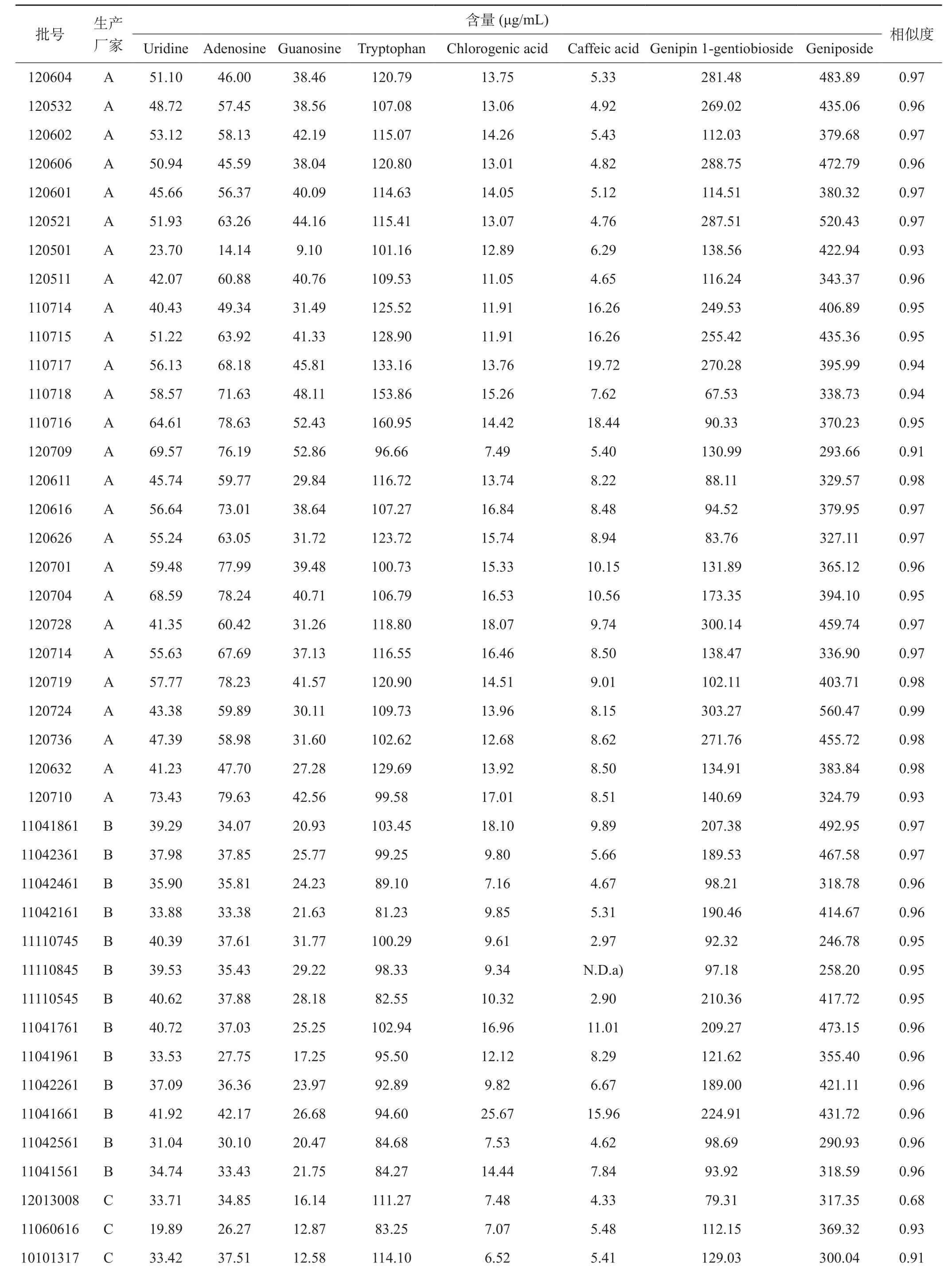
表1 45批清开灵注射液的相似度及其中8个活性成分的含量

N.D. no detected.
3.2 清开灵注射液多波长多指标成分含量测定
3.2.1 检测波长的选择 在紫外光谱200-400 nm 下扫描最大吸收波长(λmax)。其中尿苷和腺苷的最大吸收波长均为260 nm,鸟苷的最大吸收波长为254nm,绿原酸和咖啡酸的最大吸收波长为330 nm,色胺酸的最大吸收波长为280 nm,栀子苷和京尼平龙胆二糖苷的最大吸收波长为240 nm。根据中药指纹图谱“信息最大化原则”,选择254 nm为指纹图谱的测定波长;同时,根据待测化合物不同的光谱特性,建立了在4个不同紫外检测波长下,同时定量测定四类组分,8个成分的多波长多指标成分定量分析方法,选取240 nm作为栀子苷、京尼平龙胆二糖苷含量测定的检测波长,254 nm作为尿苷、腺苷和鸟苷等核苷类成分测定的检测波长,280 nm作为色氨酸含量测定的检测波长,330 nm作为绿原酸和咖啡酸的测定波长。不同波长下的多指标成分定量指纹图谱如图2所示。
3.2.2 线性关系考察 精密吸取各浓度混合对照品溶液,按清开灵注射液UHPLC含量测定色谱条件进样分析。以峰面积(Y)对对照品质量浓度(X,μg.mL-1)进行线性回归,各指标成分的回归方程、相关系数、线性范围见表1。采用信噪比法测定8个成分的检测限(以信噪比为3∶1)及定量限(信噪比为10∶1),将鸟苷、尿苷、腺苷、色氨酸、绿原酸、咖啡酸、京尼平龙胆二糖苷和栀子苷的对照品溶液分别稀释不同倍数后,测定检测限及定量限,结果见表2所示。
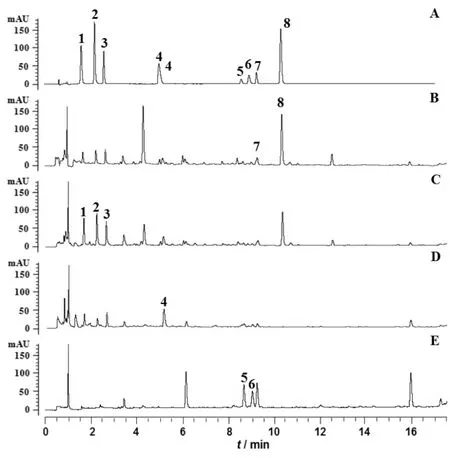
图2 4个波长下混合对照品溶液和清开灵注射液的UHPLC色谱图.
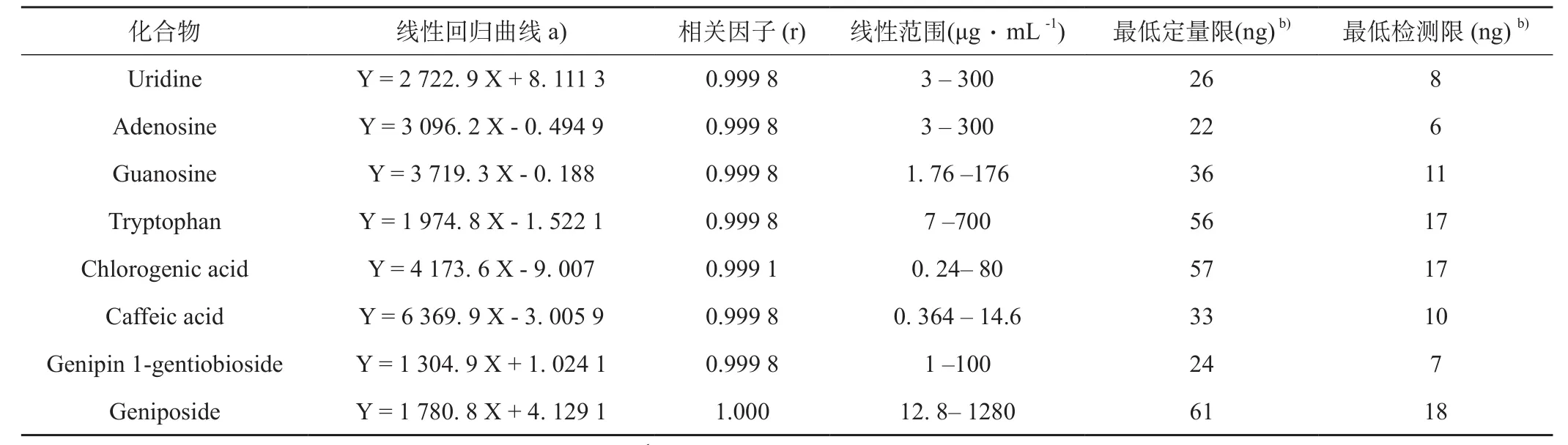
表2 线性回归曲线,线性范围,最低定量限和最低检测限
3.2.3 精密度实验 精密吸取清开灵注射液样品供试液(MX120532)0.5 μL,连续进样测定6次,计算鸟苷、尿苷、腺苷、色氨酸、绿原酸、咖啡酸、京尼平龙胆二糖苷和栀子苷峰面积的RSD分别为1. 62%、1. 06%、1. 30%、1. 64%、1. 91%、2. 72%、1. 93%和1. 21%,结果表明仪器精密度良好。
3.2.4 稳定性实验 精密吸取室温下放置的同一清开灵注射液样品供试液(MX120532)0.5 μL,分别于制备后0,1,2,4,6和8 h进样分析,结果样品中鸟苷、尿苷、腺苷、色氨酸、绿原酸、咖啡酸、京尼平龙胆二糖苷和栀子苷峰面积的RSD分别为1. 02%、1. 57%、2. 36%、2. 08%、2. 19%、2. 90%、2. 35%和2. 23%,结果表明供试品溶液在8 h内稳定。
3.2.5 重复性试验 取清开灵注射液(MX120532),平行制备6份供试品溶液,按清开灵注射液UHPLC含量测定色谱条件进样分析,每份测定3次,并计算尿苷、腺苷、绿原酸、栀子苷、京尼平龙胆二糖苷、咖啡酸和色氨酸等8种指标成分的含量,RSD均小于3. 5%,表明该UHPLC含量测定方法重现性良好。
3.2.6 加样回收率试验 取已知含量的清开灵注射液(MX120532),共6份,分别精密加入混合对照品溶液适量,按上述供试品溶液制备方法项下制备供试品溶液,按测定法进样分析,尿苷、鸟苷、腺苷、色氨酸、绿原酸、咖啡酸、京尼平龙胆二糖苷和栀子苷的平均回收率(n=6)分别为99. 6%、102.5%、99. 4%、99. 0%、98. 7%、99. 7%、103. 4%和99. 5%,RSD均小于4%,表明该UHPLC含量测定方法准确度良好。
3.2.7 含量测定 取不同厂家、不同批号的清开灵注射液,清开灵注射液UHPLC含量测定色谱条件进样分析,外标一点法计算尿苷、腺苷、鸟苷、绿原酸、栀子苷、京尼平龙胆二糖苷、咖啡酸和色氨酸等8种指标成分含量,含量测定结果见表1。
4 讨论
UHPLC所遵循的原理与HPLC相同,因此所有HPLC适用的理论及经验公式在UHPLC上都适用。比如:柱效的计算。另外,如果想很好、很顺畅地把一个传统的HPLC方法向UHPLC方法转移,色谱柱的选择是个关键因素。亚二微米的UHPLC色谱柱填料的化学性质一定要与原来的HPLC填料一致。从使用者角度,必须选择同一品牌、同一化学性质的色谱柱来确保分离选择性的一致,保证结果最小的可变性。为估算不同颗粒度填料的色谱柱的柱效,可根据由计算柱效的公式近似而来的概念,即:在柱长除以颗粒度(L/dp)的数值相当时,其两根色谱柱的柱效也相当。所以,我们假定L/dp ≈k•N(k为常数)。如果打算提高分离度,必须使L/dp值比原来更高。想要保持分离度相当,则需要保持L/dp比值不变。为此,在方法转换过程中,我们选择了与HPLC分析相同的色谱柱,即均为Agilent Zorbax StableBond-C18色谱柱,并根据Lc/dp(色谱柱柱长/填料粒径)为常数的原则,确定色谱柱规格为2.1×100mm(Lc/dp=55.6)。
使用小体积色谱柱时,数据采集速率是“人为”峰展宽的常见原因。对于快速洗脱的色谱峰,要确保在色谱峰上收集到足够的数据点,数据系统才能准确测定出峰宽、峰面积和保留时间。如果得到的数据点太少(如低数据采集速率),色谱峰就会显得比其实际要宽。而因为常规高效液相色谱柱体积较大,数据采集速率对峰宽的影响可忽略不计。为此,本研究在新的梯度条件下考察了不同数据采集速率(160Hz,80Hz,40Hz,20Hz,10Hz和5Hz)对分离性能的影响。结果表明,除鸟苷外,清开灵注射液中其他主要成分的理论塔板数随数据采集速率的不同,变化不大,而在数据采集速率为40Hz时,鸟苷的理论塔板数最大;而不同数据采集速率对各个主要成分的拖尾因子影响较大,各成分在数据采集速率为40Hz时,各成分拖尾因子最大;因此,综合考虑理论塔板数(柱效)和拖尾因子(色谱峰峰型)等因素,本研究采样频率设定为80Hz。
以清开灵注射液中尿苷、腺苷、鸟苷、绿原酸、栀子苷、京尼平龙胆二糖苷、咖啡酸和色氨酸等8个成分为指标对方法转换前后色谱峰参数进行了比较研究。将HPLC方法转换为UHPLC方法后,分析时间由原来的80分钟缩短到UHPLC分析的20分钟,且分离度优于HPLC分析方法;以栀子苷为指标成分,对HPLC和UHPLC的峰容量进行比较,峰容量按如下公式计算:P=1+tG/W(P:峰容量,tG:梯度变化时间,W:峰宽)。结果PHPLC=128,PUHPLC=108;可见方法转换前后柱效与拖尾因子并未见明显改善,推测与色谱柱的选择有关:本研究中HPLC分析所用色谱柱为Agilent Zorbax StableBond-C18 (4.6×250mm, 5μm, Lc/dp=50),而进行方法转换时,UHPLC所用色谱柱为粒径为1.8μm相同类型填料的色谱柱,其规格为2.1×100mm (Lc/dp=55.6),转换前后所用色谱柱的Lc/dp相近,柱效并未提高。
本研究测定了来自不同厂家、不同批号的45批清开灵注射液样品中尿苷、腺苷、鸟苷、绿原酸、栀子苷、京尼平龙胆二糖苷、咖啡酸和色氨酸等8个指标成分的含量,他们分别来自板蓝根、金银花和栀子等三味植物来源的药材。本研究采用质量均匀化参数P值表征不同厂家、不同批次样品质量波动情况。
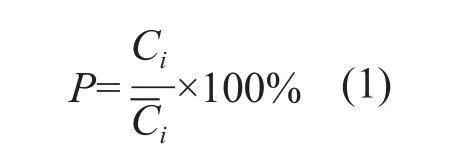
Ci代表供试样品中被测成分的含量,而Ci代表45批供试样品中被测成分平均含量。图3箱式图所示为45批被测样品中8种指标成分及相似度P值变化浮动范围。
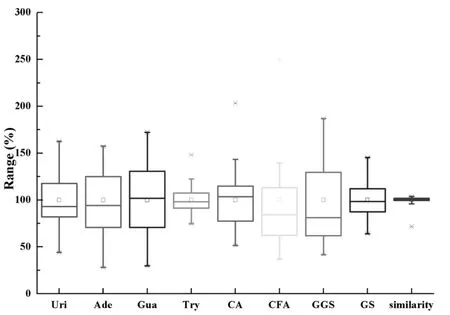
图3 45批清开灵注射液相似度及8种活性成分含量箱线图
从指纹图谱的相似度来看,除了来源于C厂的12013008批样品外,其余批次样品指纹图谱相似度在0. 905~0. 985之间,相似度RSD(%)为4. 73%,因此从整体性来看不同厂家清开灵样品化学物质组成较一致。国家药典委员会公示的清开灵注射液质量标准中,除规定了黄芩苷、胆酸和猪去氧胆酸等3个以纯度大于90%提取物为原料的指标成分外,仅规定了来源于栀子的栀子苷的含量应不少于0.1 mg/mL。由此可见,本研究中45批清开灵注射液均符合公示标准的要求。然而,尿苷等8个指标成分的含量在不同批次样品间变化较大,各指标成分含量RSD(%)在15. 58%~51. 00%之间,上述结果提示不同厂家在原料产地、生产工艺上可能会存在差异。众所周知,化学成分是中药注射液发挥药效的物质基础,化学成分含量的高低无疑会影响其药效及安全性,而指标成分的选择也将影响质量控制的效果。本研究通过多波长多指标成分定量指纹图谱,测定了来源于栀子、板蓝根和金银花等3个植物药材中8个指标成分的含量,为实现清开灵注射液质量全面控制奠定了基础。
[1] Luo GA, Liang QL, Wang YM. Traditional Chinese Medicine Fingerprint- Quality evaluation, Quality control and R&D of new drugs [S]. Beijing: Chemical Industry Press, 2009.
[2] Luo GA, Liang QL, Wang YM, Liu QF. Systems Biology of Traditional Chinese Medicine [S]. Beijing: Science Press,2010.
[3] Yan SK, Luo GA, Wang YM, Cheng YY. Simultaneous determination of nine components in Qingkailing injection by HPLC/ELSD/DAD and its application to the quality control[J].J. Pharm. Biomed. Anal., 2006, 40 (4): 889-895.
[4] Zhang HY, Hu P, Luo GA, Liang QL, Wang YL, Yan SK,Wang YM, Screening and identification of multi-component in Qingkailing injection using combination of liquid chromatography/time-of-flight mass spectrometry and liquid chromatography/ion trap mass spectrometry[J]. Anal. Chim.Acta. 2006, 577: 190-200.
[5] 曹进,徐燕,张永知,王义明,罗国安.清开灵注射液HPLC/ELSD指纹图谱建立及质量相关性研究[J].分析化学,2004,32(4):469-473.
[6] 严诗楷,辛文峰,罗国安,王义明,程翼宇.应用高效液相色谱-二极管阵列检测器-蒸发光散射检测器联用技术同时测定清开灵注射液中的五类有效成分[J].色谱, 2005, 23(5):482-486.
[7] 曹进,徐燕,王义明,罗国安.多波长高效液相色谱法测定清开灵注射液中3种有效成分[J].药物分析杂志, 2004, 24(1):8-11.
[8] Guillarme D, Veuthey J–L. Guidelines for the use of UHPLC Instruments. www.perkinelmer.com.
(责任编辑:蒋淼)
Multi-component quanti fi cation fi ngerprinting method of Qingkailing injection by UHPLC/
HU Xiao-mei, XIE Yuanyuan, LIU Ming-ying, WANG Yi-ming, LIANG Qiong-lin, LUO Guo-an//(Department of Chemistry, Tsinghua University, Beijing 100084, China)
This study was to establish a multi-component quanti fi cation fi ngerprinting method of Qingkailing injection by UHPLC on the basis of the published HPLC method. The selection of UHPLC column followed the principle that the ratio between Lc (length of the column) and dp (partical size) was a constant. And the fl ow rate, oven, injection volume, elution gradient and data acquisition frequency were optimized to get good resolution and theoretical plate number. And the contents of 8 main components including uridine, vernine, adenosine, tryptophan, chlorogenic acid, geniposide, genipin 1-gentiobioside and caffeci acid in Qingkailing injection were detected by UHPLC at different wavelength. The results indicated that the established fingerprint chromatography by UHPLC could be used to quantificationally represent the holistic chemical information of Qingkailing Injection. And this study provides theoretical and experimental basis for the analysis method transformation between HPLC and UHPLC of other Traditional Chinese medicine complex material system.
Qingkailing injection; HPLC; UHPLC; fi ngerprint; multi-component quanti fi cation
R 284.1
A
1674-926X(2016)06-008-07
国家“重大新药创制”科技重大专项(2014ZX09201-022-005)
清华大学化学系,北京 100084
胡晓妹(1989-),女,硕士研究生,主要从事中药质量控制方面的研究
Tel:(010) 62772265 Email:423869972@qq.com
谢媛媛(1980-),女,博士,高级工程师,主要从事中药质量控制方面的研究
Tel:(010) 62772265 Email:yuanyuan8078@gmail.com
2016-02-10

