生长分化因子(BMP11)重组质粒在工程菌株中的稳定性研究
,, ,2,,,,*
(1. 广西大学轻工与食品工程学院,广西南宁 530004;2.凭祥出入境检验检疫局,广西凭祥 532600)
生长分化因子(BMP11)重组质粒在工程菌株中的稳定性研究
郝丹1,尤倩倩1,郝伟1,2,梁晓琳1,袁靖琳1,李全阳1,*
(1. 广西大学轻工与食品工程学院,广西南宁 530004;2.凭祥出入境检验检疫局,广西凭祥 532600)
为了研究重组质粒pET28a-BMP11在基因工程菌E.coliBL21(DE3)中的遗传稳定性,将重组菌E.coliBL21(DE3)/pET28a-BMP11液体转接传至100代,每隔20代取样观察菌落形态,检测菌体生长量、质粒保有率和目的蛋白表达水平,并对原代、第20代、第60代和第100代工程菌进行了XhoⅠ和NdeⅠ双酶切验证和目的基因测序。结果显示:各代菌生长量和菌体菌落形态与原代菌株无显著差异。在不含卡那霉素的条件下,传代进行到40代时,质粒保有率和蛋白质表达水平显著下降,第100代菌的质粒保有率仅为56%。在含有卡那霉素的条件下,第80代菌仍有较高的蛋白质表达水平,第100代菌酶切图谱和目的基因序列仍与原代保持一致,质粒保有率高达96%,说明利用重组大肠杆菌工业化生产BMP11是可行的,并且在培养基中添加卡那霉素能够让重组质粒在传代过程中保持稳定,为BMP11的大规模工业化生产和新型抗衰老食品的研发奠定了理论基础。
生长分化因子11,重组质粒,工程菌株,稳定性
在老龄化不断发展的今天,具有提高老年人生活质量甚至是抗衰老作用效果的食品越发重要,生物活性肽具有成分明确、用量小、功能活性显著等优点,在抗衰老食品的开发上应该具有良好的前景[1-2],为此我们开展了有关研究。
生长分化因子11,又称骨形态发生蛋白11(以下简称:BMP11),是转化生长因子β(TGF-β)超家族的一种分泌性蛋白。TGF-β超家族分子广泛存在于从线虫到哺乳类动物之中,通过调节细胞增殖、分化、黏附、移行及凋亡,诱导软骨形成、分化,在生物整体及各种器官的发育、损伤后修复中起着重要作用,也参与多种病理过程[3-5]。作为TGF-β超家族成员,BMP11在胚胎发育中也发挥着举足轻重的作用[6]。目前研究发现,BMP11能够逆转心肌肥大、抵抗骨骼肌衰老、改善大脑的脉管系统和神经发生能力,使大脑年轻化[7-9],因此有人认为它具有“返老还童” 的功能[10],作为一个有希望的抗衰老因子,值得深入研究,有望用于开发新型抗衰老食品。
一般情况下,工程菌中的重组质粒具有不稳定性,必须进行稳定性验证。质粒不稳定性分为结构不稳定和分裂不稳定。结构不稳定指外源基因从质粒上丢失或碱基重排、缺失所致工程菌性能的改变,可使目的基因功能丢失,但对质粒主要遗传标记丢失影响较小。分裂不稳定指工程菌分裂时出现一定比例不含质粒的子代菌的现象,是质粒丢失的主要原因[11]。因此,质粒的不稳定性会导致重组菌在培养过程中质粒发生突变或丢失,使重组菌无法产出目的产物[12]。包含外源基因的质粒载体导入工程菌中常常会带来一系列的生理负担,影响质粒的稳定性[13]。工程菌的遗传稳定性是保证外源蛋白高效表达的必备条件,对于大规模发酵和产物制备至关重要,同时也是食品药品监督管理局对基因工程产物评审的一个重要内容[14]。因此,确定工程菌株的遗传稳定性和有限传代次数在生产实践中意义重大。本实验室以BMP11的DNA序列为模板,构建了重组BMP11质粒pET28a-BMP11,转化大肠杆菌BL21(DE3),成功构建了表达BMP11的工程菌株E.coliBL21(DE3)/pET28a-BMP11,并进行了系统研究。为了核查该工程菌在生产中的稳定性,本文对该菌株进行了传代培养,并对不同代次菌株的生长特性,遗传和表达稳定性进行了比较分析,为该工程菌下一步投入生产研发抗衰老食品进行基础性的前期工作准备。
1 材料与方法
1.1材料与仪器
大肠杆菌原始宿主菌、表达载体pET28a 诺禾致源科技股份有限公司;重组工程菌E.coliBL21(DE3)/pET28a-BMP11 本实验室构建保存;限制性内切酶XhoⅠ、NdeⅠ TaKaRa公司;快速小量质粒提取试剂盒 天根公司;卡那霉素 Amresco公司;蛋白胨、酵母粉 Oxoid公司;其它试剂均为国产分析纯。LB液体培养基(1 L):胰蛋白胨10 g,酵母浸粉5 g,氯化钠10 g,pH调至7.0,高压蒸汽灭菌;固体培养基另加琼脂粉15 g;含卡那霉素(Kan+)的LB培养基:在LB培养基中添加30 μg/mL卡那霉素。
LCT-1DC-H超净台 济南绿之洁科技有限公司;DH5000B生化培养箱 天津泰斯特仪器有限公司;FE20 pH计 梅特勒-托利多国际贸易有限公司;UV5200紫外分光光度计 上海元析仪器有限公司;DSX-280B蒸汽灭菌锅 上海申安医疗器械有限公司;ZWYR-240 恒温培养振荡器 上海智城分析仪器制造有限公司。
1.2实验方法
1.2.1 工程菌生长曲线测定 将冻存-80 ℃冰箱中的重组工程菌菌种划线接种于含卡那霉素的LB固体平板上,37 ℃培养16~18 h后,挑取工程菌单菌落接种于含卡那霉素的LB液体培养基中,37 ℃ 200 r/min振荡培养至OD600值为0.6左右,再按1%的接种量接种于400 mL LB液体培养基中,37 ℃ 200 r/min 振荡培养,每隔1 h测一次OD600值,以时间为横坐标,OD600值为纵坐标,绘制生长曲线。
1.2.2 菌种传代方法 将冻存的重组工程菌菌种划线接种于含卡那霉素的LB平板上,37 ℃培养16~18 h后,挑取单菌落接种于含卡那霉素的液体培养基中,37 ℃ 200 r/min振荡培养过夜,第2 d按1%的接种量分别接种到含卡那霉素和不含卡那霉素的LB液体培养基中,37 ℃连续振摇培养,每隔6 h转管,每传一次记一代,间隔一定时间取样,取得不同代数的菌液。
1.2.3 质粒稳定性检测 采用复制平板法,分别取第0、20、40、60、80、100代菌液。稀释10-2~10-3倍,取100 μL涂布于不含卡那霉素的LB固体培养基中,37 ℃过夜培养。分别挑取100个单菌落到含卡那霉素的LB平板上,37 ℃过夜培养,统计菌落数,计算工程菌在有无卡那霉素选择压力下传代时质粒丢失率。
质粒稳定性(%)=含卡那霉素LB平板上的菌落数/100×100
1.2.4 菌落形态观察和生长量检测 上述几代菌,在涂布平板的同时观察菌落形态变化。同时挑菌落按革兰氏染色方法,镜检观察。分别接种单菌落到含和不含卡那霉素的LB液体培养基中,37 ℃ 200 r/min 振摇培养12 h,测定OD600,确定工程菌生长量的变化。
1.2.5 质粒双酶切图谱鉴定 在传代过程中,分别取第0、20、60和100代含抗生素和不含抗生素(分别记作Kna+-0、Kna--0、Kna+-20、Kna--20、Kna+-60、Kna--60、Kna+-100、Kna--100,下同)的两种菌液,用质粒提取试剂盒提取质粒,并用XhoⅠ和NdeⅠ进行双酶切,1.5%琼脂糖电泳鉴定酶切片段,并与已验证成功表达的原代菌重组质粒的双酶切图谱比较。
1.2.6 插入片段DNA序列测定 取第0,20,60,100代菌株送交华大基因公司进行目的基因测序。
1.2.7 产物鉴定 分别取原始宿主菌和第0、20、40、60、80、100代菌液各0.5 mL,10000 r/min离心1 min,弃上清。菌体重悬于250 μL无菌水中,充分混匀,从中取40 μL加入10 μL 5倍的电泳上样缓冲液,100 ℃水煮10 min使菌体充分裂解,6000 r/min离心3 min。取10 μL上清液进行SDS-PAGE电泳(浓缩胶浓度12%,分离胶浓度为5%),检测蛋白表达。
1.2.8 数据处理 采用Origin 8.5软件作图,SPSS 19.0软件进行统计学分析。
2 结果与分析
2.1基因工程菌生长特性
由图1可以看出,培养到6 h时,菌种处于生长对数期的中段,此时菌种质量及生理性状较好,生长较快,因此在后续的研究中,选择6 h为菌种的传代时间。
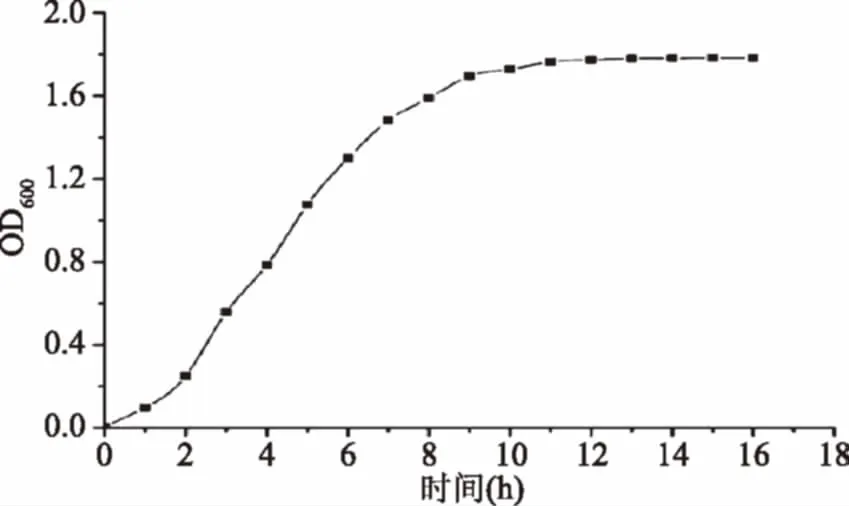
图1 工程菌生长曲线Fig.1 Growth curve of the engineering strain
2.2质粒稳定性
由表1可以看出,随着培养代数的增加,质粒稳定性降低。在无筛选压力下,传到40代时,质粒稳定性已经降低了16%,传到100代,重组菌的质粒保有率仅为56%,降低了44%。表明重组质粒pET28a-BMP11在无卡那霉素条件下表现出一定的分裂不稳定性。这与王宏华等[15]报道的表达鸡γ-干扰素基因的第100代重组大肠杆菌69%的质粒保有率相比,稳定性稍差。其原因可能是由于工程菌的质粒稳定性与所带外源基因的性质、外源基因的表达水平等多种因素有关,不同的质粒各有其特性[16]。当培养基中添加卡那霉素时,第100代菌的质粒保有率仍能够保持在96%的水平上,该结果明显高于陈悦等[17]报道研究了产乙酰鸟氨酸脱乙酰基酶基因工程菌的遗传稳定性,研究发现该基因工程菌在抗生素浓度为100 μg/mL的条件下生长时,质粒稳定性仅为86.42%。证明抗生素正向选择压力可以有效保持质粒的分裂稳定性,从而维持重组菌的重组基因稳定性。
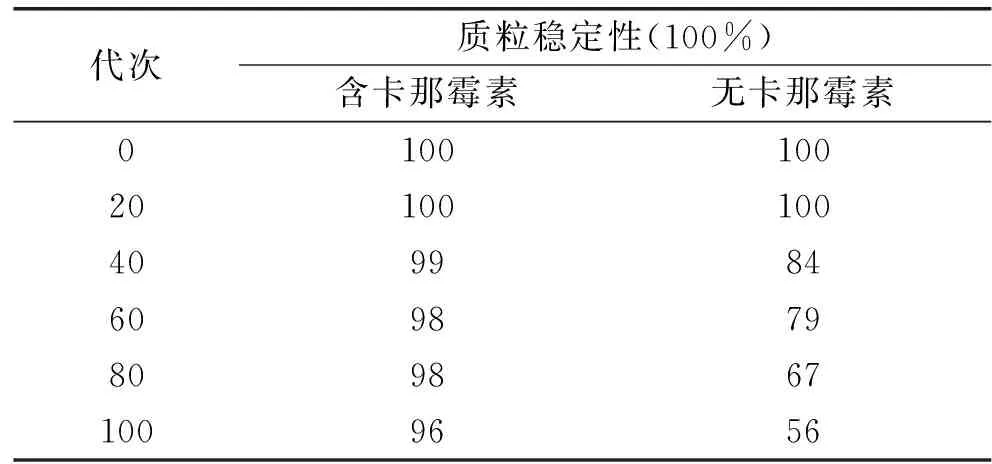
表1 工程菌传代时的质粒稳定性Table 1 The plasmids stability of theengineering strain during subculture
2.3菌落形态和生长观察
原代和第100代工程菌的菌落形态见图2。

图2 原代和100代工程菌菌落形态Fig.2 Colonial morphology of the recombinant bacterialstrain of origin strain and 100th generation strain
各代工程菌菌落直径为1~1.5 mm的圆形隆起,外表湿润光滑,白色,为典型的大肠杆菌菌落,各代之间无显著区别。对各代工程菌进行革兰氏染色观察,油镜下均为革兰阴性,两端呈钝圆的短杆状,与原代工程菌形态相同,无杂菌。
各代菌株在两种培养基中培养12 h的生长情况见表2。
表2 工程菌在不同传代次数时的生长量Table 2 The biomass of the engineering strainduring different generations(±s,n=3)
注:*:与同代含卡那霉素组相比,p<0.05。
由表2可知,含卡那霉素和不含卡那霉素两种条件下的第0代和20代菌,有显著差异(p<0.05)。其余各代菌两种条件下培养12 h的OD600 mm均无显著差异(p>0.05),说明卡那霉素的施加对工程菌的长势没有明显影响。
2.4质粒双酶切图谱鉴定
由图3和图4可以看出,第20代菌重组质粒的酶切图谱与原代并无差异,DNA序列测定结果为:

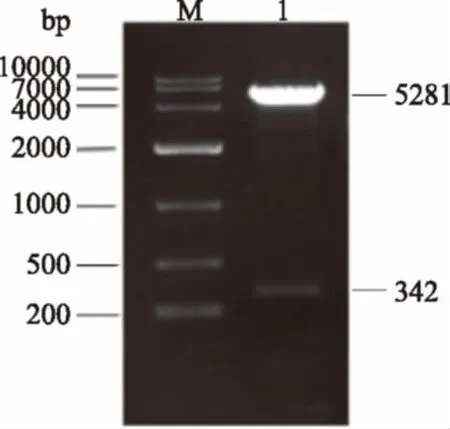
图3 原代菌重组质粒限制性酶切图谱Fig.3 Restriction enzyme map ofrecombinant expression vector of origin
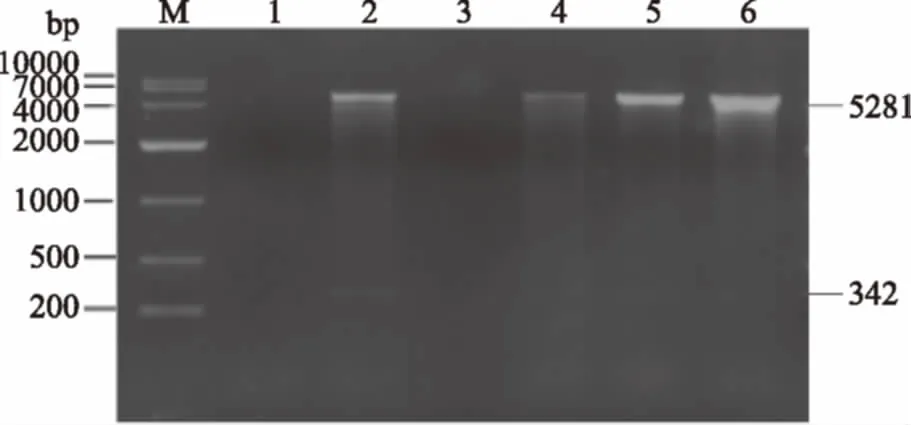
图4 重组质粒的限制性酶切图谱Fig.4 Restriction enzyme map of recombinant expression vector 注:M-DNA Marker(DL10000);1,3,5分别为不添加抗生素的第100代、60代和20代工程菌;2,4,6分别为添加抗生素的的第100代、60代和20代工程菌。
这和原代菌序列一致。
在不含抗生素条件的情况下,传到第60代时,酶切图谱在342 bp的位置无条带出现,同时DNA序列测定显示信号弱无法成功测序,说明随着传代次数的增加质粒已经出现了丢失,使得剩余的拷贝数太少以致于无法在电泳图谱中表现出来。
在含有抗生素压力的情况下,传代进行到第100代时(2泳道),重组质粒的酶切图谱和与原代几乎保持一致,DNA序列测定结果也完全一致。这说明该工程菌在卡那霉素抗性选择压力下,连续传代 100代后,质粒几乎没有丢失,并且目的基因片断blast对比与插入的目的基因片段完全一致,没有突变。
由此可知,该工程菌具有结构不稳定性,而抗生素的压力能够有效地强化重组工程菌在传代过程的结构稳定性。因此在下一步的大规模制备中可以采用添加抗生素制备种子菌,用无抗发酵液进行大规模生产的模式来降低成本同时提高安全性。
2.5产物鉴定
图5中的1、2泳道分别是在含抗生素和不含抗生素的培养基中培养的未导入重组质粒的原始宿主菌E.coliBL21(DE3),3、4泳道分别是含抗生素和不含抗生素的原代工程菌液,对比1~4泳道,可以看出在相对分子量14.75 kDa处有目标条带出现。再对比5~14泳道,发现目标蛋白表达水平随着代数的增加而降低,培养基中添加抗生素的菌液(3、5、7、9、11、13泳道)比同代不含抗生素压力的菌液(4、6、8、10、12、14泳道)蛋白表达水平高。在含有抗生素压力下,第80代菌(11泳道)仍有较高的目的蛋白表达水平,采用复制平板法,发现此时质粒的稳定性为96%。无抗生素压力下,传代进行到第40代菌(8泳道)时,目标条带扫描光密度显著降低,暗示目的蛋白的表达水平已经显著降低。传代进行到第100代(14泳道)时,蛋白表达水平已经很低,此时的质粒稳定性为56%。上述结果显示,当不用抗生素时,随着传代次数的增加,重组菌的蛋白质表达水平和质粒稳定性均明显降低,当采用抗生素时,重组菌的蛋白质表达水平和质粒稳定性在传代过程中能够保持稳定,因此在进行大规模发酵和产物制备的过程中,应添加抗生素维持菌株的目的蛋白表达水平。
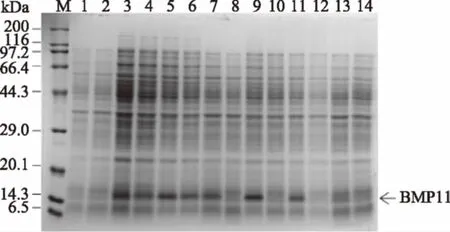
图5 工程菌表达产物的SDS-PAGE分析Fig.5 SDS-PAGE profile of expressedproducts in recombinant E.coli注:(M-蛋白质 Marker;1、2:分别为Kan+-空菌、Kan--空菌;3~14:分别为Kan+-0、Kan--0、Kan+-20、Kan--20、Kan+-40、Kan--40、Kan+-60、Kan--60、Kan+-80、Kan--80、Kan+-100、Kan--100)。
3 结论
本研究发现工程菌E.coliBL21(DE3)/pET28a-BMP11在传代过程中形态特征和生长速度稳定,在不含抗生素压力下,传代进行到第40代时,质粒稳定性和蛋白质表达水平即显著下降,传至第100代时,质粒保有率降低到56%。在添加抗生素的条件下,能够让该菌第80代菌仍有较高的蛋白质表达水平,第100代菌的酶切图谱和DNA序列与原代保持一致,质粒保有率高达96%。本实验构建保存的工程菌虽然具有一定的遗传不稳定性,但它在无抗生素选择压力下,连续传代20代保持100%的分裂稳定性,可以满足扩大生产的需要,并且可以添加抗生素来控制其重组质粒的稳定性。该成果为下一步建立BMP11基因原核表达体系和今后的规模化生产提供参考,为新型抗衰老保健食品的开发奠定了理论基础。
[1]彭德翔,丁卓平. 抗衰老活性肽的研究进展[J].现代食品科技,2006,22(2):267-270.
[2]Grosicki M,Latacz G,Szopa A,et al. The study of cellular cytotoxicity of argireline-an anti-aging peptide[J]. Acta Biochim Pol,2014,61(1):29-32.
[3]Fadini G P,Menegazzo L,Bonora B M,et al. Effects of Age,Diabetes,and Vascular Disease on Growth Differentiation Factor 11:First-in-Human Study[J].Diabetes Care,2015,38(8):118-119.
[4]Finkenzeller G,Stark G B,Strassburg S. Growth differentiation factor 11 supports migration and sprouting of endothelial progenitor cells[J]. Journal of Surgical Research,2015,198(1):50-56.
[5]Wang Y,Wehlinghenricks M,Samengo G,et al. Increases of M2a macrophages and fibrosis in aging muscle are influenced by bone marrow aging and negatively regulated by muscle-derived nitric oxide[J]. Aging Cell,2015,14(4):678-688.
[6]沈巧艳,李娜,华进联. 抗衰老的GDF11生物学特征与功能表现[J]. 中国生物化学与分子生物学报,2016,32(8):872-878.
[7]Yan Z,Jin S,Zhi W,et al. Growth differentiation factor 11 is a protective factor for osteoblastogenesis by targeting PPARgamma[J]. Gene,2015,557(2):209-214.
[8]Sinha M,Jang Y C,Oh J,et al. Restoring systemic GDF11 levels reverses age-related dysfunction in mouse skeletal muscle[J]. Science,2014,344(6184):649-652.
[9]Katsimpardi L,Litterman N K,Schein P A,et al. Vascular and Neurogenic Rejuvenation of the Aging Mouse Brain by Young Systemic Factors[J].Science,2014,344(6184):630-634.
[10]Loffredo F S,Steinhauser M L,Jay S M,et al. Growth differentiation factor 11 is a circulating factor that reverses age-related cardiac hypertrophy[J]. Cell,2013,153(4):828-839.
[11]肖硕,洪华珠,彭建新. 基因工程菌中重组质粒的稳定性研究进展[J]. 生物技术通报,2008,15(4):9-12.
[12]赵先萍. 遗传工程中重组载体的构建及稳定性问题[J]. 农业开发与装备,2015,40(10):64.
[13]郭云萍,陶凌,李刚,等. 重组人硫氧还蛋白工程菌生物学特性稳定性的检测[J]. 微生物学通报,2013,40(8):1457-1461.
[15]王宏华,凌红丽,侯竹美,等. 鸡γ-干扰素基因重组质粒在工程菌株中的稳定性研究[J]. 微生物学通报,2008,35(7):1055-1058.
[16]翟成一,徐岩,聂尧,等. 产普鲁兰酶重组大肠杆菌质粒稳定性的研究[J]. 工业微生物,2015,45(2):13-20.
[17]陈悦,李环,韦萍. 产乙酰鸟氨酸脱乙酰基酶基因工程菌的构建及遗传稳定性研究[J]. 工业微生物,2008,38(2):23-27.
Studyonthestabilityofgrowthdifferentiationfactor(BMP11)recombinantplasmidinEscherichiacoli
HAODan1,YOUQian-qian1,HAOWei1,2,LIANGXiao-lin1,YUANJing-lin1,LIQuan-yang1,*
(1.College of Light Industry and Food Engineering,Guangxi University,Nanning 530004,China;2.Pingxiang Entry-exit Inspection and Quarantine Bureau,Pingxiang 532600,China)
To investigate the hereditary stability of recombinant plasmid(pET-BMP11)in host cell(EscherichiacoliBL21(DE3)). The recombinantE.coliwas subcultured for 100 generation,samples were collected every 20 generations. Bacterial morphology,bacteria growth,plasmid stability,the target protein expressing level were analyzed. TheXhoⅠ andNdeⅠ double enzyme validation and determination of target sequence were performed on the origin,20th,60th,100thgeneration strain. The results showed that the growth characteristics and the morphology of the cultures did not show differences among the generations,in the absence of kanamycin.The plasmid stability and protein expression of 40thgeneration strain decreased significantly,and the plasmid retention rate of 100thgenerations was only 56%. In the presence of kanamycin,the 80thgeneration strain still had a high level of protein expression. The restriction enzyme map and target gene sequence of 100thwere consistent with the original ones,and the rate of plasmid retention was up to 96%. These results showed that the use of recombinantE.colito produce BMP11 was feasible,the addition of kanamycin in the medium kept the recombinant plasmid s
Table during passage,this study could provide a theoretical basis for the industrial production of BMP11 and the development of new anti-aging foods.
growth differentiation factor 11;recombinant plasmid;engineering strain;stability
TS201.3
A
1002-0306(2017)19-0114-05
10.13386/j.issn1002-0306.2017.19.022
2017-03-08
郝丹(1992-),女,硕士,研究方向:食品营养与健康长寿,E-mail:haodan0905@163.com。
*通讯作者:李全阳(1964-),男,博士,教授,研究方向:食品营养与健康长寿,E-mail:liquanyang@gxu.edu.cn。
国家自然科学基金面上项目(31371762)。

