‘航花2号’的Δ12脂肪酸脱氢酶(FAD2)基因的生物信息学分析
温世杰+李杏瑜+洪彦彬+李少雄+周桂元+陈小平+梁炫强

摘 要 植物中的Δ12脂肪酸脱氢酶(FAD2)是油酸形成亚油酸的关键酶。通过NCBI和EXPASY 2大数据库,采用SignalP、TMHMM、Psort、ProtParam和TargetP等分析程序对花生品种‘航花2号及其它物种的19个FAD2蛋白序列进行分析,利用MEGA6.0软件比对序列及构建系统进化树阐明FAD2基因的系统发育关系,亲缘相近的FAD2蛋白聚在一起。预测了‘航花2号和‘粤油13的FAD2蛋白的分子质量、等电点、信号肽、跨膜和保守结构域等。结果表明:‘航花2号FAD2蛋白的N端没有信号肽,预测定位在微体、细胞质、线粒体基质和叶绿体类囊膜中,而C端信号基序LKGL使得FAD2蛋白选择性地结合和嵌入内质网,植物的FAD2蛋白普遍有3个高度保守的组氨酸富集基序(HECGHH、HRRHH和H[A/C/T]HH)和3~5个跨膜结构,但分析结果显示,‘航花2号的FAD2蛋白的H[A/C/T]HH的组氨酸基序是缺失的,而油酸转化为亚油酸的效率上并没有显著变化,为将来FAD2基因的基因工程操作提供一定的理论基础。
关键词 花生 ;脂肪酸脱氢酶 ;生物信息学 ;油料作物
中图分类号 Q946.81 文献标识码 A Doi:10.12008/j.issn.1009-2196.2017.09.008
Bioinformatic Analysis of Delta-12 Fatty Acid Desaturase 2(FAD2)
WEN Shijie LI Xingyu HONG Yanbin LI Shaoxiong
ZHOU Guiyuan CHEN Xiaopin LIANG Xuanqiang
(Crops Research Institute, Guangdong Academy of Agricultural Sciences / Guangdong Key
Laboratory for Crops Genetic Improvement / South China Peanut Sub-Center of National
Center of Oilseed Crops Improvement, Guangzhou, Guangdong 510640)
Abstract Delta-12 fatty acid desaturase 2 (FAD2) was a key enzyme to insert oleic acid to linoleic acid. Through the NCBI and EXPASY 2 database, nineteen FAD2 protein sequences from peanut Hanghua 2 and other species of plants were analyzed by SignalP, TMHMM, Psort, ProtParam and TargetP procedures. The phylogenetic relationship of FAD2 was elucidated by neighbour-joining tree and MEGA6.0. FAD2 proteins with high similarity sequence were clustered. The molecular mass, isoelectric point, signal peptide, trans-membrane and conserved domains of FAD2 protein were predicted for peanut Hanghua 2 and Yueyou 13. The results showed that there was no signal peptide of N-terminal of FAD2 in Huanghua 2. The FAD2 proteins were predicted in microbody, cytoplasm, mitochondrial matrix space and chloroplast thylakoid membrane. C-terminal signaling motif LKGL allows FAD2 proteins to selectively bind and embed in the endoplasmic reticulum. The FAD2 proteins included three highly conserved histidine-rich motifs (HECHH, HRRHH and HV[A/C/T]HH) and three to five transmembrane anchors. But C-terminal of FAD2 in Huanghua 2 was lack of HV[A/C/T]HH histidine motif. No change was observed in efficiency of insertion of oleic acid to linoleic acid. This could be used for genetic engineering of FAD2 gene in the future.
Keywords peanut ; fatty acid desaturase ; bioinformatics ; oilseed crops
油料作物是人類重要的食材之一[1],同时也被广泛用于医药、化妆、乳化剂等领域,是重要的经济作物[2-3]。油料作物中,脂肪酸是种子的主要贮存脂质和重要的能量来源。脂肪酸脱氢酶在脂肪酸代谢过程中起着在烃链中引入双键的功能。脂肪酸脱氢酸分成两类,一类是可溶性蛋白脱氢酶(ACP-desaturas),另一类是膜结合脂肪酸脱氢酶。质体中的脱氢酶的电子供体通常是铁氧化还原蛋白,而内质网的脱氢酶则是细胞色素b5[4],质体和内质网中发生的脱氢反应是通过2种不同的途径发生的[5]。甘油三酯在菜油中大多由棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸这5种脂肪酸组成[6]。植物油的质量主要取决于油酸和亚油酸的含量。这2种不饱和脂肪酸的比例决定了食用油的营养特性和稳定性。脂肪酸脱氢酶(FAD2)是在油酸的Δ12位置形成双键从而转变为亚油酸的关键酶[5],在生物膜系统、信号、能量储存、热适应和抗生物或非生物胁迫中起着至关重要的作用[5,7]。FAD2基因推导的氨基酸有3个典型的保守组氨酸框,是氧化激活和底物氧化的场所[8-10]。endprint
花生籽粒中含油量约占种子干重的46%~57%,其中可分为饱和脂肪酸和不饱和脂肪酸。在不饱和脂肪酸中,油酸和亚油酸的含量最高,两者约占总脂肪酸的80%[11-12]。油酸和亚油酸的相对含量对花生油的营养与贮藏影响很大。由于高浓度的亚麻酸或亚油酸容易发生氧化变质,导致植物油酸败。为了解决这个问题,往往通过化学加氢的方法增加油酸含量和减小多不饱和脂肪酸的含量,但这样做会产生反式脂肪,反式脂肪与心脏病和Ⅱ型糖尿病的发病相关[13]。而高油酸的花生制品不容易氧化变质延长了保质期,可以降低胆固醇水平,有利于健康[14-15]。因此,利用基因工程改善植物油的稳定性是必要的[6,16]。‘航花2号是由‘粤油13搭载返回式卫星,返回地面后经多代选育而成的优质高产花生品种。本研究是利用生物信息学分析‘航花2号的FAD2基因结构、功能和阐明系统发生学关系,为下一步花生FAD2基因工程提供理论参考。
1 材料与方法
1.1 材料
‘航花2号广东省农业科学院作物研究所育成的花生品种,2012年通过广东省农作物品种审定委员会审定,2013年通过全国农业技术推广服务中心农作物品种鉴定。
‘粤油13广东省农业科学院作物研究所育成花生品种,2006年通过广东省农作物品种审定委员会审定,同年通过全国农业技术推广服务中心农作物品种鉴定。
1.2 FAD2基因序列的获得与收集
利用天根植物基因组DNA提取试剂盒(NO.DP305)提取以上2个品种的基因组DNA。
利用同源克隆的方法,设计引物为FAD2-sense:ACACAACAATGGGAGCTGGA FAD2-antisense :ATGGCAAATCCACACACACA,获得‘航花2号和‘粤油13花生品种的序列,其它序列从NCBI(http://www.ncbi.nih.gov)收集如表1。
1.3 生物信息学分析
利用NCBI(http://www.ncbi.nih.gov)和EXPASY(http://expasy.org/tools)这2个网站在线分析FAD2蛋白序列,利用MEME(http://meme-suite.org/tools/meme)分析序列的基序,利用MEGA软件中的Clustalw算法,进行多序列比对并生成系统进化树。利用SignalP(http://www.cbs.dtu.dk/services/SignalP)和TMHMM(http://www.cbs.dtu.dk/services/TMHMM)来预测信号肽和跨膜结构,以及其它生物信息学工具预测分子量,等电点,氨基酸组成和半衰期等。
2 结果与分析
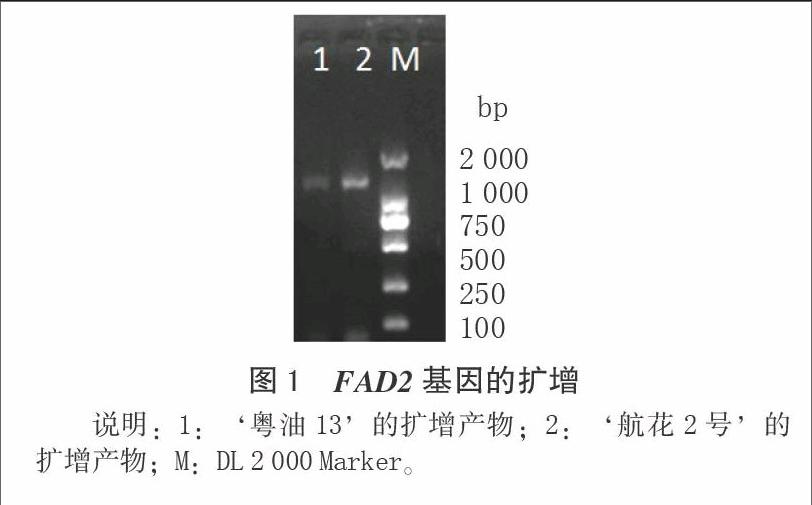
2.1 ‘航花2号FAD2基因序列及推导氨基酸信息
通过同源克隆的方法电泳图1测序得的‘航花2号和‘粤油13的FAD2基因序列(图2、3)。由Protparam程序预测,‘航花2号的FAD2蛋白长度为245 aa,分子量为28 152.74 u,等电点为9.45,分子式为C1325H1972N332O334S8,氨基酸组成包括13个带负电的氨基酸和24个带正电的氨基酸,计算的不稳定指数值为37.97,说明它是一个稳定的蛋白蛋。‘粤油13的FAD2蛋白长度为379 aa,分子量为43 588.22 u,等电点为8.78,分子式为C2045H3018N514O528S12氨基酸的组成包括了28个带负电的氨基酸和34个带正电的氨基酸,计算的不稳定指数值为38.08,说明这是一个稳定的蛋白质[17]。
2.2 不同来源的FAD2蛋白的比对与基序分析
为了阐明FAD2基因的系统进化发育关系,利用MEGA6.0软件对这19个蛋白进行多重比对并构建系统进化树(图4)。如图4可知,此系统进化树可分为3组,花生和大豆都是同一组中,比对结果,花生之间差异不大,花生与大豆的FAD2蛋白的同源性有86%。对‘航花2号和‘粤油13以及来自15个不同物种的17个FAD2蛋白进行多重比对,通过MEME分析保守基序,具体的参数为默认值,共有3个保守的基序,第一个保守组氨酸基序为HECGHH,第二个高度保守的组氨酸基序是HRRHH,但红花亚麻除外,红花亚麻是由4个疏水性脯氨酸替代这个基序。第三个组氨酸基序为HV[A/C/T]HH,在它两边存在有2个高度保守的基序:EWDWLRGALAT和LFSTMPHYHAMEA(图2、5)。据报道这些保守的组氨酸基序可能是一种铁离子结合位点,由于‘航花2号的FAD2翻译提前中止,它的第三个组氨酸基序是缺失的。
2.3 预测‘航花2号的FAD2蛋白定位
利用Psort(https://wolfpsort.hgc.jp/)[18],TargetP(http://www.cbs.dtu.dk/services/TargetP/)[19]和SignalP(http://www.cbs.dtu.dk/services/SignalP/)3种不同算法预测‘航花2号N端信号的细胞定位,结果显示,‘航花2号的FAD2蛋白N端没有信号肽,预测定位在微体、细胞质、线粒体基质和叶绿体类囊体膜中。这个蛋白质不存在内质网滞留基序(KDEL),但在C端有内质网膜保留信号KKXX-like基序为LKGL。‘粤油13信号肽预测发现同样没有信号肽,定位在内质网(膜)、质膜、微体(过氧物酶体)和线粒体内膜。这个蛋白同样不存在内质网滞留基序(KDEL),在C端不但有内质网膜保留信号KKXX-like基序为YKNK,还存在NKF氨基酸序列,在C端的NKF已经被证实是一种糖基酶目标信号[20]。在所选择的大多数FAD2蛋白中,内质网检索序列为YNNKL,而在上述序列的同源序列为Y(K/N)NKF或者YRNKI。降低基序保守性可能表明內质网检索信号的损失,导致酶从内质网中解离[21]。‘航花2号C端的内质网检索基序为LKGL使其更有选择性地结合和嵌入内质网。endprint
2.4 ‘航花2號的FAD2蛋白的跨膜结构预测
脂肪酸脱氢酶(FAD2)通常包含有5个跨膜结构,3个组氨酸盒子和内质网检索基序[22]。FAD2蛋白N端的酶的活性区域必须是疏水残基,通常是组氨酸富集基序,保守的组氨酸结构域在酶功能中起至关重要的作用,一个组氨酸的替换都有可能破坏酶的功能[23]。由ProtScale程序下的Kyte and Doolittle方法[24]得到图6-A,从图6-A可见,‘航花2号的FAD2蛋白有4个疏水峰,分别在44-66 aa、79-101 aa、174-196 aa和219-241 aa的位置。利用TMHMM软件预测跨膜螺旋见图6-B,由图6-B可见4个跨膜结构域。而由图6-C可知,‘粤油13的FAD2有4个跨膜结构域。序列跨膜结构域预测见表1。由表1可知,除了红花亚麻只有3个跨膜结构域外,其它都有4-5个跨膜结构域。呈现出不同来源的FAD2蛋白的跨膜结构域的数量不同,可能与底物的特异性有关[25]。‘航花2号与‘粤油13的FAD2跨膜结构是相似的,预示了‘航花2号和‘粤油13的FAD2功能其活性也可能相似。
2.5 ‘航花2号与‘粤油13的主要油分比较
由于FAD2基因是公认的油酸转化为亚油酸的关键基因,上述结果已表明,‘航花2号的FAD2翻译被提前中止。通过近红外光谱仪分析‘航花2号和‘粤油13的种子(图7),结果表明,‘航花2号和‘粤油13的的主要油分含量相近,并无显著变化。这说明‘航花2号和‘粤油13的FAD2功能活性相同。
3 结论与讨论
所有高等植物中,亚油酸的合成都是在油酸的C12和C13位置之间插入双键形成的。虽然FAD2酶目前为止还没有晶体结构,但是其预测结构被公认为负责油酸转化为亚油酸的酶。这些特征包括位于3~5个跨膜结构之间的高度保守的组氨酸富集基序,除此之外还有一个重要的结构特征就是使它们选择性结合或嵌入在内质网的C端内质网信号基序,在这个基序上的任何突变都会引起酶从内质网的解耦和在质膜的锚定[26]。通过比对来自不同油料作物的19个蛋白序列,识别出可能的3个高度保守的区域。所有FAD2蛋白序列的第一个组氨酸基序都是HECGHH,而且丙氨酸是紧随着第一个组氨酸盒子;第二个组氨酸基序是高度保守的HRRHH,虽然红花亚麻并没有这个特征,但在这个区域用了4个疏水性的脯氨酸代替了组氨酸盒子。第三个组氨酸基序为HV[A/C/T]HH,在第三个组氨酸盒子前后存在两个高度保守的基序:EWDWLRGALAT和LFSTMPHYHAMEA。如此长的高度保守的组氨酸同源基序可能是一种铁离子结合位点。蛋白质可能在3个组氨酸盒的间隔处螺旋。由上述结果可知,‘航花2号可能受太空辐射影响,FAD2翻译提前中止,第三个组氨酸盒及其两端的保守基序的缺失,对其油酸转化亚油酸的活性或转化效率没有影响,‘航花2号和‘粤油13二者的主要油分含量,特别是油酸和亚油酸含量都没有显著变化。预示着‘航花2号的FAD2基因的这种缺失可能未改变其油酸转化亚油酸的转化活性,但是否对其离子结合特别是铁离子的结合产生影响有待进一步的验证,可为将来对FAD2基因的基因工程操作提供了一定的理论基础。
参考文献
[1] Miquel M F. High-oleate oilseeds fail to develop at low temperature[J]. Plant Physiol, 1994, 106(2):421-427.
[2] McKevith B. Nutritional aspects of oilseeds[J]. Nutr Bull, 2005, 30(1): 13-26.
[3] Clemente T E, Cahoon E B. Soybean oil:genetic approaches for modification of functionality and total content[J]. Plant Physiol, 2009, 151(3):1 030-1 040.
[4] Za¨uner S, Jochum W, Bigorowski T, et al. Cytochrome b5-containing plastid-located fatty acid desaturase from chlamydomonas reinhardtii[J]. Eukaryot cell, 2012, 11(7):856-863.
[5] Cao S, Zhou X R, Wood C C, et al. large and functionally diverse family of FAD2 genes in safflower (Carthamus tinctorius L.) [J]. BMC Plant Biol, 2013, 13(1): 5-11.
[6] Sharma A, Chauhan R S. In silico identification and comparative genomics of candidate genes involved in biosynthesis and accumulation of seed oil in plants[J]. Int J Genomics, 2012, 138(6):14-19.
[7] Chapman K D, Austin-Brown S, Sparace SA, et al. Transgenic cotton plants with increased seed oleic acid content[J]. J Am Oil Chem Soc, 2001, 78(9):941-947.endprint
[8] Suresha G S, Santha I M. Molecular cloning and in silico analysis of novel oleate desaturase gene homologues from Brassica juncea through sub-genomic library approach[J]. Plant Omics J, 2013, 132(6): 55-64.
[9] Chi X, Yang Q, Pan L, et al. Isolation and characterization of fatty acid desaturase genes from peanut (Arachis hypogaea L.)[J]. Plant Cell Rep, 2011, 30(8): 1 393-1 404
[10] Kosova′ K, Pra′il I, Vi′ta′mva′s P. Protein contribution to plant salinity response and tolerance acquisition[J]. Int J Mol Sci, 2013, 14(4): 6 757-6 789.
[11] 萬勇善,谭 忠,范 晖,等. 花生脂肪酸组分的遗传效应研究[J]. 中国油料作物学报,2002,24(1):26-28.
[12] 许 燕,张绍龙. 我国高油酸花生育种研究进展[J]. 广东农业科学, 2011,38(1):43-45.
[13] Mozaffarian D, Katan M B, Ascherio A, et al. Trans fatty acids and cardiovascular disease[J]. N Engl J Med, 2006, 354(15):1 601-1 613.
[14] Mercer L C, Wynne J C, Young C T. Inheritance of Fatty Acid Content in Peanut Oil 1[J]. Peanut Science, 1990, 17(1): 17-21.
[15] Isleib T G, Young C T, Knauft D A. Fatty acid genotypes of five virginia-type peanut cultivars[J]. Crop Science, 1996, 36(3): 556-558.
[16] Hitz W D, Carlson T J, Booth J R, et al. Cloning of a higher-plant plastid [omega]-6 fatty acid desaturase cDNA and its expression in a cyanobacterium[J]. Plant Physiol, 1994, 105(2):635-641.
[17] Gasteiger E, Hoogland C, Gattiker A, et al. Protein identification and analysis tools on the ExPASy server[M]. In:The proteomics protocols handbook, Springer, 2005:p 571–607.
[18] Horton P, Park K J, Obayashi T, et al. PSORT:protein localization predictor[J]. Nucleic Acids Res, 35(suppl 2) 2007:585-587.
[19] Nielsen H, Engelbrecht J, Brunak S, et al. Identification of prokaryotic and eukaryotic signal peptides and prediction of their cleavage sites[J]. Protein Eng, 1997, 10(1):1-6.
[20] Horiguchi H, Yurimoto H, Goh T K, et al. Peroxisomal catalase in the methylotrophic yeast Candida boidinii:transport efficiency and metabolic significance[J]. J Bacteriol, 2001, 183(21): 6 372-6 383.
[21] McCartney A W, Dyer J M, Dhanoa P K, et al. Membrane-bound fatty acid desaturases are inserted co-translationally into the ER and contain different ER retrieval motifs at their carboxy termini[J]. Plant J, 2004, 37(2):156-173.
[22] Shanklin J, Whittle E, Fox B G. Eight histidine residues are catalytically essential in a membrane-associated iron enzyme, stearoyl-CoA desaturase, and are conserved in alkane hydroxylase and xylene monooxygenase[J]. Biochemistry, 1994, 33(43):12 787-12 794.
[23] Kurdrid P, Subudhi S, Hongsthong A, et al. Functional expression of Spirulina-D6 desaturase gene in yeast, Saccharomyces cerevisiae[J]. Mol Biol Rep, 2005, 32(4):215-226.
[24] Kyte J, Doolittle R F. A simple method for displaying the hydropathic character of a protein[J]. J Mol Biol, 1982, 157(1): 105-132.
[25] Minto RE, Gibbons WJ Jr, Cardon TB, et al. Synthesis and conformational studies of a transmembrane domain from a diverged microsomal D12-desaturase[J]. Anal Biochem, 2002, 308(1):134-140.
[26] Dehghan Nayeri, Fatemeh, Yarizade, et al. Bioinformatics study of delta-12 fatty acid desaturase 2 (FAD2) gene in oilseeds [J] Molecular Biology Reports, 2014, 41(8):5 077-5 087.endprint

