PRRSV强、弱毒株Nsp9基因对PRRSV复制的影响
赵孟孟,冯丽丽,冯松林,马红芳,张二芹,王文佳,邢 星,张 雅,冯嘉萍,张桂红
(1.华南农业大学 兽医学院,国家生猪种业工程技术研究中心,广东省动物源性人兽共患病预防与控制重点实验室,广东 广州 510642; 2.河南农业大学 牧医工程学院,河南 郑州 450002;3. 河南省农业科学院 农业经济与信息研究所,河南 郑州 450002;4.河南牧业经济学院 制药工程学院,河南 郑州 450046;5.广西钦州保税港区出入境检验检疫局,广西 钦州 535008)
猪繁殖与呼吸综合征病毒(Porcinereproductiveandrespiratorysyndromevirus, PRRSV)属于套式病毒目(Nidovirales)、动脉炎病毒科(Arteriviridae)、动脉炎病毒属(Arterivirus)成员[1-3],是一种有囊膜的单股正链RNA病毒,同属的还有马动脉炎病毒(EAV)、鼠乳酸脱氢酶病毒(LDV)、猴出血热病毒(SHFV)。其基因组长度为15 kb,包含有10个开放阅读框(Open reading frame, ORFs)。从5′端到3′端依次为ORFla、ORFlab和ORF2~ORF7,每个ORF和其相邻的ORF部分重叠。在其5′端和3′端分别有1个非编码区,在5′端非编码区前有1个“帽子”结构,3′端非编码区后有多聚腺苷酸尾巴[4-6]。ORF2~ORF7编码病毒结构蛋白,其中ORF2~ORF5编码病毒的糖基化蛋白,ORF6编码膜基质蛋白,ORF7编码核衣壳蛋白。ORF1占病毒基因组的80%,编码病毒的非结构蛋白(Nonstructural protein,Nsp),参与病毒的复制。 ORF1a可继续水解为Nsp1a、Nsp1b、Nsp2~Nsp6、Nsp7a、Nsp7b、Nsp8,ORFlab水解为Nsp9、Nsp10、Nsp11、Nsp12。
Nsp9基因位于ORFlb中,编码RNA依赖的RNA聚合酶(RNA dependent RNA polymerase, RdRp)。RNA依赖的RNA聚合酶在所有正链RNA病毒中均编码,进而形成转录复制混合物的亚单位结构[7]。前人研究报道,Nsp9基因与宿主蛋白视网膜神经胶质瘤蛋白、膜联蛋白A2、DEAD-box RNA解旋酶相互作用促进病毒复制[8-10],并且针对Nsp9基因的siRNA以及化合物可抑制病毒复制[11-16],Nsp9基因相对其他病毒蛋白高度保守[17-18],但强、弱毒株之间存在约12个氨基酸的突变,这些氨基酸的突变是否与病毒毒力和复制能力相关尚未有文献报道。广东省动物源性人兽共患病预防与控制重点实验室前期研究结果表明,Nsp9基因可以促进PRRSV的复制[19],但是强、弱毒株在促进PRRSV复制方面是否存在差异未进行研究。为此,本研究通过在Marc-145细胞上过表达PRRSV强、弱毒株XH-GD和CH-1R的Nsp9基因,探索强、弱毒株Nsp9基因对病毒的复制是否存在差异,为揭示强、弱毒株之间的致病机制差异奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 细胞和培养基 Marc-145细胞由农业部兽用疫苗创制重点实验室保存,培养细胞所用DMEM购自Gibco公司,胎牛血清购自Gibco公司,双抗购自Hyclone公司。
1.1.2 菌株和质粒、病毒 大肠杆菌DH5α感受态菌种购自天根生物科技有限公司(北京);pIRES2-EGFP载体和PRRSV弱毒株CH-1R、强毒株XH-GD由农业部兽用疫苗创制重点实验室保存(其中,PRRSV强毒株XH-GD为农业部兽用疫苗创制重点实验室分离到的强毒株,致病力强,其Nsp2存在30个氨基酸的缺失;弱毒株CH-1R为商品化的疫苗毒株)。
1.1.3 主要试剂与仪器 Premix ExTaqDNA聚合酶、内切酶XhoⅠ 和Hind Ⅲ,DL2000 Marker、SYBR®Premix ExTaq(Tli RNaseH Plus)购自宝生物(大连)生物工程有限公司;凝胶回收和质粒提取试剂盒购自OMEGA公司; TRIzol®试剂购自Invitrogen公司;琼脂糖购自Biowest公司;溴化乙锭(EB)购自宝泰克生物科技公司;EZNA Endo-Free Plasmid Mini Kit购自OMEGA公司;裂解液RIPA购自北京百泰克生物技术有限公司;PRRSV Nsp9蛋白的单克隆抗体、PRRSV N蛋白单克隆抗体由农业部兽用疫苗创制重点实验室保存, 3-磷酸甘油醛脱氢酶单克隆抗体(内参抗体GAPDH)为北京博奥森生物技术有限公司产品,HRP标记山羊抗鼠二抗为北京康为世纪生物科技有限公司产品。
1.2 试验方法
1.2.1Nsp9基因引物设计与合成 根据PRRSVNsp9基因序列特征,应用Primer Premier 6.0 软件设计引物:上游引物(Nsp9P3-F):5′-AGCTGTCGATTTAAACTGCTAGCCGCCAGCG-3′,划线部分为XhoⅠ酶切位点。下游引物(Nsp9P4-R):5′-ATAGGATCCCTCATGATTGGACCCTGAGTTTTTC-3′,划线部分为Hind Ⅲ酶切位点。PRRSV N蛋白荧光定量引物为qN-F:5′-AAACCAGTCCAGAGGCAAGG-3′,qN-R:5′-GCAAACTAAACTCCACAGTGTAA-3′,GAPDH荧光定量引物为GAPDH-F:5′-CTGCCGCCTGGAGAAACCT -3′,GAPDH-R:5′-GCTGTAGCCAAATTCATTGTCG-3′。上述引物均由上海立菲生物科技有限公司合成。
1.2.2 PRRSV RNA的提取与反转录 参照Invitrogen公司TRIzol®说明书提取XH-GD毒株和CH-1R毒株的RNA,反转录参照宝生物工程(大连)有限公司的M-MLV反转录酶的使用说明书进行反转录:RNA 9.5 μL,RNase Inhibitor 0.5 μL,5×MLV Buffer 4.0 μL,dNTPs 4.0 μL,M-MLV 1.0 μL,反转录引物1.0 μL。42 ℃水浴1 h,冰浴2 min,反转录产物(cDNA)直接进行PCR反应或-20 ℃保存备用。
1.2.3Nsp9基因真核表达载体的构建 以cDNA为模板进行PCR扩增,PCR反应体系50 μL:Premix ExTaqDNA 聚合酶25 μL,上、下游引物(10 pmol/μL)各1 μL,cDNA 2 μL,去离子水21 μL。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,30个循环; 72 ℃延伸7 min。PCR产物用1.0%琼脂糖凝胶(含0.5 μg/mL EB)电泳检测后回收纯化。将PCR产物与pIRES2-EGFP空载体分别用XhoⅠ、Hind Ⅲ内切酶进行双酶切。酶切产物使用T4 DNA连接酶连接,分别命名为pIRes2-EGFP-Nsp9-XH-GD和pIRes2-EGFP-Nsp9-CH-1R。
1.2.4Nsp9重组表达质粒转染Marc-145细胞 连接产物转化大肠杆菌DH5α并通过菌液PCR筛选出阳性克隆并送往上海立菲生物科技有限公司测序。阳性克隆参照OMEGA Endo-Free Plasmid Mini的说明书抽提去内毒素重组质粒。用Invitrogen公司的脂质体Lipofectamine 2000按照说明书将构建的pIRes2-EGFP-Nsp9-XH-GD和pIRes2-EGFP-Nsp9-CH-1R真核表达载体转染到Marc-145细胞中。
1.2.5 Western Blot检测重组质粒表达 将转染48 h的细胞样品弃去上清,用PBS清洗细胞3次,之后用RIPA裂解液进行裂解,每个6孔板加入100 μL,之后加入25 μL上样缓冲液,沸水中加热10 min,13 000 r/min离心10 min,取上清进行SDS-PAGE电泳。电泳结束后转转,15 V的电压转移60 min,5%脱脂奶粉封闭1 h,过夜封闭一抗(Nsp9单克隆抗体),洗膜3次,每次5 min,之后加入用TBST缓冲液按1∶8 000稀释的IRDye 800 CW Goat anti-mouse IgG(H+L),37 ℃ 孵育1 h,洗膜3次,每次5 min,放入双色激光分析系统Odyssey(LI-COR公司生产),拍照记录。
1.2.6 Marc-145细胞接毒与样品采集 将转染pIRes2-EGFP-Nsp9-XH-GD和pIRes2-EGFP-Nsp9-CH-1R真核表达载体的Marc-145细胞转染24 h之后,以MOI=1的剂量接种PRRSV XH-GD毒株,24 h之后采集样品。
1.2.7 qPCR测定中PRRSV N蛋白的mRNA表达水平 接毒后24 h,将病变细胞培养液反复冻融3次,4 ℃条件下12 000 r/min离心10 min,取上清液250 μL置于DEPC水处理过的1.5 mL灭菌离心管中,按照Invitrogen公司TRIzol®试剂的使用说明书操作,提取病毒总RNA。步骤同1.2.2。
以反转录的样品为模板进行PCR反应,PCR体系20 μL:SYBR®Premix ExTaq(Tli RNaseH Plus)(2×)10.0 μL,上、下游引物各0.4 μL,ROX Reference Dye Ⅱ (50×) 0.4 μL,DNA模板2 μL,ddH2O 6.8 μL。扩增条件:94 ℃预变性5 min,1个循环;94 ℃变性10 s,55 ℃ 退火20 s,72 ℃延伸30 s,45个循环。
1.2.8 Western Blot检测 PRRSV N蛋白的表达 具体操作步骤参照1.2.5,其中一抗为N蛋白或者GAPDH抗体。
1.2.9 TCID50测定PRRSV的滴度 在96孔细胞培养板上接种Marc-145细胞,待细胞生长达到85%以上时即可用样品进行接种。每个样品进行10倍梯度的倍比稀释(即10-1~10-8倍比稀释,每个稀释度接种8孔,100 μL/孔)。接毒后,将细胞板放置37 ℃、5% CO2细胞培养箱中孵育作用1.5 h。弃去病毒液,补入含2%新生牛血清的DMEM,然后放置于37 ℃、5% CO2细胞培养箱中继续培养。连续观察2~7 d,记录每个稀释度的发生细胞病变的孔数,重复3次求其平均值,并按照Reed-Muench法计算各个样品的TCID50。
1.2.10 qPCR和病毒滴度数据分析 qPCR分析计算方法采用2-ΔΔCt,qPCR数据和病毒滴度的差异性数据分析采用GraphPad软件进行处理。
2 结果与分析
2.1 PRRSV XH-GD、CH-1R毒株Nsp9基因重组质粒的构建与鉴定
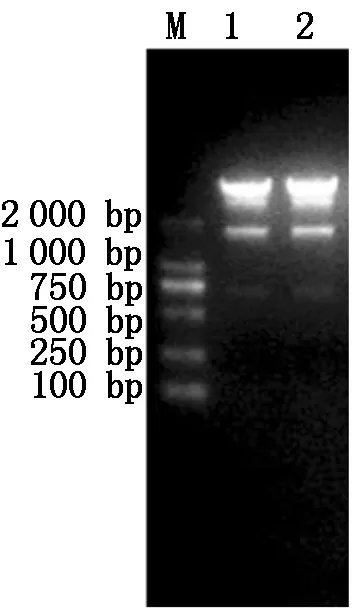
由图1可知, PRRSV XH-GD、CH-1R毒株Nsp9基因目的片段都在1 900 bp左右,与理论值相符。由图2可知,构建的重组质粒经过XhoI、Hind Ⅲ双酶切后出现1 900,5 600 bp左右的片段,与预期结果相符,表明PRRSV XH-GD、CH-1R 毒株Nsp9基因重组质粒构建成功。
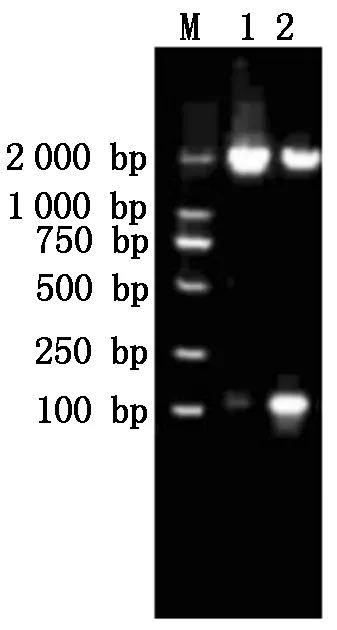
M.DL2000 Marker; 1.XH-GD毒株;2.CH-1R毒株。M. DL2000 Marker; 1. XH-GD; 2. CH-1R.
M.DL2000 Marker;1.双酶切pIRes2-EGFP-Nsp9-XH-GD;
2.2 PRRSV XH-GD、CH-1R毒株重组质粒在细胞中的转染结果
将质粒转染之后的细胞进行Western Blot 验证,一抗为Nsp9单抗,可以看到目的条带,大小为100 kDa(图3),与预期结果一致,说明PRRSV XH-GD、CH-1R毒株重组质粒在Marc-145细胞中得到了有效表达。
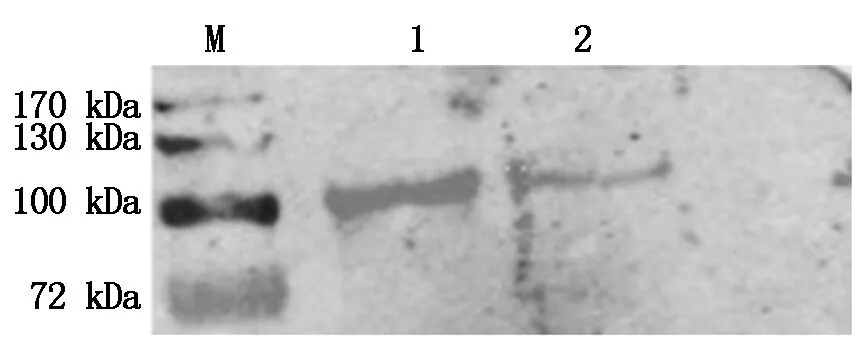
M.170 蛋白Marker ;1. pIRes2-EGFP-Nsp9-XH-GD;
2.3 转染重组质粒之后对PRRSV N蛋白的mRNA表达水平变化
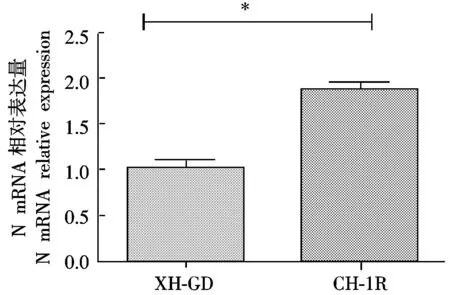
通过qPCR方法进行N蛋白在mRNA表达水平上的变化,数据用GraphPad进行处理,结果如图4所示,转染CH-1RNsp9基因Marc-145细胞上的病毒N蛋白的mRNA水平显著高于转染XH-GDNsp9基因的细胞。
2.4 转染重组质粒之后对PRRSV的N蛋白的蛋白质表达水平变化
从图5可以看出,转染CH-1RNsp9基因的Marc-145细胞上的病毒N蛋白的蛋白水平高于转染XH-GDNsp9基因的细胞。
2.5 转染重组质粒之后对PRRSV的滴度变化
从图6可以看出, 转染CH-1RNsp9基因的Marc-145细胞上的病毒滴度显著高于转染XH-GDNsp9基因的细胞。
*.差异显著( P<0.05)。图6同。
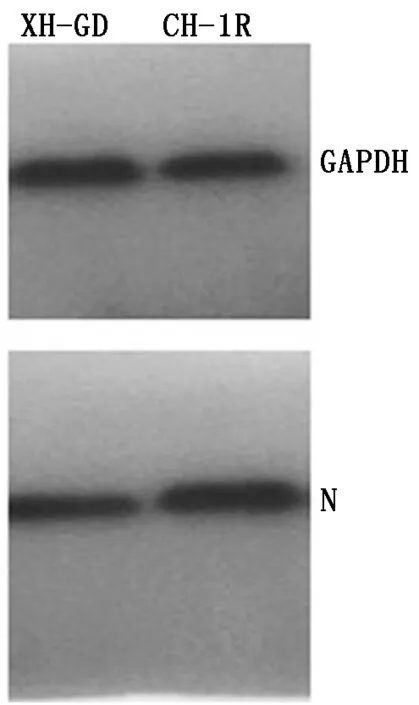
图5 PRRSV XH-GD、CH-1R毒株Nsp9基因重组质粒在Marc-145细胞上对N蛋白蛋白质水平的影响Fig.5 Protein level of N protein influence of PRRSV XH-GD,CH-1R strain Nsp9 gene transfection in Marc-145 cells
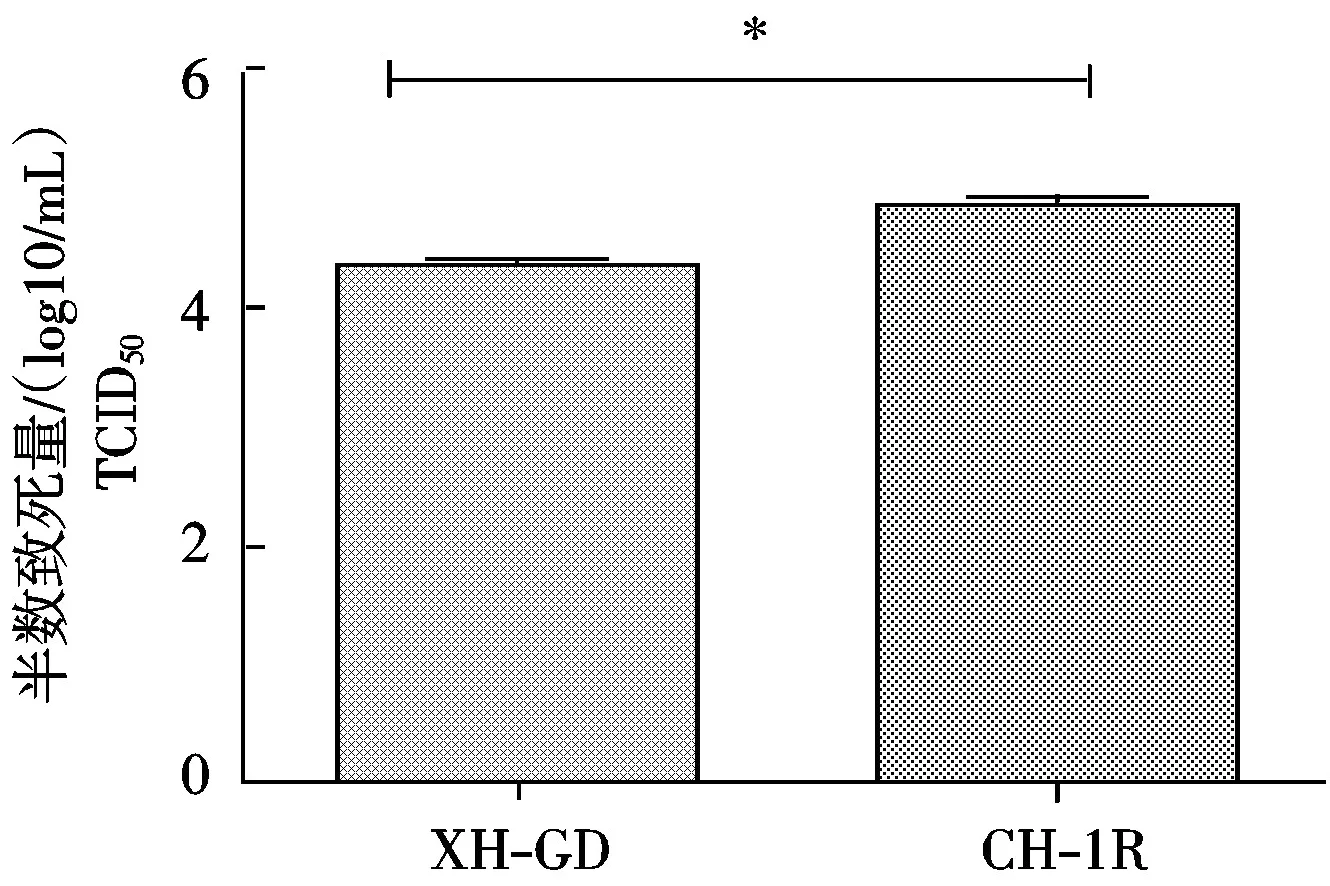
图6 PRRSV XH-GD、CH-1R毒株Nsp9基因对病毒滴度的影响Fig.6 Variance of viral titer of PRRSV XH-GD,CH-1R strain Nsp9 gene transfection in Marc-145 cells
3 讨论
前人研究结果表明,PRRSV毒力与Nsp9和Nsp10相关[20],和其他病毒蛋白相比,Nsp9高度保守,2006年之前的经典株和之后的变异株存在约12个氨基酸突变[17]。作为对病毒复制至关重要的酶,12个氨基酸的突变会不会造成对病毒复制的影响,故本研究克隆了2006年之前出现的弱毒株CH-1R的Nsp9基因和2006年之后出现的强毒株XH-GD的Nsp9基因,过表达之后,CH-1R的Nsp9基因相比XH-GD毒株的Nsp9基因更能促进病毒的复制,强、弱毒株之间的Nsp9基因存在功能差异,其是否与细胞免疫、抗药性存在关联,与毒力、聚合酶活性相关还需要进一步的试验数据验证[21-23]。也可能是这12个氨基酸的突变共同造成了Nsp9三级结构的变化,这个需要结构生物学来验证。
弱毒比强毒促进PRRSV复制,其原因可能是:弱毒株能适应Marc-145细胞,对细胞的嗜性更好;弱毒株Nsp9基因抑制干扰素、白介素等细胞因子或者其他细胞凋亡现象强于强毒的Nsp9基因;使弱毒株Nsp9基因与细胞的作用更强,可以充分利用宿主细胞蛋白促进自身的复制。从NCBI网站上预测Nsp9的活性区域为1 000~1 075 nt,本研究克隆的是Nsp9全基因,包括活性区域,是否活性区域的差别造成促进病毒复制的差别,这个需要进一步的试验验证。
关于PRRSVNsp9基因的研究日益增多,也逐步引起大家的关注,未来在预防和控制猪繁殖与呼吸综合征方面,Nsp9基因将成为新的作用靶点。目前PRRSV呈世界性广泛分布,在主要养殖国家如美国、英国、中国、荷兰、德国等都有流行[24-26]。其长时间持续感染和抗体依赖性增强效应使得猪场的净化十分困难。而Nsp9对病毒的复制有重要的作用,通过设计针对该聚合酶基因的抑制剂可能是未来预防和治疗猪繁殖与呼吸综合征的一个方向。

