解答位构性型元素推断题的有效策略
黑龙江 卢国锋
解答位构性型元素推断题的有效策略

原子结构、分子结构、化学键、元素周期律和元素周期表一起组成结构理论,它是研究元素化合物性质的重要依据,通常用“位、构、性”对此部分知识进行高度概括,其内在的逻辑性是考查科学素养的最佳素材之一。在由能力立意转向素质立意的过渡阶段,对此类型问题进行深度剖析,可以形成有效的解题策略。
一、高考档案
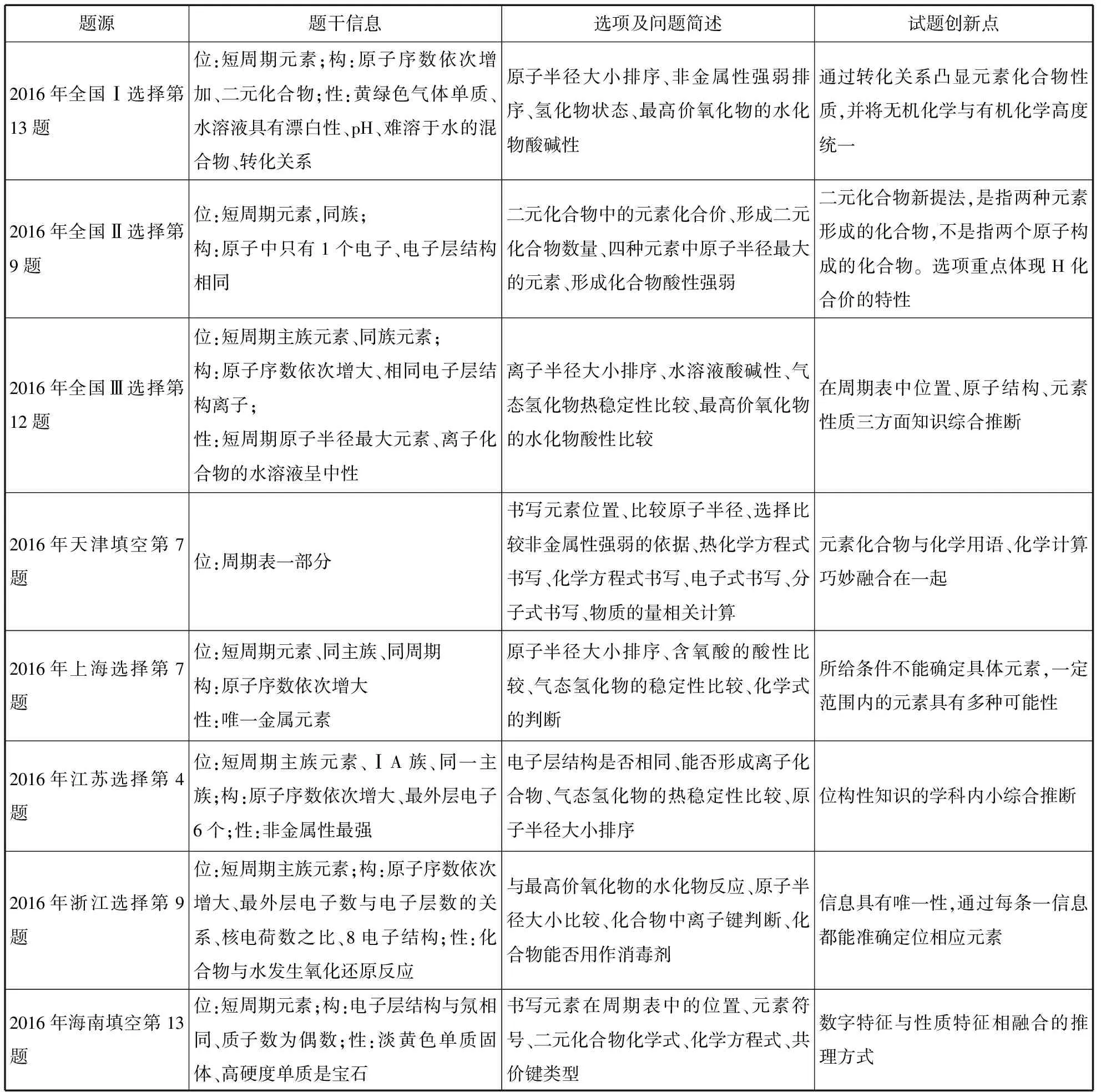
题源题干信息选项及问题简述试题创新点2016年全国Ⅰ选择第13题位:短周期元素;构:原子序数依次增加、二元化合物;性:黄绿色气体单质、水溶液具有漂白性、pH、难溶于水的混合物、转化关系原子半径大小排序、非金属性强弱排序、氢化物状态、最高价氧化物的水化物酸碱性通过转化关系凸显元素化合物性质,并将无机化学与有机化学高度统一2016年全国Ⅱ选择第9题位:短周期元素,同族;构:原子中只有1个电子、电子层结构相同二元化合物中的元素化合价、形成二元化合物数量、四种元素中原子半径最大的元素、形成化合物酸性强弱二元化合物新提法,是指两种元素形成的化合物,不是指两个原子构成的化合物。选项重点体现H化合价的特性2016年全国Ⅲ选择第12题位:短周期主族元素、同族元素;构:原子序数依次增大、相同电子层结构离子;性:短周期原子半径最大元素、离子化合物的水溶液呈中性离子半径大小排序、水溶液酸碱性、气态氢化物热稳定性比较、最高价氧化物的水化物酸性比较在周期表中位置、原子结构、元素性质三方面知识综合推断2016年天津填空第7题位:周期表一部分书写元素位置、比较原子半径、选择比较非金属性强弱的依据、热化学方程式书写、化学方程式书写、电子式书写、分子式书写、物质的量相关计算元素化合物与化学用语、化学计算巧妙融合在一起2016年上海选择第7题位:短周期元素、同主族、同周期构:原子序数依次增大性:唯一金属元素原子半径大小排序、含氧酸的酸性比较、气态氢化物的稳定性比较、化学式的判断所给条件不能确定具体元素,一定范围内的元素具有多种可能性2016年江苏选择第4题位:短周期主族元素、ⅠA族、同一主族;构:原子序数依次增大、最外层电子6个;性:非金属性最强电子层结构是否相同、能否形成离子化合物、气态氢化物的热稳定性比较、原子半径大小排序位构性知识的学科内小综合推断2016年浙江选择第9题位:短周期主族元素;构:原子序数依次增大、最外层电子数与电子层数的关系、核电荷数之比、8电子结构;性:化合物与水发生氧化还原反应与最高价氧化物的水化物反应、原子半径大小比较、化合物中离子键判断、化合物能否用作消毒剂信息具有唯一性,通过每条一信息都能准确定位相应元素2016年海南填空第13题位:短周期元素;构:电子层结构与氖相同、质子数为偶数;性:淡黄色单质固体、高硬度单质是宝石书写元素在周期表中的位置、元素符号、二元化合物化学式、化学方程式、共价键类型数字特征与性质特征相融合的推理方式
二、策略精髓
1.整合特性信息
①氢元素:原子核外只有1个电子,氕不含中子,原子半径最小,宇宙中最丰富的元素,成酸成碱的必要元素,与氧元素可组成两种常温下为液态的化合物H2O,H2O2;②锂元素:最轻的金属元素,唯一不能形成过氧化物的碱金属元素,电池原料之一;③碳元素:12C是相对原子质量的标准,形成化合物种类最多的元素,金刚石是自然界中硬度最大的物质,石墨有金属光泽,短周期元素中唯一导电的非金属,石墨烯是制造新型电池的原料,CH4是含氢质量分数最大的物质,最高价氧化物和氢化物都有温室效应;④氮元素:最稳定的单质气体,空气中含量最多的元素,粮食食品保护气,最高价氧化物水化物硝酸与氢化物氨反应生成盐,氢化物为NH3,液态时可以作致冷剂,在气态氢化物水溶液中是唯一呈碱性的物质;⑤氧元素:地壳中含量最高元素,对流层中臭氧吸收紫外线;⑥氟元素:非金属性最强的元素,无正价,能与水反应置换出水中的氧, HF为弱酸,CaF2难溶、AgF能溶于水,氢化物水溶液腐蚀玻璃;⑦钠元素:短周期原子半径最大、最活泼的金属元素,焰色反应呈黄色,过氧化钠用作供氧剂和漂白剂;⑧镁元素:镁在空气中燃烧发出耀眼白光, 镁在二氧化碳中燃烧产生黑色烟, 镁在氮气中燃烧,铝热反应的引发剂;⑨铝元素:地壳中含量最多的金属元素,与浓硫酸、浓硝酸在常温下发生钝化现象,铝与氢氧化钠溶液反应产生气体,氧化物及氧化物对应的水化物既能与酸又能与碱反应,防腐所用的“银粉”实际是铝粉;⑩硅元素:硅化学性质不活泼,但自然界中没有游离态的硅,而能与HF反应且有H2生成,与强碱溶液反应生成氢气,含氧酸不溶于水,硅为半导体常做芯片,二氧化硅是熔点最高的非金属氧化物,二氧化硅可作光导纤维;磷元素:白磷着火点低、易自燃,通常保存在水中,单质在氯气中燃烧生成白色烟雾;硫元素: 单质为淡黄色固体,是黑火药的主要成分之一, SO2是一种大气污染气体,可形成“酸雨”;氯元素: Cl2为黄绿色有毒的气体,气态氢化物的水溶液和最高价氧化物对应水化物均为强酸,高氯酸在无机含氧酸中酸性最强,单质的水溶液有漂白性,常用于自来水的消毒。
2.借助数学手段
不要死记硬背最外层与次外层电子数量关系,培养利用核外电子排布规律和画原子结构示意草图的推理能力,①如最外层电子数是次外层的一半,假设次外层为2则最外层为1,可推定Li;假设次外层为8则最外层为4,可推定Si;②如次外层电子数为最外层电子的2倍或3倍,假设次外层为2则最外层为4或6,可推定C或O;③如最外层电子数+最内层电子数=次外层电子数,信息可知该元素有3个电子层,第三层有电子意味着K、L层已排满,最外层电子数+2 =8,最外层电子数=6,可推定S。
3.注意反应条件
①高温、高压、催化剂三条件的是合成氨;②催化剂、加热两条件的有氨与氧气的反应、二氧化硫与氧气的反应、氯酸钾的分解;③放电条件的有氮气与氧气反应、氧气转化为臭氧;④光照条件的有氢气与氯气的反应、次氯酸的分解反应、甲烷与氯气的取代反应;⑤电解条件有活泼金属的冶炼、电解水、氯碱工业、电解氯化铜。
4.梳理常见规律
①阴上阳下规律,具有相同电子层结构的离子,阴离子在上一周期、阳离子在下一周期,如第2周期的O2-、F-与第3周期的Na+、Mg2+、Al3+的电子层排布相同;②“四同”半径比较规律,同周期元素原子从左到右原子半径逐渐减小,同主族元素原子和离子半径从上到下逐渐增大,相同核外电子排布的离子,核电荷数越大离子半径越小,同种元素阴离子半径大于原子半径,原子半径大于阳离子半径;③上下左右规律:同主族元素从上到下非金属性减弱、金属性增强,同周期元素从左到右金属性减弱、非金属性增强;④非金属性比较四条标准,一是与氢气化合的难易,二是气态氢化物的稳定性强弱,三是最高价氧化物的水化物酸性强弱,四是非金属性强的单质置换非金属性弱的单质;⑤金属性比较四条标准,一是与水反应的剧烈程度,二是与酸反应的剧烈程度,三是最高价氧化物的水化物碱性强弱,四是金属性强的单质置换金属性弱的单质;⑥化合价规律,奇偶一致性原则即主要化合价的数值为奇数的元素,其原子序数也为奇数;主要化合价的数值为偶数的元素,其原子序数也为偶数。最高价+│最低价│=8,最高价为氧化物,最低价为氢化物,最高价+最低价=0、2、4、6,分别为ⅣA、ⅤA、ⅥA、ⅦA;⑦判断8e-相对稳定结构规律,原子最外层电子数加化合价数值(不考虑正负)是否等于8。
5.消除认知误区
①最外层电子数的多少不是划分金属与非金属元素的标准,如H、He最外层电子数均小于4,最外层电子数的多少与金属性、非金属性强弱没有必然联系;②氢元素在化合物中一般为+1价,但在金属氢化物中为-1价;③含金属元素的离子也可能为阴离子,如AlO-2,不含金属元素的离子也可能是阳离子,如NH+4;④Na2O2中含有1个阴离子O2-2,Na2O2既有离子键也有非极性共价键;⑤稀有气体中不存在化学键,NH4NO3等铵盐是由非金属元素组成的离子化合物,AlCl3是由金属元素和非金属元素组成的共价化合物;⑥质量数、核素的相对原子质量、元素的相对原子质量是不同的三个概念,计算时可近似处理,不是所有元素都存在同位素,如钠只有一种核素;⑦只有由分子构成的物质才有分子式如CO2,而NaCl和C属于化学式,表示物质的组成元素和原子的最简整数比。
三、招法应用
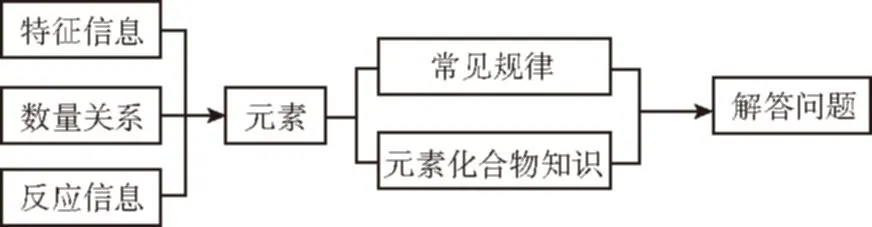
例1短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。
下列说法正确的是
( )
A.原子半径的大小Wlt;Xlt;Y
B.元素的非金属性Zgt;Xgt;Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
解析:将题目信息转译为对应的元素,n为黄绿色气体单质,n可确定为Cl2,q为含氯元素漂白性物质可确定是HClO,二元化合物意思是两种元素组成的化合物,二元化合物m为H2O、二元化合物r是HCl,Cl2光照条件与p反应生成HCl,确定二元化合物p含H,难溶于水,含氯元素混合物为卤代烃,二元化合物p为烷烃。H2O、CH4、HCl所含元素按原子序数从小到大排列为H、C、O、Cl。运用半径“四同”规律确定原子半径的大小:Wlt;Ylt;X,A选项错误;运用上下左右关系,非金属性强弱:Ygt;X,B选项错误;O的氢化物H2O和H2O2常温常压下为液态,C选项正确;X的最高价氧化物的水化物碳酸为弱酸,D选项错误。答案选C。
例2短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y的原子序数之和等于Z的原子序数;Y、Z为同周期相邻元素;X、W、Y分别排列在三个连续的奇数族,下列说法正确的是
( )
A.简单离子半径:Ygt;Zgt;W
B.最高价氧化物对应水化物的酸性:Ylt;Z
C.X分别与Y、Z形成的最简单化合物均属于电解质
D.工业上制备W单质的方法为电解熔融的W的氯化物
解析:从数量关系进行突破,依据原子序数和的关系列等式X+Y=Z,Y、Z为同周期相邻元素,原子序数应相差1,推得X的原子序数为1,为H元素;X、W、Y分别排列在三个连续的奇数族,应该是ⅠA、ⅢA、ⅤA,考虑原子序数依次增大条件,推得W为Al元素,Y为N元素,Z的原子序数=1+7=8,为O元素。A选项,具有相同电子层结构的离子,核电荷数越大离子半径越小,r(N3-)gt;r(O2-)gt;r(Al3+);B选项,O元素没有最高价含氧酸,B错误;C选项,H分别与N、O形成的最简单化合物为水、氨气,水为电解质,氨气为非电解质,C错误;D选项,氯化铝为共价化合物,熔融氯化铝不导电,无法通过电解熔融氯化铝制取金属铝,D错误;答案选A。
例3已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是( )
A.原子半径:Xgt;Ygt;Zgt;W
B.W的含氧酸的酸性比Z的含氧酸的酸性强
C.W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D.若W与X原子序数差为5,则形成化合物的化学式为X3W2
解析:通过已知信息将元素定位于元素周期表中,W、Z同主族,结合原子序数大小,可将W定位在上一周期、Z在下一周期,再根据X、Y、Z同周期画出初步草图如下:
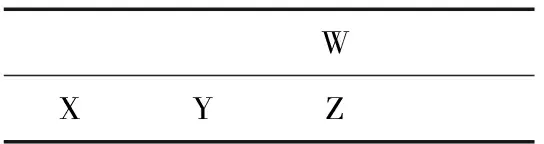
WXYZ

黑龙江省大庆市第五十六中学)

