MITFa及TYR基因在红色锦鲤体色发生不同阶段的表达分析
田 雪,庞小磊,王良炎,顾 靓,郭生强,李学军
( 河南师范大学 水产学院, 河南 新乡 453007 )
MITFa及TYR基因在红色锦鲤体色发生不同阶段的表达分析
田 雪,庞小磊,王良炎,顾 靓,郭生强,李学军
( 河南师范大学 水产学院, 河南 新乡 453007 )
本研究描述了红色锦鲤从出膜到体色形成的过程,总结和归纳不同发育阶段体色变化异同点,筛选出6个体色变化较显著时期,分别为1、2、3、4、12、48 日龄。利用荧光定量PCR分析MITFa及TYR基因在红色锦鲤6个体色变化时期的表达情况。结果显示,MITFa基因在1日龄时表达量最高,显著高于48日龄时(P<0.05),极显著高于其他4个时期(P<0.01)。48日龄时表达量次之,亦极显著高于2、3、4、12日龄 4个时期(P<0.01)。2、3、4、12日龄 4个时期MITFa基因表达量较低且不存在显著差异(P>0.05)。TYR基因在1日龄时表达量最高(P<0.01),4日龄时表达量显著高于12、48日龄(P<0.05),与2、3日龄不存在显著差异(P>0.05)。TYR基因表达量在2、3、12、48日龄 4个时期差异不显著(P>0.05)。MITFa和TYR基因在红色锦鲤体色形成过程中,表达水平整体呈现降低的趋势,其中MITFa基因表达量表现为先降后升,TYR基因则先降后升再降。以上结果显示MITFa、 TYR基因与锦鲤体色形成具有一定相关性,但MITFa和TYR基因在体色发生中的相互作用还有待进一步研究证实。
红色锦鲤;MITFa;TYR;表达分析;体色发生
鱼类体色丰富多彩,种类、性别、个体差异、甚至个体发育的不同阶段和部位都可能表现出不同颜色。除了种类、生理生化因素使鱼类体色产生差异,其生存的水域环境,摄食的饵料等一系列因素也可影响鱼类体色的形成[1-2]。环境、理化因子对鱼类体色的影响主要因其皮肤和鳞片上的色素细胞种类、数量和分布不同所致[3-6]。鱼类具有6种色素细胞,分别是黑色素细胞、红色素细胞、黄色素细胞、虹彩细胞、白色素细胞和蓝色素细胞。6种色素细胞含有不同的色素颗粒,色素颗粒的颜色、反光作用和运动迁移,使鱼类呈现从白到黑的多种颜色[7]。
鱼类色素细胞由神经嵴细胞分化形成,大量基因参与神经嵴细胞向色素细胞的迁移和分化[8]。MITF基因是黑色素细胞分化形成的重要转录因子,在鱼类色素细胞分化和成熟过程中发挥重要作用。TYR是黑色素合成的关键限速酶,调控黑色素颗粒的生成,MITF基因结合在下游TYR基因启动子区域,促进TYR基因的表达[9-12]。
锦鲤(Cyprinuscarpio),属鲤形目、鲤科、鲤属,是鲤鱼人工选育过程形成的观赏品种[13-14]。作为高档观赏鱼,锦鲤在其体色鉴赏上已形成一定系统[15],常见种类主要包括红白、大正三色、别光等。但是,这些类型体色多成斑块状或镶嵌型,遗传背景复杂。因此,本试验选用体色单一的红色锦鲤作为研究对象,观察其体色发生过程,并对其个体发育不同阶段MITFa和TYR基因进行荧光定量分析,探索MITFa和TYR基因与锦鲤体色发生的关系,为研究锦鲤体色形成机制提供理论依据,也为鱼类色素细胞系的建立提供基础研究资料。
1 材料与方法
1.1 试验鱼
2015年3月从河南师范大学水产养殖基地挑选性腺发育良好的红色锦鲤亲鱼6尾(♀∶♂=1∶1)进行人工干法授精,受精卵置于孵化桶孵化,用于仔鱼体色发生观察。
1.2 仔鱼体色发生观察和样品收集
仔鱼出膜后,0~25 日龄每日观察、取样一次,25~60 日龄每2 d取样一次。随机取样30尾仔鱼,10尾在OLYMPUS BX51研究级显微镜下观察、拍照,20尾用RNAlater(Life technologies公司,美国)保存于-80 ℃,用于RNA提取。
1.3 总RNA提取和RT-PCR扩增
依据体色发生观察结果,对1、2、3、4、12、48日龄的红色锦鲤仔鱼进行RNA提取,1%琼脂糖凝胶电泳和ND-2000核酸蛋白仪检测RNA完整性、纯度和OD值。PrimeScriptTMRT reagent Kit with gDNA Eraser(Takara公司,大连)合成cDNA用于PCR扩增。
利用Primer3Plus在线软件设计MITFa和TYR引物(http://www.primer3plus.com/)(表1),由苏州金唯智生物公司合成。取适量cDNA为模板,进行PCR扩增。PCR产物经琼脂糖凝胶电泳检测,连接pMD18-T载体(Takara公司,大连),转化DH5α感受态细胞,经蓝白斑筛选及双酶切验证的阳性克隆送苏州金唯智生物有限公司进行测序。

表1 试验用PCR 引物及序列
1.4 实时荧光定量PCR (qRT-PCR)
参照TaKaRa荧光定量PCR试剂盒说明书(TaKaRa,大连),将6个发育阶段的红色锦鲤cDNA作为模板,设3个重复,体系为10 μL: 上下游引物各0.3 μL,SYBR Premix Ⅱ TaqTM(2×) 5 μL,cDNA 1 μL,RNase free H2O 3.4 μL。qRT-PCR反应条件如下:95 ℃预变性30 s,95 ℃变性5 s,62 ℃ 20 s, 40 个循环。反应结束分析溶解曲线和Ct值,2-△△Ct法计算每个阶段MITFa和TYR基因的相对表达水平,△Ct=Ct目的基因-Ctβ-actin,△△Ct=(Ct目的基因-Ctβ-actin)试验组-(Ct目的基因-Ctβ-actin)对照组。
1.5 统计学分析
利用SPSS 20.0单因素方差分析表达量数据并进行LSD和Duncan氏比较,结果用平均值±标准差表示。
2 结 果
2.1 红色锦鲤体色发生观察
红色锦鲤出膜前时期,受精卵依靠卵黄囊提供能量用来发育,此时胚胎呈现卵黄囊颜色,表现为微弱黄色。1日龄仔鱼除眼部呈现黑色外,其他部位无色素细胞,鱼苗整体表现为无色透明。仔鱼发育至2日龄,显微镜下可观察到体色变化,色素细胞集中在锦鲤背部,从头部逐渐向尾部扩散。发育至3日龄,仔鱼背部颜色加深,腹部开始出现色素细胞。4日龄,色素细胞完全分布在背部及腹部。5~14日龄,体色逐渐加深,发育至48日龄,鳞片完全形成,鱼体呈现红色,基本同成鱼颜色一致(图1)。

图1 不同发育时期的红色锦鲤a,1日龄; b,2日龄;c,3日龄;d,4日龄;e,12日龄;f,48日龄.1,背部;2,腹部;3,眼.
2.2 锦鲤体色发生过程中MITFa基因的表达
通过红色锦鲤的体色发生观察,筛选出6个关键时期。检测MITFa基因在1、2、3、4、12、48日龄的表达情况,荧光定量PCR结果显示,MITFa基因在1日龄时表达量是1.053±0.409,显著高于48日龄(P<0.05),1、48 日龄 MITFa表达量均极显著高于其他4个时期(P<0.01)。12日龄时表达量最低,但与2、3、4日龄 3个发育阶段不存在显著差异(P>0.05)(图2)。
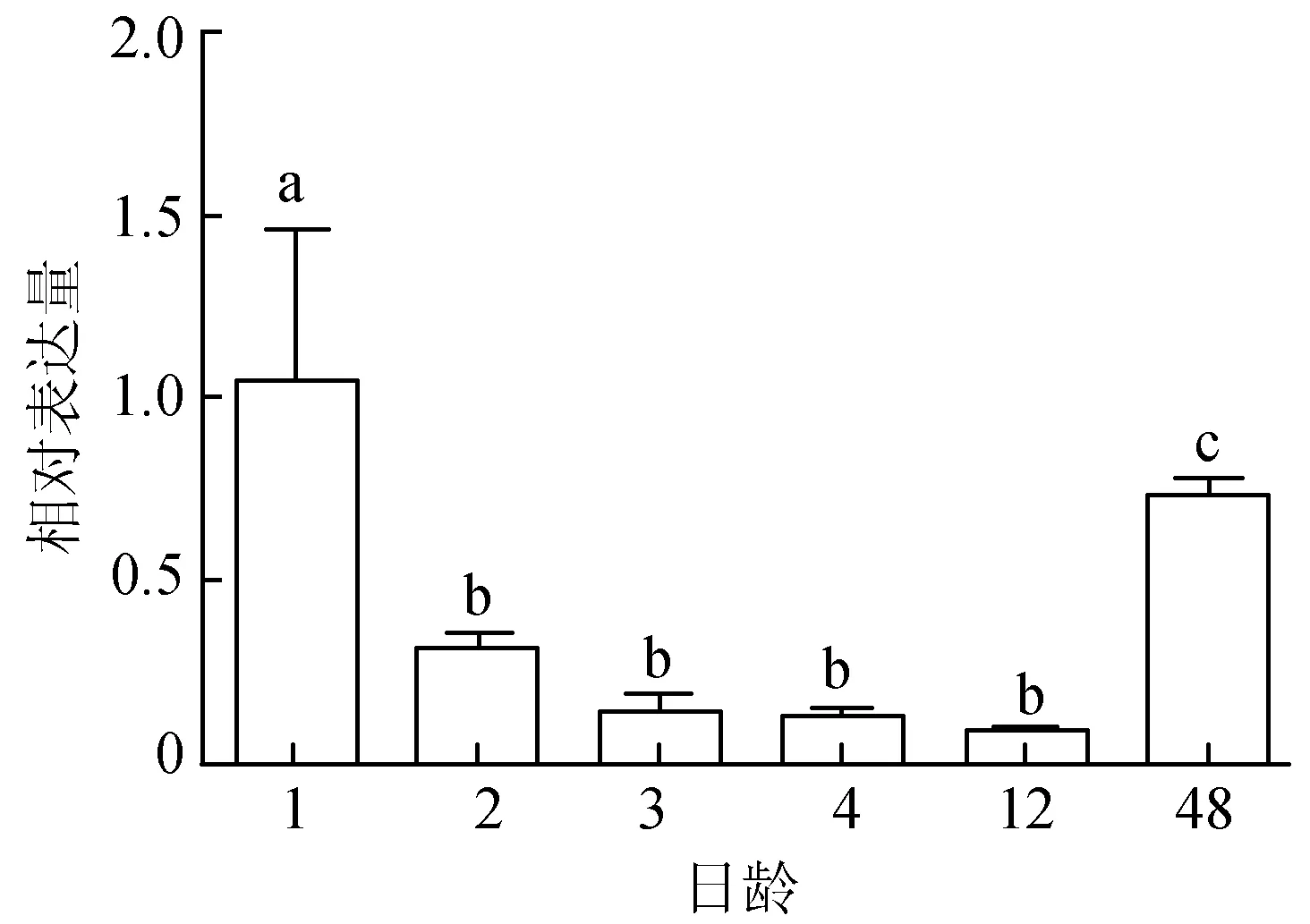
图2 锦鲤体色发生过程中MITFa基因的表达
2.3 锦鲤体色发生过程中TYR基因的表达
荧光定量PCR结果显示,TYR基因在红色锦鲤上述6个体色发生阶段的表达情况整体呈降低趋势。1日龄TYR基因表达量是1.088±0.572,极显著高于其他5个时期(P<0.01),4日龄表达量显著高于12日龄、48日龄(P<0.05),而与2日龄、3日龄这两个时期不存在显著差异(P>0.05),2、3、12、48日龄 4个时期TYR基因表达量不存在显著差异(P>0.05),48日龄 TYR基因的表达量最低,为0.0388±0.00613(图3)。
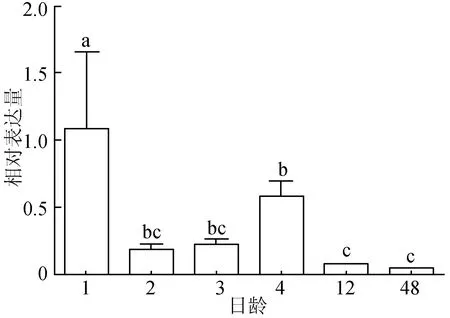
图3 锦鲤体色发生过程中TYR基因的表达
3 讨 论
3.1 红色锦鲤不同发育时期体色发生观察
利用显微观察方法对红色锦鲤出膜前、出膜后及体色完全形成等一系列体色发生过程进行了详细描述。出膜前时期受精卵依靠卵黄囊提供能量进行发育,胚胎呈现卵黄囊颜色,表现为微弱黄色,与一般鱼类胚胎颜色相近[4]。出膜后1日龄仔鱼除眼部呈现黑色,其他部位无色素细胞,身体透明,可能是鱼体内色素细胞还未开始分化发育或刚开始分化,色素颗粒尚未合成,导致整体表现为无色透明[16]。发育至2日龄,随着黄色素和红色素细胞不断分化、发育,可在显微镜下观察到体色变化,色素细胞集中呈现于锦鲤背部,从头部逐渐向尾部扩散[17]。这说明色素细胞分化存在时空差异,随着时间发展,不断向尾部迁移扩散[18]。仔鱼发育至3日龄,背部颜色加深,腹部开始出现色素细胞,这可能是由于色素细胞分化的同时,伴随着色素颗粒的合成和积累。Hultman等[19]研究证实鱼类色素细胞是由神经嵴细胞通过背腹轴模式迁移,本研究中红色锦鲤体色发生同样存在背腹轴模式。发育至4日龄,色素细胞完全分布在背部及腹部,同样也是黄色素细胞和红色素细胞相互作用的过程[20]。5~14日龄,随着色素颗粒的沉着,体色逐渐加深。发育至48日龄,鳞片完全形成,鱼体呈现红色,基本同成鱼颜色一致。
3.2 MITFa基因和TYR基因在发育过程中的表达差异
MITFa基因在红色锦鲤体色发生的6个时期均有一定量的表达。这与Liu等[12]研究结果相似,即在无黑色素细胞的锦鲤囊胚、刚出膜仔鱼、红白锦鲤和黄金锦鲤中均检测到MITFa基因。已有的研究表明,MITFa基因不仅参与黑色素细胞发育与分化,而且在体色形成相关的非黑色素细胞分化及成体体色维持中扮演重要角色[9]。发育至1日龄, MITFa基因表达量最高,可能是由于色素前体细胞向色素细胞分化过程中MITFa基因发挥一定作用导致[11]。随着色素细胞不断分化成熟,色素细胞迁移和扩散逐渐减慢,MITFa基因表达水平也呈降低趋势[21]。
TYR是一种广泛存在于植物、动物和细菌中的跨膜转运蛋白,主要存在于黑色素小体中,仅有一小部分在细胞质。TYR基因在红色锦鲤体色发生阶段都有存在,与王巍等[10,22]研究结果相似。瓯江彩鲤、纯色及黑色斑块锦鲤皮肤中均存在TYR基因的表达,说明TYR不仅在黑色素细胞中起作用,在其他类型色素细胞中也发挥一定功能[23]。MITFa和TYR基因均在1日龄表达量达到最高,显著高于其他5个时期,进一步表明在红色锦鲤体色形成初期,MITFa基因对TYR具有上调效应。随着体色的形成,MITFa基因表达量呈递减趋势,TYR基因表达量同样表现为逐渐降低。但4日龄TYR基因表达量相对增加,原因可能由于锦鲤体内存在多种酪氨酸酶形式,部分抑制状态在这个时期被激活,导致表达量增高[24- 25]。
近年来,关于锦鲤体色研究主要集中在色素着色物质及理化因素对鱼类体色的影响方面[1-2,26-27],而对于色素相关基因的研究大多从黑色素细胞色素合成关键基因入手,涉及色素细胞迁移和分化的研究,较为鲜见[9-10,12],关于MITF及TYR基因的研究主要集中在哺乳动物黑色素细胞方面[28],MITF基因可调控酪氨酸基因家族的表达,从而参与黑素生成的调控, MITF基因在生物体内能调控黑色素合成关键限制酶——酪氨酸酶基因的表达,影响黑色素细胞的分化[29]。关于这两个基因在鱼类不同发育阶段的研究较少,如Darias等[30]在其研究中所报道的那样,塞内加尔鳎(Soleasenegalensis)不同发育阶段过程中,MITF基因的表达也表现为先降后升的趋势,同时TYR基因的表达也表现为两个峰值,且其表达趋势也与在锦鲤中的表达显示出一定的相似性。但这两种基因对于其他色素细胞分化和形成是否起作用,以及如何发挥功能均未见报道。
锦鲤色素调控机制非常复杂,关于锦鲤色素调控通路、色素细胞的相互作用及其模式形成已开展相关研究[8, 19, 31-33]。在这些研究中也都提及色素细胞的调控不是由单因素决定,但对于参与黑色素细胞形成及色素合成的调控基因是否在其他类型色素细胞中发挥作用,所开展的研究相对较少。本研究对锦鲤体色发生过程进行显微观察,并分析MITFa和TYR基因在锦鲤体色发生过程中的表达水平,为将来深入研究色素形成相关基因在锦鲤体色形成的作用提供基础试验数据,但MITFa和TYR基因在非黑色素细胞中的作用及相互关系还有待进一步深入研究。
4 结 论
本研究通过显微观察技术,对红色锦鲤体色发生过程进行了详细观察,从中筛选出6个体色变化较显著的时期, 并对这6个时期中MITFa及TYR基因的表达进行荧光定量分析,确定了这两个色素关键基因的表达变化情况。结果显示MITFa、TYR基因与红色锦鲤体色形成具有一定相关性,但MITFa和TYR基因在体色发生中的相互作用还有待进一步研究证实。
[1] 张春兰, 赵文, 徐立蒲, 等. 微生态制剂和着色剂对锦鲤体色的影响[J]. 大连海洋大学学报, 2011, 26(4):328-332.
[2] 崔培, 姜志强, 王雪, 等. 不同蛋白水平的虾青素饲料对锦鲤体色、生长及免疫的影响[J]. 上海海洋大学学报, 2012, 21(3):382-388.
[3] 王安利, 刘金海, 王维娜. 锦鲤总色素及色素组分的比较研究[J]. 水生生物学报, 2005, 29(6):694-697.
[4] 徐伟, 李池陶, 曹顶臣, 等. 几种鲤鲫鳞片色素细胞和体色发生的观察[J]. 水生生物学报, 2007, 31(1):67-72.
[5] 马雪, 董少杰, 贾艳红. 五种观赏鱼色素细胞的初步组织学研究[J]. 天津农业科学, 2013, 19(12):70-72.
[6] 易云海, 宋一舸, 杨舟, 等. 鱼鳍和鳞片色素组成的比较观察[J]. 激光生物学报, 2014, 23(1):77-82.
[7] Leclercq E, Taylor J F, Migaud H. Morphological skin colour changes in teleosts[J]. Fish and Fisheries, 2010, 11(2):159-193.
[8] Rawls J F, Mellgren E M, Johnson S L. How the zebrafish gets its stripes[J]. Developmental Biology, 2001, 240(2):301-314.
[9] Johnson S L, Nguyen A N, Lister J A. MITFa is required at multiple stages of melanocyte differentiation but not to establish the melanocyte stem cell[J]. Developmental Biology, 2011, 350(2):405-413.
[10] 王巍, 胡红霞, 孙向军, 等. 锦鲤酪氨酸酶基因序列分析及其在不同锦鲤品系不同组织中的表达[J]. 水产学报, 2012, 36(11):1658-1666.
[11] 白瑞, 张美萍, 乔德瑞, 等. MITF 基因与动物毛色的研究进展[J]. 上海畜牧兽医通讯, 2006(4):2-3.
[12] Liu J, Wen S, Luo C, et al. Involvement of the MITFa gene in the development of pigment cell in Japanese ornamental (Koi) carp (CyprinuscarpioL.)[J]. Genetics and Molecular Research:GMR, 2015, 14(1):2775.
[13] Watson C A, Hill J E, Pouder D B. Species profile: koi and goldfish[R]. Stoneville:Southern Regional Aquaculture Center Publication, 2004.
[14] 王旭霞, 邵力. 观赏鱼体色的研究现状[J]. 水利渔业, 2008, 28(2):57-59.
[15] 霍凤敏, 章之蓉, 邹记兴. 中国观赏鱼产业发展概况[J]. 河北渔业, 2010(1):51-53.
[16] 文胜, 刘锦辉, 张永勤, 等. 色素细胞谱系及其发育调控研究进展[J]. 湖南师范大学:自然科学学报, 2014, 37(6):24-28.
[17] 林翔, 周桂炫, 陈菲, 等. 色素细胞发育分化的分子调控机制[J]. 福州大学学报:自然科学版, 2011, 39(5):649-657.
[18] Leclercq E, Taylor J F, Migaud H. Morphological skin colour changes in teleosts[J]. Fish and Fisheries, 2010, 11(2):159-193.
[19] Hultman K A, Johnson S L. Differential contribution of direct-developing and stem cell-derived melanocytes to the zebrafish larval pigment pattern[J]. Developmental Biology, 2010, 337(2):425-431.
[20] Watanabe M, Kondo S. Is pigment patterning in fish skin determined by the Turing mechanism[J]. Trends in Genetics, 2015, 31(2):88-96.
[21] Matthews S A. Observations on pigment migration within the fish melanophore[J]. Journal of Experimental Zoology, 1931, 58(1):471-486.
[22] 杨新鑫, 王成辉, 马玉清, 等. 瓯江彩鲤酪氨酸酶基因的克隆与序列分析[J]. 上海海洋大学学报, 2012, 21(1):14-20.
[23] Parichy D M. Evolution of danio pigment pattern development[J]. Heredity, 2006, 97(3):200-210.
[24] Venizelos A, Benetti D D. Pigment abnormalities in flatfish[J]. Aquaculture, 1999, 176(1/2):181-188.
[25] Guo H, Huang B, Zhang S, et al. Biochemical and histochemical activities of TYRosinase in the skins of normal and albino turbotScophthalmusmaximus[J]. Fish Physiology and Biochemistry, 2003, 29(1): 67-76.
[26] 何志刚, 王冬武, 邓时铭, 等. 不同饲料对锦鲤体色和着色成本的影响[J]. 中国饲料添加剂, 2015(8): 23-25.
[27] 何志刚, 王冬武, 曾国清,等. 不同饲料对红白锦鲤生长、体色和血液生化指标的影响[J]. 广东农业科学, 2015, 42(20):107-111.
[28] Poulaki V, Mitsiades N, Fiskus W. Bromodomain (BRD) inhibition as a novel strategy to inhibit the microphthalmia-associated transcription factor (MITF) axis in uveal melanoma (UM)[J]. Investigative Ophthalmology & Visual Science, 2015, 56(7):5337.
[29] Fang D, Setaluri V. Role of microphthalmia transcription factor in regulation of melanocyte differentiation marker TRP-1[J]. Biochemical and Biophysical Research Communications, 1999, 256(3):657-663.
[30] Darias M J, Andree K B, Boglino A, et al. Coordinated regulation of chromatophore differentiation and melanogenesis during the ontogeny of skin pigmentation ofSoleasenegalensis(Kaup, 1858)[J]. PloS One, 2013, 8(5):e63005.
[31] Schliwa M, Bereiter-Hahn J. Pigment movements in fish melanophores: morphological and physiological studies[J]. Zeitschrift für Zellforschung und Mikroskopische Anatomie, 1973, 147(1):127-148.
[32] Bullara D, De Decker Y. Pigment cell movement is not required for generation of Turing patterns in zebrafish skin[J]. Nature Communications, 2015(6):6971.
[33] Volkening A, Sandstede B. Modelling stripe formation in zebrafish: an agent-based approach[J]. Journal of the Royal Society Interface, 2015, 12(112): 106-114.
ExpressionofMITFaandTYRGeneinBodyColorFormationinRedColorKoiCarpCyprinuscarpioatDifferentStages
TIAN Xue, PANG Xiaolei, WANG Liangyan, GU Liang, GUO Shengqiang, LI Xuejun
( College of Fisheries, Henan Normal University, Xinxiang 453007, China )
This study described the process of the color formation in koi carpCyprinuscarpiowith red color from hatching to whole body color formation. We summarized and concluded the distinct changes in body color during pigmentation development and selected 6 obvious stages of pigmentation ontogenesis, including 1, 2, 3, 4, 12 and 48 dph (day post hatching), respectively. We assessed the expression of the MITFa (Microphthalmia-associtated Transcription Factor) and TYR (TYRosinase) gene in 6 stages by quantitative real-time PCR. The results showed that the expression level of MITFa was the maximum in 1 dph, higher than 48 dph (P<0.05) and significantly higher than other four stages (P<0.01). In addition, there was no significant difference among 2, 3, 4 and 12 dph (P>0.05). Also, the TYR gene was most highly expressed in the 1 dph (P<0.01). And in the 4 dph, TYR expression was significantly higher than the 12 dph and 48 dph, but no difference with 2 dph and 3 dph. There was no significant difference in TYR among the 2, 3, 12 and 48 dph (P>0.05). In conclusion, both MITFa and TYR gene expression trend were identified to decline associated with pigmentation development in koi carp with red color. The expression of MITFa gene was declined firstly and subsequently rised. But the expression trend of TYR gene was fluctuantly changed, which initially exhibited decreased and then reduced again. The findings indicated that the MITFa, and TYR gene had a relationship with the body color formation in koi carp, but the interaction between MITFa and TYR in the color formation remains to be further studied.
Cyprinuscarpio; MITFa; TYR; expression analysis; body color formation
10.16378/j.cnki.1003-1111.2017.02.014
2016-04-08;
2016-06-12.
国家自然科学基金资助项目(31402294);国家级大学生创新创业训练计划项目(201410476006);河南省国际科技合作计划项目(152102410040);河南师范大学博士科研启动费支持项目(qd13056).
田雪(1981-),女,讲师;研究方向:鱼类体色调控研究. E-mail: tianxue_81@126.com. 通讯作者:李学军(1967-),男,教授;研究方向:鱼类遗传育种. E-mail: xjli@htu.cn.
S965.8
A
1003-1111(2017)02-0197-05

