响应面法优化扁桃果皮熊果酸的纯化工艺
张俊,李进,吕海英,马雪
(新疆特殊环境物种保护与调控生物学实验室,干旱区植物逆境生物学重点实验室,新疆师范大学 生命科学学院,新疆 乌鲁木齐,830054)
响应面法优化扁桃果皮熊果酸的纯化工艺
张俊,李进*,吕海英,马雪
(新疆特殊环境物种保护与调控生物学实验室,干旱区植物逆境生物学重点实验室,新疆师范大学 生命科学学院,新疆 乌鲁木齐,830054)
利用响应面法优化扁桃果皮中熊果酸的最佳纯化工艺。为纯化扁桃果皮中的熊果酸,以吸附量与解析率为评价指标,从6种大孔树脂筛选出AB-8和HPD100两种最优树脂,按照一定质量比进行混合试验。在单因素试验基础上,根据Box-Benhnken 实验原理设计响应面试验,得到优化纯化工艺为:上样液浓度0.31 mg/mL,上样液pH5.01,上样液流速1.0 mL/min;洗脱液浓度90%,洗脱液pH 5.06,洗脱液流速1.0 mL/min,在此条件下熊果酸的纯度由原来的6.35%提高到32%,提高了5.03倍。
扁桃;熊果酸;混合树脂;响应面
扁桃(AmygdaluscommunisL.),属蔷薇科(Rosaceae)桃属(AmygdalusL.)乔木,为世界上著名的木本油料树和干果树种[1]。我国扁桃的规模化生产主要集中在新疆的喀什和和田地区[2],以喀什莎车县为主产区[3],扁桃的生产为当地果农带来了丰厚的经济效益,同时,加工过程中也产生了大量果皮废弃物,而果皮中含有具有生物活性的熊果酸[4]。熊果酸是多种天然产物的功能性成分[5],具有抗氧化、保肝、抗肿瘤、抗炎抑菌、降低血脂等多种活性[6-11],具有广泛的应用前景。
大孔吸附树脂广泛应用于关于黄酮、多糖、多酚、皂苷等活性成分的分离纯化[12-15],其成本较低、吸附速度快、洗脱容易等优点[16]。扁桃的研究主要有营养功效及栽培技术,但对扁桃果皮熊果酸研究鲜有报导。本实验以扁桃果皮为原料来提取扁桃果皮中的熊果酸。
1 材料与方法
1.1 材料与试剂
扁桃果皮,2016年8月下旬采集于新疆莎车县扁桃种植区,由本实验室植物学专家鉴定。扁桃干燥果皮经粉碎机粉碎,过40目筛后,存于室内阴凉干燥处备用。
熊果酸标准品:上海源叶生物科技有限公司;乙醇、香草醛-冰醋酸、高氯酸、冰醋酸,均为分析纯;蒸馏水。
1.2 仪器与设备
多功能粉碎机,永康市小宝电器有限公司;RV10自动控制型立式旋转蒸发仪,德国IKA集团; AUY220电子天平,日本岛津公司;TDL-60-B台式离心机,长沙湘仪仪器有限公司;VIS-7220紫外可见分光光度计,上海恒平科学仪器有限公司。
1.3 实验方法
1.3.1 熊果酸标准曲线的绘制
精密称取干燥至恒重的熊果酸标准品5 mg,无水乙醇定容至50 mL容量瓶中,即得0.1 mg/mL的熊果酸标准溶液。准确吸取熊果酸标准溶液0.1、0.2、0.3、0.4、0.5、0.6 mL分别置于6个比色管内,水浴加热挥去溶剂,加入5%香草醛-冰乙酸溶液0.2 mL,加入高氯酸0.8 mL,摇匀;在60℃的水浴锅内进行显色处理15 min,用冰乙酸定容至5 mL,摇匀。以空白试剂为参比,测定546 nm波长处吸光度,以熊果酸标准品含量(μg/mL)为横坐标,吸光度为纵坐标绘制标准曲线[17-18]。得回归方程y=0.067x-0.003 3,相关系数R2=0.997 8。
1.3.2 样品溶液的制备
取2 g扁桃果皮粉,以体积分数为65%乙醇为提取液,料液比1∶20(g∶mL),80 ℃提取1.5 h,浸提2次,合并浸提液,减压浓缩,常温下定容至100 mL容量瓶中,待用。
1. 4 大孔树脂的筛选
1.4.1 大孔树脂预处理[19]
D101、AB-8、HPD-100、X-5、S-8和NKA-9大孔吸附树脂,使用体积分数95%乙醇溶液浸泡24 h,用蒸馏水冲洗树脂无醇味,然后进行酸碱处理,5% HCl溶液浸泡3 h,5% NaOH溶液浸泡3 h,分别用蒸馏水洗至溶液pH值为中性,放入烘箱50 ℃烘干,备用。
1.4.2 大孔树脂静态吸附和解吸试验
取已处理好的大孔吸附树脂各2.0 g,置于250 mL 锥形瓶中,加入熊果酸提取液20 mL,室温置于120 r/min振荡器吸附24 h。将充分吸附后的树脂过滤,置于250 mL锥形瓶中,再加入95%的乙醇20 mL,室温置于振荡器洗脱24 h,计算树脂的静态饱和吸附率和解吸量、解吸率。
吸附量/(mg·g-1)=(C0-C1)V1/m
(1)
解吸量/(mg·g-1)=C2V2/m
(2)
解吸率/%=[C2V2/(C0-C1)V1]×100
(3)
式中:C0为上样液中熊果酸质量浓度,mg/mL;C1为吸附液中熊果质量酸浓度,mg/mL;C2为解吸液中熊果酸质量浓度,mg/mL;m为干树脂质量,g;V1为吸附液体积,mL;V2为解吸液体积,mL。
上述方法选出的效果较好的2种树脂按照不同质量比例混合[20],准确称取2.0 g预处理过的混合树脂放入锥形瓶中,量取0.15 mg/mL的扁桃果皮熊果酸溶液20 mL进行吸附和洗脱,计算吸附率和洗脱率,选出最优的混合比例。
1.5 大孔树脂动态吸附和解吸单因素试验
1.5.1 大孔树脂动态吸附单因素试验
准确量取已预处理好的大孔吸附树脂各8 mL湿法装柱,分别考察上样液浓度、上样量、pH、流速对吸附率的影响,测定流出液中熊果酸的含量,计算吸附率。
1.5.2 大孔树脂动态解吸单因素试验
按上述确定的最佳吸附条件上样,用3BV蒸馏水冲洗,分别考察洗脱液体积分数、洗脱量、pH、流速对解吸率的影响,测定流出液中熊果酸的含量,计算解吸率。
1.6 吸附与解吸响应面试验
在单因素试验基础上,通过 Design-Expert 8.0.6.1软件,根据Box-Benhnken 实验原理设计响应面试验,试验因素水平见表1、表2。

表1 吸附响应面因素水平表Table 1 Factors and levels of response surface design for the optimization of adsorption conditions

表2 解吸响应面因素水平表Table 2 Factors and levels of response surface design for the optimization of desorption conditions
2 结果与分析
2.1 大孔树脂的筛选
2.1.1 大孔树脂静态吸附和解吸试验
6种不同型号树脂对扁桃果皮熊果酸的静态吸附和解吸性能试验结果见表3。S-8和HPD100树脂吸附量较大,但在静态解吸试验中,AB-8解吸率较大,综合吸附量与解吸率数据,最终选用AB-8和HPD100树脂按一定质量比进行混合。

表3 不同树脂对熊果酸的静态吸附和解吸性能Table 3 Static Adsorption and Desorption capabilities of different resins to ursolic acid
2.1.2 AB-8和HPD100树脂混合比例的筛选
AB-8和HPD100按照不同质量比例混合,静态吸附和解吸性能试验结果见图1。当质量比例为1∶2时纯化效果最佳,故最终选择AB-8和HPD100的混合质量比例为1∶2。
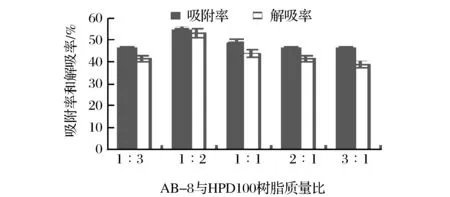
图1 AB-8和HPD100的混合比例的筛选Fig.1 Determination of the ratio of AB-8 and HPD100
2.2 大孔树脂动态吸附和解吸试验
2.2.1 大孔树脂动态吸附单因素试验
由图2可以看出,当上样液质量浓度为0.35 mg/mL时,吸附率达到最大,之后树脂吸附率随着上样液质量浓度增加而减小。这可能是上样液浓度达到0.35 mg/mL时,树脂达到吸附饱和[21],又因为随着上样液质量浓度的增大,树脂吸附的杂质量也有所增加,产生多层吸附,树脂微孔堵塞,导致吸附率降低[22],故选择上样液质量浓度为0.35 mg/mL。
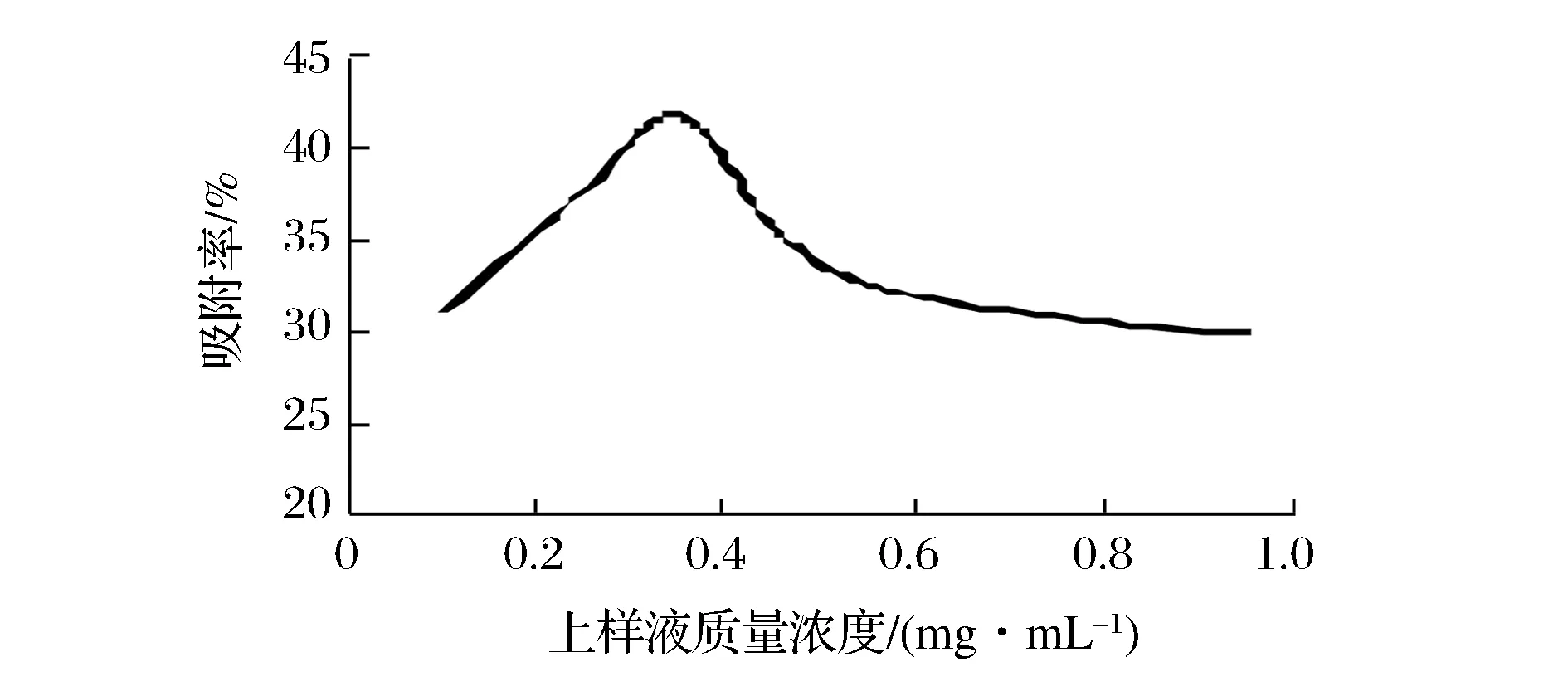
图2 上样液浓度对吸附率的影响Fig.2 Effect of sample concentration on the adsorption rate
由图3可知,当上样量为2 BV时,流出液中熊果酸的浓度达到上样液浓度的10%,为大孔树脂的泄漏点[23],随着上样量的增加,流出液中熊果酸浓度逐渐增大,为了避免样品浪费,选择最佳上样量为2 BV。

图3 上样量对吸附率的影响Fig.3 Effect of sample volume on the adsorption rate
如图4所示,当pH=5时吸附率达到最大值,随着pH值的继续增大,树脂吸附率逐渐减小,这是因为pH值过低熊果酸以佯盐形式存在,不利于其吸附;pH值过高则以离子形式存在,都不利于被弱极性的树脂吸附[24],故选择上样液pH=5 为最佳。

图4 上样液pH对吸附率的影响Fig.4 Effect of sample pH on the adsorption rate
从图5可知,随着上样液流速的增大,树脂吸附率逐渐降低。上样液流速对树脂吸附的影响主要是溶质向树脂表面的扩散作用[25]。流速太快,不利于上样液与树脂表面充分接触,吸附率降低,但流速过低,生产周期延长,生产效率降低。综合考虑选取上样液流速为2.0 mL/min。
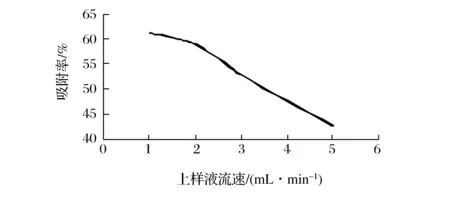
图5 上样液流速对吸附率的影响Fig.5 Effect of flow rate on the adsorption rate
2.2.2 大孔树脂动态解吸单因素试验
由图6所示,当洗脱液体积分数为95%时,熊果酸解吸率接近最大值。洗脱液体积分数过低,熊果酸不易被洗脱,体积分数过大,部分杂质被一起洗脱。故选用体积分数为95%的乙醇进行解吸。

图6 洗脱液体积分数对解吸率的影响Fig.6 Effect of eluent concentration on the desorption rate
由图7可知,洗脱液用量为2BV时,洗脱液中熊果酸浓度达到最大值,增加洗脱液用量,熊果酸浓度降低,当洗脱液用量为3BV 时,洗脱液中熊果酸浓度不足0.01 mg/mL,说明熊果酸基本洗脱完全[26]。

图7 洗脱液用量对解吸率的影响Fig.7 Effect of eluent volume on the desorption rate
由图8可知,当洗脱液pH=5时解析率达到最大值,说明洗脱液偏弱酸时,解吸率效果较好,继续增大pH,解吸率快速降低。因此选择洗脱液pH=5。
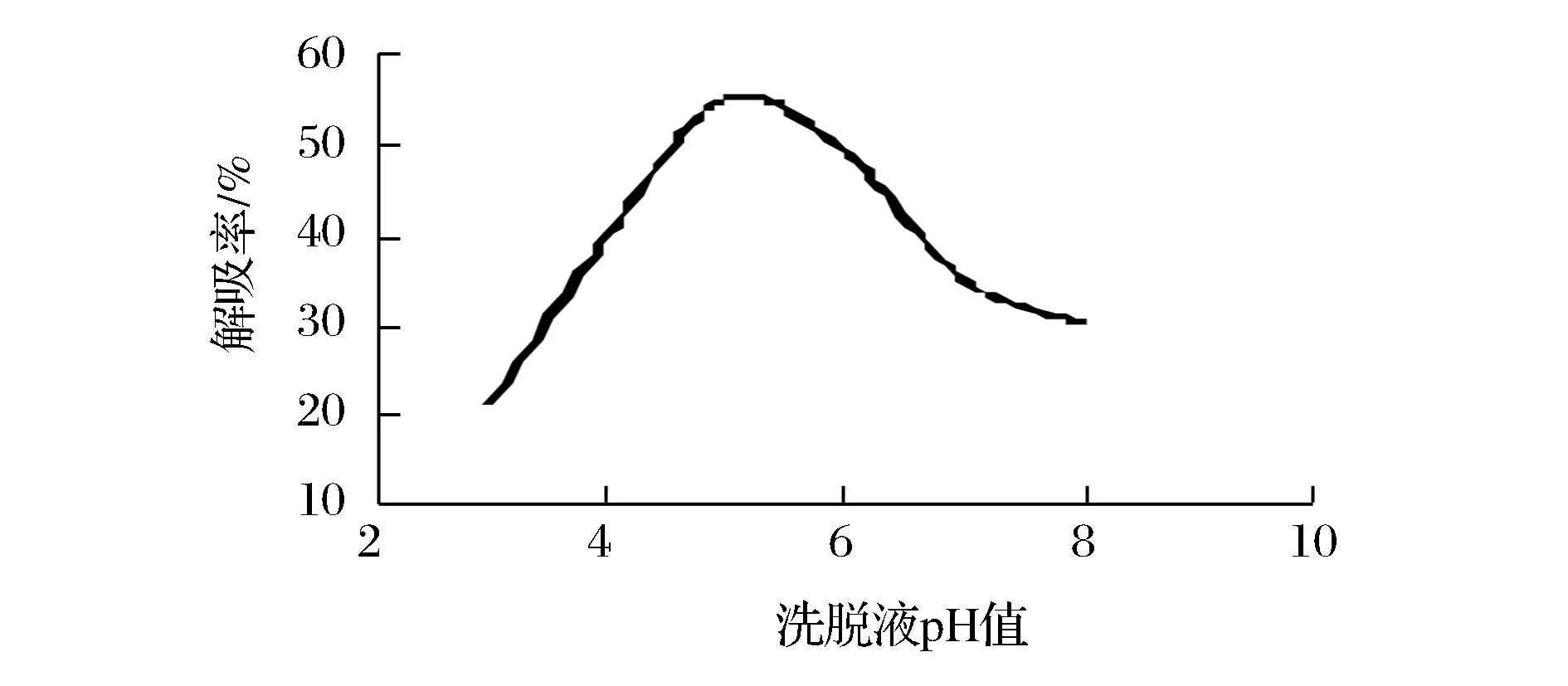
图8 洗脱液pH对解吸率的影响Fig.8 Effect of eluent pH on the desorption rate
如图9所示,随着洗脱液流速的增大,洗脱率逐渐降低。由于洗脱液流速过快,洗脱液不能与树脂吸附的熊果酸分子充分接触,导致熊果酸解吸率降低。综合考虑生产效率与生产周期最终选择洗脱液流速为2.0 mL/min。
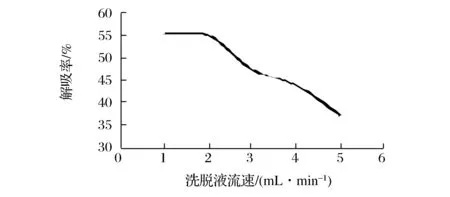
图9 洗脱液流速对解吸率的影响Fig.9 Effect of eluent flow rate on the desorption rate
2.3 响应面试验结果
2.3.1 响应面试验设计
在单因素试验基础上,根据Box-Benhken试验设计原理,通过 Design-Expert 8.0.6.1软件试验方案及结果见表4、表5。

表4 吸附熊果酸响应面试验方案及结果Table 4 Design and results of response surface experiment for adsorption rate of ursolic acid
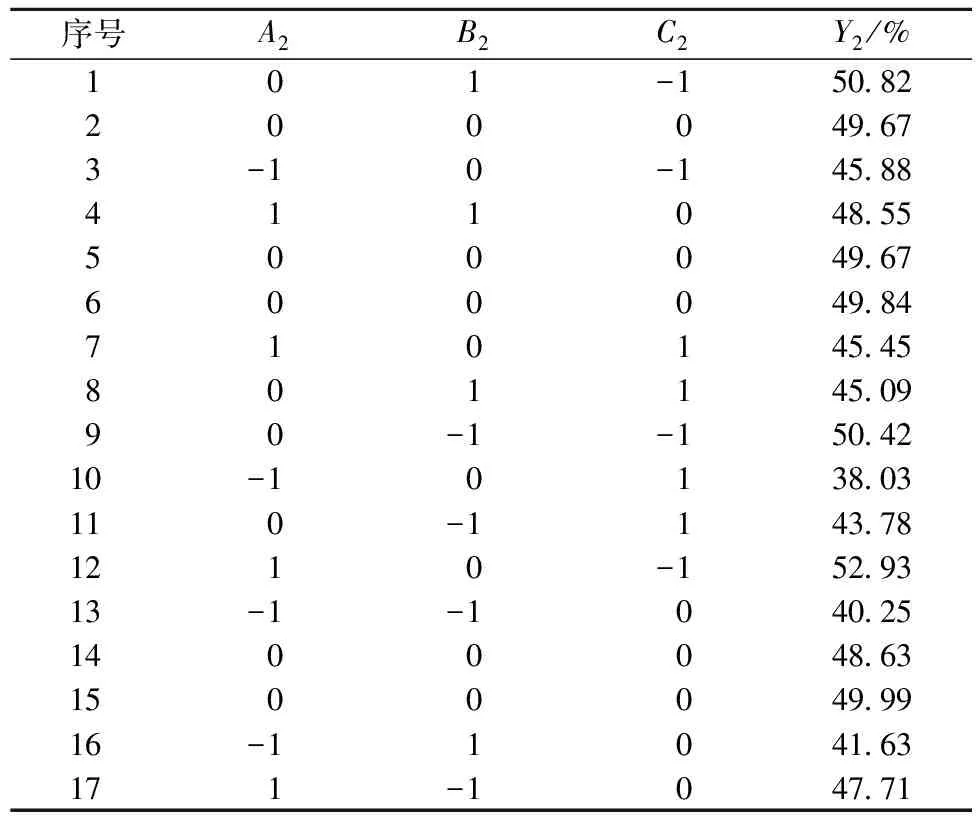
表5 解吸熊果酸响应面试验方案及结果Table 5 Design and results of response surface experiment for the desorption rate of ursolic acid
2.3.2 响应面方差分析
采用 Design expert 8.0.6.1 软件对试验数据进行回归拟合。
吸附率(Y1)对上样液浓度(A1)、上样液pH(B1)、上样液流速(C1)的二次多元回归方程:
Y1=63.05-2.19A1+0.69B1-2.69C1+0.5A1B1+1.15A1C1+0.43B1C1-3.83A12-1.85B12-0.38C12
(4)
解吸率(Y2)对洗脱液体积分数(A2)、洗脱液pH(B2)、洗脱液流速(C2)的二次多元回归方程:
Y2=49.56+3.61A2+0.49B2-3.46C2-0.14A2B2+0.092A2C2+0.23B2C2-3.49A22-1.53B22-0.5C22
(5)


表6 吸附率回归模型方差分析Table 6 Variance analysis of regression model for the adsorption rate
注:**.极显著(p<0.01),*.显著(p<0.05),下同。
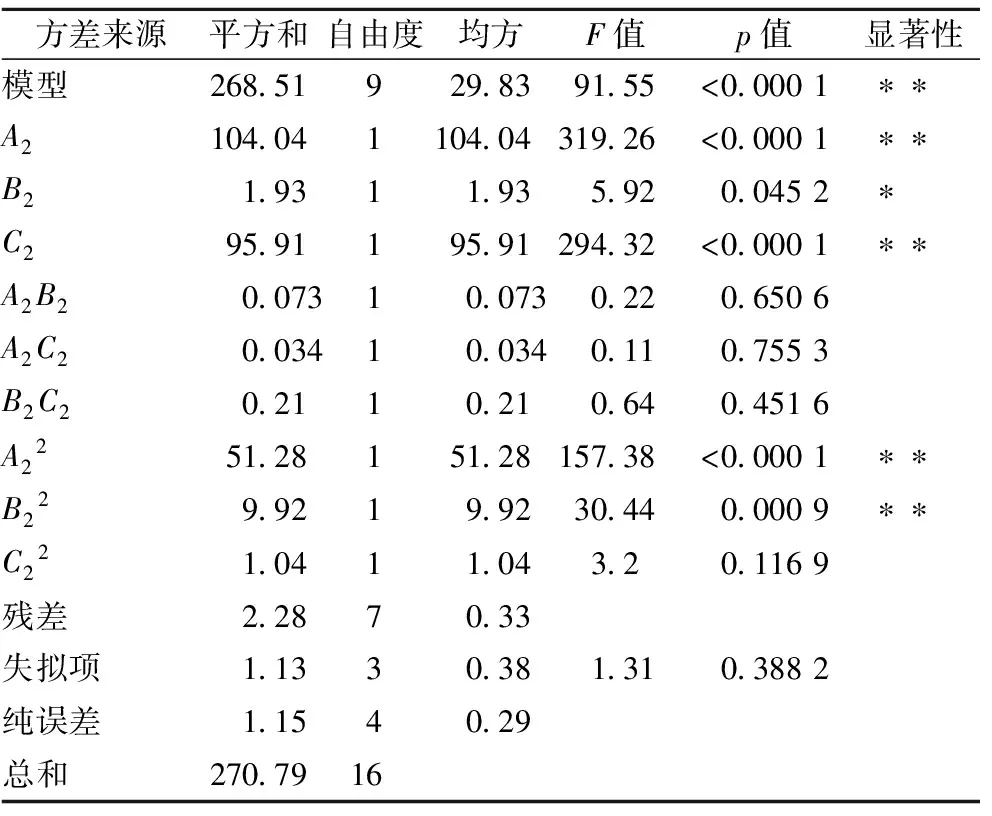
表7 解吸率回归模型方差分析Table 7 Variance analysis of regression model for the desorption rate
2.3.3 响应面分析
如图10所示,响应面开口向下,随着各因素的增加,响应值呈现先增大后减小的趋势,说明响应值具有最大值,响应面图的坡度及等高线的形状可以反应两因素之间交互作用强弱,响应面图形的坡度越陡,等高线形状为椭圆形则表示两因素交互作用显著[28]。通过Design expert 8.0.6.1分析可得,吸附最佳条件为:上样液浓度0.31 mg/mL,上样液pH 5.01,上样液流速1 mL/min,吸附率为66.23%;洗脱最佳条件为:洗脱液浓度90.2%,洗脱液pH 5.06,洗脱液流速1.0 mL/min,解吸率为53.42%。为实际操作方便,将洗脱最佳条件修正为:洗脱液浓度90%,洗脱液pH5.06,洗脱液流速1.0 mL/min。在此条件下实际测得吸附率为62.25%,解吸率为50.35%,与预测值相差不大,说明由响应面法得出的熊果酸最佳纯化工艺的可行的。

图10 两因素交互影响吸附率与解吸率的响应曲面图分析Fig.10 Response surface analysis of adsorption and desorption rate affected by two-factor
3 结论
通过比较树脂对熊果酸吸附和解吸效果,AB-8和HPD100为最佳树脂,当树脂质量比为1∶2时纯化效果最佳。利用响应面法对熊果酸纯化工艺进行优化,得到最佳吸附工艺条件为上样液浓度0.31 mg/mL,上样液pH 5.01,上样液流速1 mL/min,在此条件下熊果酸吸附率为62.25%;最佳洗脱工艺条件为洗脱液浓度90%,洗脱液pH 5.06,洗脱液流速1.0 mL/min,在此条件下熊果酸解吸率为50.35%,熊果酸纯度由原来的6.35%提升到32%。
[1] 孙月娥,明鸣,王卫东,等.巴旦木蛋白提取工艺[J].食品科学,2011,32(18):19-23.
[2] 尤努斯江·吐拉洪,马木提·库尔班,木妮热·依布拉音.巴旦木的营养保健作用研究进展[J].中国食物与营养,2008,14(10):56-58.
[3] 何建木,肖雪锋.莎车巴旦木产业化种植与经营对策研究[J].喀什师范学院学报,2013,34(5):28-35.
[4] 李维霞,魏佳,苏玉红,等.高效液相色谱法测定巴旦木青皮提取物中齐墩果酸和熊果酸[J].食品科学,2016,37(10):151-157.
[5] 杨艳,任亚梅,马婷,等.响应面优化超声波提取猕猴桃根熊果酸工艺[J].食品科学,2014,35(4):44-49.
[6] 林科,张太平,张鹤云.山楂中熊果酸的提取及其对小鼠的降血脂作用[J].天然产物研究与开发,2007,19(6):1 052-1 054.
[7] 纪晓花.乌梅熊果酸抑菌活性和抗氧化性研究[J].食品工业,2013,34(9):142-144.
[8] LI D,REN D,LUO Y,et al.Protective effects of ursolic acid against hepatotoxicity and endothelial dysfunction in mice with chronic high choline diet consumption[J].Chem Biol Interact,2016,258:102-107.
[9] HASSAN L,PINON A,LIMAMI Y,et al.Resistance to ursolic acid-induced apoptosis through involvement of melanogenesis and COX-2/PGE 2,pathways in human M4Beu melanoma cancer cells[J].Experimental Cell Research,2016,345(1):60-69.
[10] 王翔,阎昭,王旭,等.熊果酸纳米脂质体的镇痛作用和抗炎活性[J].山东医药,2013,53(29):31-35.
[11] WOLSKA K I, GRUDNIAK A M, FIECEK B, et al. Antibacterial activity of oleanolic and ursolic acids and their derivatives.[J].Central European Journal of Biology,2010,5(5):543-553.
[12] 兰艳素,李长江,潘乐.大孔树脂纯化广豆根总黄酮工艺的优化[J].中成药,2016,38(7):1 644-1 647.
[13] 李敏晶,刘昌雨,刘远,等.多棘海盘车多糖大孔树脂脱色方法的研究[J].安徽农业科学,2013,41(18):7 838-7 839,7 855.
[14] 张旭,陈丹,曹丽娟,等.5种大孔树脂纯化鲜核桃青皮汁多酚工艺的比较[J].中成药,2016,38(8):1 852-1 855.
[15] 张若洁,徐永霞,鲁峰,等.大孔树脂纯化芦笋总皂苷的工艺研究[J].中草药,2012,43(6):1 097-1 100.
[16] 张旭,王锦玉,仝燕,等.大孔树脂技术在中药提取纯化中的应用及展望[J].中国实验方剂学杂志,2012,18(6):286-290.
[17] 于虹敏,卢雪花,王英豪,等.玉叶金花总三萜类成分含量测定方法建立[J].辽宁中医药大学学报,2015,17(2):40-42.
[18] 李莹,陈新梅.分光光度法测定大山楂丸中熊果酸含量[J].食品与药品,2013,15(3):200-201.
[19] 朱西平,王茂广,孟少华,等.大孔树脂分离纯化芡实壳三萜类化合物[J].食品工业科技,2015,36(1):286-288.
[20] 李辰,赵燕,巫莹柱,等.应用混合树脂技术从蛹虫草中提取纯化虫草素[J].安徽农业科学,2015,43(1):266-26.
[19] 朱西平,王茂广,孟少华,等.大孔树脂分离纯化芡实壳三萜类化合物[J].食品工业科技,2015,36(1):286-288.
[20] 李辰,赵燕,巫莹柱,等.应用混合树脂技术从蛹虫草中提取纯化虫草素[J].安徽农业科学,2015,43(1):266-269,307.
[21] 郑翠萍,田呈瑞,马婷婷,等.大孔树脂纯化苦菜多酚及其组成分析[J].食品与机械,2016.32(4):176-180.
[22] 刘笑,侯顺超,顾林. HPD大孔树脂纯化白胡椒中胡椒碱[J].食品与发酵工业,2015,(4):136-140.
[23] 刘雪辉,张思,张志旭,等.大孔吸附树脂纯化薄荷总黄酮工艺优选[J].食品与机械,2016,32(8):156-158+177.
[24] 李贵文,张明芮.树脂吸附法分离纯化锁阳中熊果酸的工艺研究[J].中成药,2011,33(9):1612-1615.
[25] 李琼,陈恺,陈燕勤,等.大孔吸附树脂分离纯化核桃青皮总多酚[J].食品与机械,2015,31(1):175-180.
[26] 陈建中,葛水莲,昝立峰,等.响应面优化大孔吸附树脂分离纯化茼蒿总黄酮[J].食品与发酵工业,2015,41(11):115-120.
[27] SWAMY GJ, SANGAMITHRA A, CHANDRASEKAR V. Response surface modeling and process optimization of aqueous extraction of natural pigments from Beta vulgaris using BoxeBehnken design of experiments[J].Dyes and Pigments,2014,111:64-74.
[28] 周小双,王锦旭,杨贤庆,等.响应面法优化合浦珠母贝糖胺聚糖提取工艺[J].食品与发酵工业,2016,42(1):238-243.
OptimizationofpurificationprocessforursolicacidfromAmygdaluscommunisL.peelbyresponsesurfacemethodology
ZHANG Jun, LI Jin*, LYU Hai-ying, MA Xue
(Xinjiang Key Laboratory of Special Species Conservation and Regulatory Biology,Key Laboratory of Plant Stress Biology in Arid Land,College of Life Sciences, Xinjiang Normal University, Ürümqi 830054, China)
Response surface methodology was used to optimize purification process of ursolic acid fromAmygdaluscommunisL. peel. In order to purify ursolic acid inAmygdaluscommunisL. peel, adsorption mass and desorption rate were selected as the evaluation indexes, two resins of AB-8 and HPD100 were screened from six resins, and mixed with a certain mass ratio. On the basis of single factor experiments, response surface test was designed by Box-Benhnken experimental principle. The optimum purification process were as follows: sample concentration 0.31 mg/mL, sample pH 5.01, sample flow rate1.0 mL/min; eluent concentration 90%, eluent pH 5.06, eluent flow rate 1.0 mL/min. Under the above conditions, ursolic acid purity increased 5.03 times which was from 6.35% to 32%.
amygdalus communis; ursolic acid; mixed resin; response surface methodology
10.13995/j.cnki.11-1802/ts.014344
硕士研究生(李进教授为通讯作者,E-mail:xjcjlj4@xjnu.edu.cn)。
新疆维吾尔自治区重点实验室开放基金项目(xjsfdx2016-06)
2017-03-20,改回日期:2017-04-20

