一株海洋细菌YCSC6的鉴定及其体外杀盾纤毛虫的能力
杜光迅, 曲凌云, 2, 尚 琨, 3, 王 琛, 高 萍
一株海洋细菌YCSC6的鉴定及其体外杀盾纤毛虫的能力
杜光迅1, 曲凌云1, 2, 尚 琨1, 3, 王 琛1, 高 萍1
(1. 国家海洋局 第一海洋研究所, 山东 青岛 266061; 2. 海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266235; 3. 大连海洋大学, 辽宁 大连116023)
为开发安全、高效的防治大菱鲆()盾纤毛虫(scuticociliate)病新型药物, 本研究从近海微生物菌种资源库中筛选获得了一株有杀盾纤毛虫效果的细菌, 利用形态学和分子生物学方法鉴定该菌为肋生盐弧菌(), 通过共培养实验进行YCSC6杀灭大菱鲆病原性盾纤毛虫的药效活性实验, 同时利用光学显微镜和扫描电镜观察记录YCSC6的杀虫特征。结果发现海洋细菌YCSC6发酵上清液可导致盾纤毛虫膜出现穿孔, 膜完整性丧失从而裂解, 在一定时间内, 发酵液发酵时间越长, 裂解能力越强。本研究从安全、高效的角度出发, 筛得一株可裂解盾纤毛虫的海洋细菌YCSC6, 并初步探究了其杀虫特征及能力, 为养殖渔业微生物杀虫剂的开发提供了安全有效的来源。
大菱鲆(); 盾纤毛虫(scuticociliate); YCSC6; 裂解; 微生物杀虫剂
大菱鲆()养殖是中国一项特色产业, 然而病害的困扰使该产业每年都面临巨大经济损失[1-4]。在各种养殖疾病中, 寄生虫疾病是一种常见病, 而其中危害最大的是盾纤毛虫(scuticociliate)病[5]。盾纤毛虫属兼性寄生虫, 寄生在鱼类的组织中, 通过吞噬鱼细胞及组织进行生长、繁殖[6]。感染初期, 鱼体出现白斑且黏液增多, 随后病灶处出现红肿, 甚至溃烂出血。该病在育苗期、养成期均可发生, 且传染快、发病率高, 往往引起养殖鱼的大规模死亡, 造成无法挽回的损失[5-7]。近年来, 在各种海水经济动物的养殖中(鱼类、甲壳类和海参等), 由纤毛虫所导致的病害发生范围及危害程度均呈递增趋势[8-10]。针对纤毛虫病危害的频发, 国内主要采用甲醛、硫酸铜等来防治该病的发生[11]。但长期使用农药及化学药物, 会带来环境污染、药物残留等问题, 也成为当前食品安全和水产品出口的绿色贸易壁垒问题, 因此寻找新型的杀虫药物成为当务之急, 国内许多研究组开展了中草药制剂的研制工作, 但鲜有通过微生物进行生物防治盾纤毛虫的报道及研究[12-13]。
微生物杀虫剂是21世纪农药工业的新产业, 指应用微生物本身及其代谢产物防治害虫的一种制剂, 具有药效稳定、施用方便、环保等优势[14]。海洋微生物数量庞大且生境特殊, 其可产生不同于陆地来源的代谢产物, 这些代谢产物往往具有结构新颖独特、生物活性多样显著的特点[15], 研究者不断获得来自于海洋微生物的抗菌杀虫活性物质。例如Marques等[16]研究的海洋细菌sp.胞外分泌物具有抗菌及清除DPPH自由基的能力; 谭洪升等[17]从两株海洋放线菌(sp.)的次级代谢物中发现13种对HeLa细胞系有极强毒性的抗霉素类化合物; 李子等[18]研究的真菌H-21可产生一种fusarentin类杀虫药物; 徐树兰[19]发现海洋真菌(代号为1893)发酵液的乙酸乙酯萃取物对白蚊伊蚊()和桃蚜()具有一定的毒杀作用; 吴珊等[20]发现芽孢杆菌()UST050418-715的代谢产物中存有大量可防御硅藻附着海绵的二肽类化合物; 方卫东等[21]发现蜡状芽孢杆菌()K2-1发酵上清液对大菱鲆常见致病菌有较强拮抗作用。
本研究针对大菱鲆病原性盾纤毛虫, 从近海微生物菌种资源库中筛选获得了一株有杀盾纤毛虫效果的细菌, 对该菌株开展了细菌鉴定和杀虫机制的初步研究, 旨在为防治大菱鲆盾纤毛虫病开发安全、高效的新型药物。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株及盾纤毛虫
海洋菌株YCSC6来自黄海海域, 保藏于国家海洋局第一海洋研究所菌种库(–80℃); 盾纤毛虫分离自大菱鲆病变脑组织, 并由中国海洋大学原生动物学研究室鉴定(另文报道)。
1.1.2 纤毛虫培养液
20 mL海水高压灭菌, 待冷却至室温加入10粒大米, 接种1 mL纤毛虫原液, 放置于17℃培养室培养。
1.2 试验方法
1.2.1 菌株形态特征观察及生长特性
平板法观察YCSC6的菌落特征, 用透射电镜来观察细菌形态特征。生长曲线的测定: 将YCSC6菌株按照1%()接种于2216E液体培养基中, 30℃、120 r/min振荡培养, 每隔1 h取样1次, 测其OD600值。盐度耐受实验中盐度梯度为0、1、2、3、4、5、6、7、8、9、10、12、15、20、25、30, 温度耐受实验中温度梯度为4、10、15、20、25、30、35、37、40、42、45、55及65℃, pH耐受实验中pH值梯度为4、5、6、7、8、9、10、11, 12 h后测定各菌液的OD600值。
1.2.2 细菌生理生化特性实验
采用API 20NE、API ZYM、API 50CH试纸条及 Biolog GN2微孔板对菌株的生理特性进行测定。选用纸片扩散法进行YCSC6抗生素药敏试验, 根据抑菌圈直径的大小, 判定该菌株对抗生素的敏感性。
1.2.3 16S rRNA基因的扩增与序列分析
采用水煮法获得YCSC6基因组DNA作为模板, 以27F和1492R[22]为引物, 配制PCR反应体系60 μL, 按PCR反应条件扩增16SrRNA基因。将PCR产物送至青岛擎科生物医药科技有限公司测序。
1.2.4 系统发育分析
将所得的16S rRNA基因序列提交到NCBI, 同时将测定的16S rRNA序列在Ez-Taxon数据库中进行同源性比对[23], 选取与该菌株相似性最高的模式菌16S rRNA基因序列, 构建系统发育树。
1.2.5 细菌发酵液的获取及处理方法
按1%接种量接种细菌母液于20 mL灭菌液体培养基中, 并在30℃、120 r/min条件下振荡培养24 h; 培养结束后, 将发酵液以5 000 r/min的速度离心20 min, 收集上清液于灭菌锥形瓶中以备后续试验使用。
1.2.6 盾纤毛虫的培养
将盾纤毛虫接入纤毛虫培养液中, 于17℃培养箱中进行扩繁培养。培养大约10 d后, 盾纤毛虫种群密度可达到8 000个/mL, 此时的密度适合后续试验的进行。
1.2.7 细菌发酵液与盾纤毛虫的共培养
取10 mL杂质少的盾纤毛虫培养液于灭菌锥形瓶中, 然后加入等量经离心处理的细菌发酵液, 轻轻震荡混匀, 于20℃培养箱中共培养。
1.2.8 盾纤毛虫的显微及扫描电镜观察
显微观察: (1)取刚刚混匀后的共培养液500 μL于浮游生物计数框中, 在显微镜下观察并记录盾纤毛虫的运动情况; (2)分别在0、3、6、9、12、24 h后, 取1 mL共培养液于1.5 mL Ep管中, 并立即加入100 μL 2%戊二醛进行固定[12], 然后取200 μL液体于载玻片上, 在显微镜下观察纤毛虫的裂解情况, 并拍照记录。扫描电镜观察: 分别取适量纤毛虫原液及共培养6 h后的纤毛虫于胚胎皿中, 在解剖镜下按照胡镝[24]的方法进行固定、清洗、脱水、置换, 采用真空冷冻干燥进行最终干燥后, 使用扫描电镜观察拍照。
1.2.9 YCSC6发酵液裂解能力的初步测定
准备12个相同规格的50 mL锥形瓶, 分别准确量取20 mL液体培养基并高压灭菌。其中11瓶按1%的接种量接种等量细菌母液, 剩余1瓶加等量无菌海水作为对照组。将接种后的锥形瓶于30℃摇床培养箱中分别培养12、18、24、30、36、42、48、54、60、66及72 h后, 按照1.2.5的方法收集发酵液。将发酵时间不同的发酵液与等体积纤毛虫共培养, 培养时间分别为0、1、2、3、4、5、6、7、8、9、10、11及12 h, 设置3组平行实验, 然后各取1 mL共培养液, 经戊二醛固定后用浮游生物计数框在显微镜下计数完整盾纤毛虫个体数量, 并记录。
2 结果
2.1 菌株形态特征及生长特性
YCSC6为革兰氏阴性菌, 菌落表面较湿润、平滑, 边缘平整, 正反面、中央与边缘颜色一致, 均呈淡黄色、半透明, 菌落小而隆起, 致密。透射电镜下观察: 菌体弯曲成弧形尾部有一长鞭毛、大小为(1.40~ 2.85)μm×(0.57~0.71)μm(长×宽, 图1)。
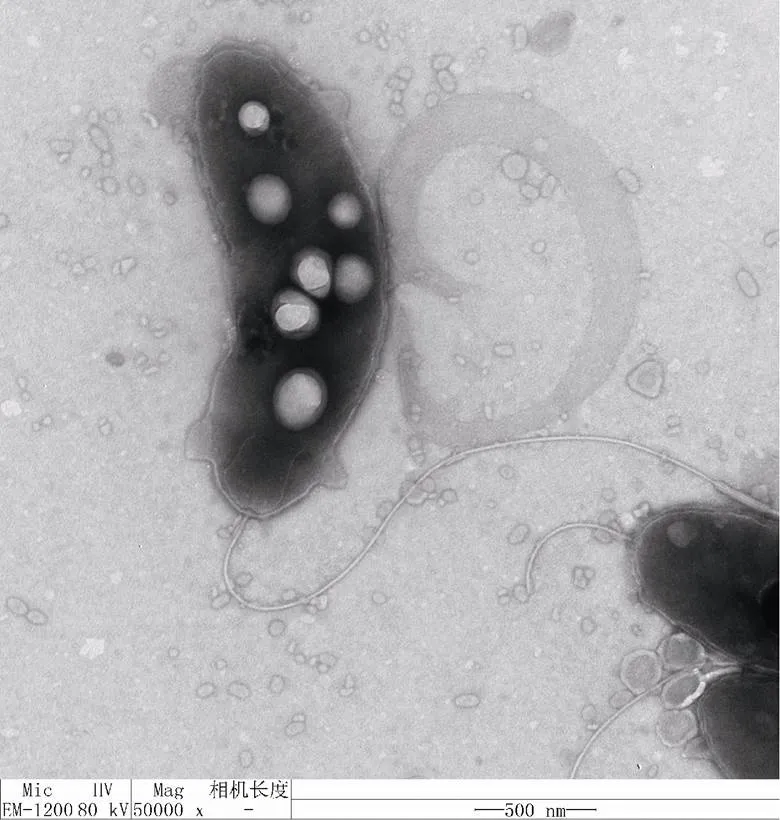
图1 YCSC6的透射电镜照片(标尺为500 nm)
该菌株的生长盐度范围为1%~15%, 最适生长盐度为3%; 生长温度范围10~45 ℃, 最适生长温度为37℃, 生长pH范围6~9, 最适生长pH为6~7。生长曲线显示YCSC6在液体培养11 ~12 h后达生长稳定期(图2)。
2.2 YCSC6生理生化特性
采用API 20NE、API ZYM、API 50CH试纸条对菌株YCSC6的生理特性进行测定, 结果如表1所示。
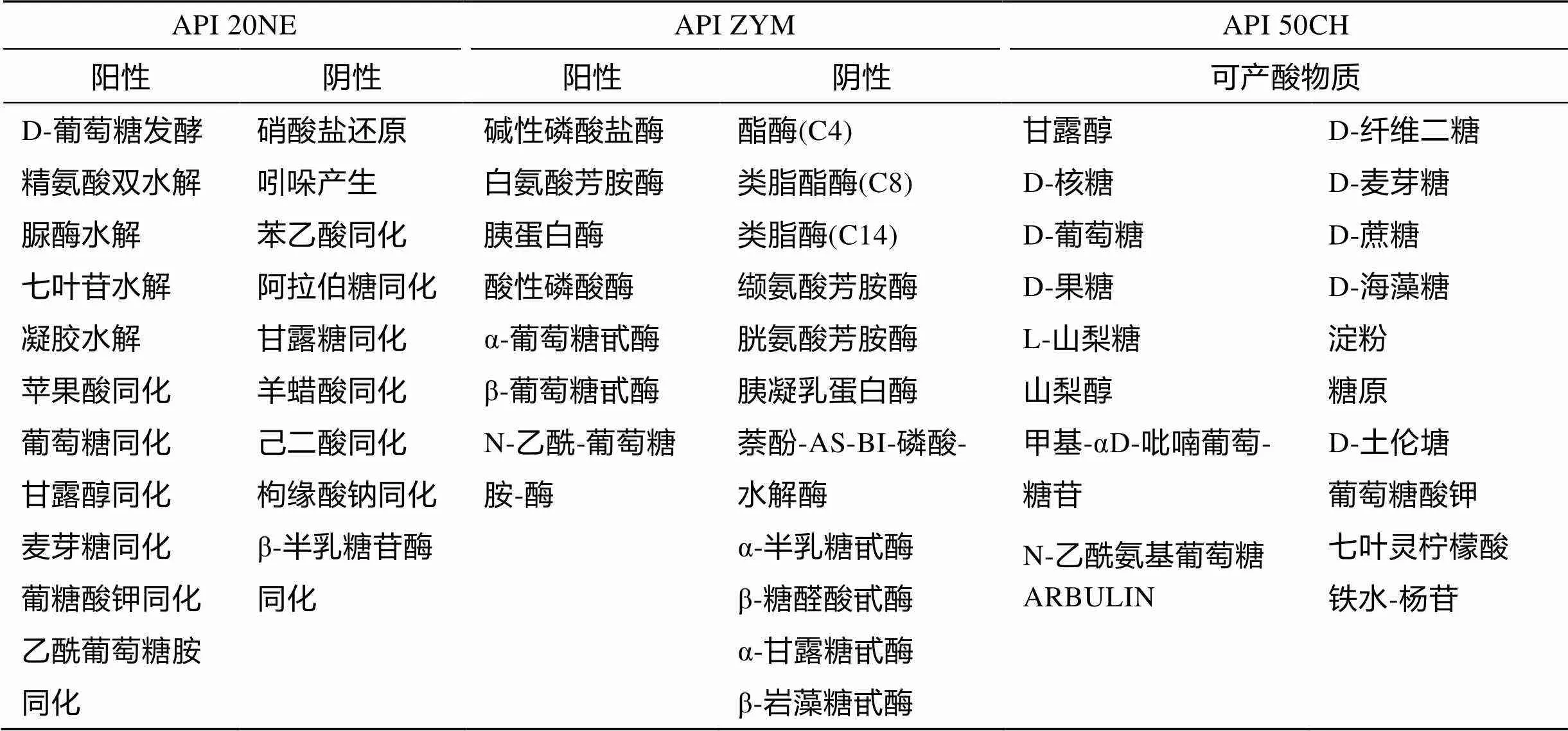
表1 细菌YCSC6的API测试结果
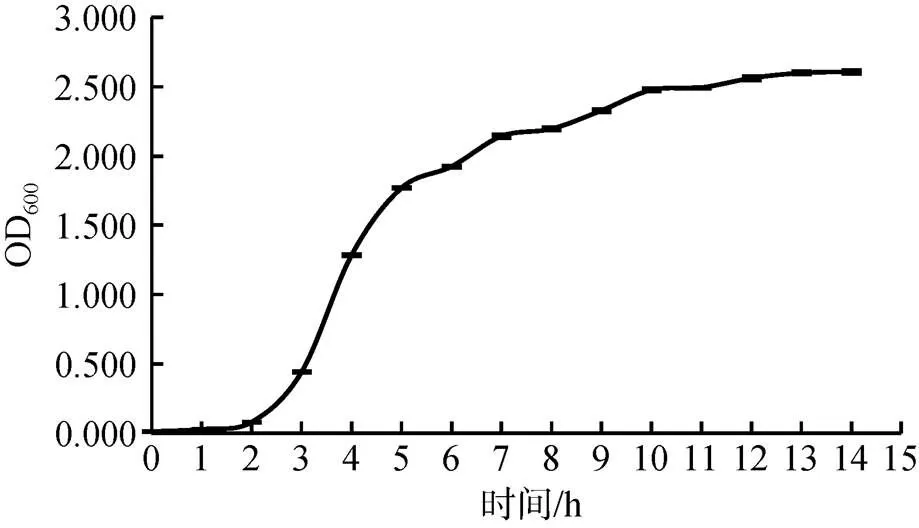
图2 菌株YCSC6的生长曲线
Biolog测试结果显示下列物质可以被YCSC6用作单一碳源: 糊精、吐温-40、吐温-80、N-乙酰基-D-半乳糖胺、N-乙酰基-D-葡萄糖胺、D-果糖、α-D葡萄糖、麦芽糖、D-阿洛酮糖、D-山梨醇、D-海藻糖、甲基丙酮酸、D-葡萄糖酸、D, L-乳酸、琥珀酸、肌苷、胸腺嘧啶核苷、丙三醇。主要碳源: 吐温-40、N-乙酰基-D-半乳糖胺、α-D葡萄糖、D-海藻糖、甲基丙酮酸。
通过对YCSC6的17种常见抗生素药物的药敏测试, 发现该菌对庆大霉素、新霉素、青霉素(G)、林可霉素、万古霉素、头孢氨苄、头孢拉定、丁胺卡那有抗性, 能够被硫酸粘菌素、多西环素多粘菌素B、恩诺沙星、氟苯尼考、环丙沙星、复方新诺明、诺氟沙星、氯霉素抑制。
2.3 YCSC6的16S rRNA基因的同源性比对及系统发育分析
菌株YCSC6的16S rDNA的Genbank注册号为KU984713.1, 序列长度为1 409 bp。将该菌株的16S rDNA序列在Genbank中进行同源性比较, 可知菌株YCSC6与死谷肋生盐弧菌亚种(subsp)DSM8285T[25]亲缘关系最近(图3)。
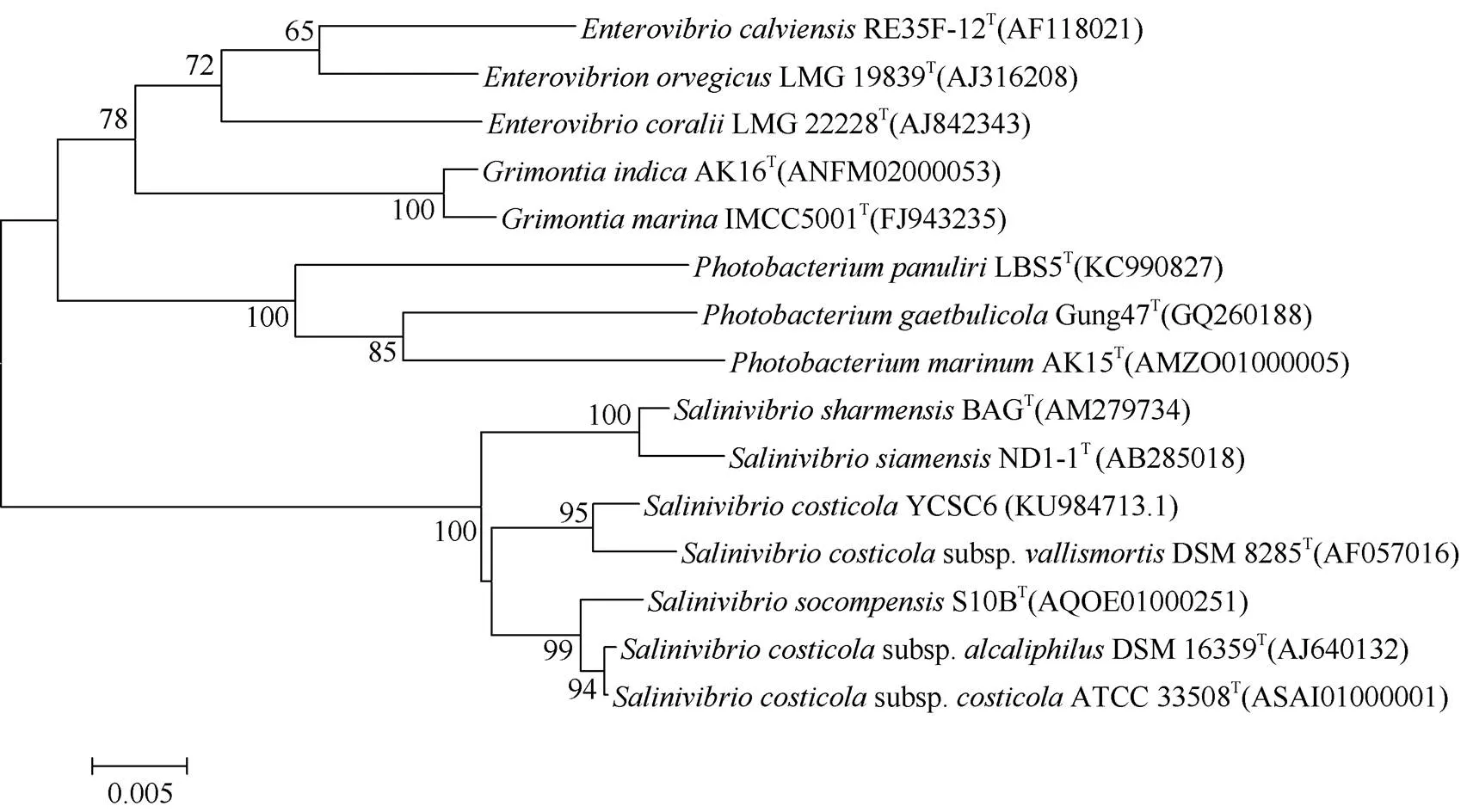
图3 依据16S rDNA基因序列构建的菌株YCSC6与其他相关细菌的系统发育树
2.4 共培养下纤毛虫体的变化
将发酵液与等量纤毛虫混合后, 立即取0.5 mL于计数框中, 在显微镜下可逐渐观察到纤毛虫运动明显变缓慢, 且出现纤毛虫原地打转的现象。当培养时间3、6、9、12、24 h后, 纤毛虫逐渐表现出运动停止、纤毛停止摆动、裂解的现象。且共培养时间越长, 纤毛虫裂解数量越多, 裂解程度越大, 直至最后虫体结构完全裂解, 胞质流出。共培养过程中纤毛虫裂解如下图(图4)所示。
扫描电镜下, 未经共培养的完整虫体结构如图5所示, 虫体表膜结构完整, 表膜无裂解。经过共培养的纤毛虫结构如图6所示, 纤毛虫表膜开始出现裂解现象, 在纤毛虫的尾端出现穿孔, 纤毛虫表膜完整性丧失。
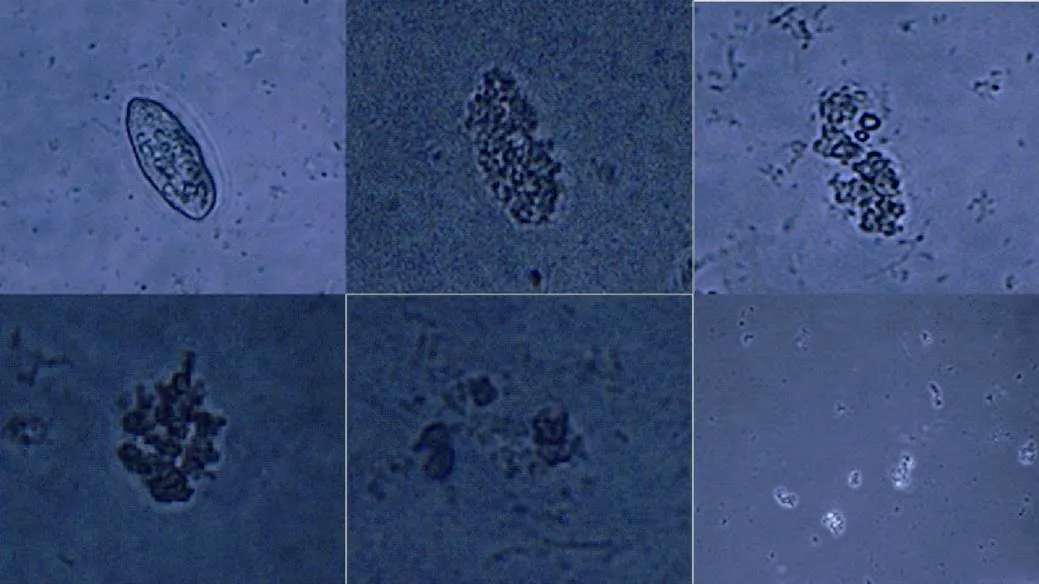
图4 盾纤毛虫裂解过程图
2.5 共培养下盾纤毛虫裂解率
数据统计显示, 当发酵时间为12 h时, 共培养12 h后, 完整虫体剩余量为40.4%; 随发酵时间的延长, 共培养12 h后, 完整虫体剩余量逐渐减少。最终当发酵时间为60 h时, 共培养12 h后, 盾纤毛虫的剩余量为0; 而当发酵时间为66 h时, 共培养10 h, 完整虫体的剩余量就降为0; 当发酵时间为72 h时, 共培养9 h后, 完整虫体的剩余量就降为0 (图7)。
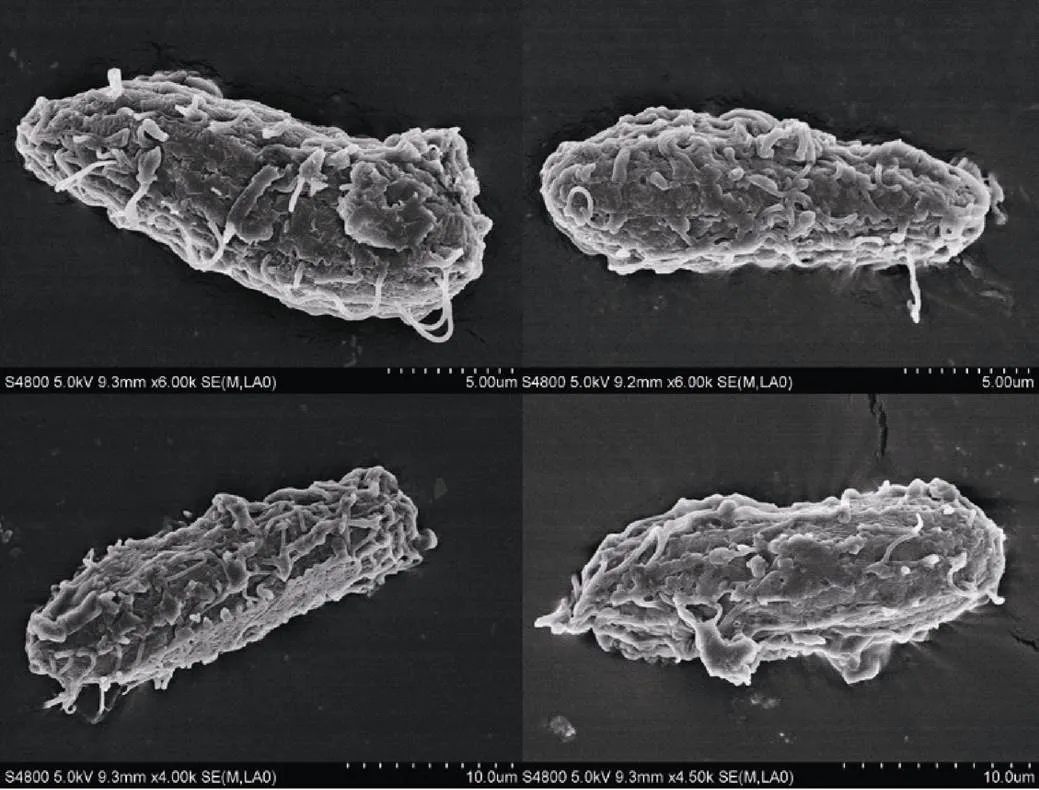
图5 完整盾纤毛虫扫描电镜图
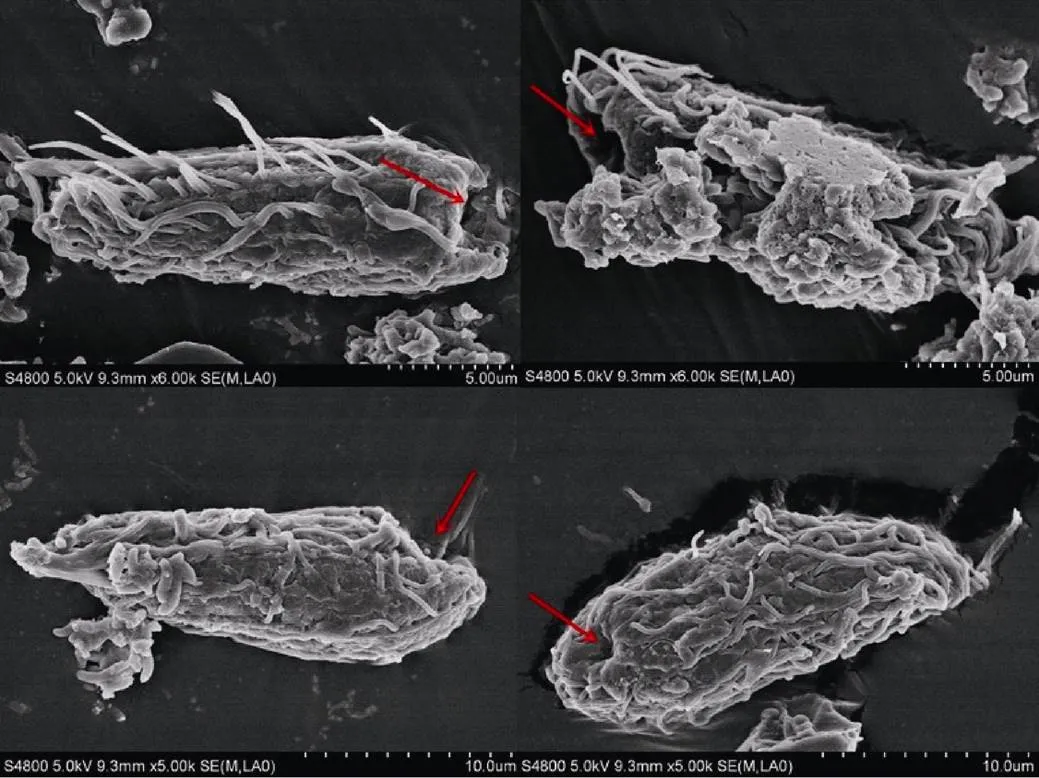
图6 裂解盾纤毛虫扫描电镜图(箭头指示裂解处)
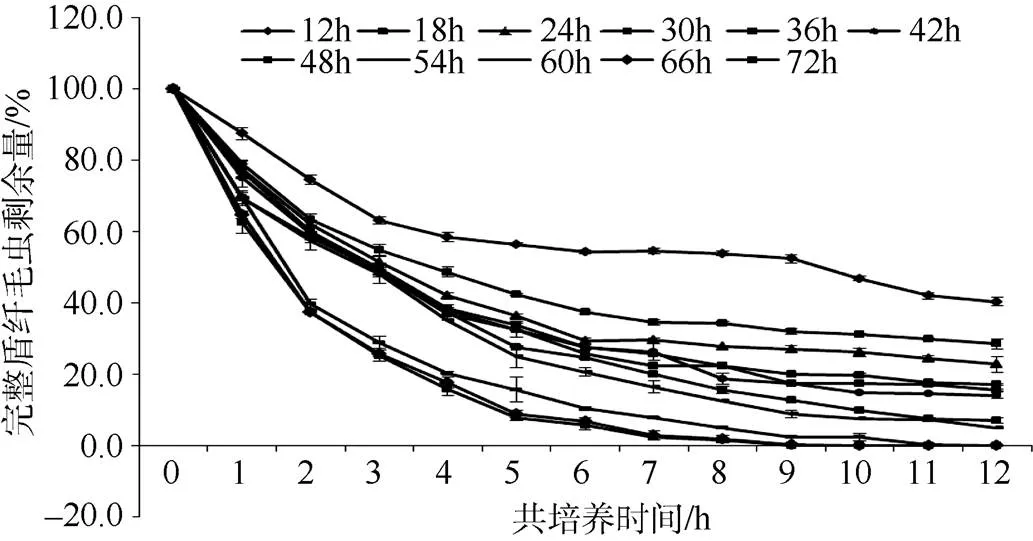
图7 YCSC6的杀虫活性
上述统计数据表明, 在一定时间范围内, 随着发酵时间的延长, 发酵液的裂解能力也随之增强, 且发酵66 h和72 h的发酵液, 其裂解活性相当。由表2可见: 发酵液的不同发酵时间与共培养液虫体剩余量呈负相关, 且回归方程相关系数的绝对值均大于0.8, 说明共培养时间与完整盾纤毛虫剩余量之间密切相关。
3 讨论
微生物代谢产物具有结构新颖性和多样性的特点, 其在抗菌、杀虫、抗真菌等各领域得到广泛的认可并展现出巨大的潜力[26]。然而, 目前在水产动物杀虫药物研究开发领域还极少, 本研究从近海微生物菌种资源库中筛得一株有杀盾纤毛虫效果的细菌YCSC6, 对该菌株开展了细菌鉴定和杀虫能力的初步研究, 旨在为防治大菱鲆盾纤毛虫病开发安全、高效的新型药物。
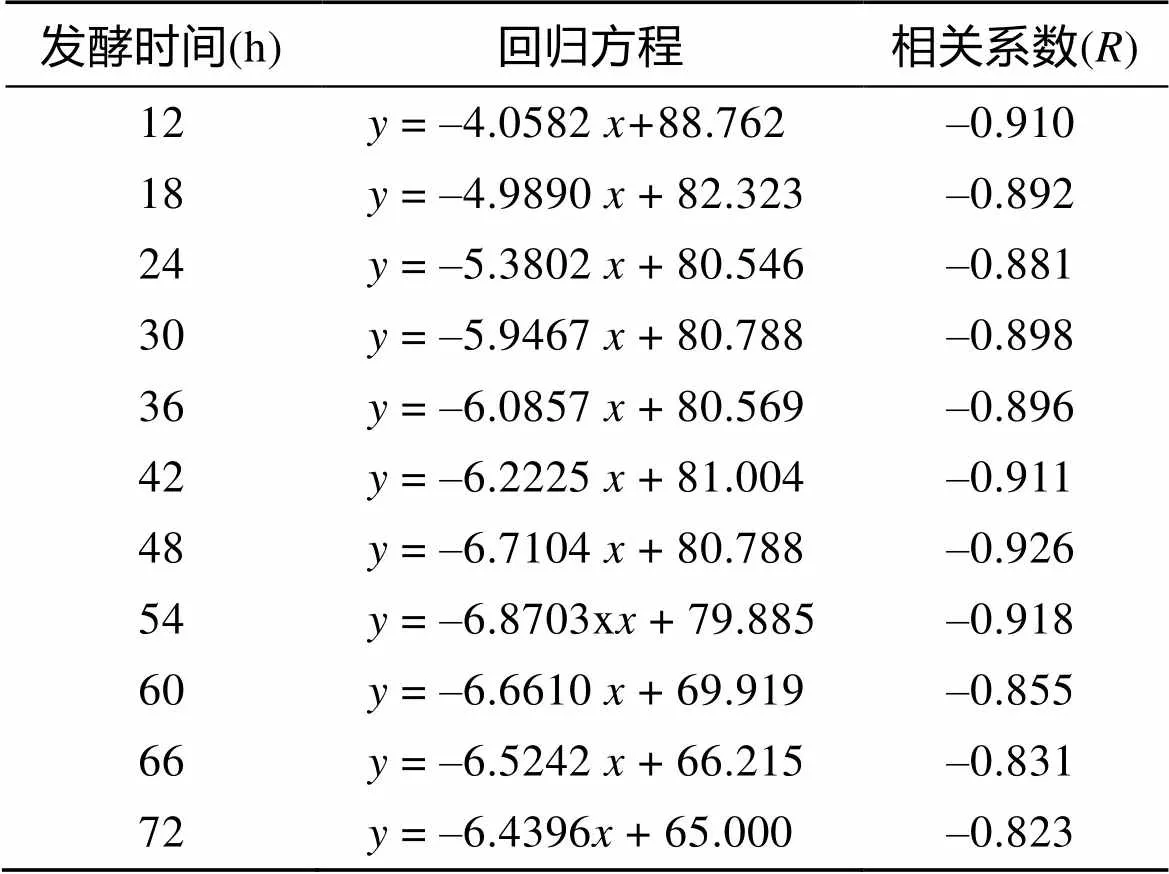
表2 YCSC6杀虫活性的统计学分析
本实验自黄海分得一株对盾纤毛虫有明显裂解作用的海洋细菌YCSC6, 该菌最适生长条件是37℃, pH为6, 盐度3%, 这与菌株DSM8285T的最适生长条件相近; 该菌菌体弯曲成弧形, 尾部有一长鞭毛, 这一特征与菌株DSM8285T相同。在碳源利用方面, 两菌均主要利用α-D葡萄糖、D-海藻糖、丙酮酸, 且两者16S rDNA序列相似度高达99.18%, 系统发育分析也显示, 菌株YCSC6与肋生盐弧菌也聚类到同一支上[25], 因而将菌株YCSC6鉴定为肋生盐弧菌。
通过共培养实验, 在光学显微镜下发现盾纤毛虫的裂解过程为: 虫体运动变缓慢, 原地打转, 3 h后虫体显微结构变模糊, 开始出现裂解现象, 随着作用时间延长, 虫体表膜裂解程度越大, 胞质流出, 直至最后虫体结构完全裂解。扫描电镜可观察到作用初期纤毛虫胞膜出现穿孔, 裂解作用开始。姚嘉赟等[26]发现链霉菌-XY52代谢产物可导致小瓜虫胞膜及细胞核破裂; 胡金城[12]发现某些中草药可完全被破坏纤毛虫结构, 使胞质流出, 凝固; 田海军[27]曾报道复方中草药制剂可导致南美白对虾()纤毛虫虫体结构完全被破坏, 胞质流出, 凝固; 孙裔雷等[28]发现当某些中草药可损害小瓜虫()细胞膜完整性, 增加细胞膜通透性。本实验所研究YCSC6发酵液与上述所研究的中草药及抗生素作用效果相似, 说明YCSC6发酵液中可能含有某种或某几种成分, 也具有裂解盾纤毛虫的作用; 樊海平等[29]发现, 当中草药质量浓度40 mg/ L以上时, 作用10 min后刺激隐核虫()幼虫死亡率大于50%, 作用2 h死亡率为100%, 其中质量浓度200 mg/ L作用1 h的死亡率达100%, 质量浓度400和800 mg/L 2个处理作用10 min的死亡率达100%。本研究在对YCSC6的杀虫能力进行初步测定后, 发现随着发酵时间延长, 发酵液的裂解活性增强, 完全裂解虫体所需要的时间缩短, 但发酵66 h后, 其作用效果无明显增强。表明随着细菌的生长繁殖, 其代谢产物中的杀虫成分不断积累, 浓度增大, 杀虫效果增强, 但积累到一定程度不再增加。
本研究初步探究了YCSC6的杀虫能力及杀虫机制, 但尚未对其有效成分进行分离鉴定, 因此本研究下一步将重点从有效杀虫成分提取鉴定及基因组方向深入研究其杀虫机制, 为大菱鲆盾纤毛虫病的防治提供新材料。
[1] 雷霁霖, 刘新富, 关长涛. 中国大菱鲆养殖20年成就和展望——庆祝大菱鲆引进中国20周年[J]. 渔业科学进展, 2012, 33(4): 123-130.Lei Jilin, Liu Xinfu, Guan Changtao.Turbot culture in China for two decades: achievements and prospect[J]. Progress In Fishery Sciences, 2012, 33(4): 123-130.
[2] 程开敏, 俞开康. 大菱鲆疾病的研究进展[J].鱼类病害研究, 2001, 2: 33-38. Cheng Kaimin, Yu Kaikang. Advances in research on diseases of turbot[J]. Fish Diseases, 2001, 2: 33-38.
[3] 陈洁君. 养殖大菱鲆盾纤虫病及其防治研究[D]. 青岛: 中国海洋大学, 2005. Chen Jiejun. Studies on the scuticociliatosis in cultured turbotand its prevention and treatment[D]. Qingdao: Ocean University of China, 2005.
[4] 中国水产科学研究院大菱鲆专家组.大菱鲆常见病害防治方法及用药指南[J]. 中国水产, 2007, 374(1): 64-69. Expert Group of Turbot, Chinese Academy of Fishery Sciences. Method for preventing and treating common diseases of turbot and its medication guide[J]. China Fisheries, 2007, 374(1): 64-69.
[5] 陈总会, 肖宝华, 黄志斌, 等. 海水养殖鱼类主要纤毛虫病及其防治方法[J]. 水产科技情报, 2007, 34(2): 94-96. Chen Zonghui, Xiao Baohua, Huang Zhibin, et al. Main ciliate diseases of marine cultured fishes and the control methods[J]. Fisheries Science&Technology Information, 2007, 34(2): 94-96.
[6] 郭春山, 李文全, 张丽.大菱鲆盾纤毛虫病的病因及防治方法[J]. 河北渔业, 2012, 10: 33. Guo Chunshan, Li Wenquan, Zhang Li. The causes and control methods of the ciliate disease of turbot[J]. Hebei Yuye, 2012, 10: 33.
[7] 崔龙波, 刘冉, 王琛, 等. 大菱鲆盾纤毛虫病的流行病学调查[J]. 科学养鱼, 2015, 3: 54-56. Cui Longbo, Liu Ran, Wang Chen, et al. Epidemiological investigation on the ciliate disease of turbot[J]. Scientific Fish Farming, 2015, 3: 54-56.
[8] 王印庚, 荣小军, 张春云, 等.养殖海参主要疾病及防治技术[J]. 海洋科学, 2005, 29(3): 1-7. Wang Yingeng, Rong Xiaojun, Zhang Chunyun, et al.Main diseases of cultured: prevention and treatment[J]. Marine Sciences, 2005, 29(3): 1-7.
[9] 陈爱平, 刘福林, 吴凡修.2010年水产养殖病害发生情况与2011年流行趋势分析[J].科学养鱼, 2011, 3: 56-59. Chen Aiping, Liu Fulin, Wu Fanxiu. Occurrence of aquaculture diseases in 2010 and analysis of current range in the year of 2011[J]. Scientific Fish Farming, 2011, 3: 56-59.
[10] 盖珊珊, 于道德, 王其翔, 等.双齿围沙蚕的胚胎发育与纤毛虫病害[J]. 海洋科学, 2012, 36(2): 7-10. Gai Shanshan, Yu Daode, Wang Qixiang, et al. Embryonic development of and disease of infusorium in[J]. Marine Sciences, 2012, 36(2): 7-10.
[11] 王孟华. 牙鲆幼鱼盾纤毛虫病药物防治初步试验[J]. 水产养殖, 2012, 33(2): 49-51. Wang Menghua. A preliminary study on the control of the ciliate disease in juvenile[J]. Journal of Aquaculture, 2012, 33(2): 49-51.
[12] 胡金城. 中草药防治大菱鲆感染盾纤毛虫的技术初探[J]. 北京水产, 2005, 6: 20. Hu Jincheng. A preliminary study on the prevention and cure of Chinese herbal medicine for the infection of the ciliate of turbot[J]. Journal of Beijing Fisheries, 2005, 6: 20.
[13] 姚志刚. 大菱鲆纤毛虫病发病机理及中药治疗技术研究[J]. 河北渔业, 2008, 8: 34-36. Yao Zhigang. Study on the mechanism of ciliates disease and traditional Chinese medicine treatment technology of turbot[J]. Hebei Fisheries, 2008, 8: 34-36.
[14] 范月蕾, 赵晓勤, 陈大明, 等. 微生物杀虫剂研发现状和产业化发展态势[J]. 生物产业技术, 2016, 1: 54- 58. Fan Yuelei, Zhao Xiaoqin, Chen Daming, et al. Research status and development trend of microbial insecticides[J]. Biotechnology&Business, 2016, 1: 54-58.
[15] 肖春. 海洋细菌抗真菌活性物质的筛选[D].海口: 华南热带农业大学, 2003. Xiao Chun. Screening of antifungal active substances from marine bacteria[D]. Haikou: South China University of Tropical Agriculture, 2003.
[16] Marques C, Pinteus S, Horta A, et al. Extracellular compounds from marine bacteriasp. with high biotechnological potential[J]. Frontiers in Marine Science2014, 1(2): e101569.
[17] 谭洪升.两株海洋来源的放线菌次级代谢产物及其抗肿瘤活性的研究[D]. 青岛: 中国海洋大学, 2015. Tan Hongsheng. Studies on secondary metabolites of two marine-derived actinomycetes and their anti-tumor activities[D]. Qingdao: Ocean University of China, 2015.
[18] 李子. 杀松材线虫海洋真菌H-21的分离鉴定、培养条件及其活性物质研究[D]. 青岛: 青岛大学, 2015. Li Zi. Isolation, identification and culture conditions of marine fungus H-21 with nematicidal activity against pine wood nematode and characterization of its nematicidal substances[D].Qingdao: Qingdao University, 2015.
[19] 徐树兰. 海洋真菌1893发酵培养条件及杀虫活性物质的初步研究[D]. 广州: 中山大学, 2007. Xu Shulan. Primary study on fermentation conditions and pesticidal metabolites of marine fungus 1893[D]. Guangzhou: Sun Yat-sen University, 2007.
[20] 吴珊, 俞思羽, 姜薇, 等. 一株海绵附生芽孢杆菌的抗硅藻附着活性成分的分离鉴定[J]. 海洋科学, 2016, 40(7): 23-32. Wu Shan, Yu Siyu, Jiang Wei, et al. Isolation and identification of active compounds inhibiting diatom settlements using sponge-associated Bacillus sp.[J]. Marine Sciences, 2016, 40(7): 23-32.
[21] 方卫东, 唐旭, 刘源森, 等. 生防细菌K2-1对大菱鲆病原菌的抑制作用及其抗菌特性分析[J]. 海洋科学, 2015, 39(9): 51-56. Fang Weidong, Tang Xu, Liu Yuansen, et al. Antim icrobialactivity ofa biocontrolbacterium strain K2-1 against selected pathogens ofand itsantim icrobialproperty analysis[J]. Marine Sciences, 2015, 39(9): 51-56.
[22] Marlow J J, Steele J A, Case D H, et al. Microbial abundance and diversity patterns associated with sediments and carbonates from the methane seep environments of hydrate ridge, OR[J].Frontiers in Marine Science, 2014, 1: 44.
[23] Naveed M, Mubeen S, Khan S, et al. Identification and characterization of rhizospheric microbial diversity by 16S ribosomal RNA gene sequencing[J]. Brazilian Journal of Microbiology, 2014, 45(3): 985-993.
[24] 胡镝, 张金安, 章立, 等. 草履虫的扫描及透射电镜标本制备[J]. 生物学通报, 1992, 8: 36. Hu Di, Zhang Jinan, Zhang Li, et al. Preparation of scanning and transmission electron microscope specimen of[J]. Bulletin of Biology, 1992, 8: 36.
[25] Huang C Y, Garcia J L, Patel B K, et al.subsp.subsp. nov. a halotolerant facultative anaerobe from Death Valley, and emended description of[J]. International Journal of Systematic & Evolutionary Microbiology, 2000, 50(2): 615-622.
[26] 姚嘉赟, 袁雪梅, 徐洋, 等. 链霉菌-XY52代谢产物对小瓜虫的体外杀灭活性研究[J]. 安徽农业科学, 2015(6): 138-140. Yao Jiayun, Yuan Xuemei, Xu Yang, et al.antiparasitic activity of bacterial extracellular products ofspXY-52 against[J]. Journal of Anhui Agri.Sci. 2015(6): 138-140.
[27] 田海军, 李峥, 李生玲. 复方中草药制剂对南美白对虾纤毛虫病的防治[J]. 科学养鱼, 2013, 1: 56-57. Tian Haijun, Li Zheng, Li Shengling. The prevention and cure of compound Chinese herbal medicine on the disease of[J]. Scientific Fish Farming, 2013, 1: 56-57.
[28] 孙裔雷, 王荻, 刘红柏. 中草药防治淡水鱼小瓜虫病的研究进展[J]. 生物技术通讯, 2015, 2: 301-304. Sun Yilei, Wang Di, Liu Hongbai. Research advance on anti-ichthyophthiriasis of Chinese herbal medicine on freshwater fish[J]. Letters in Biotechnology, 2015, 2: 301-304.
[29] 樊海平, 林煜, 钟全福, 等. 中草药对刺激隐核虫幼虫的杀灭效果[J]. 福建农业科技, 2016, 3: 12-14. Fan Haiping, Lin Yu, Zhong Quanfu, et al. Insecticidal efficacy of Chinese herbal medicine on[J]. Fujian Agricultural Science and Technology, 2016, 3: 12-14.
(本文编辑: 谭雪静)
Identification of marine bacterium YCSC6 and its insecticidal ability against Scuticociliate
DU Guang-xun1, QU Ling-yun1, 2, SHANG Kun1, 3, WANG Chen1, GAO Ping1
(1. First Institute of Oceanography, SOA, Qingdao 266061, China; 2.Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266235, China; 3. Dalian Ocean University, Dalian 116023, China)
To develop a safe and effective new drug for the prevention and control of turbot scuticociliate disease, from the library of offshore marine microbial resources we screened out a marine bacterium that showed insecticidal activity against scuticociliate. We identified YCSC6 asusing morphological and molecular biological methods. We conducted co-culture pharmacodynamics experiments in which YCSC6 killed pathogenic scuticociliate. We characterized the insecticidal properties of YCSC6 by optical and scanning electron microscopy. The results show that the fermentation supernatant of YCSC6 can lead to membrane perforation inscuticociliate, after which the scuticociliate loses its membrane integrity and cracks. After a certain period of time, the cracking ability strengthens with time. In this research, we made preliminary explorations of the insecticidal characteristics and abilityof YCSC6 and found it to be a safe and effective source for the development of a microbe insecticide for aquaculture.
turbot; scuticociliatlda; YCSC6; lytic process; microbe insecticide
[National Key R & D Program of China, No. 2017YFC1404504; Independent Innovation and Achievement Transformation Project in ShandongProvince, No. 2014ZZCX06205; The Scientific and Technological Innovation Project Financially Supported by Qingdao National Laboratory for MarineScience and Technology, No. 2015ASKJ02-03]
Dec. 2, 2016
Q939.99
A
1000-3096(2017)08-0024-08
10.11759//hykx20161202001
2016-12-02;
2017-03-06
十三五海洋环境安全保障重点专项(2017YFC1404504); 山东省自主创新及成果转化专项(2014ZZCX06205); 青岛海洋科学与技术国家实验室鳌山科技创新计划(2015ASKJ02-03)
杜光迅(1991-), 男, 山东章丘人, 硕士研究生, 主要从事海洋微生物学研究, 电话: 18954296525, E-mail: 1193892753@qq.com; 曲凌云, 通信作者, 博士, 研究员, 电话: 13407609057, E-mail: qly@fio.org.cn

