减数分裂期雄性大菱鲆孕激素及受体基因的表达分析
丰程程, 柳意樊, 安 皓, 徐世宏, 王彦丰, 宋宗诚, 刘清华, 李 军
减数分裂期雄性大菱鲆孕激素及受体基因的表达分析
丰程程1, 2, 3, 柳意樊1, 3, 安 皓1, 2, 3, 徐世宏1, 3, 王彦丰1, 3, 宋宗诚4, 刘清华1, 3, 李 军1, 3
(1. 中国科学院海洋研究所 中国科学院实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266237; 4. 山东威海圣航水产科技有限公司, 山东 威海 264200)
为研究孕激素在大菱鲆()精原细胞增殖到减数分裂过程中的作用, 以6~22月龄的大菱鲆精巢为材料, 通过组织学方法和定量、基因确定精原细胞增殖期和减数分裂期的大菱鲆精巢发育过程。通过酶联免疫吸附技术(ELISA)检测6~22月龄雄性大菱鲆血清中的孕酮(P4)和17α, 20β, 双羟孕酮(DHP)含量变化, 利用qRT-PCR技术和原位杂交技术检测孕酮核受体()和膜受体()在不同组织和不同发育时期的表达情况。结果表明孕激素在精原细胞增殖期高表达, 开始出现初级精母细胞时降低, 在精子细胞数量增加时表达量再次升高, 在精子细胞变态形成精子时降低。在减数分裂初期定位于精巢中的sertoli细胞, 在精原细胞增殖至减数分裂期表达量逐渐增加, 出现精子后显著降低;在精原细胞增殖和初级精母细胞增加时表达量都很低, 在精子细胞不断增加时显著增加。推测在精原细胞增殖和减数分裂阶段孕激素可能主要通过调节的表达量来促进精巢发育, 而在减数分裂II期和都发挥作用在精子细胞变态成熟时, 主要是发挥作用。
大菱鲆(); 减数分裂; 孕激素;;
低等脊椎动物中, 雌鱼生殖细胞先增殖进入减数分裂阶段, 而雄鱼处于有丝分裂阻滞, 晚于雌鱼再进入减数分裂期[1]。减数分裂进程一旦出错, 精子发生就会停滞并最终导致不育。因此, 确保雄鱼生殖细胞减数分裂正常进行是鱼类繁殖的必要条件。早期研究认为, 孕激素在雄鱼最后的精子成熟和排放过程中发挥重要作用[2]。但最近的研究表明, 孕激素的活性成分之一 ——17α, 20β-双羟孕酮(DHP)在鱼类减数分裂起始阶段必不可少, 在日本鳗鲡()、尼罗罗非鱼()和斑马鱼()中, DHP诱导精原细胞进入减数分裂起始阶段[3-5]。另外, 孕激素的生物活性受孕激素受体调控, 受体主要包括核受体()和膜受体()两大类。孕激素与核受体如(progesterone receptor)结合后移动到胞核内作为转录因子调节靶基因的转录, 在胞质中还可以激活相关信号通路, 共同调节细胞的增殖和分化[6-7]。而膜受体如(membrane progestin receptor alpha)与孕酮特异性结合, 通过激活G蛋白调控下游的腺苷酸环化酶-环磷酸腺苷(AC-cAMP)和丝裂原活化蛋白激酶(MAPK)通路来介导孕酮对精子运动的激活[8]。
大菱鲆() 为原产于欧洲沿海的冷水性鲆科鱼类, 自1992年引进中国后, 成为重要海水养殖良种之一, 其工厂化养殖取得重大经济效益, 是中国水产养殖业一个新的经济增长点[9]。然而大菱鲆生长期长, 精巢发育缓慢, 排精量低已经成为制约产业发展的瓶颈。如何促进精巢中精原细胞快速增殖并进入减数分裂是确保精子发生正常进行, 提高产精量的必要条件。本实验以6~22月龄的雄性大菱鲆为研究对象, 观察大菱鲆精巢从精原细胞增殖到减数分裂的发育过程。检测大菱鲆血清中的孕酮(P4)和DHP含量变化以及不同时期的精巢中和的时空表达模式。由此推测孕激素及其受体在精原细胞增殖到减数分裂阶段发挥的作用, 为进一步阐明孕激素及相应受体的相关生理功能提供理论依据, 同时也为深入了解孕激素在鱼类生殖周期调控中的生物学功能提供重要参考。
1 材料和方法
1.1 实验材料
实验材料取自山东省威海市圣航水产科技有限公司和山东省烟台市东方海洋科技股份有限公司, 养殖水温17℃。取月龄分别为6月龄(体质量17.2 g± 5.5 g)、10月龄(体质量54.2 g±10.7 g)、12月龄(体质量119.5 g±19.7 g)、14月龄(体质量232.2 g±30.2 g)、16月龄(体质量416.7 g±54.3 g)、20月龄(体质量818 g± 69.3 g)、22月龄(体质量972.5 g±53.3 g)的成鱼, 每个时期取5~20尾。将鱼麻醉后, 测量全长、体长、体质量和性腺质量。尾部静脉抽取血液, 4 000 r/min离心10 min取上清用于激素测定。取组织样品(心、脑、垂体、肝、肠、胃、肾、脾、肌、鳃、精巢和卵巢)投入液氮, –80℃保存, 用于后续RNA提取。精巢样品取一半分别固定于波恩氏液和4%多聚甲醛(PFA)中, 用于组织学观察和原位杂交。
1.2 血清激素水平测定
所取的不同月龄的雄鱼血清通过ELISA方法测定血清中P4和DHP的含量(pg/mL)。所用试剂盒为美国TSZ公司的Fish Progesterone(P)ELISA Kit和Fish 17α, 20βOH-PROG ELISA Kit。
1.3 组织学观察
精巢在波恩氏液中固定22 h, 然后转入70%乙醇中保存。固定的样品梯度酒精脱水, 二甲苯透明, 常规石蜡包埋, 做连续切片, 厚度为3μm, 苏木精-伊红染色(HE), 显微镜观察(Nikon E200), 并拍照记录。
1.4 实时荧光定量PCR
通过荧光定量PCR研究和在大菱鲆成体各组织及不同月龄性腺中的表达模式。选用上海飞捷总RNA抽提试剂盒提取总RNA, 根据Nanodrop 2000 测定的RNA浓度, 按照Takara反转录试剂盒说明书合成cDNA。以合成的cDNA为模板,(ubiquitin)和(radial spoke protein 4)为内参, 扩增参数如下: 95℃30 s; 95℃10 s, 55℃30 s循环40圈。荧光定量引物见表1。

表1 实验用引物及序列
1.5 切片原位杂交
用梯度乙醇脱水4%PFA固定的精巢样品, 透蜡处理, 石蜡包埋切片, 切片厚度为3 μm。切片脱蜡复水, 4%PFA15 min固定, PBST洗涤3次, 每次5 min, 蛋白酶K(10 μg/mL)37oC消化15 min, 再用PBST洗涤3次, 每次5 min。65℃预杂交2 h, 终质量浓度为1 ng/μL的探针80℃变性 10 min后滴加在切片上, 200 μL/片, 封口膜覆盖, 65℃孵育过夜。第二天洗涤, 室温2% blocking buffer 封闭2 h, 荧光抗体孵育过夜。第三天再洗涤, 封闭, 地高辛抗体孵育过夜。第四天洗涤, 用NTMT稀释NBT/BCIP后避光显色, 待样品达到理想色度后, 用PBST洗涤3次, 每次5 min, 终止显色, 50%甘油封片, 拍照观察。原位探针引物见表1, 根据设计的引物从精巢cDNA中扩增/目的条带, 胶回收连接到PGEM-T easy 载体, 转化到大肠杆菌感受态, 挑选阳性克隆测序。选取含正确插入方向的单克隆, 提取质粒, 酶切纯化, 用T7和SP6RNA转录酶分别合成/a反义和正义探针。
1.6 统计学处理
激素和基因的表达变化以平均值±标准误差表示, 每组数据包括3个平行样品。统计学处理使用spss17.0进行单因素方差分析LSD法, 检验水平均为<0.05。
2 结果
2.1 组织学观察
通过组织学切片观察大菱鲆6月龄~22月龄的精巢发育过程。在6月龄~10月龄阶段, 大菱鲆精巢中的生殖细胞全部为精原细胞(图1a, 1b)。从12月龄开始, 随鱼体生长, 精巢中逐渐观察到初级精母细胞(图 1c), 之后初级精母细胞占总生殖细胞的比例逐渐增加。在16月龄的精巢中观察到大量的初级精母细胞和少量精子细胞(图1e), 之后精子细胞的数量不断增加(图 1f), 在22月龄时, 出现少量精子混杂在精子细胞中(图1g)。
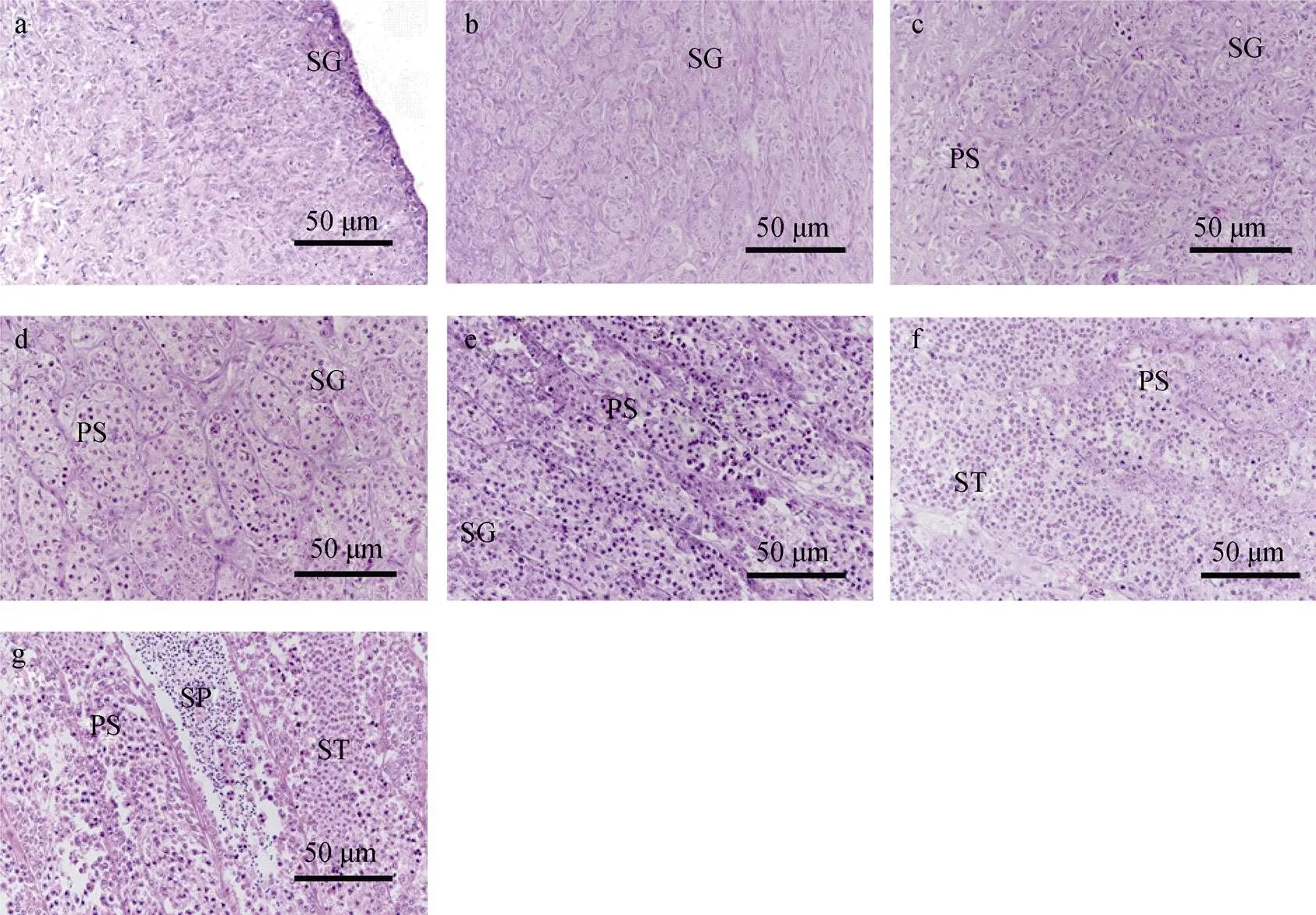
图1 大菱鲆6~22月龄精巢发育形态特征
a. 6月龄, 精原细胞; b. 10月龄, 精原细胞; c. 12月龄, 主要类型为精原细胞和初级精母细胞; d. 14月龄, 主要类型为精原细胞和初级精母细胞; e. 16月龄, 主要类型为初级精母细胞和精子细胞; f. 20月龄, 主要类型为初级精母细胞和精子细胞; g. 22月龄, 主要类型为初级精母细胞, 精子细胞和精子; SG. 精原细胞; PS. 初级精母细胞; ST. 精子细胞; SP. 精子
a. 6 mah, spermatogonia; b. 10 mah, spermatogonia; c. 12 mah, the major types include spermatogonia and primary spermatocytes; d.14 mah, the major types include spermatogonia and primary spermatocytes; e. 16 mah, the major types include primary spermatocytes and spermatids; f. 20 mah, the major types include primary spermatocytes and spermatids; g. 22 mah, the major types include primary spermatocytes, spermatids and sperm; SG. Spermatogonia; PS. primary spermatocytes; ST. spermatids; SP. sperm
2.2 激素含量变化
P4和DHP在6月龄时高表达, 之后在12~14月龄初级精母细胞增加时表达量逐渐降低, 在14月龄时表达量最低, 之后在出现大量精子细胞的16~20月龄阶段表达量显著升高, 随精子细胞变态形成精子P4和DHP的表达量再次显著降低(图2)。
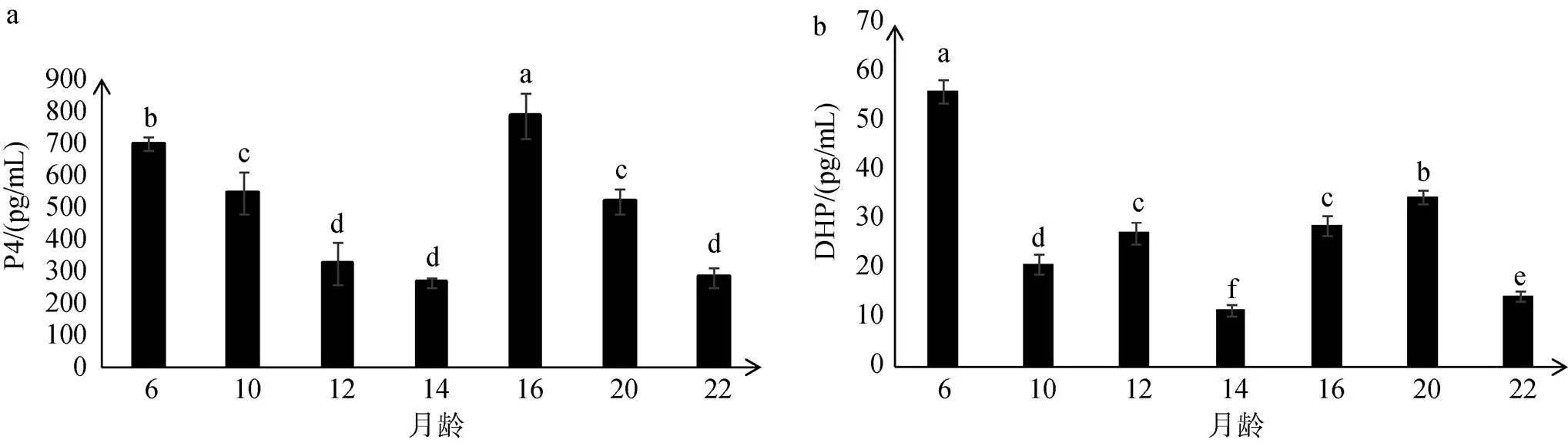
图2 6~22月龄雄性大菱鲆血清中P4和DHP的含量
a. P4; b. DHP; 每组数据为3个平行样的平均值土标准差; 标注的不同字母表明具有显著性的差异(< 0.05)
a. progesterone (P4); b. 17α, 20β-dihydroxy-4-pregnen-3-one(DHP); the concentrations of steroids levels are represented as means ± SEM of three independent samples; Different letters above histograms indicate significant difference (< 0.05)
2.3 组织表达模式分析
对和在10月龄大菱鲆不同组织中的表达结果分析显示,在垂体和精巢中表达量显著高于其他组织, 其次是卵巢, 在其他组织中的表达量都非常低(图3a)。在脑中表达量显著高于其他组织。其次是垂体和眼, 在其他组织中的表达量都非常低(图3b)。
2.4 pgr, mPRα, sycp3, amh在不同时期性腺中的表达
在6月龄精原细胞增殖期就已经表达, 之后持续显著上升, 在20月龄精巢中主要细胞类型为精子细胞时表达量最高, 在22月龄出现少量精子时期显著降低(图4a)。在6~14月龄阶段主要细胞类型为精原细胞和初级精母细胞时表达量较低, 在16月龄出现大量初级精母细胞和少量精子细胞时显著升高, 16~22月龄阶段略有降低, 但仍显著高于6~14月龄阶段(图4b)。在6月龄就已经开始表达, 之后持续升高, 在16月龄出现大量初级精母细胞和少量精子细胞时表达量显著升高, 随精子细胞数量增加,相对表达量略有下降, 在22月龄出现少量精子时期时表达量最高(图4c)。的表达量从6月龄开始持续升高, 在14月龄出现少量初级精母细胞时达到最高峰, 显著高于其他时期。之后随精子细胞数量的不断增加,的表达量显著下降, 在之后的16~22月龄阶段持续低表达(图4d)。
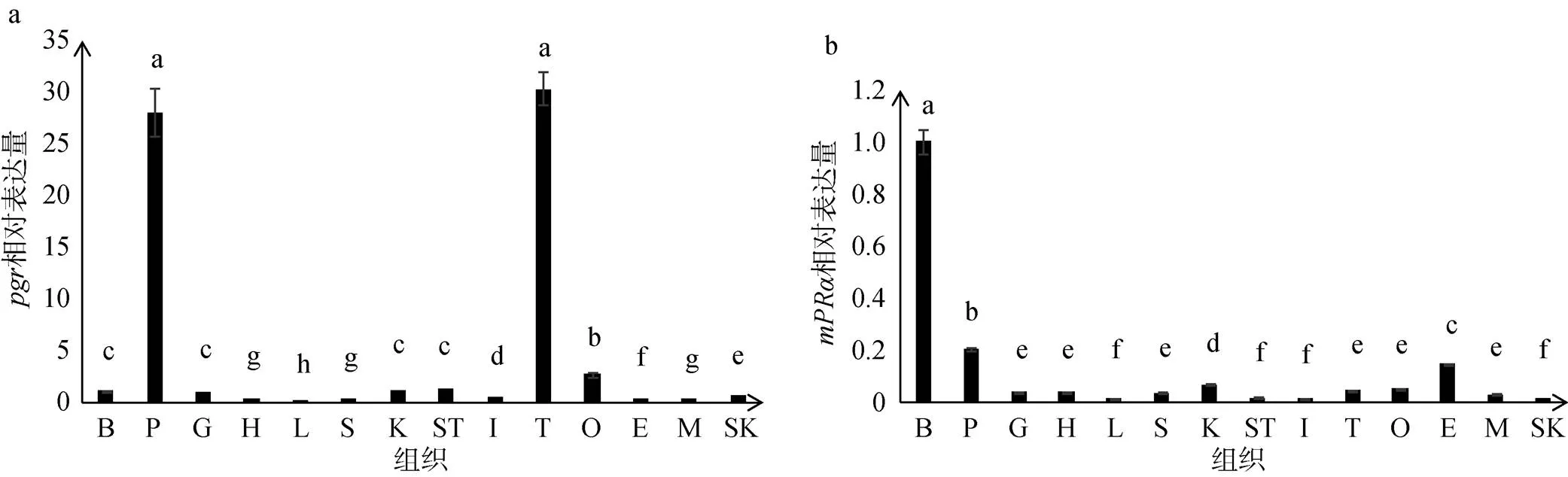
图3 Real-Time PCR检测在10月龄大菱鲆不同组织中pgr和mPRαmRNA的表达
B. 脑; P. 垂体; G. 鳃; H. 心脏; L. 肝脏; S. 脾; K. 肾; ST. 胃; I. 肠; T. 精巢; O. 卵巢; E. 眼; M. 肌肉; SK. 皮肤。实验使用10月龄雄鱼为材料, 设3次重复。数值代表mRNA的相对表达量。3次重复数据以平均值±标准差展示。通过单因素方差分析, 不同字母表明具有显著性差异(<0.05)
B. brain; P. pituitary; G. gill: H. heart; L. liver; S. spleen; K. kidney; ST. stomach; I. intestines; T. testis; O. ovary; E. eye; M. muscle; SK. skin; Relative mRNA level represents the mean ± SEM of three independent samples. Different letters indicate significant difference ofand mPRα mRNA levels (< 0.05)
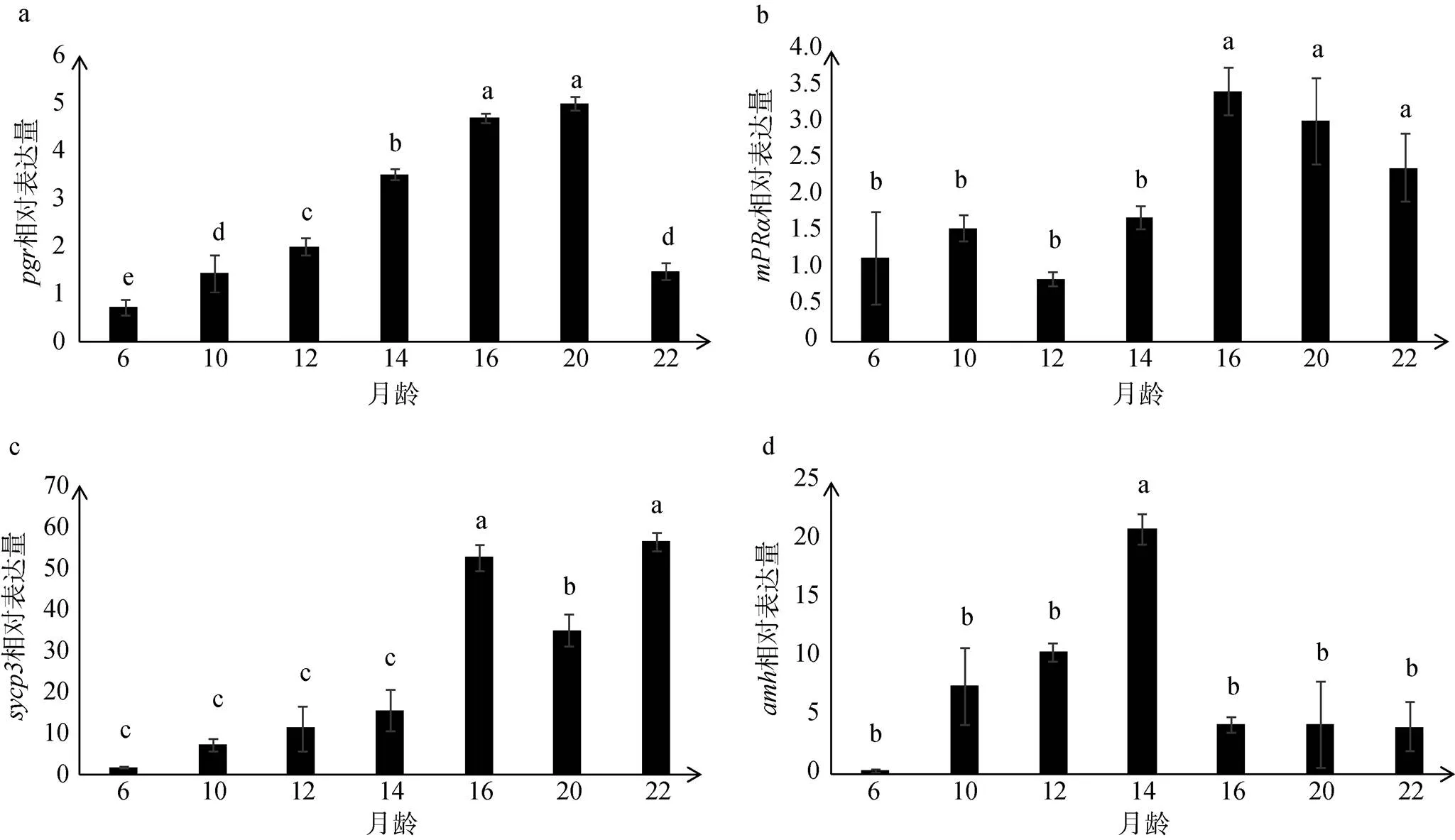
图4 Real-Time PCR检测pgr, mPRα, sycp3和amh在6~22月龄性腺中的表达水平
相对表达量为3个平行样的平均值士标准差。图上标注的不同字母表明具有显著性的差异(<0.05)
Relative mRNA levels are represented as mean ± SEM of multiple independent samples. Different letters indicate significant difference of,,andmRNA levels (< 0.05)
2.5 pgr, mPRα在减数分裂期大菱鲆精巢上的定位
通过原位杂交技术定位和在16月龄的精巢中的分布, 在精巢边缘位置在间质细胞中表达(图5b),没有检测到信号(图5c)。该位置的精巢中主要细胞类型为精原细胞和初级精母细胞(图5a)。图5d和5e分别为和的对照组。

图5 pgr和mPRα在16月龄大菱鲆精巢中的定位
SG. 精原细胞; PS. 初级精母细胞; Ser. 间质细胞
SG. Spermatogonia; PS. primary spermatocytes; Ser. sertoli cells
3 讨论
低等脊椎动物中, 雌鱼生殖细胞先增殖进入减数分裂阶段, 而雄鱼处于有丝分裂阻滞[1], 如尼罗罗非鱼雌鱼孵化后35 d进入减数分裂Ⅰ期, 而雄鱼在孵化后85 d进入减数分裂Ⅰ期; 雌性黑鲷鱼孵化后120 d进入减数分裂Ⅰ期, 而雄鱼在孵化后150 d出现少量进入减数分裂阶段的生殖细胞。减数分裂Ⅰ期是一个相当特殊的过程, 包括同源染色体的配对、联会和同源染色体重组。之后初级精母细胞分裂为两个子细胞, 重新生成的细胞紧接着发生第二次分裂。
减数分裂进程一旦出错, 精子发生就会停滞并最终导致不育。通过组织切片观察表明大菱鲆在6~10月龄阶段为精原细胞增殖期, 大菱鲆精巢中的生殖细胞类型只有精原细胞, 精原细胞不断增殖, 之后在12~14月龄阶段逐渐出现初级精母细胞, 表明精巢从精原细胞增殖期开始进入减数分裂Ⅰ期。在16~20月龄阶段, 初级精母细胞和精子细胞为主要的生殖细胞类型, 精原细胞仅在精巢边缘存在, 表明精巢开始进入第二次减数分裂阶段。在22月龄的精巢中可以观察到精子细胞占主导地位, 并出现少量精子混杂在精子细胞中。基因编码的蛋白主要表达在初级精母细胞中, 是第一次减数分裂偶线期同源染色体配对过程中联会复合体的主要结构蛋白, 因此可以作为减数分裂Ⅰ期的标记基因。本实验中, 在6月龄的大菱鲆精巢中已经开始低表达, 但在组织切片中没有观察到精母细胞, 虽然此时精巢中的精原细胞还没有开始减数分裂, 但是已经开始表达, 推测的表达可能开始于精原细胞增殖期。在6~14月龄期间的表达量持续增加, 表明随月龄增加, 精巢发育, 越来越多的精原细胞发育成初级精母细胞, 这也和组织切片观察到的吻合, 在16和22月龄时高表达, 表明虽然在这两个时期主要细胞类型分别为精子细胞和精子, 但在精巢边缘仍有精原细胞源源不断的发育成初级精母细胞。在6~14月龄阶段持续升高, 在之后的16~22月龄阶段显著降低。由此表明,在大菱鲆精原细胞增殖期和减数分裂起始阶段显著高表达, 在进入减数分裂Ⅱ期后表达量显著降低。推测促进精原细胞增殖并发育成初级精母细胞, 而精子细胞和精子对的表达起抑制作用。(Anti-Mullerianhormone)是一类以多肽形式存在的细胞生长因子, 是转化生长因子P超家族(TGF-P)的分泌型糖蛋白。哺乳动物睾丸sertoli细胞分泌的引起缪勒氏管退化。虽然硬骨鱼类并不存在缪勒氏管, 但是仍存在基因的表达。在银汉鱼()和尼罗罗非鱼中认为是雄性性别决定的必要基因[10-11]。本实验研究结果与半滑舌鳎()上的研究结果类似, 在半滑舌鳎中,在孵化后70 d之前表达量低, 在70 d时达到最高峰, 而在8月龄生精期的表达量下降[12]。同样, 在青鳉()和日本牙鲆()中,主要在未成熟的精巢中表达, 在精子发生前停止表达, 如果持续表达则会抑制精子发生过程[13-14]。在尼罗罗非鱼鱼中,在5~180 日龄的精巢的sertoli细胞和叶边细胞中持续高表达。敲除银汉鱼和尼罗罗非鱼中位于Y 染色体上的复制基因, 会导致雄性XY型胚胎个体朝卵巢方向发育[10-11]。另外,是sertoli细胞的起源基因[15], 大菱鲆的表达量在14月龄后显著降低, 也表明在进入减数分裂后, sertoli细胞占精巢总细胞的比例显著降低。
早期关于孕激素对硬骨鱼精子发生的研究主要集中在促进精子成熟排精和提高精子活力方面[2], 对孕激素通过孕酮受体对精原细胞增殖至减数分裂阶段的调节机制研究的较少。目前在硬骨鱼中得到两种具有生物活性的孕激素: 17α,20β-双羟孕酮(DHP)和17α,20β-21-三羟孕酮(20β-s), 而在已报到的硬骨鱼减数分裂起始阶段起作用的都是DHP[16-17]。本实验中, P4和DHP水平在精原细胞增殖期显著高于减数分裂Ⅰ期。这和在斑马鱼, 大西洋鲑()和大西洋鳕鱼()中DHP水平在减数分裂起始阶段增高的结果相似[5, 18-19]。用DHP体内处理斑马鱼, 诱导早期精原细胞增殖分化成后期的精原细胞和精母细胞[15]。另外DHP体外处理日本鳗鲡()精巢会刺激精原细胞DNA复制和减数分裂起始[3]。这些都说明DHP参与于早期精子发生的调节过程。因此推测在大菱鲆中P4和DHP促进精原细胞增殖和减数分裂起始。另外在减数分裂Ⅱ期, P4和DHP的表达量再次显著升高, 这和在鲑科()鱼类的研究中相似[2, 20], 因此推测P4和DHP在大菱鲆中促进精子细胞变态成熟。
在斑马鱼、尼罗罗非鱼、大西洋鳕鱼等鱼中已证明DHP是的天然配体[4, 6, 19]。在斑马鱼中DHP也可以和特异结合[21]。本实验中,的表达量在10月龄时就开始显著升高, 之后持续升高, 至20月龄达到最高峰后显著下降。表明从精原细胞增殖期就开始显著增加, 之后表达量持续升高, 直至精巢进入精子细胞变态成熟期, 才显著降低。推测促进精原细胞增殖和减数分裂。之前在斑马鱼、尼罗罗非鱼、日本鳗鲡中的研究结果表明,仅在生殖细胞减数分裂启动的关键时期出现显著上升[3-4, 6], 本实验结果延长了发挥作用的时期, 推测孕激素通过调节基因表达量促进精原细胞增殖和减数分裂两个阶段。本实验中大菱鲆精巢中的表达量在6~14月龄阶段较低, 之后显著升高, 表明在精原细胞增殖期和减数分裂Ⅰ期表达量低, 在减数分裂Ⅱ期细胞类型主要为精子细胞和精子时,的表达量显著升高。之前的研究主要集中在在精子上的表达和作用[22], 在减数分裂期精巢中的表达还没有研究。本实验定量在大菱鲆不同时期精巢中的表达水平, 推测在精子发生早期不发挥作用, 在减数分裂Ⅱ期和精子变态成熟阶段作为主要的孕酮受体发挥重要作用。
定位结果表明, 在精巢中的生殖细胞类型主要为精原细胞和初级精母细胞时,在sertoli 细胞上表达, 这和尼罗罗非鱼上的结果相似[4]。而没有明显信号, 结合荧光定量结果推测可能是由于这个阶段的表达量很低, 所以没有检测到明显信号。
[1] Lau E L, Lee M F, Chang C F, et al. Conserved sex-specific timing of meiotic initiation during sex differentiation in the protandrous black porgy[J]Biol Reprod, 2013, 88(6): 1-13.
[2] Scott A P, Sumpter J P, Stacey N, et al. The role of the maturation-inducing steroid, 17, 20beta-dihydroxypregn- 4-en-3-one, in male fishes: a review[J]. J Fish Biol, 2010, 76(1): 183-224.
[3] Higuchi M, Miura C, Iwai T, et al. Trypsin regulates meiotic initiation in the Japanese eel () by promoting the uptake of taurine into germ cells during spermatogenesis[J]Biol Reprod, 2013, 89(3): 1-9, 58.
[4] Liu G, Luo F, Song Q, et al. Blocking of progestin action disrupts spermatogenesis in Nile tilapia () [J]J Mol Endocrinol, 2014, 53(1): 57-70.
[5] Chen S X, Bogerd J, Schoonen E, et al. A progestin (17alpha, 20beta-dihydroxy-4-pregnen-3-one) stimulates early stages of spermatogenesis in zebrafish[J]Gen Comp Endocrinol, 2013, 185: 1-9.
[6] Chen S X, Bogerd J, García-López A, et al. Molecular cloning and functional characterization of a zebrafish nuclear progesterone receptor[J]Biol Reprod, 2010, 82(1): 171-181.
[7] 张瑞, 阙华勇, 张国范, 等.海湾扇贝维甲酸受体_RXR_ cDNA克隆与表达分析[J]. 海洋科学, 2016, 40(9): 1-8. Zhang Rui, Que Huayong, Zhang Guofan, et al. Molecular cloning and expression of the retinoid X receptor gene in[J]. Marine Sciences, 2016, 40(9): 1-8.
[8] Salazar M. Progestin-mediated activation of MAPK and AKT in nuclear progesterone receptor negative breast epithelial cells: The role of membrane progesterone receptors[J]Gene, 2016, 591(1): 6-13.
[9] 郭佳伟, 谭训刚, 尤锋, 等. 大菱鲆周期蛋白依赖激酶基因cdk1、cdk6克隆及表达分析[J]. 海洋科学, 2016, 40(4): 11-21. Guo Jiawei, Tan Xungang, You Feng, et al. Cloning and expression analysis of cdk1 and cdk6 in[J]. Marine Sciences, 2016, 40(4): 11-21.
[10] Hattori R S, Murai Y, Oura M, et al. A Y-linked anti-Mullerian hormone duplication takes over a critical role in sex determination[J]Proc Natl Acad Sci USA, 2012, 109(8): 2955-2959.
[11] Li M, Sun Y, Zhao J, et al. A tandem duplicate of anti-mullerian hormone with a missense SNP on the Y chromosome is essential for male sex determination in nile tilapia,[J]. PLoS Genet, 2015, 11(11): 1-23.
[12] Liu S, Sun B, Liang Z, et al. Cloning and expression of anti-mullerian hormone gene in halfsmooth tongue-sole[J]Journal of Fishery Sciences of China, 2013, 20(1): 35-43.
[13] Yoshinaga N, Shiraishi E, Yamamoto T, et al. Sexually dimorphic expression of a teleost homologue of Mullerian inhibiting substance during gonadal sex differentiation in Japanese flounder,[J]Biochemical and Biophysical Research Communications, 2004, 322(2): 508-513.
[14] Shiraishi E, Yoshinaga N, Miura T, et al.Mullerian inhibiting substance is required for germ cell proliferation during early gonadal differentiation in medaka ()[J]Endocrinology, 2008, 149(4): 1813- 1819.
[15] Liang Y Q, Huang G, Ying G, et al. The effects of progesterone on transcriptional expression profiles of genes associated with hypothalamic-pituitary-gonadal and hypothalamic-pituitary-adrenal axes during the earlydevelopment of zebrafish ()[J]Chemosphere, 2015, 128: 199-206.
[16] Miura T, Higuchi M, Ozaki Y, et al. Progestin is an essential factor for the initiation of the meiosis in spermatogenetic cells of the eel[J]Proc Natl Acad Sci U S A, 2006, 103(19): 7333-7338.
[17] Tubbs C, Tan W, Shi B, et al. Identification of 17, 20beta, 21-trihydroxy-4-pregnen-3-one (20beta-S) receptor binding and membrane progestin receptor alpha on southern flounder spermand their likely role in 20beta-S stimulation of sperm hypermotility[J]Gen Comp Endocrinol, 2011, 170(3): 629-639.
[18] Chen S X, Jan B, Eva A, et al. Cloning, pharmacological characterization, and expression analysis of Atlantic salmon (L.) nuclear progesterone receptor[J]Reproduction, 2011, 141(4): 491-500.
[19] Chen S X, Fernanda A, Eva A, et al. Cloning, pharmacological characterization and expression analysis of Atlantic cod(L.)nuclear progesterone receptor[J]. Gen Comp Endocrinol, 2012, 179(1): 71-77.
[20] Milla S, Terrien X, Sturm A, et al. Plasma 11-deoxycorticosterone (DOC) and mineralocorticoid receptor testicular expression during rainbow troutspermiation: implication with 17alpha, 20beta- dihydroxyprogesterone on the milt fluidity[J]. Reprod Biol Endocrinol, 2008, 6: 19.
[21] Hanna R N, Zhu Y. Expression of membrane progestin receptors in zebrafish () oocytes, testis and pituitary[J]Gen Comp Endocrinol, 2009, 161(1): 153- 157.
[22] Tan W, Aizen J, Thomas P. Membrane progestin receptor alpha mediates progestin-induced sperm hypermotility and increased fertilization success in southern flounder()[J]. Gen Comp Endocrinol, 2014, 200: 18-26.
(本文编辑: 谭雪静)
Progestin actions and expression analysis of progestin receptors in the meiotic in male turbot ()
FENG Cheng-cheng1, 2, 3, LIU Yi-fan1, 3, AN Hao1, 2, 3, XU Shi-hong1, 3, WANG Yan-feng1, 3, SONG Zong-cheng4, LIU Qing-hua1, 3, LI Jun1, 3
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China; 4.Weihai Shenghang Aquatic Science and Technology Co., LTD, Weihai 264200, China)
To explore the function of progestin during spermatogonial proliferation and meiosis, we used histological methods to investigate the gonadal development process of the male turbot () 6 to 22 months of age. We detected the expression ofandvia the real-time quantitative polymerase chain reaction (qRT-PCR). Using enzyme-linked immunosorbent (ELISA) technology, qRT-PCR, and in-situ hybridization, we detected the serum P4 and DHP levels and the expression patterns of the nuclear progesterone receptor () and membrane progestin receptor alpha () during different development periods. The results reveal that the P4 and DHP levels were high during spermatogonial proliferation and meiosis Ⅱ. Theexpression was high from spermatogonial proliferation to meiosis I, whereas theexpression was high during meiosis Ⅱ and spermiogenesis. Our in-situ hybridization results indicatemRNA to be predominantly located in the Sertoli cells that were in contact with the proliferating spermatogonia and primary spermatocyte and that themRNA was undetectable. Taken together, our data indicate theexpression to be involved in mediating the progestin stimulation of spermatogonia proliferation and meiosis, whereas theplays an important role in meiosis Ⅱ and spermiogenesis.
; meiosis; progestin;;
[National Science Foundation of China, No. 31472264, 31572602; The Scientific and Technological Innovation Project Financially Supported by Qingdao National Laboratory for Marine Science and Technology, No.2015ASKJ02, 2015ASKJ02-03-03; Modern Agro-Industry Technology Research System, No.nycytx-50; Youth Innovation Promotion Association CAS and Chinese Academy of Science and Technology Service Network Planning, No.KFJ-EW-STS-060]; Project from the National Infrastructure of Fishery Germplasm Resource, No.2016DKA30470]
Feb. 27, 2017
Q256
A
1000-3096(2017)08-0091-08
10.11759//hykx20170227002
2017-02-27;
2017-03-29
国家自然科学基金资助项目(31472264, 31572602); 鳌山科技创新计划资助项目(2015ASKJ02, 2015ASKJ02-03-03)资助; 鲆鲽类产业技术体系项目(nycytx-50); 中国科学院青促会项目(KFJ-EW-STS- 060); 国家科技基础条件平台建设运行项目(2016DKA30470)
丰程程(1989-), 女, 博士研究生, 主要从事海水鱼类增养殖与生物技术研究, 电话: 15610052087, E-mail: fcc19891026@163.com;李军,通信作者, E-mail: junli@qdio.ac.cn; 刘清华, 通信作者, E-mail: qinghualiu@qdio.ac.cn

