玫瑰茄花色素的提取工艺研究
黄晓德,张锋伦,钱 骅,陈 斌,朱羽尧,赵伯涛*,徐湘婷
(1. 南京野生植物综合利用研究院,江苏 南京210042;2. 南京师范大学, 江苏 南京 210023)
玫瑰茄花色素的提取工艺研究
黄晓德1,张锋伦,钱 骅1,陈 斌1,朱羽尧1,赵伯涛1*,徐湘婷2
(1. 南京野生植物综合利用研究院,江苏 南京210042;2. 南京师范大学, 江苏 南京 210023)
通过单因素和正交实验对玫瑰茄花色素提取工艺条件进行了比较筛选和优化。结果表明:玫瑰茄花色素提取的适宜溶剂为乙醇,适宜的酸碱度为pH 2.0;影响提取效果因素依次是提取时间、乙醇浓度、温度、料液比;最佳提取工艺条件为粉碎粒度40目、乙醇浓度70%(V∶V)、提取温度40 ℃、提取时间1.5 h、最佳料液比1∶20,在此优化条件下,玫瑰茄花色素的提取率可达0.485%。
玫瑰茄;花色素;提取
玫瑰茄(HibiscussabdariffaL.),又名洛神花、山茄,是锦葵科木槿属一年生草本植物,原产非洲,我国的海南、福建、广东、云南等地区有规模化种植。玫瑰茄的花萼中含有丰富的玫瑰茄花色素,现代化学分析表明,玫瑰茄花色素的主要成分为飞燕草素-3-接骨木二糖苷、矢车菊-3-接骨木二糖苷,还含有少量的飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷[1]。玫瑰茄花色素不仅颜色艳丽、天然安全,而且具有抗氧化功效,是良好的食品添加剂。
近年来,随着对合成色素安全风险认识的深入,国内外对天然色素的需求迅速增加,天然色素成为新的研究热点,玫瑰茄花色素作为新型天然色素资源,已列入我国食品添加剂目录,并制定了相应的产品标准,在我国食品加工领域有着均有广泛的应用。本文通过对玫瑰茄干花萼中花色素的提取工艺的研究,以期建立高效的玫瑰茄花色素提取工艺,为玫瑰茄花色素的开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料试剂
玫瑰茄:为南京市场销售的玫瑰干花萼。
实验所用乙醇、乙酸乙酯、蒸馏水、盐酸等均为国产分析纯试剂。
1.1.2 实验仪器
UTP-313 型电子天平:上海花潮电器有限公司;
HWS-12型电热恒温水浴锅:上海一恒试验设备有限公司;
JCS-600电子天平:凯丰集团有限公司;
YS-08小型高速粉碎机:北京燕山正德机械设备有限公司;
T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;
YHG-9140A电热恒温鼓风干燥箱:上海姚氏仪器设备厂;
DT5-1实验室离心机:上海京工实业有限公司;
LIDA921型精密pH计:上海理达仪器厂。
1.2 实验方法
1.2.1 提取pH及溶剂的筛选
以盐酸、氢氧化钠调节pH的蒸馏水为提取溶剂,比较不同pH提取液在400~700 nm波长的吸收光谱,筛选出适于进行玫瑰茄花色素测定比较的波长;以乙醇、蒸馏水、甲醇、乙酸乙酯为溶剂提取玫瑰茄花色素,通过分析扫描提取液的吸收广谱,比较吸收峰值,筛选出适宜的提取溶剂。
1.2.2 单因素试验
采用单因素随机区组实验设计方法,试验分析提取温度、乙醇浓度、提取时间、料液比、粉碎程度5个因素对花色素提取效果的影响,筛选适于玫瑰茄花色素提取的工艺参数。
1.2.3 正交试验
在单因素实验结果的基础上,对乙醇浓度、提取时间、料液比、提取温度进行4因素3水平的正交优
化实验。因素、水平设置参见表1。
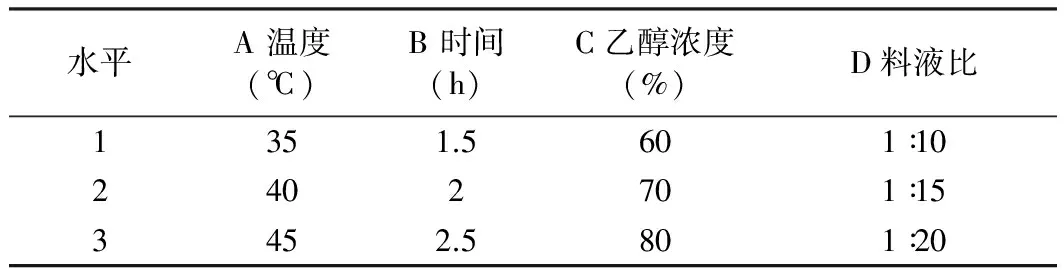
表1 玫瑰茄花色素提取的L9(43)正交试验
1.2.4 花色素含量测定
参照pH示差法[2-4],分别将提取液稀释定容后,取1 mL用pH1.0的KCl-HCl缓冲液、pH 4.5的乙酸钠-盐酸缓冲液,稀释混匀,以蒸馏水作为对照,用分光光度计于最吸收波长,测定吸光度OD530pH 1.0、OD530pH 4.5,提取液中花色素含量按下式计算。
花色素提取率C(%)=(ODpH1.0-ODpH4.5)×MW×DF×V) /(ε×m×L)×100%
式中:
MW—花色苷分子量(449.2);DF—稀释倍数;ε—摩尔消光系数(26 900);L—光程(1 cm);V—提取液体积(L);m—样品质量(g)。
2 结果与分析
2.1.1 提取pH的选择
取经干燥、粉碎的玫瑰茄花萼5 g,以盐酸、氢氧化钠调节pH的蒸馏水为提取液,按照1∶20料液比,40 ℃水浴提取2 h,提取2次后,经离心分离上清液,定溶至200 mL,稀释后,以蒸馏水对照测定400~700 nm波长的吸收光谱,结果如图1
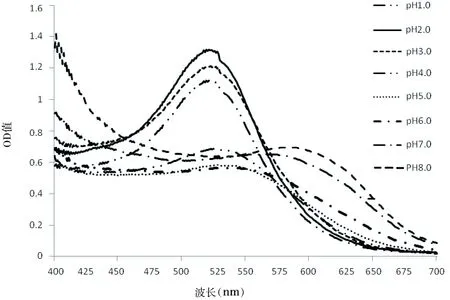
图1 溶液pH对花色素光谱的影响
分析图1可知,玫瑰茄花色素随着pH的升高,其溶液的最大吸收峰的波长也呈现出增大趋势。 pH值在1.0~3.0时,溶液最大吸收峰在520 nm左右,当pH 3~6之间时,溶液最大吸收峰在550 nm左右,pH 7、8时,最大吸收峰偏移至590 nm左右,溶液颜色由鲜红变浅在pH 5~6时,减弱至近无色,随后呈蓝色并逐渐加深色;溶液呈颜色有红色变为紫色。可见,溶液pH对玫瑰茄花色素呈色特性影响较大,以作红色素为目的提取时,适宜采用酸性溶剂进行提取,因此选择pH 2.0的提取液进行提取实验。
2.1.2 浸提溶剂的选择
分别用甲醇、无水乙醇、乙酸乙酯、70%乙醇水溶液和蒸馏水作为浸提溶剂进行提取,所得溶液光进行紫外可见光扫描,结果见图2。
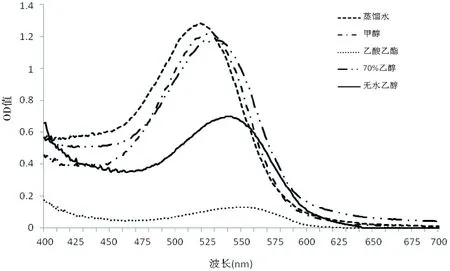
图2 提取溶剂对玫瑰红色素提取效果的影响
由图2可知,实验所选用的五种溶剂所提取的玫瑰茄花色素的吸收峰值均在520~560 nm波长范围内存,但最大吸收值存在较大的差异,蒸馏水、甲醇、50%乙醇水溶液的提取样品的最大吸收值分别为0.673、0.625和0.597,无水乙醇提取样品的最大吸收值为0.352,乙酸乙酯提取样品的最大吸收值最低,仅为0.083,表明不同溶剂间对玫瑰茄红素的溶解性存在较大差异。
同时,不同提取溶剂所提样品的最大吸收波长也有所偏移,70%酸性乙醇为溶剂提取的色素最大吸收峰出现在540 nm处,乙酸乙酯为溶剂提取的色素最大吸收峰在547 nm,蒸馏水为浸提溶剂提取的色素最大吸收峰在526 nm。分析可能是由于不同提取溶剂的极性差异,导致玫瑰茄花色的溶出量和组分有所不同,极性较大水蒸馏水和70%乙醇三个适于提取玫瑰茄花色素中的花色苷组分,而极性较弱的乙酸乙酯更易提取到花色素中的苷元成分。且考虑到花色素的含量与其溶液颜色存在一定的正相关性,比较可知,蒸馏水、甲醇和70%乙醇对玫瑰茄色素均有较好的提取效果,考虑到食用安全性及提取浓缩的需求,选择乙醇溶液作为玫瑰茄色素浸提溶剂。
2. 2 单因素试验
2.2.1 粉碎粒度
分别将玫瑰茄干花萼粉碎过10目、20目、30目、40目、60目、80目筛得到不同粉碎粒度的干花萼粉。分别称取5 g,用pH 2.0的70%乙醇作为浸提溶剂,1∶20的料液比, 40 ℃浸提2 h,离心后定容至100 mL。测定花色素提取率,结果如图3。
由图3可知,随着筛网目数变化,玫瑰茄花色素的提取率呈逐渐上升趋势,在粉碎粒度40目达到最大值0.465%,随后趋于提取率变化趋缓,并略有下降,可能是持续粉碎过程中的高温对色素造成了破坏,同时粒径过小时,比表面积增大,会色素产生较强的表面吸附作用,也是提取率下降的一个因素,因此选用40目为实验材料的粉碎粒度。
2.2.2 乙醇浓度
其他提取条件保持不变,对4份5 g玫瑰茄干粉分别用pH 2.0,体积百分比浓度为30%、50%、70%、90%的乙醇溶剂进行浸提,测定花色素提取率,结果如图4。

图3 粉碎粒度对花色素提取效果的影响

图4 乙醇浓度对花色素提取效果的影响
由图4可知,在实验设定条件下,30%、50%、70%乙醇浓度对玫瑰茄色素提取率明显高于90%和无水乙醇的提取率,而30%、50%、70%浓度的乙醇之间的差异并不明显,分析原因可能是由于玫瑰茄花色素的主要组分飞燕草素-3-接骨木二糖苷、矢车菊-3-接骨木二糖苷更易溶于极性溶剂所导致的。另外,考虑到高浓度的乙醇可以有效降低植物材料中多糖、蛋白对色素提取的干扰,降低提取浓缩过程的温度和能耗,因此选择70%乙醇溶液作为提取溶剂较为适宜。
2.2.3 料液比
保持其他条件不变,取4份等量的玫瑰茄干粉各5 g,分别用1∶5、1∶10、1∶15、1∶20的料液比进行浸提,并测定花色素提取率,结果如图5。
由图5可知,在实验设定条件下,随着液料比的增加,玫瑰茄花色素提取率呈升高趋势,在料液比达到1∶20以后,提取率的变化趋缓,这可能是由于随着料液比的增大,花色素在提取液中的浓度减小,增大了料液间的浓度梯度差,促进了花色素的溶出;当料液比增加到一定程度时,虽然料液的色素浓度差变化趋缓,色素溶出量减少。因此,在玫瑰茄花色素提取时需要的料液比大些较好,考虑节约能源和经济因素,选择料液比在1∶20到1∶30之间为宜。
2.2.4 浸提温度
称取等量玫瑰茄干粉8份,每份5 g,用pH 2.0、浓度70%的乙醇溶剂分别在4℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃温度下提取后,定容。测定花色素提取率,结果见图6。
由图6可以看出,在实验条件下,随着温度的升高,玫瑰茄花色素的提取率也随之升高,在30 ℃达到最高0.469%。此后,随着温度的继续升高呈现下降趋势,提取温度达到70 ℃时,提取率下降为0.254%,分析原因可能是高温造成玫瑰茄花色素组分的分子结构被破坏或发生降解所致。另外,考虑到高温也易造成提取溶剂挥发,故提取温度控制在30~50 ℃之间为宜。
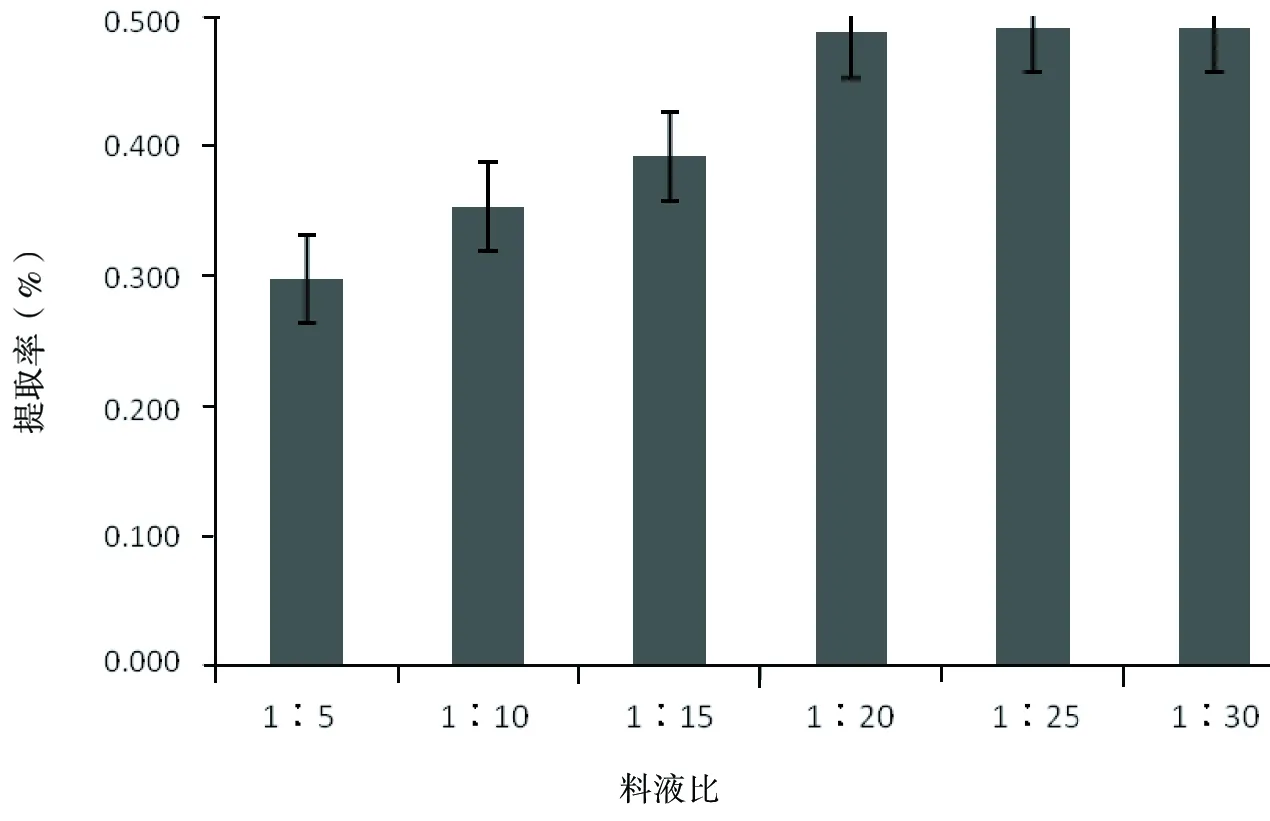
图5 料液比对花色素提取效果的影响
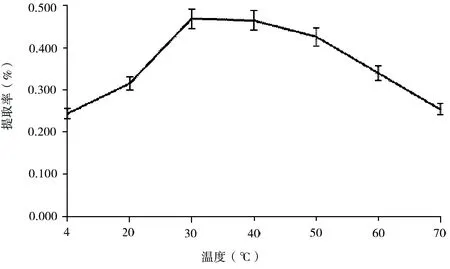
图6 温度对花色提取效果的影响
2.2.5 浸提时间
分别称取玫瑰茄花粉5 g,加入400 mL蒸馏水,于40 ℃下提取0.5 h,1.0 h,1.5 h,2.0 h,2.5 h,3.0 h,过滤定容后测定花色素提取率,结果见图7。
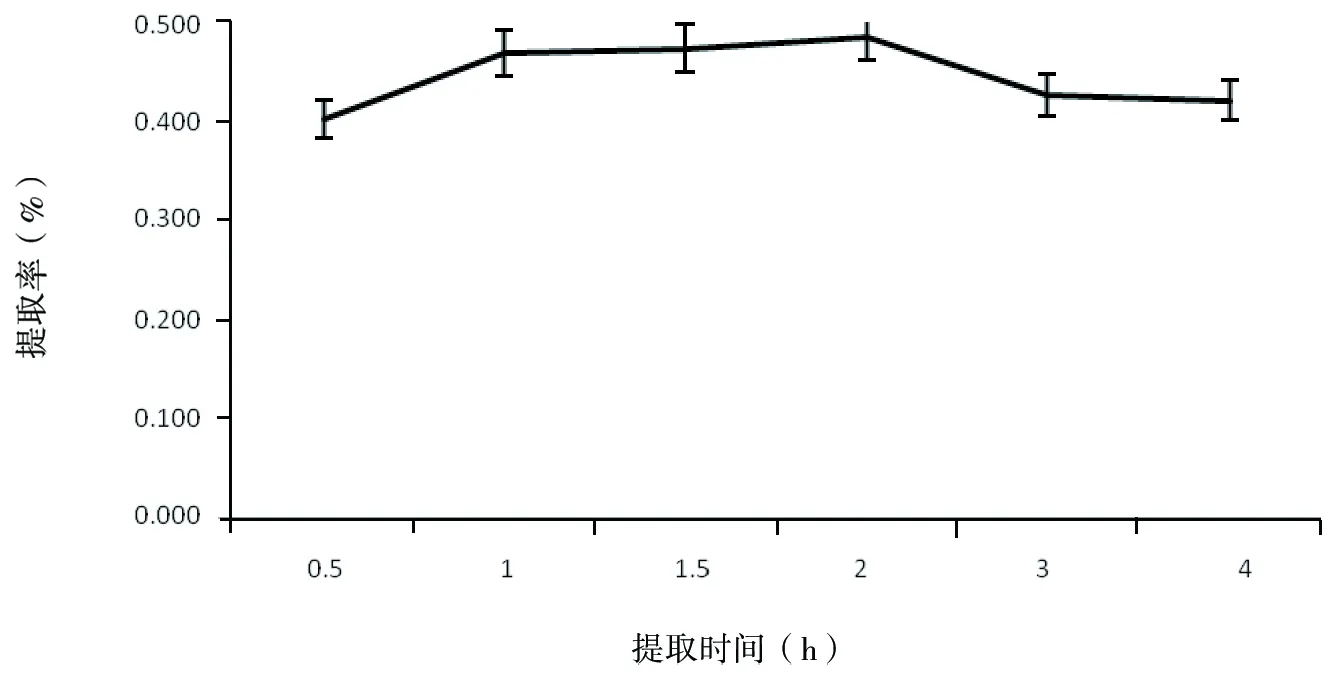
图7 时间对红色素提取效果的影响
由图7可知,在实验设定的条件下,随着提取时间的延长,玫瑰茄花色素的提取率呈现先升高后降低的趋势。在提取时间2.0 h时,提取率达到最大值0.485%,在提取时间达到2 h以后,随着提取时间的延长,提取液中花色素含量呈现下降趋势,到4 h时,提取率下降为0.705%。可能是长时间的保温提取过程导致了花色素分子结构的变化或破环的缘故。同时考虑时间、能耗等因素,选择提取时间控制在1~2 h。
2.3 正交试验分析
在上述单因素试验的基础上,对用酸性乙醇溶剂浸提玫瑰茄花色素的对浸提温度、浸提时间、浸提浓度、浸提料液比进行了L9(34)正交试验。通过所得极差大小对比来分析各因素对试验结果的影响。结果见表2。
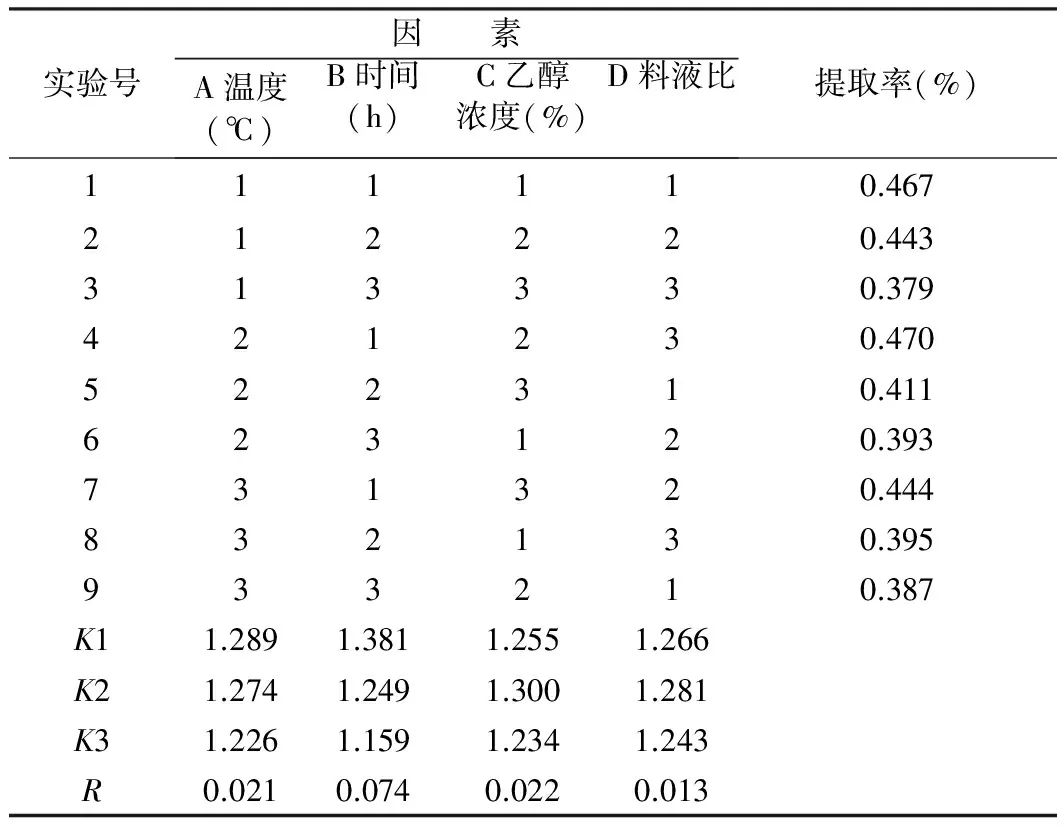
表2 正交试验因素与水平
由表2可知:在实验条件下,浸提时间之间的极差最大,为0.010 1,说明在实验设定条件范围内,提取时间对玫瑰茄花色素提取率的影响显著。其余因素主次顺序为乙醇浓度、浸提温度、料液比,由极差分析确定玫瑰茄花色素提取的优化工艺参数为A2B1C2D3,即用70%乙醇作为浸提溶剂,以1∶20的料液比,在40 ℃下浸提1.5 h。
3 结果与讨论
通过溶剂及pH筛选实验表明,玫瑰茄花色素更易溶解于极性溶剂,在提取中适于用乙醇溶液作为提取溶剂以降低杂质的溶出;提取溶剂酸碱度变化对溶液色泽及吸收光谱影响较大,以红色调色剂为目的的提取工艺时,提取液的适宜酸碱度为 pH 2.0;单因素和正交优化试验表明,玫瑰茄花色素提取效果影响因素依次是时间、乙醇浓度、温度、料液比,较优提取条件为粉碎粒度为40目、乙醇浓度70%、提取温度40 ℃、料液比1∶20、提取时间为1.5 h,在此条件下,玫瑰茄花色素的提取率达0.485%。
[1] 余华. 玫瑰茄红色素主要呈色物质分离提纯的研究[J]. 食品科学,2005(2):79-82.
[2] 冯建光,谷文英. 葡萄皮红色素的示差法测定[J]. 食品工业科技,2002,23(9):85-86.
[3] 翦祎,韩舜愈,张波,等.单一pH法、pH示差法和差减法快速测定干红葡萄酒中总花色苷含量的比较[J]. 食品工业科技,2012,33(23):323-325.
[4] 唐琳,李子江,赵磊,等. 两种pH值法测定玫瑰花花色苷含量的比较[J]. 食品科学,2009,30(18):310-313.
StudyontheExtractionProcessofAnthocyaninfromHibiscussabdariffaFlowers
Huang Xiaode1, Zhang Fenglun1, Qian Hua1, Chen Bin1, Zhu Yuyao1, Zhao Botao1*, Xu Xiangting2
(1. Nanjing Institute for Comprehensive Utilization of Wild Plants, Nanjing 210042, China;2. Nanjing Normal University, Nanjing 210023, China )
The extraction process of anthocyanin from roselle was screened and optimized by single factor and orthogonal test. The results showed that the optimum solvent for the extraction of roselle anthocyanin is ethanol and the proper pH value was 2.0; the optimum conditions of ethanol-extracting were obtained as follows: the degree of crushed roselle calyx 40 mesh, 70% ethanol as extraction solvent at 40 ℃ for 1.5 h, and the ratio of material to solvent was 1∶20. Under this condition, the extraction rate of roselle anthocyanin is 0.485%.
HibiscussabdariffaL.; anthocyanin; extraction
10.3969/j.issn.1006-9690.2017.06.006
2017-04-19
国家重点研发计划项目(2016YFF0201904)。
黄晓德(1975—),男, 硕士,研究员,主要从事植物资源利用、农业标准化研究。
*通讯作者:赵伯涛。 E-mail: zbt_nj@163.com
TS202.3
A
1006-9690(2017)06-0023-06

