漂洗次数对鳊鱼鱼糜风味物质的影响
,,
(上海海洋大学食品学院,上海 201306)
中国淡水资源丰富,是水产养殖大国。2015年中国淡水养殖总量为3062.27万t,比上年增长4.31%。其中鱼类产量2715.01万t,比上年增加112.04万t,增长4.30%[1]。鳊鱼产量为79.68万t,比上年增长了1.76%[1]。长期以来,中国淡水产品由于其结构特点和消费习惯,加工比例仅为15%左右,远低于海产品加工。而国内外研究学者普遍认为鱼糜制品加工是中国淡水鱼加工业发展的重要方向之一。
漂洗是鱼糜制作过程中一道非常重要的工序,漂洗一方面使肌原纤维蛋白浓度得到相对提高,增强鱼糜凝胶形成能力,去除鱼肉腥味,改善鱼糜品质,另一方面则会降低一些呈味核苷酸类物质和水溶性游离氨基酸的含量,影响鱼糜产品的风味。施文正等[3]研究了漂洗过程对草鱼鱼糜挥发性成分变化的影响,结果表明随着漂洗次数的增加,挥发性成分的数量及挥发物总量减少,经过一次漂洗和两次漂洗后鱼糜的挥发性成分均有显著改变,而经过两次漂洗和三次漂洗后的鱼糜挥发性成分无显著改变。马海建等[2]研究了漂洗过程中白鲢鱼风味物质的变化,结果表明一次漂洗和二次漂洗后鱼糜中IMP含量显著减少(p<0.05),三次漂洗后AMP含量显著减少(p<0.05);游离氨基酸总量和鲜、甜味氨基酸总量均随漂洗次数的增加而显著减少(p<0.05)。
本文以鳊鱼为原料,研究了漂洗次数对鳊鱼鱼糜的主要呈味核苷酸类物质和游离氨基酸含量的影响,通过电子舌分析了其滋味的变化,用气相色谱联用仪(GC-MS)分析了其挥发性成分的变化,旨在进一步研究漂洗次数在鱼糜生产过程中对其风味物质的影响,为脱除淡水鱼腥味和生产优质鱼糜制品提供理论依据。
1 材料与方法
1.1材料与仪器
鳊鱼 2016年10月购买于上海市古棕路农贸市场,体重(1.0~1.5 kg)/尾;标准品三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、一磷酸腺苷(AMP)、肌苷酸(IMP)、次黄嘌呤核苷(HxR)、次黄嘌呤(Hx) Sigma公司;甲醇、磷酸二氢钠和磷酸氢二钠(色谱纯)、氢氧化钾、氢氧化钠、氯化钠、高氯酸、三氯乙酸、磷酸(分析纯) 国药集团。
滚筒采肉机、JL-200自动精滤机、LC-2010CHT高效液相色谱仪 日本岛津公司;L-8800氨基酸全自动分析仪 日本Hitachi公司;ASTREE电子舌 法国Alpha M.O.S 公司;7890A-5975C气相色谱-质谱联用仪 美国Agilent公司;固相萃取整体捕集剂MonoTrap RCC18(2.9 mm×5 mm,孔径1 mm) 日本GL sciences公司。
1.2实验方法
1.2.1 样品准备 鳊鱼经去头、尾及内脏后洗净剖片,放入采肉机进行采肉,然后精滤,再用鱼肉质量五倍的低温清水(范围采用0~10 ℃)漂洗三次,每次漂洗时间均为10 min。分别取精滤后未漂洗、一次漂洗、两次漂洗和三次漂洗后的鳊鱼鱼糜样品进行各项指标的测定。
1.2.2 ATP关联物的测定
1.2.2.1 样品处理 参考Yokoyama[4]和马海建[2]的方法。分别称取鱼肉样品5 g,加高氯酸匀浆,取上清液,沉淀用5 mL 5%的高氯酸洗涤、10000 r/min离心15 min后取上清液,重复操作两次,合并上清液,用KOH溶液调节pH至6.5,静置30 min后取上清液定容至50 mL,摇匀,过0.45 μm膜后待测。
1.2.2.2 高效液相色谱仪(HPLC)条件 GL Sciences公司Inertsil ODS-SP C18(4.6 mm×250 mm,5 μm)液相色谱柱;保护柱柱芯Inertsil ODS-SP(4 mm×10 mm,5 μm);流动相:A为0.05 mol/L磷酸二氢钾和磷酸氢二钾(1∶1)溶液,用磷酸调节pH至6.5,B为甲醇溶液,A∶B=95∶5,等度洗脱;流速:1 mL/min;柱温:28 ℃;进样量:10 μL;检验波长:254 nm。
1.2.3 游离氨基酸的测定
1.2.3.1 样品处理 参考姚志勇[5]和马海建[2]方法。分别称取鱼糜样品2 g,加入三氯乙酸匀浆,静置沉淀,然后用冷冻离心机离心,取上清液,用NaOH溶液调节pH至2.0,定容,摇匀,过0.22 μm膜后待测。
1.2.3.2 氨基酸自动分析仪条件 分离柱:4.6 mm I.D.×60 mm,分离树脂为阳离子交换树脂;分离柱温度:57 ℃;检测波长:570 nm(脯氨酸为440 nm);缓冲溶液流速:0.40 mL/min;反应液:茚三酮试剂;反应液流量:0.35 mL/min;反应单元温度:135 ℃;进样量20 μL。
1.2.4 电子舌分析
1.2.4.1 样品处理 准确称取2 g鱼肉,经前处理后取其上清液进行过滤,定容待测。
1.2.4.2 电子舌条件 平衡溶液为去离子水,样品体积80 mL,分析时间180 s,采集时间120 s,传感器每秒采集一个数据,选取第120 s的响应值作为原始数据信号进行分析[6]。
1.2.5 挥发性成分的分析
1.2.5.1 固相微萃取(SPME)条件 称取鱼糜样品3 g,置于20 mL顶空瓶内,将3个固相萃取整体捕集剂MonoTrapRCC18(下文以MTRCC18表示)用固定装置串连,置于顶空瓶中样品上方[7]。50 ℃水浴45 min,萃取完全后取出,迅速装入热脱附管中,由进样器转移至热脱附器(TDU)中进行热脱附。
1.2.5.2 TDU条件 不分流模式,起始温度50 ℃,以180 ℃/min升至250 ℃,保留10 min。
1.2.5.3 CIS条件 起始温度55 ℃,平衡60 s,以12 ℃/s升至270 ℃,保留2 min。
1.2.5.4 色谱条件 DB-5MS弹性毛细管柱(60 m×0.32 mm×1 μm),不分流模式,程序升温。
1.2.5.5 质谱条件 传输线温度280 ℃;离子源温度230 ℃;四极杆温度150 ℃;电子能量70 eV;质量扫描范围m/z:35~350。
1.2.5.6 定性及定量分析 将检测到的挥发性成分通过系统自带NIST 02和Wiley质谱数据库进行定性确认,通过面积归一化法求得各成分在各组挥发性成分中的相对含量。
1.2.5.7 关键风味化合物的确定 采用相对气味活度值(relative odor activity value,ROAV)法[8],定义对样品总体风味贡献最大的组分:ROAVstan=100,对其他挥发性物质则按下面的公式计算:
式中:Cri、Ti是各挥发性物质的相对含量和相应的感觉阈值;Crstan、Tstan分别是对样品总体风味贡献最大的组分的相对含量和相应的感觉阈值。
1.3数据处理
实验数据均由Excel、SPSS 17.0等软件进行分析处理。
2 结果与分析
2.1漂洗次数对鳊鱼鱼糜呈味核苷酸含量的影响
ATP及其降解产物是影响鱼肉风味的重要因素之一,其体内降解途径如图1所示[9]:
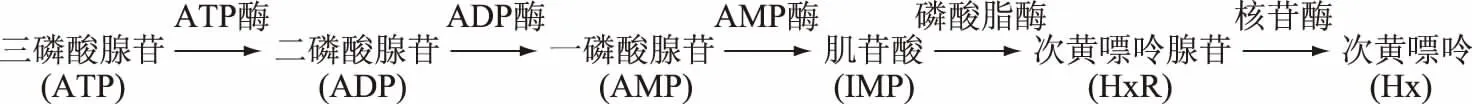
图1 ATP降解途径
Fig.1 Degradation pathway of ATP
在ATP降解产物中,对其风味有主要贡献的是IMP和AMP[2]。AMP有着压抑苦味的特性,能使食品产生理想的咸味和甜味,是水产食品中良好的风味增强剂[9]。IMP是主要的呈味核苷酸,与谷氨酸共存时对风味有显著的协同作用[4],作为一种重要的呈味物质,已逐渐广泛应用于食品调味中。
图2为漂洗次数对鳊鱼鱼糜ATP、AMP、IMP含量的影响。由图2可见,未漂洗鱼糜组中IMP含量为1536.84 μg/g,相对于未漂洗组,一次漂洗后为250.87 μg/g,降幅达到83.67%,二次漂洗后为69.82 μg/g,降幅为95.46%,三次漂洗后为59.47 μg/g,降幅为96.13%,均差异显著(p<0.05)。漂洗过程中ATP和AMP含量的变化较为平缓。未漂洗鱼糜组中ATP含量为38.34 μg/g,经一至三次漂洗后分别下降了56%、66.01%和71.65%。未漂洗鱼糜组中AMP含量为31.86 μg/g,一次漂洗后为10.39 μg/g,降幅达到67.39%,差异显著(p<0.05),两次和三次漂洗后分别为10.20 μg/g和9.89 μg/g,变化不显著(p>0.05)。三次漂洗后AMP含量相对于未漂洗组减少了68.96%。
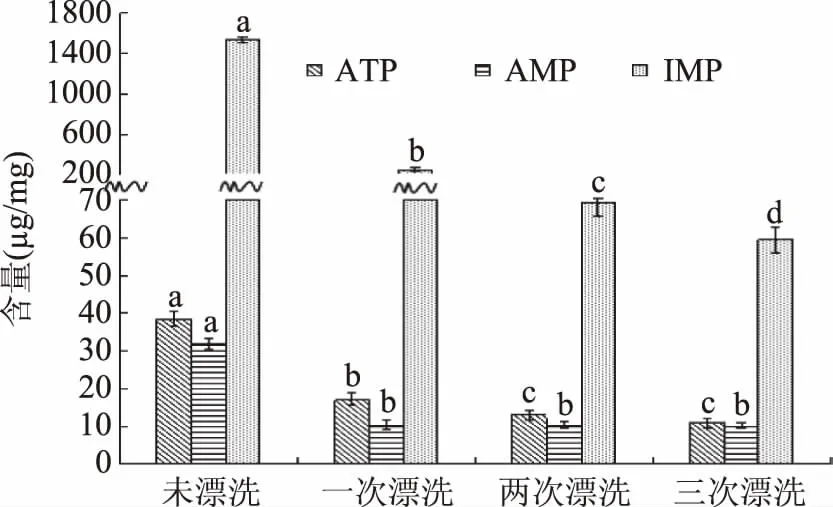
图2 不同漂洗次数鳊鱼鱼糜ATP、AMP和IMP含量的变化Fig.2 Changes of ATP、AMP and IMP content in Bream surimi at different rinsing times注:不同字母表示同一组间有显著性差异(p<0.05)。
因此,漂洗次数对鳊鱼鱼糜核苷酸物质的含量有明显影响。一次漂洗对鳊鱼鱼糜中ATP、AMP和IMP的损失影响最为严重,一次漂洗后ATP、AMP和IMP的含量均显著减少(p<0.05)。两次和三次漂洗后IMP的含量显著减少(p<0.05),而ATP和AMP的含量变化不显著(p>0.05)。马海建[2]等人对漂洗过程中白鲢鱼糜呈味核苷酸变化的研究结果也呈现相同规律。
2.2漂洗次数对鳊鱼鱼糜游离氨基酸含量的影响
游离氨基酸也是水产品中一类重要的呈味物质,它对滋味的影响不仅和种类及含量相关,还与各种氨基酸本身的阈值以及相互作用有关。经过对各组鱼糜样品中游离氨基酸含量的测定,结果发现在未漂洗鱼糜组中甘氨酸(Gly)、丙氨酸(Ala)、赖氨酸(Lys)、组氨酸(His)和脯氨酸(Pro)含量较高。Gly对鱼肉的甜味有贡献,His也是呈甜味的特征氨基酸,使某些水产品呈现“肉香”特征[11],Ala是略带苦味的甜味氨基酸,与谷氨酸、鸟苷酸、肌苷酸等配伍能产生鲜味相乘作用[12],Lys是人体第一必需氨基酸,能在体内发生转氨基反应,在营养学上意义重要[13]。
由表1可知,漂洗次数对鳊鱼鱼糜游离氨基酸总量有明显的影响。未漂洗鱼糜组中游离氨基酸总量为2754.93 μg/g,经一到三次漂洗后,游离氨基酸总量均显著性减少(p<0.05),分别下降了72.80%、81.45%和86.29%,一次漂洗后损失最为严重。
鲜、甜味氨基酸主要包括Asp、Thr、Ser、Glu、Gly、Ala、Pro七种,其中Asp和Glu是呈鲜味的特征性氨基酸,其他五种氨基酸和甜味有关[13]。未漂洗鱼糜组中的鲜、甜味氨基酸总量为945.53 μg/g,相比未漂洗组,一次、两次和三次漂洗后的鱼糜鲜、甜味氨基酸总量降幅分别为73.39%、87.57和93.66%,可知一次漂洗后鲜、甜味氨基酸的损失最大,随着漂洗次数增加,鲜、甜味氨基酸损失增加。其中Gly、Ala和Pro的含量变化比较明显。相对于未漂洗鱼糜组,三次漂洗后Gly、Ala降幅分别为95.72%、92.91%,两次和三次漂洗后的鱼糜组中未检测出Pro。
呈苦味特征的氨基酸主要包括Val、Met、Ile、Leu、Tyr、Phe、Lys、His和Arg。漂洗次数对苦味氨基酸总量损失有显著影响(p<0.05)。未漂洗鱼糜组中苦味氨基酸总量为1675.81 μg/g,一到三次漂洗后,苦味氨基酸总量降幅分别为71.85%、77.99%和81.34%。其中Lys和His的含量变化最为明显。相对于未漂洗鱼糜组,三次漂洗后Lys和His降幅分别为84.18%和92.22%。
值得关注的是,每一次漂洗,鲜、甜味氨基酸的损失量均大于苦味氨基酸。
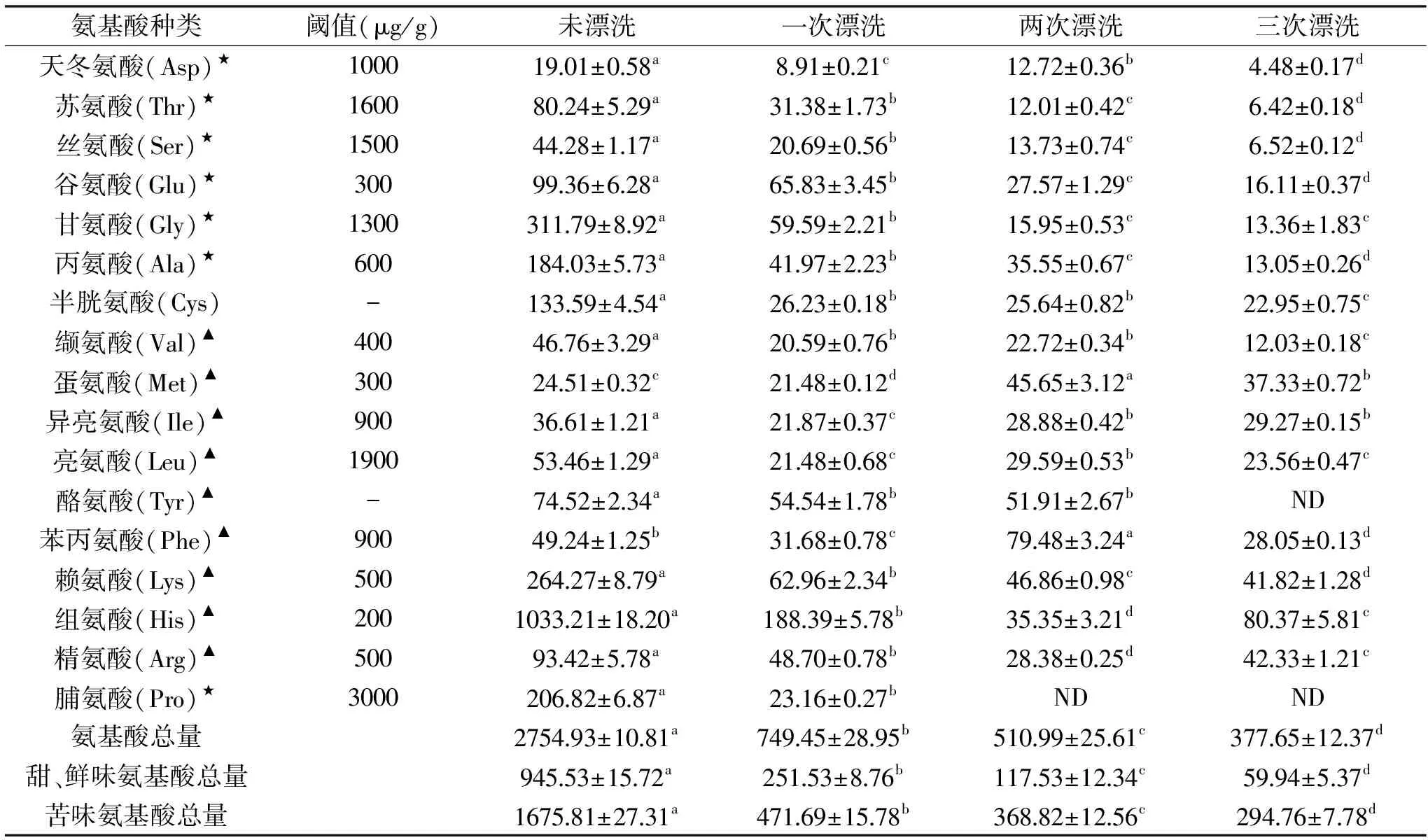
表1 不同漂洗次数鳊鱼鱼糜游离氨基酸含量的变化(μg/g)Table 1 Changes of free amino acid content in Bream surimi at different rinsing times(μg/g)
注:表中数据均已换算到相同水分含量(80%);★为鲜、甜味氨基酸,▲表示苦味氨基酸。不同字母表示同一行间有显著性差异(p<0.05),“-”表示未查到,ND 表示未测出。
2.3 不同漂洗次数处理的鳊鱼鱼糜电子舌数据主成分分析
电子舌是模拟生物味觉模式建立起来的基于化学传感器和模式识别的液体分析仪器。作为一种快速检测食品滋味品质的新技术,通过检测样品中水溶性物质从而达到快速区别食品滋味差别,具有高灵敏度、可靠性、重复性的特点。
如图3所示,PC1和PC2的贡献率分别为58.1%和33.0%,累积贡献率为91.1%,说明该图基本能够反映样本整体差异性信息在主成分平面上的完整程度。从图3可以看出,每一组样品的三个点离散度较小且相互之间无干扰,说明四组样品的滋味可以被电子舌很好区分。其中未漂洗组和其他三组样品间间隔较远,而两次和三次漂洗组间隔较小,说明漂洗次数对鳊鱼鱼糜的整体滋味轮廓有影响,一次漂洗对滋味轮廓影响最大,两次和三次漂洗的滋味轮廓接近。这与呈味核苷酸以及游离氨基酸的分析结果一致。

图3 各组样品的电子舌数据主成分分析(PCA)图Fig.3 PCA analysis of E-nose for each samples
2.4漂洗次数对鳊鱼鱼糜挥发性物质的影响
采用3个串联的新型固相萃取整体捕集剂作为吸附介质,结合两级热脱附技术,利用GC-MS对各组鱼糜样品的挥发性成分进行测定。
经过NIST图库检索和文献参考确认,未漂洗、一次、两次和三次漂洗后的鱼糜样品中分别检测出38、25、22和21种挥发性成分,主要为醛酮类、醇类、烷烃烯烃类和芳香族类化合物。未漂洗组中,检测到的醛酮类化合物16种,相对含量占49.36%,醇类物质8种,相对含量占30.01%,其他三组和未漂洗组一样,醛酮类和醇类化合物在种类和数量上均占有最大优势,共同作用形成鱼肉的气味。一次漂洗后,醛酮类的2-甲基丁醛、2-庚酮、2-癸酮、苯丙酮和十一醛未在样品中检出,醇类中的3-甲基戊醇和1.3-甲基-4-戊烯醇也未被检出;两次漂洗后,3-甲基戊醛、2-己酮、2,3-辛二酮和2-壬醇未被检出,三次漂洗后与两次漂洗后的挥发性物质种类差别很小。这些未被检出的挥发性化合物可能是导致鳊鱼肉鱼腥味的主要原因。随着漂洗次数的增加,甲苯、2-甲基萘、联苯、2-甲基联苯和苯乙烯等含苯化合物逐渐被洗脱而未被检出。含苯化合物的存在,说明鱼体被环境在一定程度上被污染,漂洗可以去除一些环境污染物,增加鱼糜的卫生安全性。
1~3次漂洗后,醛酮类物质的总相对含量分别增加到61.15%、61.29%和73.79%,而对于醇类物质总相对含量,一次漂洗对其影响小,两次和三次漂洗后分别减少为21.82%和14.77%。对鱼肉气味形成贡献较大的醛酮类和醇类物质的总相对含量在未漂洗、一次、两次和三次漂洗后分别为79.37%、92.11%、83.79%和88.56%。随着漂洗次数的增加,烷烃类化合物总相对含量减少,由于烷烃类化合物的阈值较高,对鳊鱼鱼糜的风味形成影响较小,而芳香族化合物总相对含量略有增加。由此可见漂洗次数对鳊鱼鱼糜挥发性物质含量有明显的影响,一次漂洗对鳊鱼鱼糜挥发性成分相对含量影响最大,其次是两次漂洗,三次漂洗影响最小。这和施文正[3]对草鱼鱼糜以及马海建[2]对白鲢鱼鱼糜在漂洗过程中的挥发性成分变化研究结果基本一致。
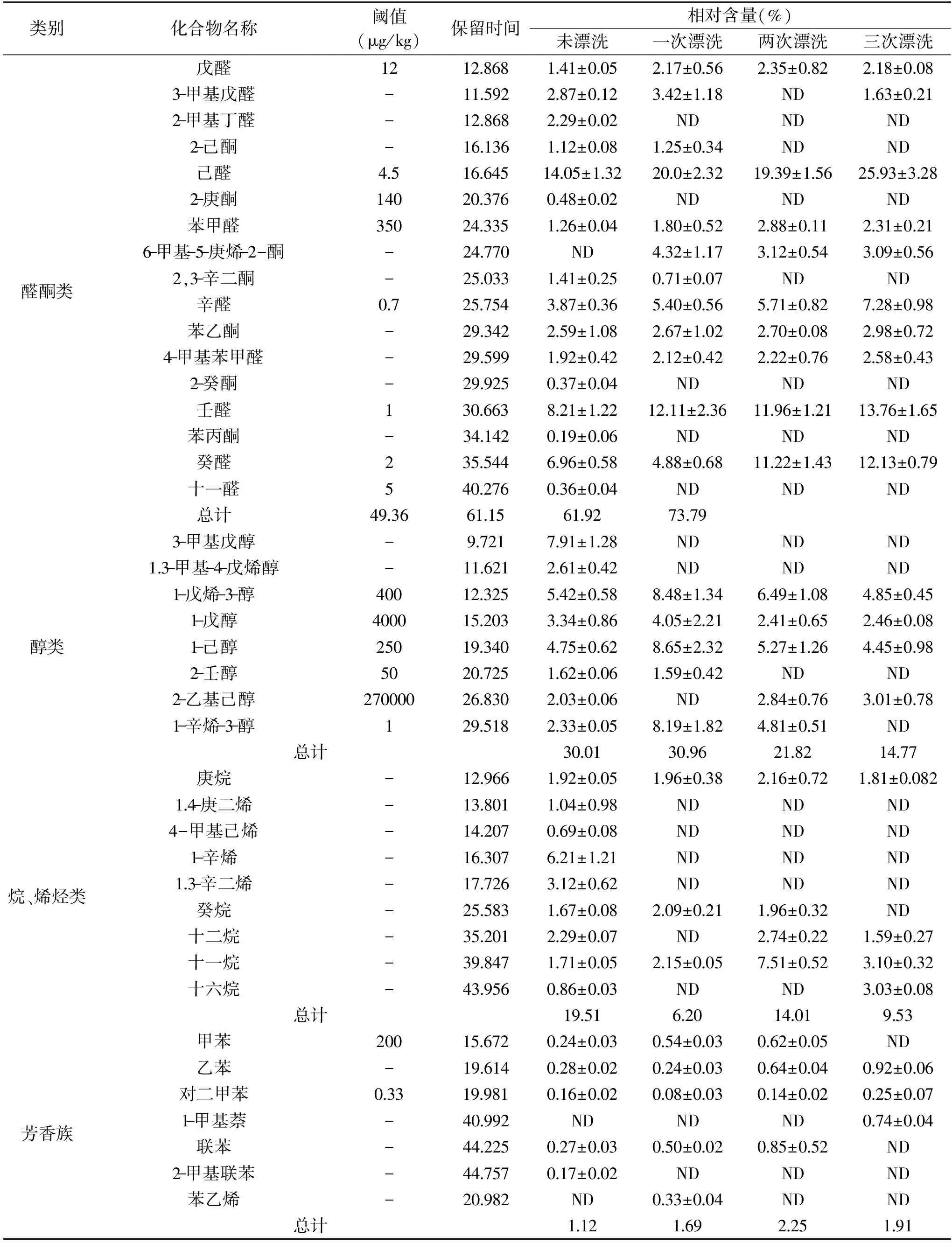
表2 不同漂洗次数鳊鱼鱼糜挥发性成分含量的变化Table 2 Changes of content of volatile compounds in Bream surimi at different rinsing times
注:-表示阈值未查到,ND 表示未测出。
各种挥发性物质对样品总体风味的贡献,不仅与其在样品中的相对含量有关,还与其感觉阈值有关。为进一步确定不同漂洗次数下各组样品的关键风味化合物,结合表2中各种挥发性物质的相对含量和感觉阈值,根据公式(1)计算各挥发性物质的相对气味活度值(ROVA值)。其中壬醛在各组样品中的相对含量均较高,且其阈值较低,为1 μg/kg,所以壬醛对各自所在样品的总体气味贡献最大,确定壬醛在各组样品的ROAVstan=100,其他各挥发性物质的ROVA值见表3。显然,所有组分0≤ROAV≤100,而且ROAV 值越大的组分对样品总体风味的贡献也越大。一般认为ROAV≥1 的物质为所分析样品的关键风味化合物,0.1≤ROAV<1的物质对样品的总体风味具有重要的影响[15]。

表3 不同漂洗次数下鳊鱼鱼糜挥发性成分的相对气味活度值Table 3 Relative odor activity values of bream surimi at different rinsing times
注:ND表示无法计算出。
由表3可以看出,醛酮类化合物中,戊醛、己醛、辛醛、壬醛和癸醛均为四组样品中的关键风味化合物。不同的醛类具有不同的气味特征,C5-C9醛具有清香、油蜡和油腻味;C10-C12醛具有桔皮和柠檬味[16]。其中己醛普遍存在于淡水鱼及海水鱼中,具有清香或青草气味,常常会与八碳或九碳挥发性物质混合在一起共同对其香味产生贡献[17]。壬醛有青草味和脂香[18]。随着漂洗次数的增加,戊醛、己醛、辛醛和癸醛对鱼糜气味的贡献在增加。这可能是因为随着漂洗次数的增加,那些易溶于水的挥发性物质被洗去,保留下来的都是一些不易溶于水且含量较高的物质,这些挥发性物质的相对含量在增加,对气味的贡献也在增大。醇类化合物中,1-辛烯-3-醇是未漂洗、一次和两次漂洗组的关键风味化合物,它是一种亚油酸的氢过氧化物的降解物,具有类似蘑菇的气味[19]。1-辛烯-3-醇在三次漂洗组中未检测到,可能是由于随着漂洗次数的增加,其相对含量略有增加,但其绝对含量却在降低,以至于低于仪器的检测限而未被检出。1-己醇在各组的相对含量较高,在新鲜淡水鱼肉中呈现青草味[20],但由于其气味阈值太高,其在各组中的ROVA值均小于1,所以它并不是鳊鱼鱼糜的关键风味化合物。芳香族化合物中对二甲苯均为四组样品的关键风味化合物,它会使鱼肉产生令人不愉快的气味[3],说明鱼体在一定程度上被污染。在以上检测出的关键风味化合物,随着漂洗次数的增加,它们对鱼糜气味的贡献也在一定程度的增加,说明漂洗次数对鱼糜气味有显著影响。
3 结论
3.1通过对各组鱼糜呈味核苷酸和游离氨基酸的测定,结果表明漂洗次数对鳊鱼鱼糜的滋味有明显的影响。一次漂洗对鱼糜样品中ATP、AMP和IMP的损失影响最为严重。两次和三次漂洗对IMP含量有显著影响(p<0.05),对ATP和AMP含量的影响不显著(p>0.05);一次漂洗使游离氨基酸含量降低最显著(p<0.05),两次和三次漂洗使游离氨基酸含量进一步降低,但降低幅度减缓。
3.2通过GC-MS分析,结果表明漂洗次数对鳊鱼鱼糜气味有所影响。鳊鱼鱼糜的挥发性成分以醛酮类和醇类为主,其中关键风味化合物有6种,分别为戊醛、己醛、辛醛、壬醛、癸醛和1-辛烯-3-醇。一次漂洗对挥发性成分的影响最大,两次漂洗次之,三次漂洗影响最小。随着漂洗次数的增加,这6种关键风味化合物对鱼糜风味的贡献在增加。
3.3综合以上两点,随着漂洗次数的增加,鳊鱼鱼糜中的呈味核苷酸和游离氨基酸会逐渐流失,导致风味下降,但漂洗可以一定程度上去除鱼糜中的鱼腥味,所以鳊鱼鱼糜的生产过程中采用两次漂洗效果最佳。
[1]农业部渔业局.中国渔业统计年鉴 2016[M].北京:中国农业出版社,2016.
[2]马海建,施文正,付强,等. 漂洗过程中白鲢鱼糜风味物质变化的分析[J].现代食品科技,2015(7):354-360.
[3]施文正,汪之和,朱耀周,等. 漂洗过程中草鱼鱼糜挥发性成分变化的研究[J]. 食品工业科技,2009,12:376-379,384.
[4]Yokoyama Y,Sakaguchi M,Kawai F,et al. Change in concentration of ATP-related compounds in various tissues of oyster during ice storage[J]. Nippon Suisan Gakkaishi,1992,58(11):2125-2136.
[5]姚志勇,万金庆,庞文燕,等. 真空冷诱导对冰温贮藏罗非鱼片鲜度和滋味的影响[J].现代食品科技,2014,30(2):198-203.
[6]刘源,仇春泱,王锡昌,等. 养殖暗纹东方鲀肌肉中呈味肽的分离鉴定[J].现代食品科技,2014,30(8):38-42.
[7]顾赛麒,吴浩,张晶晶,等. 固相萃取整体捕集剂-气相色谱-质谱联用技术分析中华绒螯蟹性腺中挥发性成分[J].现代食品科技,2013,29(12):3019-3025.
[8]刘登勇,周光宏,徐幸莲. 确定食品关键风味化合物的一种新方法:“ROAV”法[J].食品科学,2008,29(7):370-374.
[9]汤辰婧,王锡昌,刘源,等. 水产品滋味成分研究及开发利用进展[J].水产科技情报,2013,40(3):164-168.
[10]邓捷春,王锡昌,刘源. 鱼肉风味研究进展[J]. 食品工业科技,2010(6):375-378.
[11]须山二千三,鸿巢章二. 水产食品学[M]. 东京:恒星社厚
生阁,1987.
[12]杨晋,陶宁萍,王锡昌. 文蛤的营养成分及其对风味的影响[J]. 中国食物与营养,2007(5):43-45.
[13]叶鸽,郝淑贤,李来好,等. 不同养殖模式罗非鱼品质的比较[J]. 食品科学,2014,35(2):196-200.
[14]田晓静. 基于电子鼻和电子舌的羊肉品质检测[D].杭州:浙江大学,2014:9-15.
[15]刘登勇,周光宏,徐幸莲. 确定食品关键风味化合物的一种新方法:“ROAV”法[J].食品科学,2008,29(7):370-374.
[16]Forss D A. Odor and flavor compounds from lipid[J]. Progress in the Chemistry of Fats & Other Lipids. 1972.13(4):181-258.
[17]Guillén M D,Errecalde M C,Salmerón J,et al. Headspace volatile components of smoked swordfish(Xiphias gladius)and cod(Gadus morhua)detected by means of solid phase microextraction and gas chromatography-mass spectrometry[J]. Food Chemistry,2006,94(1):151-156.
[18]Morales M T,Rios J J,Aparicio R. Changes in the volatile composition of virgin olive oil during oxidation:flavors and off-flavors[J]. Journal of Agricultural and Food Chemistry,1997,45(7):2666-2673.
[19]David B,Josephson D. Identification of comounds characterizing the aroma of fresh whitefish[J]. J Agric Food Chem,1983,31:326-330.
[20]Ogata M. Indenfication of substance in petroleum causing objectionable odors in fish[J].J Wat Res,1973(7):1493-1504.

