糖基化方法对于大豆7S球蛋白糖基化反应及产物的影响
,,,
(1.广东食品药品职业学院食品学院,广东广州 510220;2.华南理工大学食品科学与工程学院,淀粉与植物蛋白深加工教育部工程研究中心,广东广州 510640)
在食品中蛋白质糖基化的主要方法是基于Maillard反应机理的非酶糖基化,属于蛋白质化学改性范畴,通过蛋白质糖基化作用,不仅拓宽了蛋白质包括大豆蛋白质在某些食品体系中的应用,而且提升了蛋白质的某些功能特性。在此反应中,蛋白质与糖发生共价结合,不需要添加任何化学试剂作为催化剂,仅加热就可使反应自发进行,因此是比较安全的蛋白质改性方法。对于以Maillard为反应机理的蛋白质和多糖的糖基化接枝方法而言,主要是干热法和湿热法,这两种方法在反应条件、产物性质方面各有优劣。干热法和湿热法糖基化反应的差异主要是由反应的水分活度和加热强度不同造成[1-2],干热法反应物在固相体系中进行,反应条件比较温和,反应时间较长多则几天甚至几周,反应温度较低[3-5]。湿热法在水分活度和加热强度方面均明显高于干热法的条件[6-8],另一方面,在比干热法反应条件剧烈的情况下,蛋白质分子和多糖分子相互碰撞、互相接触的机会也会多于干热法[9-10],导致了二者反应时间、反应产物和反应机制存在差异性。近些年研究者也在不断开发新的接枝方法,如微波辅助法[11]、有机溶剂辅助法[12]、脉冲电场辅助[13]、超声辅助法[14]等,这些方法多是利用相应技术手段辅助湿热法,但是由于所采用的设备、试剂而限制了实现工业化的可能性,因此和传统方法一样难以实现过程的可控性。
蛋白质和多糖这两类生物大分子本身所具有的复杂性,以及Maillard反应的复杂化,使得这两种方法都难以很好地实现过程的可控性和生产的工业化,并且两种方法目前缺乏系统地比较,二者反应机制的分析探讨也不够深入,因此开展相关方面的研究对于传统糖基化接枝方法的改进及应用具有十分重要的意义。本研究选用大豆蛋白中主要储藏蛋白之一的大豆7S球蛋白作为研究对象,利用跨学科的思路,采用化工合成方面广泛应用的水热法,并进行相应的改进,研究了这种改进的加压辅助湿热法(即水热法)和干热法、湿热法在大豆7S球蛋白和多糖糖基化反应的应用,对传统的两种糖基化接枝方法和改进方法从糖基化反应程度进行系统比较,探讨不同糖基化方法之间的机理差异,并对产物氨基酸组成进行分析,为相关研究提供方法依据和理论信息。
1 材料与方法
1.1材料与仪器
低温脱脂大豆胚片(蛋白干基含量55%) 山东禹王蛋白厂;透析袋(截留相对分子量10±2 kDa) 上海君创生物科技有限公司;中分子量范围蛋白Marker 广州鼎国生物技术有限公司;葡聚糖(分子量为67 kDa)、邻苯二甲醛(OPA) Sigma公司;赖氨酸,硼砂,β-巯基乙醇,盐酸等均为分析纯。本研究用水均为去离子水。
Rapid N cube Analyze杜马斯定氮仪 Germany Elementar Inc.;CR22GII型高速冷冻离心机 日立(Hitachi)公司;Scientz-18N型冷冻干燥机 宁波新芝生物股份有限公司;TU-1810型紫外可见分光光度计 北京普析通用仪器有限责任公司;M510型HPLC氨基酸自动分析仪 美国Waters公司;F4500型荧光光谱仪 日立(Hitachi)公司。
1.2实验方法
1.2.1 大豆7S球蛋白分离制备及纯度测定 大豆7S球蛋白依照Nagano等[15]的方法分离制备。采用杜马斯燃烧定氮法[16]测定分离制备出的大豆7S球蛋白含量,测定结果为三次测量的平均值,采用SDS-PAGE法检测大豆7S球蛋白的纯度,利用软件Gel Pro Analyzer(Quantity One 2.0,Bio Red.)对胶片成像进行光密度分析确定大豆7S球蛋白的纯度。
1.2.2 大豆7S球蛋白糖基化产物的制备干热法 参照Kato等人方法[17],将大豆7S球蛋白与葡聚糖以1∶1 (w/w)比例,和水溶解均匀后冷冻干燥。冻干粉过100目筛后放置于干燥器(底部放置饱和KBr溶液)中,保持RH 79%,60 ℃恒温反应1周,取样分析。
湿热法[18]:将大豆7S球蛋白与葡聚糖以1∶1 (w/w)比例混合溶于0.2 mol/L磷酸盐缓冲液中(pH7.2,大豆7S球蛋白浓度4 mg/mL),在密闭容器中不加压,100 ℃分别反应1、2、3、4、5、6 h,反应液冷却至室温,2000 g离心20 min除去不溶物,上清液透析24 h,冻干后分析。
加压辅助湿热法(又称水热法):大豆7S球蛋白与葡聚糖以1∶1 (w/w)比例混合溶于0.2 M磷酸盐缓冲液中(pH7.2,大豆7S球蛋白浓度4 mg/mL),带有搅拌桨压力反应釜中,压力设置为10 MPa,100 ℃分别反应1、2、3、4、5、6 h,反应液冷却至室温,2000×g离心20 min除去不溶物,上清液透析24 h,冻干后分析。
1.2.3 褐变程度的测定 准确称取25 mg待测品溶于5 mL水中,以水作空白样,于420 nm下测定吸光值[19]。
采用XRF法[15]检测样品(NaCl、城市固体废弃物模拟组分和厨余沼渣)中的Cl含量;取约3 g样品,分别将硼酸和样品用压片机(10 MPa下恒压30 s)压制成片放入 XRF仪器中,测定其中的 Cl含量。
1.2.4 接枝度的测定 准确称取40 mg的OPA溶解于1 mL的甲醇中,分别加入20%(w/V)的SDS 2.5 mL、0.1 mol/L的硼砂25 mL、100 μLβ-巯基乙醇,最后用蒸馏水定容至50 mL。此为OPA试剂。测定时,取OPA试剂4 mL于试管中,分别注入200 μL样品液,混匀后于35 ℃反应2 min,340 nm下测其吸光值A1,以在OPA试剂中加入200 μL水为空白样,二者之差ΔA为自由氨基的净吸光值[20]。以赖氨酸作出标准曲线(y=11.387x-0.0226,R2=0.9915),根据ΔA计算样品中自由氨基的含量C。
接枝度(DG,%)=(A0-A1)/A0×100
1.2.4 氨基酸分析 称取一定量的样品置于消解管中,加入6 mol/L HCl溶液,在110 ℃下密封水解24 h。用Waters美国高效液相色谱仪进行氨基酸自动分析除色氨酸以外的氨基酸含量,采用PICO.TAG氨基酸分析柱,柱温38 ℃,检测波长为254 nm,流速1 mL/min。
1.2.5 内源荧光光谱分析 参考文献方法[21],有少许改动。用10 m mol/L的磷酸缓冲液(pH7.0)配制不同方法制备的糖基化产品待测液(蛋白浓度1 mg/mL),使用荧光分光光度计分别在激发波长为334 nm处进行发射波长扫描(350~500 nm)。
1.2.6 统计分析 实验中所有数据都是三次测定的平均值,利用一维方差分析的LSD比较样品平均值之间的差异显著性。
2 结果与分析
2.1大豆7S球蛋白的纯度
分离纯化的大豆7S球蛋白图谱见图1,从图1可以看出,大豆7S球蛋白的α′、α、和β亚基被明显分离出来,并且泳道上大豆11S球蛋白的亚基条带非常弱,说明大豆7S球蛋白组份的纯度较高,光密度分析结果显示,大豆7S球蛋白的纯度在90%以上,并且利用杜马斯燃烧定氮法测定出的大豆7S球蛋白含量为:92.56%±1.21%(干基含量,N×5.71),可以满足本研究所用纯度。
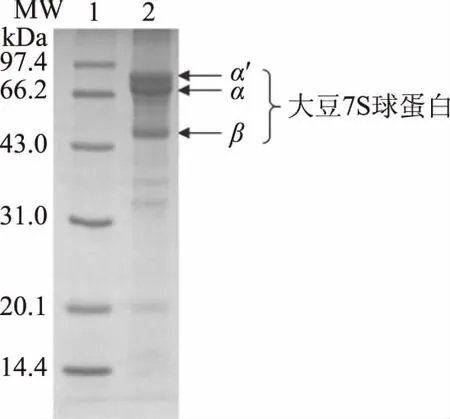
图1 大豆7S球蛋白组分SDS-PAGE分析Fig.1 SDS-PAGE analysis for soybean 7S fraction
2.2.1 湿热法和加压辅助湿热法反应时间对于反应程度的影响 图2显示的是反应时间对于湿热法和加压辅助湿热法褐变程度和接枝度的影响,结果显示:反应时间的延长有利于糖基化反应的进行,并且反应在0~1 h时,褐变程度和接枝度增长最快,褐变程度由吸光值0.095增加至吸光值0.24,接枝度由零增加至10.60%,在2~3 h时,褐变程度和接枝度出现第二个增长较快区,褐变程度由吸光值0.29增加至吸光值0.368,接枝度由12.5%增加至19.61%,反应程度增加较快。
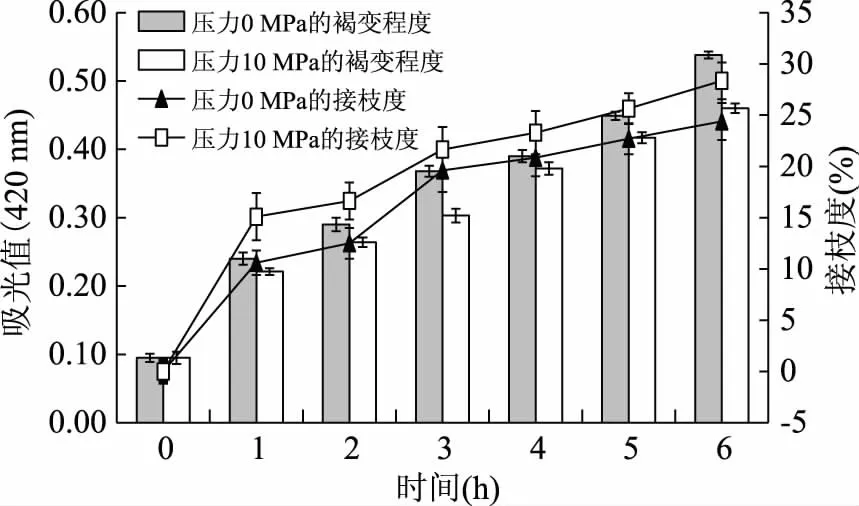
图2 时间对接枝度和褐变程度的影响Fig.2 Effect of time on the DG and the browning
从图2还可以发现,随着反应时间的进行,压力体系的褐变程度始终略低于不加压的体系,这说明低压能够抑制反应物的褐变程度。在接枝度的检测中发现,压力体系的接枝度始终略高于不加压的体系,随着反应时间的延长,压力体系褐变程度的增加却始终低于不加压体系,一些资料报道[22-23],高静压能够加速Maillard反应的初级阶段但是延迟了高级阶段有色物质的产生,说明在10 MPa较低的压力体系中这种作用依然存在,而这种作用正是所期望的蛋白质和多糖糖基化理想的反应程度,也就是抑制功能特性较差以及产生较多有害物质的Maillard高级阶段产物的形成,使得反应产物集中在功能特性好以及有害物质较少的初级阶段末期和中级阶段。
为了更确切地比较三种制备产物的性质和结构,本研究选择接枝度接近于干热法产物的湿法产物和水热法产物,最终湿热法和水热法产物选择的反应时间为3 h,三者接枝度分别是:干热法为18.70%±0.32%;湿热法为19.61%±0.21%;水热法为21.65%±0.23%。
2.2.2 加压辅助湿热法中压力对于反应程度的影响 本研究对湿热法反应体系通过充入氮气施加压力,从图3可以看出,压力从0~10 MPa过程中,褐变程度随着压力的增加而略有下降,吸光值从0.325下降至0.303,接枝度从19.61%升高至21.6%,接枝度在6 MPa以后升高较快,有可能是压力在0~6 MPa之间,压力过小对于反应的加速作用不明显,图3也显示,低压仍有助于反应的进行,这可能是由于在反应体系压力和温度的作用下,蛋白质肽链有利于展开[24],暴露更多的游离氨基于肽链表面而促使更多的游离氨基和糖链发生共价结合。因此,压力体系中根据压力反应釜的压力范围最终选用10 MPa作为加压辅助湿热法所用压力值。
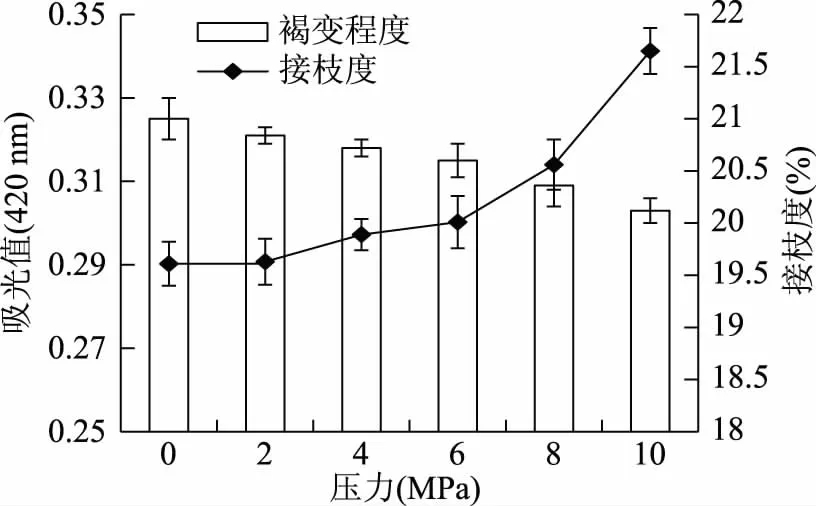
图3 压力对接枝度及褐变程度的影响Fig.3 Effect of pressure on the DG and the browning
2.3糖基化产物反应程度的比较
利用褐变程度、接枝度来反映三种糖基化方法的反应程度,见图4。图4表明,在接枝度接近的情况下,干热法糖基化产物褐变程度明显低于另外两种方法的糖基化产物,有显著性差异(p<0.05),这说明在干法相对湿法温和的反应条件下,干法能够抑制产物的褐变,即抑制了高级阶段产物的形成。
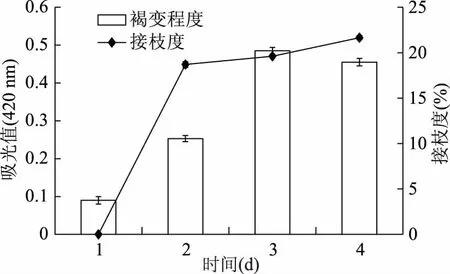
图4 三种制备产物褐变程度和接枝度的比较Fig.4 Effect of glycosylation methods on the DG and the browning注:1-未反应的大豆7S球蛋白;2-干热法糖基化产物;3-湿热法糖基化产物;4-加压辅助湿热法产物;不同小写字母代表差异显著(p<0.05)。
2.4糖基化产物氨基酸分析
对三种糖基化产物进行氨基酸分析,结果见表1。通过对氨基酸含量进行分析,在糖基化反应过程中,大豆7S球蛋白氨基酸中主要是赖氨酸和精氨酸含量减少,这是由于赖氨酸和精氨酸的侧链上存在自由氨基,参与了大豆7S球蛋白和葡聚糖的糖基化反应,在表1中也发现,干热法产品精氨酸含量从7.86%减少至6.79%,湿热法产品和加压辅助湿热法产品分别减少至7.66%和7.61%,说明干热法与其他两种方法相比有利于精氨酸自由氨基的反应,然而干热法产品赖氨酸含量减少幅度没有其他两种方法大,干热法产品赖氨酸含量从4.77%减少至3.37%,湿热法产品和加压辅助湿热法产品分别减少至2.58%和2.45%,表明湿热法产品和加压辅助湿热法产品有利于赖氨酸自由氨基参与反应。
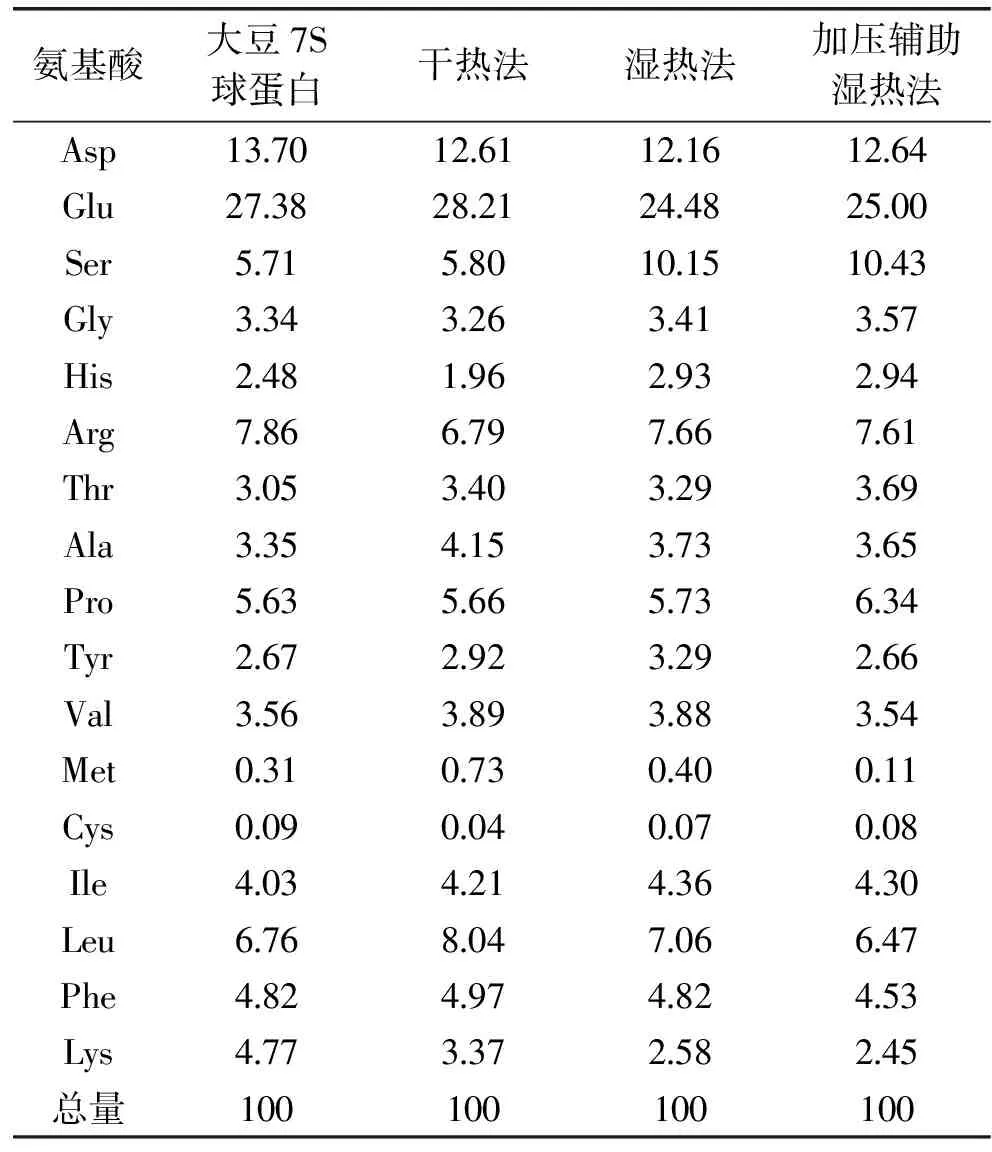
表1 大豆7S球蛋白和糖基化产物的氨基酸组成(g/100 g氨基酸)Table 1 Amino acid compositions of β-conglycinin and glycated products(g/100 g amino acid)
2.5糖基化产物内源荧光光谱分析
有色物质的形成是Maillard反应中一个显著又重要的特征,在Maillard反应中产生的荧光物质和有色物质并非完全相同[25],研究发现[26]荧光物质是有色物质的前体物。因此可以对三种产物的荧光强度进行比较,以进一步对三种产物的反应程度进行比较,在对三种糖基化产物进行荧光分析时,选定激发波长为334 nm,所得荧光光谱扫描图如图5所示,大豆7S球蛋白在430 nm处有最大荧光强度,而糖基化产品在400 nm左右处有最大荧光强度,符合Maillard产物具有的荧光特征。对三种产物的荧光光谱图比较,发现湿热法产品的荧光光谱图谱高于其它两种方法,三种产物在400 nm处荧光强度高低顺序为:湿热法产品>水热法产品>干热法产品,并且湿热法和水热法两种产品在400 nm处的荧光强度明显高于干热法,这说明在水相体系中的糖基化反应程度高于干热法的反应程度,反应易向高级阶段进行,在水相体系中压力对于生成荧光物质具有抑制作用,即压力反应程度没有不加压的湿热法高,也印证了2.2.1的结论。
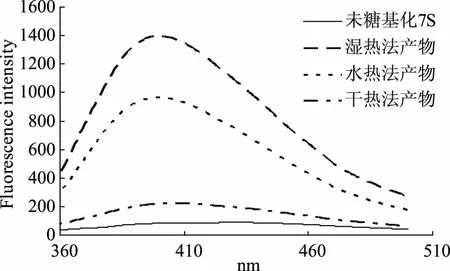
图5 大豆7S球蛋白和糖基化产物荧光光谱Fig.5 Fluorescence spectra of β-conglycinin and glycated products
3 结论
对大豆7S球蛋白和葡聚糖的糖基化产物从反应程度、氨基酸组成等方面进行研究可知三种制备方法反应程度的差异,干热法反应环境拥挤,反应条件温和,产物主要形成于Maillard反应的初期末期和中期初期,即理想的反应阶段,而湿热法反应剧烈,易于发生蛋白质肽链的聚集和展开,加速了Maillard反应的进行,产物较多形成于Maillard反应的高级阶段,压力能够对Maillard反应的进行具有一定的抑制作用,可以控制反应向理想阶段进行。并且氨基酸分析发现,大豆7S球蛋白和葡聚糖的糖基化主要发生在蛋白质肽链上的赖氨酸和精氨酸侧链上的自由氨基,而干热法与其它两种方法相比糖链更有易于和精氨酸侧链上的自由氨基发生共价交联,而湿热法和加压辅助湿热法相比糖链更易于和赖氨酸侧链上的自由氨基发生共价交联。压力作为糖基化反应的一种技术辅助手段,对于以Maillard反应为机理的蛋白质糖基化反应的可控性及工业化实现,均具有实际应用价值。
[1]Lagemaat J,Silván MJ,MorenoJF,et al.Invitroglycation and antigenicity of soy proteins[J]. Food research international,2007,40:153-160.
[2]BellLN. Kinetics of non-enzymatic browning in amorphous solid systems:distinguishing the effects of water activity and the glass transition[J]. Food research international,1995,28:591-597.
[3]Wooster TJ,Augustin MA.β-Lactoglobulin-dextran Maillard conjugates:Their effect on interfacial thickness and emulsion stability[J]. Journal of Colloid and Interface Science,2006,303:564-572.
[4]Medrano A,Abirached C,Panizzolo L,et al. The effect of glycation on foam and structural properties ofβ-lactoglobulin[J].Food Chemistry,2009,113:127-133.
[5]Wang J,Sun BG,Cao YP,et al. Protein glycation inhibitory activity of wheat bran feruloyl oligosaccharides[J]. Food Chemistry,2009,112:350-353.
[6]Dickinson E,Mcclements DJ. Adbances in food colloids[M]. Blackic Academic and Professional. 1996.
[7]Zhu D,Damodaran S,Lucey JA. Physicochemical and emulsifying properties of whey protein isolate(WPI)-dextran conjugates produced in aqueous solution[J]. Journal of Agricultural and Food Chemistry,2010,58:2988-2994.
[8]Petueccelli S,Anon MC. Thermal aggregation of soy protein isolates[J]. Journal of Agricultural and Food Chemistry,1995,43:3035-3041.
[9]Lertittikul W,Benjakul S,Tanaka M. Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucos model system as influenced by pH[J]. Food Chemistry,2007,100:669-677.
[10]Xi Zhang,Jun-Qu Qi,Kang-Kang LI,et al. Characterization of soyβ-conglycinin-dextran prepared by Maillard reaction in crowed liquid system[J]. Food Reseach International,2012,49:648-654.
[11]Guan JJ,Qiu AY,Liu XY,et al. Microwave improvement of soy protein isolate-saccharide graft reactions[J]. Food Chemistry,2006,97:577-585.
[12]齐军茹. 蛋白-多糖共价复合物的制备及其功能性质的研究[D]. 广州:华南理工大学,2004.
[13]Yong-GuangGuan,Hua Lin,Zhong Han,Jun Wang,et al. Effects of pulsed electric field treatment on a bovine serum albumin-dextran model system,a means of promoting the Maillard reaction[J]. Food Chemistry,2010,123:275-280.
[14]Bo Zhang,Yujie JC,Bing Li. Effect of ultrasound treatment on the wet heating Maillard reaction betweenβ-conglycinin and maltodextrin and on the emulsifying properties of conjugates[J]. European Food Research and Technology,2014,238:129-138.
[15]Nagano T,Hirotsuka M,Mori H,et al. Dynamic Viscoelastic Study on the Gelation of 7S Globulin from Soybeans[J]. Journal of Agricultural and Food Chemistry,1992,40:941-944.
[16]Cai-hong Xu,Xiao-quan Yang,Shu-juan Yu,et al. Emulsifying properties and structural characteristics ofβ-conglycinin and dextran conjugates synthesized in a pressurized liquid system[J].International Journal of Food Science & Technology,2010,45:995-1001.
[17]Kato A,Minaki K,Kobayashi K. Improvement of emulsifying properties of egg white proteins by the attachment of polysaccharide through Maillard reaction in a dry state[J]. Journal of Agricultural and Food Chemistry,1993,41:540-543.
[18]Cai-hong Xu,Xiao-quan Yang,Shu-juan Yu,et al. The effect of glycosylation with dextran chains of differing lengths on the thermal aggregation ofβ-conglycinin and glycinin[J]. Food Research International,2010,43:2270-2276.
[19]Baisier WM,Labuza TP. Maillard browning kinetics in a liquid model system[J]. Journal of Agricultural and Food Chemistry,1992,40(5):707-713.
[20]Laroque D,Inisan C,Berger C,et al. Kinetic study on the Maillard reaction. Consideration of sugar reactivity[J]. Food Chemistry,2008,111:1032-1042.
[21]Morales FJ,Salvio FP. Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence[J]. Food Chemistry,2001,72:119-125.
[22]Tamaoka T,Itoh N. HayashiR. High pressure effect on Maillard reaction[J]. Agricultural and Biological Chemistry,1991,55(8):2071-2074.
[23]Isaacs NS,Coulson M. Effect of Pressure on processes modeling the Maillard reaction[J]. Journal of physical organic chemistry,1996,9:639-644.
[24]Tang C H,Chen L,Ma CY. Effect of high pressure treatment on aggregation and structural properties of soy protein isolate[J]. Swiss Society of Food Science and Technology,2009,42:606-611.
[25]Jing H,Kitts DD. Chemical and biochemical properties of casein-sugar Maillard reaction products[J]. Food and Chemical Toxicology,2002,40:1007-1015.
[26]Morales FJ,Boekel V MAJS. A study on advanced Maillard reaction in heated casein/sugar solutions:fluorescence accumulation[J]. International Dairy Journal,1997,7:675-683.

