芝麻香型白酒酿造过程中乳酸菌分离及其碳源利用特征
杜海,邢敏钰,徐岩
(江南大学 酿酒科学与酶技术中心,工业生物技术教育部重点实验室,江苏 无锡,214122)
芝麻香型白酒是20世纪60年代出现的一种创新香型的白酒。其生产工艺是结合酱香型白酒和浓香型白酒的工艺优点发展起来的。芝麻香型白酒酿造过程采用清蒸清烧,蒸前高温润粮的工艺,高温堆积、高温发酵,高温发酵是在泥底砖窖的窖池内完成的。独特的工艺使芝麻香型白酒既具有突出的焦香,又有轻微的酱香,生成独特优雅的芝麻香味[1]。芝麻香型白酒因其独具特色的风味吸引了越来越多消费者的喜爱。
除了工艺的创新,芝麻香型白酒酿造还将高温大曲、麸曲(主要指河内白曲)、生香酵母曲、细菌曲混合使用,做为糖化发酵剂[2]。其中,河内白曲,由黑曲霉变异而来,能够耐高温、耐乙醇,产生的酸性蛋白酶具有较高的糖化力和液化力,因此被广泛应用于白酒酿造过程[3-5]。酵母曲中通常为Pichiakudriavzevii、Wickerhamomycesanomalus、Saccharomycescerevisiae以及Candidatropicalis等[6]。其中,Saccharomycescerevisiae发酵产生大量乙醇,是主要的产酒酵母[7-8]。细菌曲主要是由Bacilluslicheniformis、Bacillussubtitles、Bacillusstearothermophilus等芽孢杆菌组成[3, 6]。由于纯种菌株的人为添加,芝麻香型白酒发酵过程中霉菌、酵母、芽孢杆菌的功能相对清楚[6,9]。白酒发酵过程是由多种微生物共同发酵产生的,其中来源于酿造环境的乳酸菌与上述人为添加微生物之间存在一定的相互作用,构成稳定的酿造微生物群落进行自然发酵。乳酸菌的种类及群落动态对白酒品质至关重要。然而,由于技术水平的局限,对芝麻香型白酒酿造过程中乳酸菌研究较少,对于该香型白酒酿造过程中乳酸菌群结构和代谢特征的认识仍不清楚。
本文旨在通过可培养技术考察芝麻香型白酒发酵过程中乳酸菌的群落结构,解析乳酸菌的菌群演替规律,确定芝麻香型白酒中重要的乳酸菌菌种。同时利用BiologGenIII微孔板对可培养乳酸菌对不同碳源的代谢能力进行测定。通过分析乳酸菌对代谢特征,解析不同乳酸菌在白酒发酵体系的功能。
1 材料与方法
1.1 材料
BiologGenIII微孔板、厌氧盒等。酒醅样品均取自某芝麻香型白酒厂,堆积周期为18 h,发酵周期为50 d。
1.2 主要试剂及培养基
M.R.S.肉汤培养基,购于OXOID公司。M.R.S.固体培养基:在M.R.S.肉汤培养基中,加入2%的琼脂配置而成。饱和苯溶液(pH=7.9±0.2),购于上海生工。三氯甲烷,购于上海生工。
1.3 采样方法
样品为芝麻香型白酒酒醅。芝麻香型白酒除了传统的手工发酵方式,还存在机械化操作的生产方式。两种发酵过程中的原料、发酵剂、以及工艺均相同,但是由于操作方式不同,导致发酵环境的不同,而乳酸菌大多是来自于发酵环境中的。因此,分别采取手工班和机械班的酒醅,用于乳酸菌的研究。
为了科学取样,分别选择手工班和机械班各3组堆积样品进行跟踪取样,作为平行样品。堆积发酵周期为18 h,每隔6 h取1次样品,取样时间分别为0、6、12、18 h。手工班的酒醅在地面直接进行堆积发酵,堆积酒醅取样位置如图1 (a)所示,取样点为a、b、c、d四个点;机械班的堆积发酵是在堆积箱中进行的,堆积酒醅的取样位置如图1 (b)所示为a~i九个点。不同取样位置分别取50 g左右的酒醅混合成一个样品。堆积结束的样品即为窖池发酵0 d的样品。窖池发酵周期为50 d,取样时间分别为3、5、10、15、20、25、30、35、40、50 d,取样位置为a~i九个点,如图1 (c)所示。在每个取样点分别取50 g左右的酒醅混合成一个样品。将采集的酒醅样品密封,在-80 ℃冰箱中保存。

图1 酒醅取样位置示意图Fig.1 The schematic graph of the sampling sites
1.4 乳酸菌的分离、鉴定
(1)分离:将10 g酒醅样品溶于100 mL无菌水中,混匀。对其进行梯度稀释,取10-2、10-3、10-43个稀释度的菌悬液加入无菌平皿,分别倾入已熔化并冷至40 ℃左右的乙醇浓度5%、10%,pH梯度为4.0、5.0、6.0的M.R.S.固体培养基,立即混匀,待凝固后,放入厌氧盒中倒置,于30 ℃、37 ℃厌氧培养。选择合适梯度的倾注平板,用无菌牙签尽可能多的挑取单菌落,在新平板的不同区域进行点种,以菌种原始的培养条件进行培养。将点种平板上菌落形态差异较大的菌株接种M.R.S.肉汤培养基,培养4 d左右,取2 mL菌液,用于甘油管保藏,剩余菌液用于提取基因组进行测序,以判断其种属。
(2)鉴定:取2 mL菌液,12 000 r/min离心2 min,收集菌体,加入1 mL无菌水混匀,离心洗涤菌体。加入0.2 mL的无菌水,重悬菌体,将其转移至含有0.3 g无菌玻璃珠的螺旋管内,再加入0.3 mL酚∶氯仿混合溶液(V∶V=1∶1)。用Beadbeater细胞破碎仪击打30 s,进行破碎。破碎后,向混合体系内加入0.6 mL的无菌水,颠倒混匀,12 000 r/min离心10min。将上清液转移至干净无菌的离心管内,加入上清液二倍体积的冰乙醇。-20 ℃沉淀,过夜。12 000 r/min离心20 min,弃上清,将乙醇用真空干燥箱烘干,加入30 μL无菌水复溶。选择细菌通用引物27F/1492R对菌株的基因组进行PCR扩增,PCR产物送公司测序,测序结果在NCBI网站与模式菌进行比对,确定菌株的种属信息。
1.6 乳酸菌碳源代谢能力测定
利用Biolog GenIII微孔板对11株可培养乳酸菌对71种碳源的代谢能力进行测定。具体操作过程:在M.R.S.固体培养基上划线,分离乳酸菌,挑取单菌落,接种在MRS液体培养基中,于30 ℃、厌氧条件下静置培养20 h,9 000 r/min离心10 min,在无菌条件下除去培养基,再加入5 mL的无菌超纯水重悬,将菌悬液转接至接种液中,配成细胞浓度为90%~98% 的菌悬液。将菌悬液加到微孔板上,每孔加入100 μL的量。将微孔板置于30 ℃、厌氧条件下静置培养48 h。根据孔内颜色变化确定乳酸菌碳源利用能力的大小。
2 结果与分析
2.1 可培养方法分离到的乳酸菌种
取芝麻香型白酒不同堆积发酵过程的酒醅样品,对其进行梯度稀释,取10-2、10-3、10-43个稀释度的菌悬液加入无菌平皿,分别倾入已熔化并冷至50 ℃左右的乙醇浓度5%、10%,pH梯度为4.0、5.0、6.0的MRS培养基,立即混匀,待凝固后于厌氧盒中倒置,于37 ℃培养。
选择合适梯度的倾注平板,并后续通过划线方法对菌落进行纯化。用无菌牙签尽可能多的挑取单菌落,在新平板的不同区域进行点种,以菌种原始的培养条件进行培养。将点种平板上菌落形态差异较大的菌株接种M.R.S.培养基,培养4 d左右,取2 mL菌液,提取其基因组进行测序,以判断其种属,剩余菌液用于甘油管保藏。以倾注平板法从芝麻香型白酒的堆积酒醅样品获得了267株菌。
图2 可培养菌种初筛结果Fig.2 Screening results of strains
2.2 酒醅中乳酸菌的分类鉴定
将初筛获得菌株分离纯化,选取上述菌落形态差异较大的单菌,接种至M.R.S.肉汤培养基,培养4 d后,收集菌体,提取单菌基因组,然后用细菌通用引物27F和1492R进行PCR。PCR结果显示,成功从37个单菌基因组中获得目标PCR产物。将上述PCR产物进行测序,其中32株被确定为乳酸菌(如表1所示)。
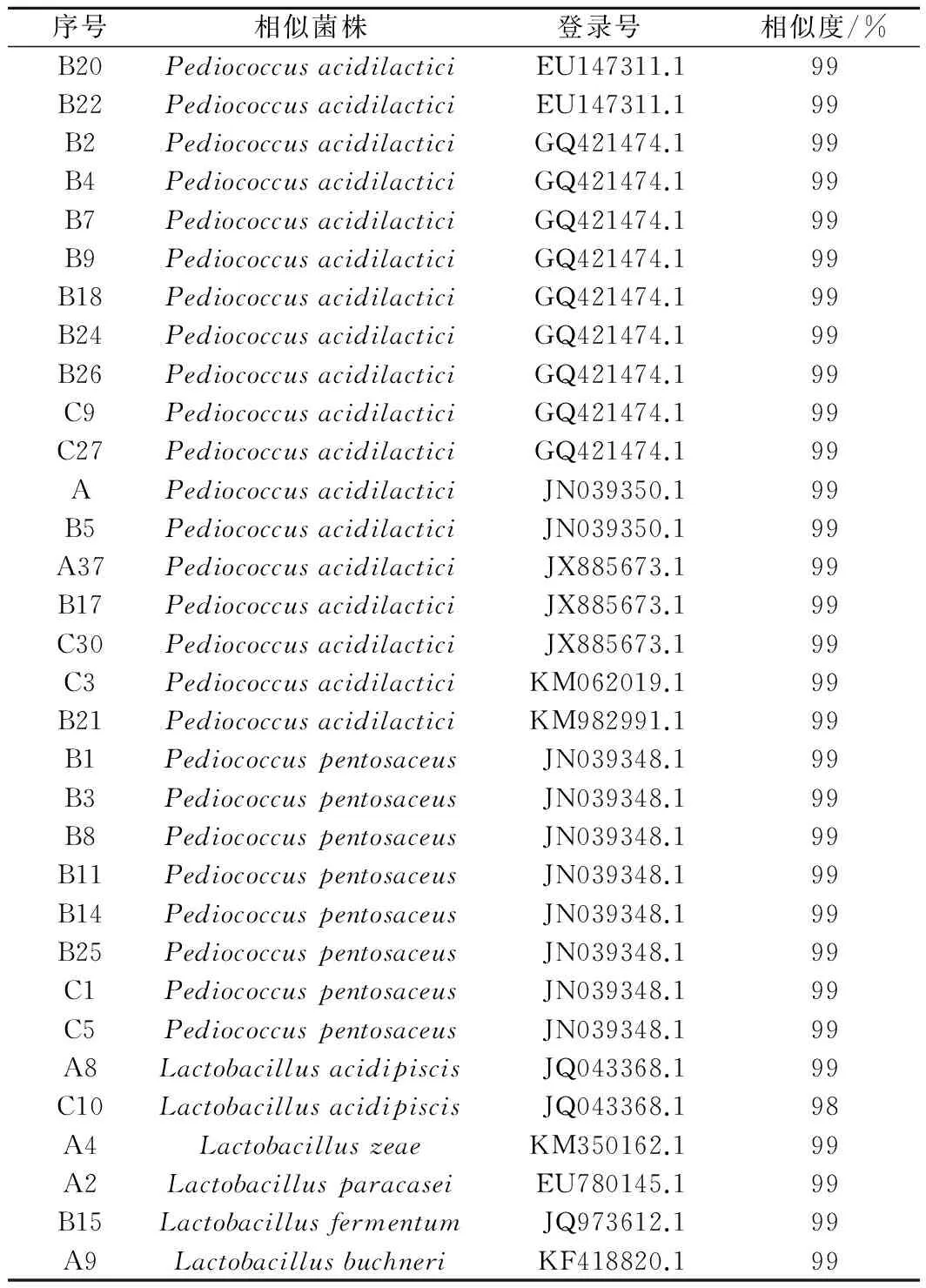
表1 可培养方法分离芝麻香白酒酒醅中乳酸菌鉴定结果
由表1可知,获得测序结果的32株菌,从种水平可以分为7类,其中A2是Lactobacillusparacasei(副干酪乳杆菌),A4是Lactobacilluszeae(玉米乳杆菌),A8、C10是Lactobacillusacidipiscis(嗜酸乳杆菌),A9是Lactobacillusbuchneri(布氏乳杆菌),B15是Lactobacillusfermentum(发酵乳杆菌),A、A37、B2、B4、B5、B7、B9、B17、B18、B20、B21、B22、B24、B26、C3、C9、C10、C27、C30是Pediococcusacidilactici(乳酸片球菌),B1、B3、B8、B11、B14、B25、C1、C5是Pediococcuspentosaceus(戊糖片球菌)。
与之前酱香型白酒的测序结果对比,发现新获得Lactobacillusparacasei(副干酪乳杆菌)、Lactobacillusacidipiscis(嗜酸乳杆菌)、Lactobacillusbuchneri(布氏乳杆菌)、Pediococcuspentosaceus(戊糖片球菌)为芝麻香型白酒和酱香型白酒共有的。
2.3 乳酸菌代谢特征
选择芝麻香型白酒酒醅中分离获得的主要乳酸菌PediococcuspentosaceusB24、PediococcusacidilacticiJSA6、LactobacillusparacaseiJJA1、LactobacillusplantarumJD19、LactobacillusfermentumJSA30、Lactobacillusacetotolerans19,白酒发酵体系中常见的乳酸菌LactobacilluspontisJSC25、LactobacilluspentosusNA、LactobacillusacidipiscisA8、LactobacillusbuchneriA9,以及实验室前期分离得到的乳酸菌WeissellaviridescensW,进行活化,并接种至Biolog GenIII微孔板进行实验,考察这11株乳酸菌对于71种不同碳源的利用情况。
如图3所示,大部分乳酸菌对于糖类物质的利用较强,比如糊精、D-麦芽糖、纤维二糖、α-D-葡糖、D-甘露糖、D-果糖、D-半乳糖等。绝大多数可培养乳酸菌能够很好地利用葡萄糖,Lactobacillus对糊精的利用能力很好,而Pediococcus对糊精的利用相对较弱,Lactobacillusacetotolerans对于碳源的利用能力普遍弱于其他乳酸菌,Lactobacillusacetotolerans利用能力最强的是糊精,其次是D-果糖、D-葡萄糖、D-海藻糖等。因而在发酵过程中,可培养乳酸菌对于葡萄糖的消耗要快于糊精,随着体系中葡萄糖含量的逐渐降低,可培养乳酸菌物种与功能的多样性将受到碳源利用能力的制约,白酒双边发酵的特点,在一定程度上给乳酸菌发挥其代谢功能提供了一个相对较好的模式。
乳酸菌对于氨基酸的利用较弱,从整体上看,乳酸菌对于氨基酸的利用能力由强到弱依次为:Pediococcus、Weissella、Lactobacillus。乳杆菌中的LactobacilluspentosusNA、LactobacillusparacaseiJJA1、Lactobacillus

图3 乳酸菌的碳源利用能力图Fig.3 Carbon source utilization ability of lactic acid bacteria
plantarumJD19对氨基酸代谢相对较强,能利用的氨基酸种类也较多。氨基酸代谢可以为芳香族化合物形成提供前体物质,LactobacilluspentosusNA、LactobacillusparacaseiJJA1、LactobacillusplantarumJD19可能对芳香类物质的形成具有一定的贡献。
在乳酸菌碳源利用能力测定实验中,发现大多数乳酸菌几乎不能利用有机酸,PediococcusacidilacticiB24、LactobacilluspentosusNA、LactobacillusparacaseiJJA1的有机酸利用能力相对较好,但还是很微弱。这表明大多数乳酸菌在生长代谢过程中,几乎不需要利用外来的有机酸,通过有机酸利用能力的测试,可以为研究乳酸菌产相应有机酸能力的研究提供一定的借鉴。
3 讨论
乳酸菌是能够发酵糖类物质产生乳酸的一类微生物的总称,乳酸菌通常呈革兰氏染色阳性,不产孢子,过氧化氢酶实验阴性,耐酸,最适pH在4.0~4.5,厌氧或耐氧的,菌体形态各异,有棒状(杆菌)和球体(球菌)等[10]。由于乳酸菌普遍存在于食品发酵过程中[11],对于食品的品质有重要影响,因此,引起了国内外的广泛关注。
传统食品发酵过程中风味物质的生成与乳酸菌群的代谢活动密切相关。乳酸菌能够产生有机酸[12],直接影响食品的风味。乳酸菌同型发酵的产物主要是乳酸,异型发酵除了乳酸之外,还产生乙酸。乳酸菌代谢产生的乳酸、乙酸等有机酸既可以直接影响食品风味的形成,还能够以其为底物产生乳酸乙酯、乙酸乙酯等酯类物质对食品风味产生影响。
在发酵过程中,乳酸菌具有调节菌群结构和调控发酵进程的作用。一方面,乳酸菌能够通过产生乳酸、乙酸等有机酸,产生细菌素等拮抗物质,以及与其他微生物竞争底物等途径影响其他微生物的生长[13-16],从而调节发酵过程中的菌群结构。另一方面,乳酸菌直接调控发酵过程,例如Weissella和Leuconostoc能够启动发酵,Lactobacillusplantarum能够加速发酵进程[17-18]。因此研究发酵过程中乳酸菌与其他微生物的相互作用有助于进一步探究发酵机理。
中国白酒是在开放的生产环境下,通过多种微生物相互作用共同发酵产生的[19]。由酒醅微生物和窖池微生物构成的白酒酿造微生物群落自然发酵,最终形成独具特色的白酒产品。酒醅微生物构成十分复杂,除了来自大曲的微生物以外,还有各种各样的环境微生物[20]。白酒酿造过程中存在细菌、酵母菌和霉菌等各类微生物。细菌既能代谢产生酸类、醛类等物质对白酒风味产生直接影响,也能通过产生淀粉酶、酯化酶等对出酒率和酒的香味产生影响[21]。其中,乳酸菌作为白酒发酵过程中的优势细菌,其种类、数量以及动态变化对于白酒酿造过程至关重要[22]。
在白酒发酵的中后期,随着发酵的进行,发酵体系内酸度和乙醇浓度的升高,氧气含量逐渐减少,大部分的微生物不能够耐受高酸度、高乙醇浓度、厌氧等不利条件而逐渐衰亡,而乳酸菌则成为绝对优势的细菌。乳酸菌的主要产物是乳酸,乳酸能够减少白酒的刺激感,增加酒体的醇厚感。乳酸菌还能通过异型发酵途径产生少量的乙酸,乙酸有一定的刺激性,对白酒产品风味的形成有重要影响。同时,乳酸能够与其他微生物代谢产生的乙醇发生反应,生成乳酸乙酯,乳酸乙酯能够增加酒体的醇甜感、醇厚度,是重要的呈味呈香物质。除此以外,乳酸菌还能够通过产生有机酸,降低发酵体系pH,产生拮抗类物质等途径影响发酵体系中其他微生物的生长代谢,从而调控整个发酵过程。因此,白酒乳酸菌引起了越来越多研究人员的关注。
综上所述,在芝麻香型白酒发酵过程中,乳酸菌种类丰富,其中既有同型发酵乳酸菌,也有异型发酵乳酸菌。而且不同乳酸菌的生长要求不同,对于碳源的选择性利用和利用能力的大小均存在较大的差异。白酒酿造的原料是高粱等谷物,其主要成分是淀粉,淀粉水解产生糊精、葡萄糖等物质,而乳酸菌对葡萄糖、糊精等物质的利用能力以及发酵过程中碳源物质的分布对于菌群结构有重要影响。然而,由于筛选条件的设定比较局限,不能满足所有乳酸菌的生长需求,后续将结合高通量测序等技术的辅助手段,更加全面的分析乳酸菌群的群落组成和演替。
[1] 来安贵,赵德义,曹建全. 芝麻香型白酒的发展历史、现状及发展趋势[J]. 酿酒,2009, 36(1): 91-93.
[2] 刘明明,王君高,孙朋朋,等. 麸曲在芝麻香型白酒生产中的应用[J]. 酿酒科技,2013(3): 69-74.
[3] 李环宇. 芝麻香型白酒工艺探究[J]. 泰安:山东轻工业学院,2010.
[4] 唐胜球,董小英. 酒用酸性蛋白酶的研究进展[J]. 酿酒科技,2005(1):41-44.
[5] 雷军,宣灵,黄龙龙,等. 河内白曲酸性蛋白酶活力与酸度相关性探究[J]. 酿酒,2015, 42(2): 83-85.
[6] 张彬. 芝麻香型白酒专用曲的生产及应用[J]. 酿酒,2012, 39(6):38-41.
[7] NYANGA L K, NOUT M J R, SMID E J. et al. Fermentation characteristics of yeasts isolated from traditionally fermented masau (Ziziphusmauritiana) fruits[J]. International Journal of Food Microbiology,2013, 166(3): 426-432.
[8] CANAS P M I, GARCIA-ROMERO E, MANSO J M H, et al. Influence of sequential inoculation ofWickerhamomycesanomalusandSaccharomycescerevisiaein the quality of red wines[J]. European Food Research and Technology,2014, 239(2): 279-286.
[9] WU Q, LING J, XU Y. Starter culture selection for making Chinese sesame-flavored liquor based on microbial metabolic activity in mixed-culture fermentation[J]. Applied and Environmental Microbiology,2014, 80(14): 4 450-4 459.
[10] CALO-MATA P, ARLINDO S, BOEHME K, et al. Current applications and future trends of lactic acid bacteria and their bacteriocins for the biopreservation of aquatic food products[J]. Food and Bioprocess Technology,2008, 1: 43-63.
[11] LIU S N, HAN Y, ZHOU Z J. Lactic acid bacteria in traditional fermented Chinese foods[J]. Food Research International,2011, 44(3): 643-651.
[12] WU Z F, ZHUANG B W, WENG P F, et al. Fermentation quality characteristics and flavor formation changes during the process of pickled wax gourd in eastern zhejiang[J]. International Journal of Food Properties,2016, 19(2): 409-419.
[13] LE LC, COTON E, CHOBERT JM, et al. Identification and quantification of antifungal compounds produced by lactic acid bacteria and propionibacteria[J]. International Journal of Food Microbiology,2016, 239: 79-85.
[14] GEREZ C L, TORRES M J, DE VALDEZ G F, et al.Control of spoilage fungi by lactic acid bacteria[J]. Biological Control,2013, 64(3): 231-237.
[15] MAGNUSSON J, STROM K, ROOS S, et al. Broad and complex antifungal activity among environmental isolates of lactic acid bacteria[J]. Fems Microbiology Letters,2003, 219(1): 129-135.
[16] DALIE D K D, DESCHAMPS A M, Richard-Forget F. Lactic acid bacteria - Potential for control of mould growth and mycotoxins: A review[J]. Food Control,2010, 21(4): 370-380.
[17] JUNG J Y, LEE S H, JEON C O. Kimchi microflora: history, current status, and perspectives for industrial kimchi production[J]. Applied Microbiology and Biotechnology,2014, 98(6): 2 385-2 393.
[18] LEE M E, JANG J Y, LEE J H, et al. Starter cultures for kimchi fermentation[J]. Journal of Microbiology and Biotechnology,2015, 25(5): 559-568.
[19] 邱并生. 混菌发酵对白酒液态发酵效率和风味物质的影响[J]. 微生物学通报,2014, 41(1): 1 477-1 478.
[20] 乔宗伟,张文学,张丽莺,等, 浓香型白酒发酵过程中酒醅的微生物区系[J]. 酿酒,2005, 32(1): 18-21.
[21] 庾昌文,薛栋升,周敏,等, 清香型小曲白酒机械化酿造过程中细菌多样性及酿造性能分析[J]. 湖北农业科技,2016(11): 2 860-2 863.
[22] 吴莉莉, 王海燕, 徐岩,等, 酱香型与清香型白酒发酵过程中乳酸菌菌群的差异性分析[J]. 微生物学通报, 2013, 40(12): 2 182-2 188.

