不同营养添加物对黄酒酵母的乙醇耐受及发酵性能的影响
杨昳津,林祥娜,夏永军,王光强,俞剑燊,胡健,艾连中*
1(上海理工大学 医疗器械与食品学院,上海,200093)2(上海食品微生物工程技术研究中心,上海,200093) 3(上海金枫酒业股份有限公司,上海,200120)
黄酒是我国传统的酿造饮料酒,与啤酒、葡萄酒并列为世界“三大古酒”[1]。黄酒酿酒酵母的酿造性能直接影响黄酒酿造的生产效率和产品品质[2-3]。但随着发酵过程中乙醇的不断积累,会对酵母细胞的生长、存活和发酵产生抑制[4-6]。高浓度乙醇对酿酒酵母细胞的毒害作用主要体现在改变细胞的形态和细胞生理活动。酵母为了生长、生存和发酵会对乙醇的胁迫产生相对的应激反应,即乙醇耐受性[7]。
提高黄酒酵母的乙醇耐受性不但可以提高原料利用率和发酵速率,同时可以使发酵进行得更为彻底,从而进一步提高乙醇产量,提高黄酒酿造品质[8-10]。在乙醇胁迫环境下生长时,不同的酵母表现出不同程度的乙醇耐受性,表明不同酵母对乙醇胁迫的应答存在极大的差异[11-13]。酿酒酵母对乙醇胁迫的应答及耐受机理一直是国内外学者研究的重点[14-18],细胞中的许多组分与酵母的乙醇耐受特性密切相关,如影响细胞膜流动性的磷脂脂肪酸和肌醇等[19]、与蛋白质活性相关的氨基酸[20]、与质膜两侧跨膜电势运输相关的无机离子[21]、作为分子伴侣防止蛋白质错误折叠的海藻糖[22];并且细胞的许多基因也控制着酵母菌的乙醇耐受性[23-27]。而通过添加一些对应的效应物,如氨基酸、无机盐离子、海藻糖等,若可以提高黄酒酵母的乙醇耐受性,则在实际发酵生产中,可通过添加效应物提高酵母的乙醇耐受性能进而提高黄酒酿造的生产效率,为优质黄酒的酿造提供前提。
本课题通过乙醇定向驯化得到1株乙醇耐受性明显提高的黄酒酿酒酵母单倍体菌株。为了维持酵母的优良性状,最好是培育纯合二倍体菌株,因此,获得优良的单倍体不仅是性状遗传分析所必须,又可为育种作好亲本的准备。通过培养及发酵过程中添加不同浓度的脂肪酸、氨基酸、无机离子、海藻糖和肌醇,分析不同的外源添加物对定向驯化后黄酒酵母的乙醇耐受性及发酵性能的影响,该单倍体黄酒酵母可用于进一步选育优良的二倍体黄酒发酵菌种,良好的发酵菌种对优质黄酒的酿造具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
酿酒酵母BR 20菌株,从黄酒发酵醪液中分离得到并保存于中国微生物保藏中心,保藏编号为CGMCC 9445。
1.1.2 主要培养基与试剂
生长培养基(YPD):葡萄糖 20 g/L, 蛋白胨 20 g/L,酵母粉10 g/L,20 g/L琼脂;
发酵培养基:MgSO41 g/L, KH2PO42 g/L, (NH4)2SO43 g/L, 蛋白胨3.6 g/L, 酵母粉4 g/L, 葡萄糖80 g/L;
产孢培养基:葡萄糖1 g/L,KCl 1.8 g/L,乙酸钠8.2 g/L,酵母粉2.5 g/L,20 g/L琼脂;
于121 ℃下灭菌15 min,冷却后备用。
棕榈酸、硬脂酸、油酸、甘氨酸、谷氨酸、脯氨酸、MgSO4、NaCl、KCl、无水乙醇、海藻糖、肌醇等,均为分析纯试剂。蜗牛酶购于上海生工生物工程有限公司,碘化丙啶购于上海诩圣生物公司。
1.2 仪器与设备
3-18K型离心机,德国Sigma公司;PB-10 普及型 pH 计,德国 Sartorius 公司;Guava EasyCyte plus流式细胞仪,美国Merk Millipore公司;Bioscreen C MBR全自动生长曲线仪,芬兰Oy Growth Curves Ab 公司,ZQZY-BS8全温振荡培养箱,上海知楚仪器有限公司;V-1600 PC可分光光度计,上海美谱达仪器有限公司。
1.3 实验方法
1.3.1 单倍体的制备与分离
根据肖冬光[28]的方法,将酿酒酵母BR 20活化后接种至YPD液体培养基中,28 ℃过夜培养后少量涂布于产孢培养基上,28 ℃培养7 d后涂片染色,观察子囊孢子的形成率。待孢子大量生成时,用无菌生理盐水制成孢子悬液,并调整菌液的浓度为107CFU/mL,取1 mL菌液4 000 r/min离心10 min后收集菌体,加入1 mL 蜗牛酶(20 mg/mL)进行悬浮,37 ℃水浴酶解4~8 h,酶解期间取样观察子囊壁的破壁情况。因酵母孢子比酵母细胞更耐热,酶解液在58 ℃条件下处理10 min以致死酵母细胞,待温度冷却至室温后离心收集孢子,后用Tris-Cl洗涤2次后进行10-1~10-6稀释后涂布于YPD平板,28 ℃培养2~3 d。待长出菌落后,将获得的疑为单倍体的菌株再次接入产孢培养基,7 d后染色观察其生孢情况,如果不生孢,则可确认为单倍体。同时将未经热处理的孢子液同时接种于生孢培养基上,作为对照。
1.3.2 子囊孢子的染色
取干净载玻片1张,滴加少许蒸馏水,接种环取少许菌,涂片固定。滴加5%孔雀石绿染液,在火焰上方加热3~5 min,冷却,水洗;加95%酒精脱色20~30 s,水洗;滴加0.5%番红水溶液复染1 min,水洗,干燥;在显微镜下观察,酵母子囊孢子呈绿色,酵母细胞则为粉红色。
1.3.3 单倍体黄酒酵母的乙醇定向驯化
对分离得到的单倍体菌株进行乙醇的定向驯化,具体流程步骤见图1。
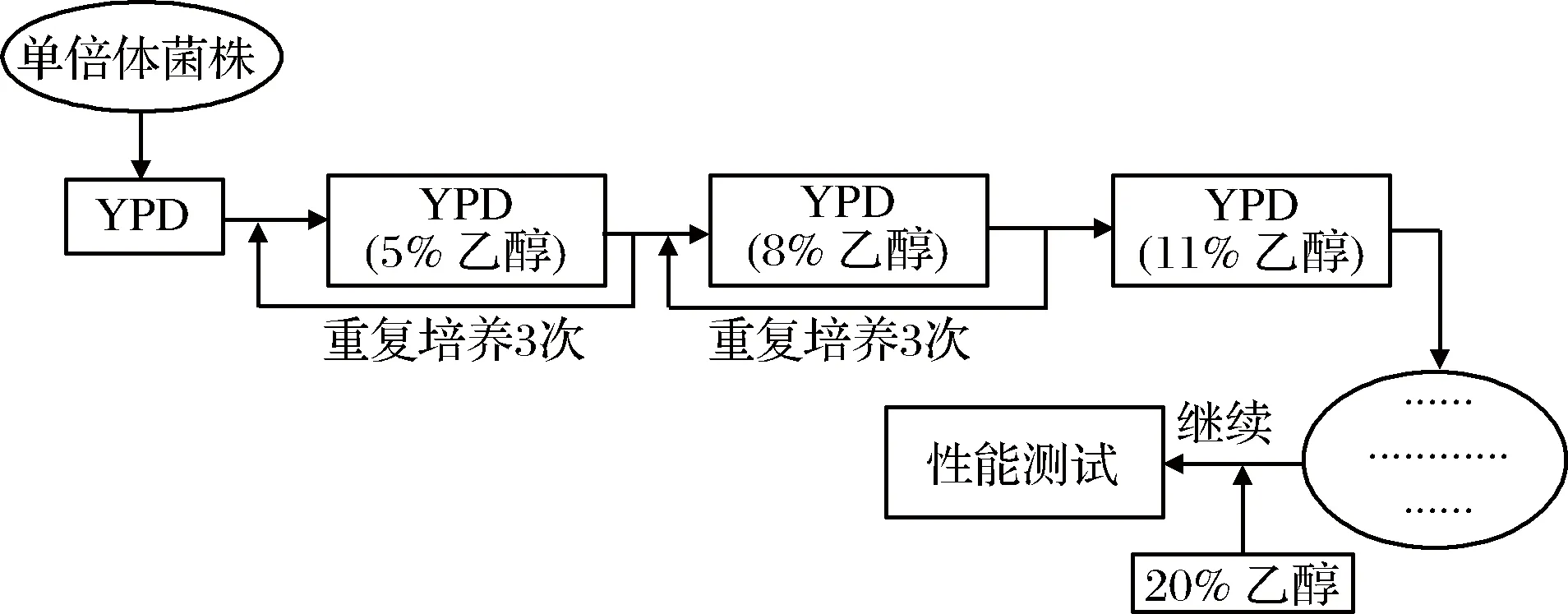
图1 单倍体黄酒酵母的乙醇定向驯化过程Fig.1 The redirect process of ethanol domestication in haploid Chinese rice wine yeast
1.3.4 乙醇驯化酵母株的倍型鉴定
根据参考文献[29],用流式细胞仪进行细胞内核酸含量的测定。将活化后的酵母制成种子液后以2%的接种量接入50 mL的YPD培养基中,以200 r/min于28 ℃下培养12~16 h后,调整菌液的浓度为2×105CFU/mL,取1 mL菌液以12 000 r/min离心1 min后收集菌体细胞,加入1 mL常温存放的PBS溶液重悬;加入4 mL预冷的无水乙醇于-20 ℃中固定10 min;以12 000 r/min离心1 min收集细胞,除去乙醇;用1 mL的PBS缓冲液清洗1次,以12 000 r/min离心1 min收集细胞;加入5 mL室温存放的PBS缓冲液重悬菌体,12 000 r/min离心1 min收集细胞,加入1 mL碘化丙啶染色液(3 μmol/L),室温孵育15 min后进行流式细胞仪分析。
1.3.5 单倍体黄酒酵母的乙醇耐受能力
定向驯化所得菌株与其出发菌株活化后,以2%接种量分别接入含有乙醇体积分数分别为5%、10%及20%的YPD培养基中,于28 ℃下以全自动生长曲线仪记录其生长情况。
活化后的单倍体酵母,接入液体YPD中培养12~16 h至对数期,调整OD600值为1.0后,制成菌悬液,加入无水乙醇,使乙醇体积分数为18%、19%、20%、21%和22%,振荡均匀,培养12 h后,以初始的置于冰箱的菌悬液作为对照,用分光光度计测其生长情况。另外,培养4 h后,每12 mL 菌悬液中加入1 mL 0.1 %碱性美蓝染色液用血球计数板法测活菌数,计算黄酒酵母的存活率[30-31]。
1.3.6 不同浓度添加物对黄酒酵母乙醇耐受能力的影响
将活化后的单倍体黄酒酵母,制成种子液后以2%的接种量接入生长培养基中,于28 ℃下以150 r/min培养至对数期,转移接种至含乙醇体积分数为10%的生长培养基中,生长培养基中分别加入不同浓度的外源添加物,以加入等体积去离子水作为空白对照,28 ℃下150 r/min培养 48 h,利用光密度法测定菌体生物量。
1.3.7 不同添加物对黄酒酵母乙醇发酵性能的影响
在发酵培养基中分别加入可以最大程度促进菌株在乙醇胁迫下生长的外源添加物,以10%的接种量将种子液接入含乙醇体积分数为10%的发酵培养基中,置于28 ℃ 静置发酵,以添加等体积去离子水作为空白对照。每隔1天进行称重,并记录失重情况,待失重小于0.2 g时,可认为发酵基本完成,停止培养[32]。比较不同外源添加物对菌株发酵的逐日失重量的影响。
2 结果与分析
2.1 黄酒酵母单倍体的分离与制备
利用产孢培养基对酿酒酵母BR 20进行产孢培养,7天后按照1.3.2方法进行单倍体的检验,对检验结果染色鉴定后拍照,见图2。
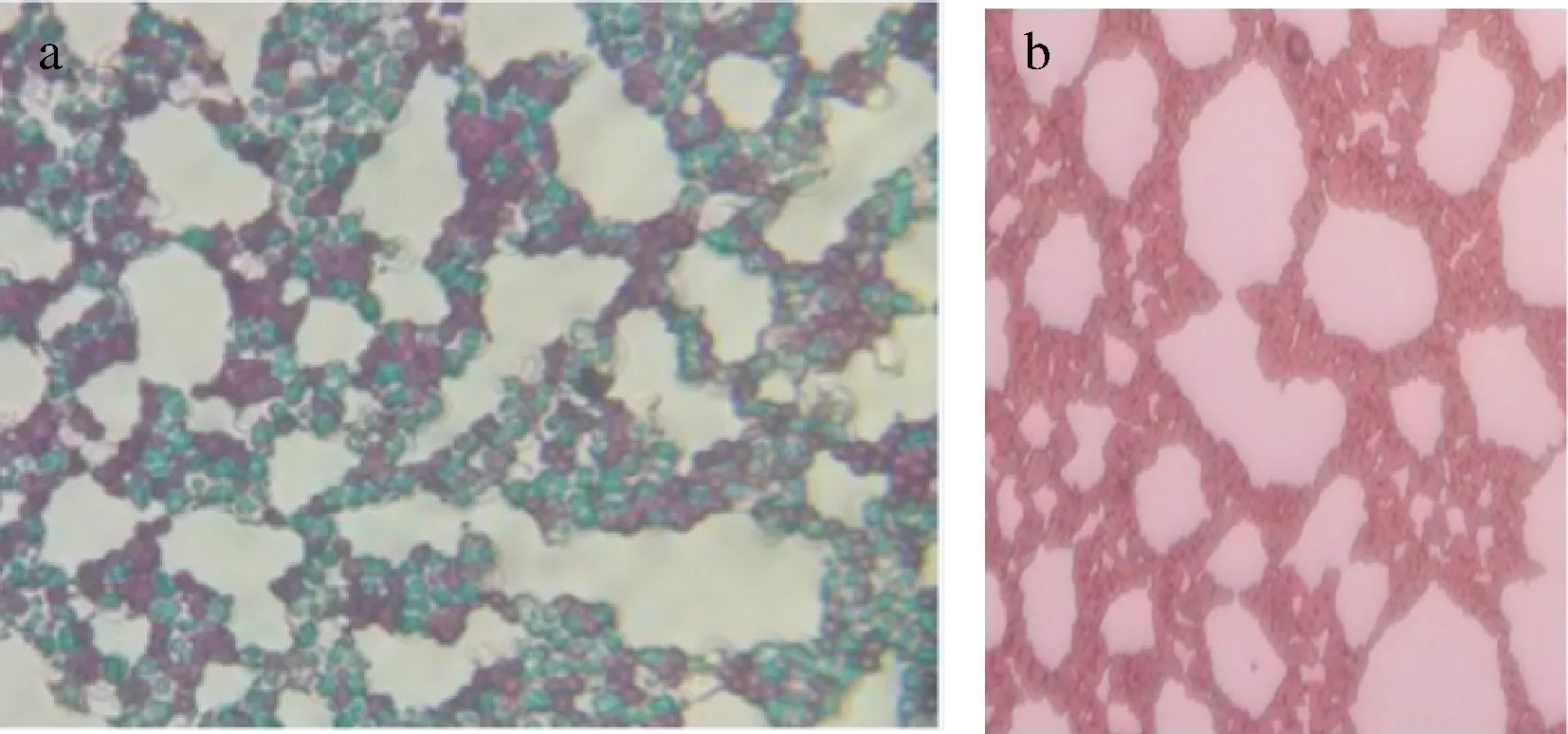
a-未经热处理致死的营养体;b-单倍体酵母细胞图2 黄酒酵母子囊孢子的染色结果Fig.2 The staining results of ascospore in Chinese rice wine yeast
由图2(a)可知,对照组未经过热处理致死营养体,经产孢培养基培养染色后,可同时观察到酵母子囊孢子与子囊细胞,颜色表现为红绿并存。图2(b)为疑似酵母单倍体菌株在生孢培养基培养后的染色结果,结果均为粉红色,没有被染上绿色,说明其在产孢培养基上没有产生孢子,可确认其为单倍体菌株[33]。将其编号为20-Ha后于-80 ℃条件下保藏于甘油中。
2.2 乙醇定向驯化后黄酒酵母菌株的乙醇耐受性
对20-Ha菌株按1.3.3的方法进行乙醇定向驯化后最终得到Et 20,连续传代并进行表型观察。为确定Et 20菌株没有因为自身配型转换后杂交从而形成二倍体菌株,以单倍体模式菌株S288c作为对照,采用流式细胞仪进行细胞内核酸含量的测定从而进行倍型的验证,结果如图3所示。Et 20的核酸含量峰面积为9794,与S288c的核酸含量峰面积相当(10 000),说明Et 20与S288c有相似的倍性,均为单倍体菌株,Et 20没有在乙醇定向驯化的过程中发生自杂交。

图3 Et 20与S288c的流式细胞仪倍型验证Fig.3 Genome types of Et 20 and S288c by cell flow analysis
在不同乙醇体积分数下下,绘制驯化前的出发菌株20-Ha与驯化株Et 20生长曲线,并分别进行18%、19%、20%、21%和22%体积分数的乙醇冲击,分析Et 20的乙醇耐受能力,结果见图4与表1。

图4 不同乙醇体积分数下Et 20与20-Ha的生长曲线Fig.4 Growth curves of strains Et 20 and 20-Ha under different ethanol concentration
图4表明, 5%乙醇对菌株的生长没有太大的影响,Et 20与20-Ha表现出基本一致的生长规律;当培养基中初始乙醇体积分数为10%时,Et 20与20-Ha的生长速率明显降低,20-Ha的延滞期延长,而Et 20的延滞期则几乎没有变化;当乙醇体积分数为20%时,20-Ha停止生长,Et 20的延滞期延长至16 h,对数期生长时间也明显缩短,却仍表现出一定的生长活力。
经过乙醇定向驯化后,Et 20的乙醇耐受性能得到了明显的提高。
进一步分析高体积分数乙醇处理对菌株存活率的影响,由表1可知,乙醇处理体积分数低于20%时,短时的乙醇冲击对Et 20的生长无明显影响,培养24 h后存活率从87.9%略微下降至85.1%;20-Ha菌株则生长微弱,经18%乙醇冲击后的存活率仅为23.2%,继续提高乙醇浓度菌株则停止生长。当乙醇处理体积分数高于20%时,无论是短时的乙醇冲击或培养24 h,Et 20的存活率均大幅下降。OD600值从0.163降到0.092,降低了43.56%,培养24 h后的存活率从82.9%降低至37.3%,降低了55.01%。综上可知,经过定向驯化后的Et 20菌株对高体积分数乙醇的耐受性明显高于驯化前的出发菌株20-Ha,进一步提高乙醇冲击体积分数,虽然生长会受到的限制,却仍有一定的存活率,其乙醇耐受性得到了明显的提高。
表1定向驯化后黄酒酵母的乙醇耐受情况(n=3)
Table1EthanoltoleranceofdirectedlydomesticatedChinesericewineyeast(n=3)

乙醇体积分数Et20乙醇冲击4h后的存活率20-Ha乙醇冲击4h后的存活率Et20培养24h后的OD60020-Ha培养24h后的OD60018%87.9%±0.04a23.2%±0.020.166±0.003b0.089±0.002a19%85.1%±0.03b00.173±0.005a0.032±0.001b20%82.9%±0.06c00.163±0.003cND21%61.4%±0.03d00.121±0.002dND22%37.3%±0.02e00.092±0.002eND
注:1. ND表示菌株不生长;2. 右上角不同字母表示在p<0.05(Duncan)时,样品存在显著性差异。
2.3 不同营养添加物对乙醇胁迫下黄酒单倍体酵母生长的影响
乙醇胁迫时,酵母的生长可以反映它的乙醇耐受性,高浓度乙醇存在时,菌株生长的延滞期会相应增加[7-8],故选择中等强度的乙醇进行胁迫。在含有10%乙醇的生长培养基中分别添加不同浓度的脂肪酸、氨基酸、无机盐、海藻糖和肌醇,培养48 h后测定菌体的生物量,以无营养添加物作为空白对照,结果见图5。
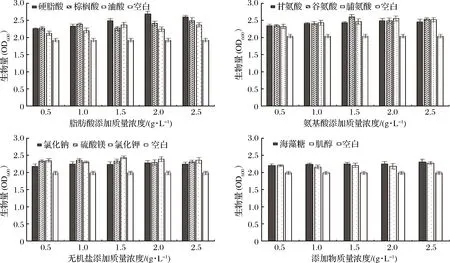
图5 不同添加物对乙醇胁迫下黄酒酵母生长的影响 (n=3)Fig.5 The effects of different additives on the growth of Chinese rice wine yeast under ethanol stress (n=3)
在乙醇胁迫下,添加的营养物均可使酵母的生物量得到显著的提高。可见,脂肪酸、氨基酸、无机盐、海藻糖与肌醇的添加可在一定程度上显著提高Et 20的乙醇耐受性。与空白对照相比,脂肪酸的添加,使Et 20的生物量提高了10%~40%,其中硬脂酸的促进作用最大,与邢建宇等[30]、胡铁功[34]等的研究结果一致;氨基酸的添加,使Et 20的生物量提高了14%~28%,其中谷氨酸的促进作用最大,与梁泽新等的研究结果一致[35];无机盐的添加,使Et 20的生物量提高了10%~23%,其中KCl的促进作用最大;添加海藻糖使Et 20的生物量提高了10%~16%;肌醇的添加使Et 20的生物量提高了9%~14%。乙醇胁迫时,脂肪酸的添加可以最大程度地提高单倍体酵母的乙醇耐受性,其中硬脂酸的效果最好。
随着添加物质量浓度的提高,Et 20的生物量呈现先增加后降低的趋势。棕榈酸、NaCl和MgSO4在1.0 g/L时能最大程度提高Et 20的乙醇耐受性,油酸、谷氨酸、KCl为1.5 g/L,硬脂酸、甘氨酸和脯氨酸为2.0 g/L,海藻糖和肌醇为2.5 g/L;效果最佳的硬脂酸促进提高了40%的生物量,谷氨酸次之,为28%,其后为棕榈酸和KCl,分别促进提高了24%和23%的生物量,海藻糖和肌醇的添加效果相对较差,均低于20%。不同种类、不同浓度的营养添加物可以不同程度地提高Et 20的乙醇耐受性,总体而言,脂肪酸的促进作用优于氨基酸,无机盐、海藻糖和肌醇分别次之。
2.4 不同营养添加物对黄酒单倍体酵母发酵性能的影响
在实际发酵及酒的酿造过程中通常会采用CO2的损失量来表征酵母菌株的发酵能力和发酵强度。在10%乙醇胁迫下,向发酵培养基中分别加入最大程度促进菌株生长的添加物(2.3分析结果),不同营养添加物对Et 20发酵时产生的CO2失重情况如图6所示。
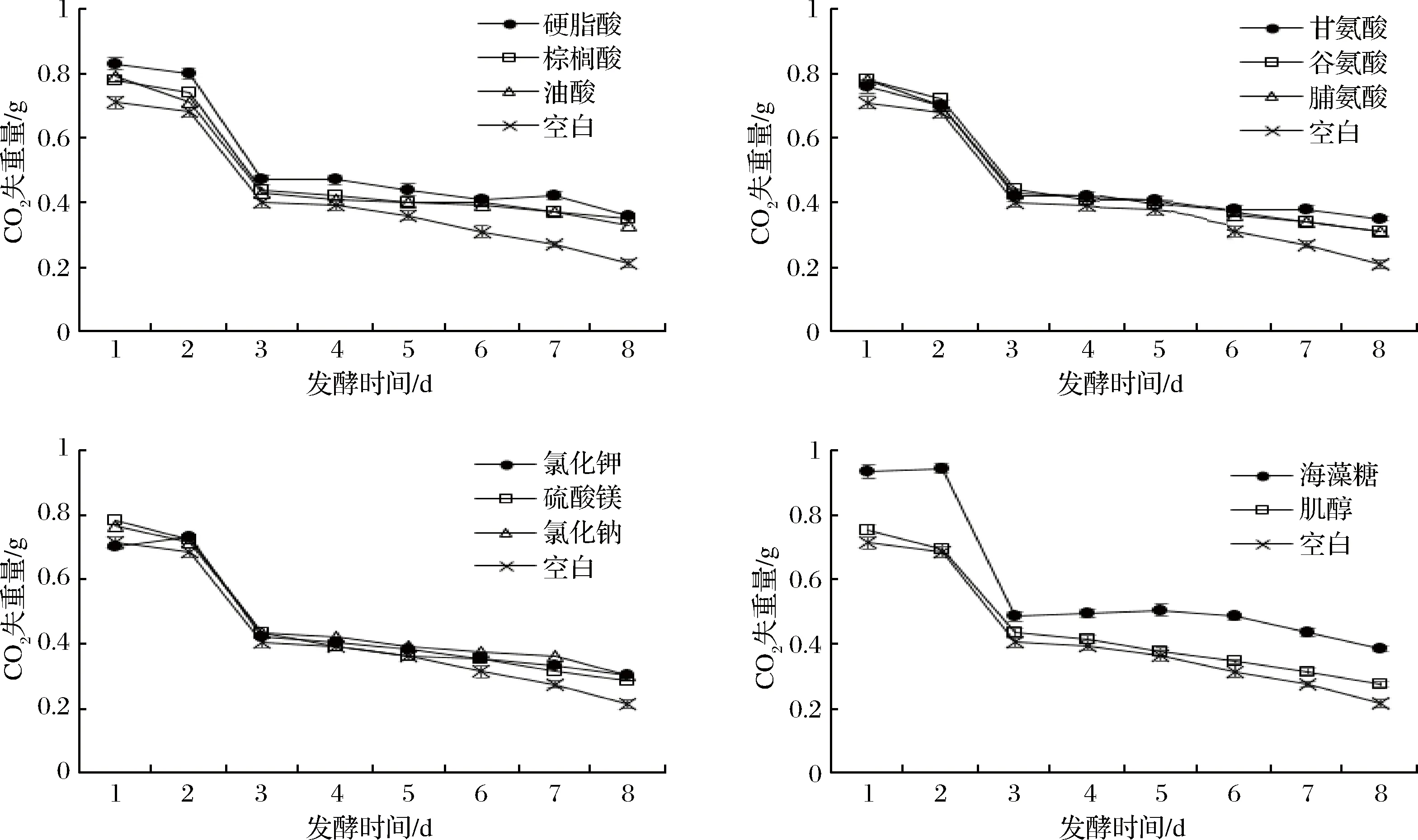
图6 不同添加物对乙醇胁迫下黄酒酵母发酵性能的影响 (n=3)Fig.6 The effects of different additives on the fermentation performance of Chinese rice wine yeast under ethanol stress (n=3)
从图6可以看出,发酵过程中,添加不同营养物后Et 20的总发酵强度均明显高于空白对照。不同的营养添加物对Et 20发酵释放产生CO2的规律基本相同:在发酵1天后出现了单日最大的CO2释放量;随着发酵时间的增加,CO2的失重量也逐渐降低。黄酒发酵为半开放式发酵,故用于发酵的黄酒酵母一般采用“前急后缓”菌种,即在发酵初期酵母可迅速增殖形成生长优势从而抑制细菌过度的生长引发的酸败。Et 20亦符合该种模式,故发酵3天后,在乙醇积累与营养消耗的双重胁迫下,发酵强度随时间延长明显降低,但不同营养添加物对Et 20在乙醇胁迫下的发酵性能产生了不同的影响。相比空白对照,海藻糖在乙醇胁迫下能较好地提高Et 20的总发酵强度,脂肪酸、氨基酸与无机盐分别次之,而肌醇的效果相对较差。添加的脂肪酸中,硬脂酸添加后,Et 20在发酵3天后的发酵强度下降幅度最低;添加的氨基酸中,甘氨酸能较好的提高Et 20的发酵性能;而所添加的3种无机盐则作用相当。
在10%乙醇胁迫下,添加海藻糖可最大限度地提高Et 20的总发酵强度(4.63 g),较空白对照(3.33 g)高出了39.04%;硬脂酸添加效果次之,发酵8天后Et 20累积的总CO2失重量(4.20 g)较对照高出26.13%;其后为甘氨酸,Et 20总发酵强度提高了14.71%;无机盐的添加最大可提高12.31%的总发酵强度;添加肌醇后则仅提高了7.21%的发酵强度。随着发酵的深入与乙醇的积累,添加外源营养物可不同程度地降低乙醇胁迫对黄酒酵母发酵性能的影响。海藻糖作为细胞内源性的“保护物质”,虽然可极大促进Et 20在乙醇胁迫下的发酵强度,但在促进菌株在乙醇胁迫下的生长却没有明显的优势;而硬脂酸既可以较好地促进Et 20在乙醇胁迫下的生长,同时也可以较大程度地提高Et 20的发酵强度。
3 结论
为选育高乙醇耐受性的黄酒酵母,为后期黄酒育种提供优质的前提,本课题通过菌种单倍体化与乙醇定向驯化获得了1株可耐受乙醇体积分数为20%的单倍体酿酒酵母Et 20,在一定乙醇胁迫条件下添加不同种类的脂肪酸、氨基酸、无机盐离子、海藻糖和肌醇,这些添加物均能不同程度提高Et 20菌株的乙醇耐受性,并且随着添加浓度的升高,外源添加物有先提高后降低菌株乙醇耐受性的趋势。硬脂酸能最大限度提高Et 20的乙醇耐受性,谷氨酸、KCl分别次之,海藻糖与肌醇的添加效果则相对较差。在10%乙醇胁迫下,添加海藻糖与硬脂酸能较大程度降低乙醇胁迫对Et 20发酵的影响,可分别提高39.03%与26.12%的总发酵强度。海藻糖虽然可极大程度促进Et 20在乙醇胁迫下的发酵强度,却对提高菌株的乙醇耐受性没有明显优势;而硬脂酸既可以较好地促进Et 20在乙醇胁迫下的生长,也可以较大程度地提高Et 20的发酵强度。定向驯化高乙醇耐受性黄酒酵母,为选育优良的黄酒发酵菌种提供前提,对优质黄酒的酿造具有重要的意义。
[1] 杨鲁君,蒋予箭,李予动.黄酒酵母优良抗逆菌株的筛选、鉴定及发酵特性研究[J].中国食品学报,2013,13(9):71-77.
[2] 汪建国,沈玉根,陆伟杰等.我国黄酒研究现状与发展趋势[J]. 中国酿造, 2012, 31(11): 15-20.
[3] 黄笃厚,陈双,徐岩.采用新型抗性选育高效黄酒酵母菌株[J].微生物学通报,2014,41(4):654-660.
[4] STATANLEY D,BANDARA A,FRASER S,et al.The ethanol stress response and ethanol tolerance ofSaccharomycescerevisiae[J].Journal of Application Microbiology,2010,109(1):13-24.
[5] PISKUR J,ROZPEDOWSKA E,POLAKOVA S,et al.How didSaccharomycesevolve to become a good brewer?[J].Trends in Genetics,2006,22(4):183-186.
[6] THOMSON J M,GAUCHER E A,BURGAN M F,et al.Resurrecting ancestral alcohol dehydrogenases from yeast[J].Nature Genetics,2005,37(6): 630-635.
[7] CASEY G P, INGLEDEW W M.Ethanol tolerance in yeasts[J].Critical Reviews in Microbiology,1986,13(3):219-280.
[8] SHI D,WANG C,WANG K.Genome shuffling to improve thermotolerance,ethanol tolerance and ethanol productivity ofSaccharomycescerevisiae[J].Journal of Industrial Microbiology and Biotechnology,2008,36(1):139-147.
[9] BISWAS R,PRABHU S,LYND L,et al.Increase in ethanol yield via elimination of lactate production in an ethanol-tolerant mutant of clostridium thermocellum[J].PLoS ONE,2014,9(2):e86389.
[10] TSUJI M,KUDOH S,HOSHINO T.Ethanol productivity of cryophilic basidiomycetous yeastMrakiaspp. correlates with ethanol tolerance[J].Mycoscience,2016,57(1):42-50.
[11] TOKSOYÖNER E.Optimization of ethanol production from starch by an amylolytic nuclear petiteSaccharomycescerevisiaestrain[J].Yeast,2006,23(12):849-856.
[12] KATO K,YAMAMOTO Y, IZAWA S.Severe ethanol stress induces assembly of stress granules inSaccharomycescerevisiae[J].Yeast, 2011,28(5):339-347.
[13] GUO Z,ZHANG L, DING Z,et al.Improving the performance of industrial ethanol-producing yeast by expressing the aspartyl protease on the cell surface[J].Yeast,2010,27(12):1 017-1 027.
[14] INOUE T,IEFUJI H,FUJII T,et al.Cloning and characterization of a gene complementing the mutation of an ethanol-sensitive mutant of sake yeast[J].Bioscience Biotechnology and Biochemistry,2000,64(2):229-236.
[15] YOU K M,ROSENFIELD C L,KNIPPLE D C.Ethanol tolerance in the yeastSaccharomycescerevisiaeisdependent on cellular oleic acid content[J].Applied and Environmental Microbiology,2003,69(3):1499-1503.
[16] MA M,LIU Z L.Mechanisms of ethanol tolerance inSaccharomycescerevisiae[J].Applied and Environmental Microbiology,2010,87(3):829-845.
[17] VANEGAS J M,CONTRERAS M F,FALLER Ret al.Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes[J].Biophysical Journal,2014,102(3):507-516.
[18] LAM F H,GHADERI A,FINK G R,et al.Engineering alcohol tolerance in yeast[J].Science,2014,346(6 205):71-75.
[19] DONG S,YI C,LI H.Changes ofSaccharomycescerevisiaecell membrane components and promotion to ethanol tolerance during the bioethanol fermentation[J].The International Journal of Biochemistry and Cell Biology,2015,69:196-203.
[20] SWINNEN S,GOOVAERTS A,SCHAERLAEKENS K,et al.Auxotrophic mutations reduce tolerance ofSaccharomycescerevisiaeto very high levels of ethanol stress[J].Eukaryot Cell,2015,14(9):884-897.
[21] ALPER H,MOSLEY J,NEVOIGT E,et al.Engineering yeast transcription machinery for improved ethanol tolerance and production[J].Science,2006,314(5805):1 565-1 568.
[22] VAN VOORST F,HOUGHTON-LARSEN J,JONSON L,et al.Genome-wide identification of genes required for growth ofSaccharomycescerevisiaeunder ethanol stress[J].Yeast,2006,23(5):351-359.
[23] SWINNEN S,SCHAERLAEKENS K,PAIS T,et al.Identification of novel causative genes determining the complex trait of high ethanol tolerance in yeast using pooled-segregant whole-genome sequence analysis[J].Genome Research,2012,22(5):975-984.
[24] PAISTM T,FOULQUIE-MORENO M R,HUBMANN G,et al.Comparative polygenic analysis of maximal ethanol accumulation capacity and tolerance to high ethanol levels of cell proliferation in yeast[J].PLoS Genetics,2013,9:e1003548.
[25] TAKAHASHI T,SHIMOI H,ITO K.Identification of genes required for growth under ethanol stress using transposon mutagenesis inSaccharomycescerevisiae[J].Molecular Genetics and Genomics,2001,265(6):1 112-1 119.
[26] DUITAMA J,SANCHEZ-RODRIGUEZ A,GOOVAERTS A, et al.Improved linkage analysis of quantitative trait loci using bulk segregants unveils a novel determinant of high ethanol tolerance in yeast[J].BMC Genomics,2014,15(1):207-214.
[27] VOODECHERS K,KOMINEK J,DAS A,et al.Adaptation to high ethanol reveals complex evolutionary pathways[J].PLoS Genetics,2015,11:e1005635.
[28] 郝欣,肖冬光,申童,等.低产高级醇酿酒酵母菌株筛选及其单倍体制备[J].酿酒科技,2010(6):35-38.
[29] CHAN C,BOTSTEIN D.Isolation and characterization of chromosome-gain and increase-in-ploidy mutants in yeast[J].Genetics,1993,135(3):677-691.
[30] 邢建宇,李春荣,李亚丹.脂肪酸对酿酒酵母乙醇耐受性的影响[J].食品研究与开发,2009,30(6):33-35.
[31] 胡纯铿,白凤武,安利佳.细胞膜蛋白质氨基酸组成对自絮凝颗粒酵母耐酒精能力的影响及作用机制[J].微生物学报,2004,44(5):636-640.
[32] JEAN-PAUL M,PAOLA R,MARIA R, et al.Polygenic analysis and targeted improvement of the complex trait of high acetic acid tolerance in the yeastSaccharomycescerevisiae[J].Biotechnology for Biofuels,2016,9(5): 1-18.
[33] 龚熠,伍时华,易弋,等.酿酒酵母子囊孢子单倍体形成和制备的研究[J].中国酿造,2011,30(9):80-84.
[34] 胡铁功,朱文众,刘广慧.添加脂肪酸对玉米固态发酵乙醇中酵母酒精耐性的影响[J].食品与发酵工业,2008,34(1):97-99.
[35] 梁泽新,王川,戴川.几种无机离子和氨基酸对酿酒酵母酒精耐性的影响[J].四川理工学院学报,2015,28(2):1-4.

