参附注射液对脓毒症老龄大鼠肾脏组织炎症因子表达的影响
冯 敏 刘 刚 徐大千
(郑州大学第一附属医院重症医学科,河南 郑州 450052)
脓毒症是一种具有全身性的炎症反应综合征,起病急,发展迅速,致死率高,常并发于严重创伤、烧伤、感染及大手术等多种应激状况,可诱发多器官病变,成为目前临床急危重症患者主要的死亡原因之一。约有17%的脓毒症病人会并发急性肾衰竭,损害中枢神经系统,发生电解质紊乱,导致尿毒症性肺部炎症,最终引起呼吸衰竭、死亡〔1,2〕。脓毒症的突出特征是炎症反应与抗炎反应失控。白细胞介素(IL)-6、CD14、IL-18在脓毒症发病机制中起关键作用,参与免疫和炎性反应的调控,可诱导急性期蛋白的合成,诱导炎症反应〔3~10〕。目前有关参附注射液对脓毒症方面的研究报道较少。本实验研究参附注射液对脓毒症大鼠肾脏的保护作用。
1 材料与方法
1.1材料
1.1.1药品与试剂 乌司他丁注射液,广东天普生化医药股份有限公司,批号:国药准字H20040506。尿素氮(BUN)、肌酐(Cr)及谷氨酸氨基转移酶(ALT)生化试剂(德国Prodia公司),IL-6、CD14、IL-18试剂盒(美国Biosource公司),β2-免疫分析盒(北方生物技术研究所),参附注射液(每毫升相当于生药:红参0.1 g,附片0.2 g,雅安三九药业有限公司)。
1.1.2动物 健康雄性SD大鼠136只,购于广东药学院实验动物中心,SPF级,体质量(350±20)g,许可证号SCXK(粤)2015-0022。本实验操作过程中及实验结束后,对各大鼠的处理方法均符合2006年中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》。
1.2方法
1.2.1脓毒症大鼠模型制备与分组 脓毒症大鼠模型的制备方法参照文献〔11~14〕:造模前SD大鼠禁食12 h,以7.5 mg/100 g盐酸氯胺酮和2.0 mg/100 g赛拉嗪腹腔注射进行麻醉,固定于无菌操作台上,用碘酊进行常规消毒,沿中下腹正中线进行1.5 cm切口,在大鼠盲肠中部进行结扎,用16号针贯穿盲肠一次(为防止针孔闭合,留一条橡皮片贯通盲肠),将盲肠还纳腹腔,缝合切口。术后立即注射5 ml 0.9%生理盐水,放回鼠笼,自由饮食。
分为正常组(不作任何处理,n=8),假手术组(不结扎不穿孔,只于相同部位进行切口及盲肠提出后再放回,n=8),模型组(脓毒症大鼠,n=40),参附注射液中剂量组(脓毒症大鼠,n=40),参附注射液低、高剂量组(脓毒症大鼠,n=8),阳性药组(脓毒症大鼠,n=40);前2组匀于尾静脉注射等量生理盐水,模型组于术后0、12、24、36、48 h经尾静脉注射等量生理盐水,参附注射液中剂量组于相同时间点经大鼠尾静脉注射参附注射液,每次剂量4 ml/kg(参考临床剂量),低剂量组每次注射剂量为2 ml/kg,高剂量组每次注射剂量为6 ml/kg,阳性药组于相同时间点经大鼠尾静脉以100 000 U/kg注射乌司他丁注射液;模型组与参附注射液组分别于各时间随机取8只,采集标本。
1.2.2标本的采集与处理 SD大鼠麻醉、消毒后,无菌条件下开腹,剥离暴露出腹主动脉,采集腹主动脉血约5 ml,置于离心试管中,3 000 r/min低温高速离心10 min,取上层清液,于-80℃冰箱中保存,用于血清生化指标的测定;同样无菌操作下摘取肾组织,于-80℃冰箱中保存,用于组织形态学观察;用2 ml注射器从膀胱采集尿液,于-80℃冰箱中保存。
1.2.3血清及尿液中生化指标的测定 利用自动生化分析仪测定血清中Cr、BUN、ALT、K+及尿液中N-乙酰β-D-葡萄糖苷酶(NAG)、Na+含量,计算尿钠排泄分数(FENa)。
1.2.4血清中IL-6及肾组织中IL-6、CD14、IL-18蛋白含量检测 将肾组织从-80℃冰箱中取出,称重后置于EP管中,加入15倍生理盐水,用匀浆器匀浆,以1 400 r/min低温离心15 min,吸取上清液;从冰箱中取出血清,于室温融化,采用Bio-rad蛋白检测试剂盒测定提取蛋白,采用双抗体夹心酶联免疫吸附法检测肾组织和血清中的IL-6、CD14、IL-18蛋白含量。
1.3统计学分析 采用SPSS16.0统计,计量资料进行t检验、方差分析及相关回归分析。
2 结 果
2.1各组肾功能指标比较 与正常组相比,模型组从12 h开始血清中BUN明显升高(P<0.01),虽然36 h呈现明显降低,但到48 h又再次显著升高(P<0.01);同样,与正常组比较,36 h和48 h模型组血清ALT显著增加(P<0.05);相较于血清中的BUN及ALT,大鼠血清中Cr含量增加缓慢,在48 h才表现出明显增加(P<0.05)。与模型组比较,脓毒症大鼠经各剂量参附注射液治疗12 h和48 h后,血清中BUN显著降低(P<0.05),治疗36 h和48 h后血清中ALT显著降低(P<0.05),而Cr虽也有所降低,但降低缓慢,于48 h后才明显降低(P<0.05);与阳性药组比较,参附注射液各剂量治疗后效果明显优于阳性药组。给药48 h,参附注射液低剂量组治疗效果最差,与中、高剂量组差异有统计学意义(P<0.05),说明有一定的剂量依赖性,而中、高剂量组间相比差异无统计学意义(P>0.05),说明达到一定剂量后对治疗并没有表现出明显的效果。与正常组相比,48 h后模型组血清中的K+含量明显增加(P<0.05);12 h后模型组血清β2微球蛋白明显升高(P<0.01),但48 h后显著降低(P<0.01)。尿液指标检测显示,与正常组相比,12~36 h模型组的FENa均呈现降低(P<0.01);而同时间点模型大鼠尿NAG含量差异无统计学意义(P>0.05)。与模型组相比,参附注射液各剂量组治疗12 h后大鼠血清β2微球蛋白降低(P<0.01),而治疗组12~48 h FENa及NAG含量并没有明显变化;与阳性药组比较差异无统计学意义(P>0.05)。不同给药剂量数据结果分析,给药48 h,参附注射液低剂量组治疗效果与中、高剂量组差异有统计学意义(P<0.05),说明有一定的剂量依赖性,而中、高剂量组间相比差异无统计学意义(P>0.05),说明达到一定剂量后对治疗并没有表现出明显的效果。见图1,图2。

图1 各组大鼠肾功能血清指标检测结果
2.2各组IL-6蛋白水平比较 正常组与假手术组大鼠血清中均含有少量IL-6,组间差异无统计学意义(P>0.05)。造模成功后12 h,与正常组相比,模型大鼠血清中IL-6蛋白表达水平明显增加(P<0.05),24 h达到最高(P<0.01),而至36 h血清中IL-6蛋白表达水平下降显著,接近于正常组,但48 h又明显升高(P<0.01);模型组肾脏组织中IL-6蛋白表达水平从12~36 h有缓慢升高表现,与正常组差异有统计学意义(P<0.01),而至48 h又下降至与正常组持平水平。与模型组相比,参附注射液治疗后,各剂量组12~48 h大鼠血清中IL-6蛋白表达水平明显降低(P<0.05),12 h肾脏组织中IL-6水平却无显著变化,而24~36 h肾脏组织中IL-6蛋白表达水平明显降低(P<0.05);脓毒症大鼠经参附注射液治疗后,效果明显优于阳性药组。参附注射液具有一定的剂量依赖性,且中、高剂量组间相比差异无统计学意义(P>0.05),说明达到一定剂量后对治疗并没有表现出明显的效果。见图3。
2.3各组肾脏组织中CD14、IL-18蛋白相对含量比较 模型组肾脏组织中CD14蛋白表达水平最高,而阳性组与参附注射液各剂量组肾脏组织中CD14蛋白表达水平与模型组相比明显降低(P<0.01)。与对照组相比,模型组IL-18蛋白表达水平明显增高(P<0.01);与模型组相比,参附注射液高、中、低组肾脏组织中IL-18蛋白表达水平明显减少(P<0.01)。见图4。

图2 各组大鼠肾功能尿液指标检测结果
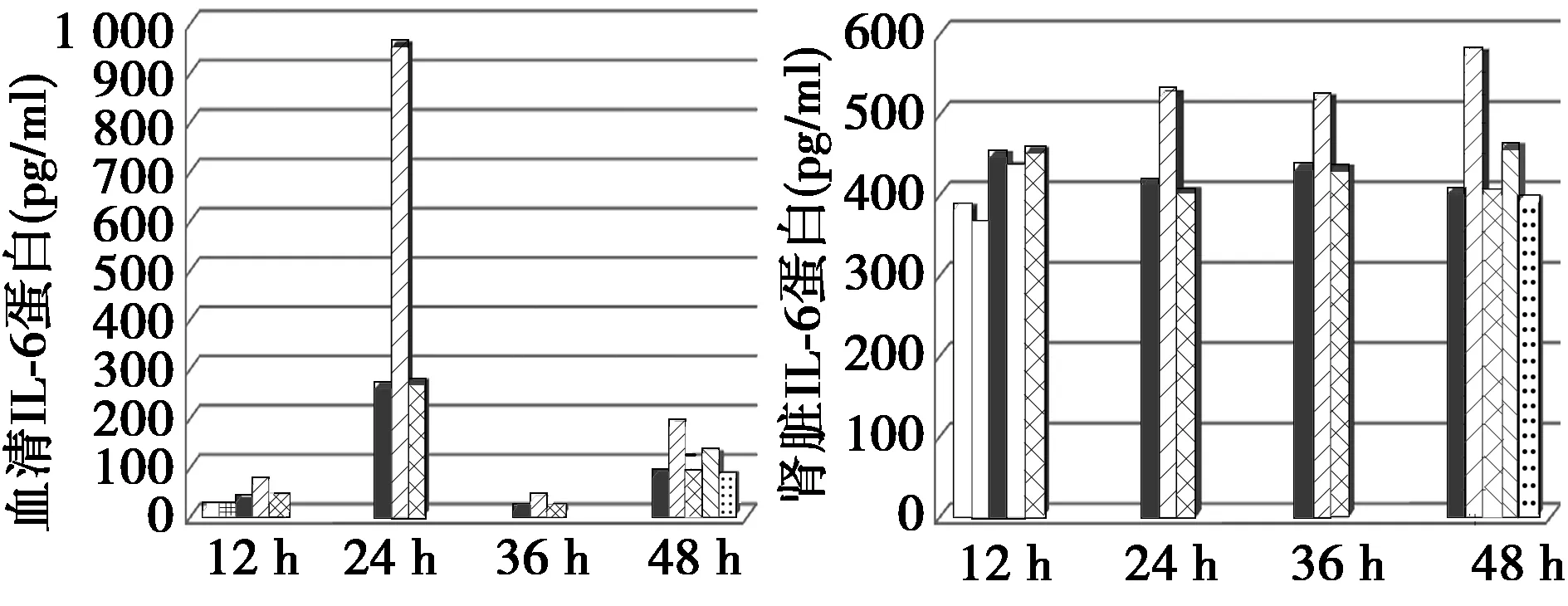
图3 各组大鼠IL-6蛋白水平的检测结果
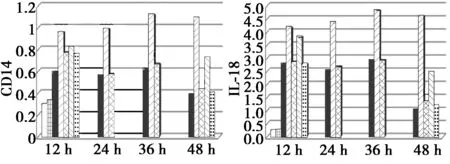
图4 大鼠肾脏组织中CD14、IL-18蛋白相对含量
3 讨 论
炎症反应是引起多器官功能障碍的主要因素,炎细胞的持续活化与播散导致炎症介质过多产生与释放,引起细胞乃至脏器损伤,严重者导致多脏器衰竭。研究显示,通过激活炎症因子可导致核转录因子(NF)-κB活化入核,引起IL-6,IL-18等炎症因子的合成与释放。参附注射液由红参、附子组成,人参皂苷和乌头碱为主要活性成分,具有温阳益气养心、回阳救逆的药效。研究显示,参附注射液对脓毒症患者或动物具有一定的改善及保护作用,调节脓毒症免疫紊乱及维持机体炎症平衡〔15,16〕。脓毒症可引起多种器官损伤,肾脏损伤是其常引起的并发症,本研究结果显示,参附注射液对脓毒症炎症大鼠肾脏具有明显的保护作用,其通过抑制血清与肾组织中的IL-6、CD14、IL-18蛋白表达水平,抑制炎症因子的释放,实现参附注射液对脓毒症大鼠的肾脏保护作用。
1Mongardon N,Bouglé A,Geri G,etal.Pathophysiology and management of post-cardiac arrest syndrome〔J〕.Ann Fr Anesth Reanim,2013;32(11):779-86.
2Dellinger RP,Levy MM,Rhodes A.Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2012〔J〕.Crit Care Med,2013;41(2):580-637.
3Dejager L,Pinheiro I,Dejonckheere E.Cecal ligation and puncture:the gold standard model for polymicrobial sepsis〔J〕?Trends Microbiol,2011;19(4):198-208.
4Wu HP,Shih CC,Lin CY.Serial increase of IL-12 response and human leukocyte antigen-DR expression in severe sepsis survivors〔J〕.Crit Care,2011;15(5):R224.
5黄 慧,傅应云,齐 晖.IL-6、IL-18和TPO等指标对预测脓毒症预后的意义〔J〕.中国医药指南,2013;24:621.
6Peng Z,Pai P,Hong-Bao L,etal.The impacts of continuous veno-venous hemofiltration on plasma cytokines and monocyte human leukocyte antigen-DR expression in septic patients〔J〕.Cytokine,2010;50(2):186-91.
7项文娜,黄雨茅,吴 亮.早产儿感染诊断中检测白介素-6、白介素-8、白介素-10的临床价值〔J〕.中国医刊,2013;48(5):91-2.
8Zeitlinger M,Marsik C,Steiner I.Immunomodulatory effects of fosfomycin in an endotoxin model in human blood〔J〕.J Antimicrob Chemother,2007;59(2):219-23.
9Mostafa Anower AK,Shim JA,Choi B,etal.Pretreatment with interleukin-6 small interfering RNA can improve the survival rate of polymicrobial cecal ligation and puncture mice by down regulating interleukin-6 production〔J〕.Eur J Pharmacol,2012;688(1-3):76-83.
10Li S,Bao HG,Han L,etal.Effects of adiponectin on mortality and its mechanism in a sepsis mouse model〔J〕.J Invest Surg,2012;25(4):214-9.
11Ozdemir S,Toplan S,Tanriverdi G.The effects of β-glucan on iron levels and lipid peroxidation in intra- abdominal sepsis in rats〔J〕.Gen Physiol Biophys,2011;30(2):138-44.
12Coelho CW,Jannig PR,Souza AB.Exercise training prevents skeletal muscle damage in an experimental sepsis model〔J〕.Clinics (Sao Paulo),2013;68(1):107-14.
13Morel J,Li JY,Eyenga P.Early adverse changes in liver microvascular circulation during experimental septic shock are not linked to an absolute nitric oxide deficit〔J〕.Microvasc Res,2013;90:187-91.
14Gille-Johnson P,Smedman C,Gudmundsdotter L,etal.Circulating monocytes are not the major source of plasma cytokines in patients with sepsis〔J〕.Shock,2012;38(6):577-83.
15江荣林,雷 澍,王灵聪,等.参附注射液对重度脓毒症患者组织氧代谢的影响〔J〕.中华中医药杂志,2009;(7):965-7.
16邱泽亮,叶一萍,张 宁,等.参附注射液对严重脓毒症免疫调节的前瞻性研究〔J〕.中华中医药学刊,2012;(2):363-6.

