NiMoAl2O3上H2还原脱除烟气中SO2和NO探索
张春城,薛 峰,武传朋,郭大为
(1.中国石化石油化工科学研究院,北京 100083;2.北京茵泰德科技有限公司)
烟气中的硫氧化物(简称SOx,为SO3和SO2的总称)或氮氧化物(简称NOx,指NO,NO2,N2O等)是主要的大气污染物,严重危害人体健康和生态环境。近年来,世界各国对SOx和NOx的排放限制越来越严格,这当然也包括对炼油工业中流化催化裂化装置(FCCU)再生烟气的排放限制。
目前国内外关于脱除FCCU再生烟气中的SOx和NOx的技术主要有2种:一是干式选择性还原法脱NOx单元(SCR)连接湿法脱SOx单元,再连接后处理单元;二是湿法脱SOx单元连接湿式低温氧化法脱NOx单元(LoTOx),再连接后处理单元[1]。这样的过程很难避免气液固相的二次污染,而且低温烟气夹带或次生的颗粒物是大气中雾霾加重的重要因素之一。现在也有干式脱SO2的技术,如基于流化床的吸附-再生ESR工艺[1],但未见工业化的报道。中国石化石油化工科学研究院开发的干式回收法同时脱硫脱硝技术(RESN)[2]已在中国石化中原油田分公司完成了工业侧线试验,目前正在筹备工业示范。
针对已有技术虽然工艺成熟、脱硫脱硝率稳定,但是存在易产生二次污染、设备腐蚀和工艺复杂等问题,还原法处理烟气中的SOx及NOx成为一个可选方向。烟气直接还原脱硫脱硝技术是利用还原剂将烟道气中的SOx和NOx分别选择性催化还原成单质硫和N2。该方法可采用多类催化剂,如Sn与Ti的氧化物或硫化物、Al2O3负载的过渡金属(Co,Mo,CoMo,FeMo)硫化物、稀土氧化物催化剂、钙钛矿型催化剂LaMO3(M为Cr,Mn,Fe,Co,Ni)等。按照所采用的还原剂可大致分为H2还原法、C还原法、CH4还原法、NH3还原法和CO还原法5大类。催化还原法的优势在于:①将SO2催化还原为单质硫的工艺过程不产生废气和废渣,唯一产品是单质硫;②反应过程一步完成,工艺简单,操作简便;③可同时达到脱除SO2和NOx的双重效果[3]。
CoMo、NiW和NiMo催化剂是石油化工领域常用的高效加氢催化剂,有研究表明以H2为还原剂、在无氧条件下,CoMo、NiW加氢催化剂具有良好的还原SO2[4]或NO[5]以及能够同时还原SO2和NO的性能[6-7],专利文献中也指出了NiMoAl2O3等催化剂在还原法脱除烟气中的SOx和NOx的应用[8-9]。
1 实 验
1.1 实验装置
采用连续流动式固定床实验装置,其工艺流程如图1所示。装置主要包括配气系统、反应器、硫磺收集器、冷凝器、尾气处理罐等。实验气体按需配制,经混合罐混合、预热后进入反应器,气体产物依次经过硫磺回收罐和冷凝器收集单质硫和水蒸气,尾气经处理后放空。
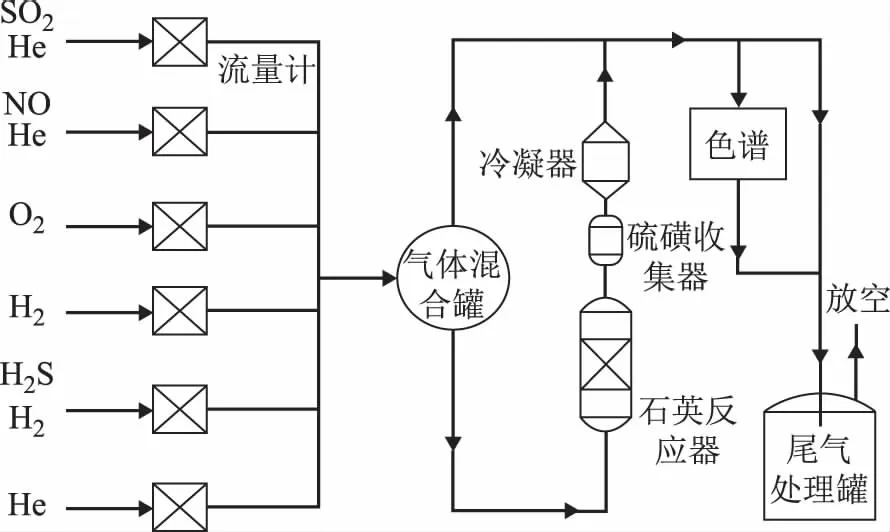
图1 连续固定床实验装置的工艺流程
1.2 实验原料
以氦气为稀释气分别配制SO2,NO,H2S,H2的标准气,4种标准气中标准物的体积分数分别为10%,10%,14%,86%。用作稀释气的氦气由北京兆格气体科技有限公司生产,纯度(φ)不低于99.999%。氧气:纯度(φ)不低于99.995%,由北京海谱北分气体工业有限公司生产。氢气:纯度(φ)不低于99.999%,由北京龙辉京城气体有限公司生产。
1.3 催化剂及预硫化方法

表1 催化剂RS-1100的主要物化性质[10]
采用干法原位方式对催化剂进行预硫化:从常温开始,以5 ℃min的速率升温至360 ℃,恒温30 min,再以2 ℃min的速率升温至400 ℃,恒温120 min,硫化结束后改用氦气吹扫反应器降到室温。
1.4 反应性能评价方法
评价采用石英材质反应器,内径为20 mm,高度为500 mm,反应器置于可控加热炉中加热。选取20~40目的催化剂,装填量为5 g,反应压力为常压。
采用Agilent 3000A气相色谱仪分析反应前后混合气体的组成。由于色谱对气体中的NOx分析不准,考虑到还原NO过程的目标产物为N2,因此着重对N2的生成率进行考察。
脱硫转化率、单质硫选择性以及产物N2生成率按下式计算:
x(SO2)=[1-F1n(SO2)F0n0(SO2)]×100%
(1)
s(S)={1-F1[n(H2S)+n(SO3)][F0n0(SO2)-F1n(SO2)]}×100%
(2)
y(N2)=[F1×2×n(N2)F0n(NO)]×100%
(3)
式中:x(SO2)为SO2转化率,%;s(S)为单质硫选择性,%;y(N2)为N2生成率,%;F1为反应后体系的体积流量,mLmin;F0为反应前体系的体积流量,mLmin;n为反应后某物质的摩尔分数;n0为反应前某物质的摩尔分数。
关于此类体系中SO3的生成问题,班志辉等[11]对含氧条件下H2催化还原SO2进行了研究,结果表明O2组分的主要作用是耗氢,而未发现有SO3的生成,因此本实验暂不计量SO3。
2 结果与讨论
H2与SO2、NO的化学反应方程式为:
SO2+2H2=S+2H2O
(4)
2NO+2H2=N2+2H2O
(5)
式(4)和式(5)所示化学反应的化学计量比是考虑原料配比时的基准性数据。
2.1 无催化剂时H2单独脱硫脱硝
在反应器入口气体组成为φ(H2)∶φ(SO2)∶φ(He)=4∶2∶94、体积流量(标准状态)为500 mLmin、温度为100~650 ℃的条件下,于无催化剂的情况下考察 SO2转化率、单质硫选择性随反应温度的变化,结果见表2。由表2可见:不使用催化剂时,SO2的转化比较困难,起始反应温度需要500 ℃,到650 ℃的高温时SO2转化率也仅有11.0%;SO2还原生成单质硫的选择性也很低,在600 ℃时仅为65%左右。
将反应气体组成调整为φ(H2)∶φ(NO)∶φ(He)=2∶2∶96,于反应温度100~600 ℃、其条件不变的情况下,考察无催化剂存在时NO还原生成N2的生成率随反应温度的变化,结果见表3。
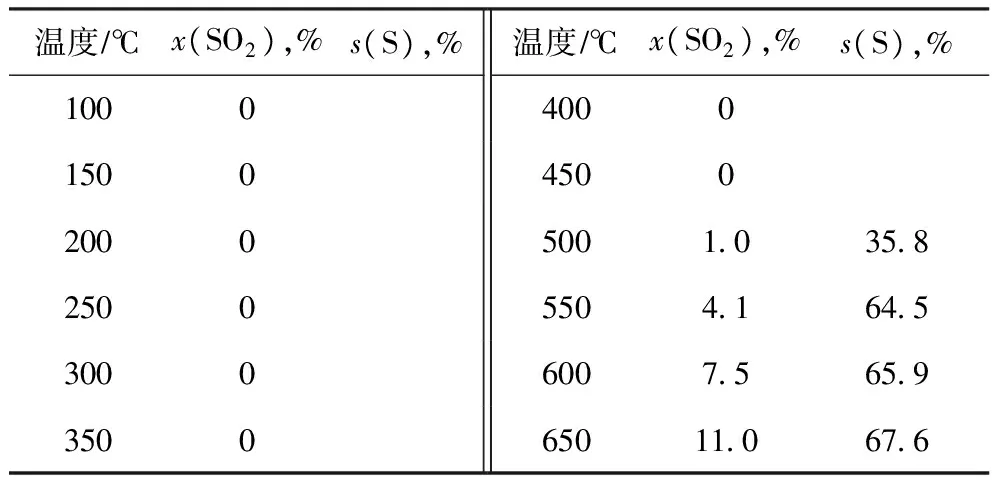
表2 无催化剂时H2还原SO2的反应性能
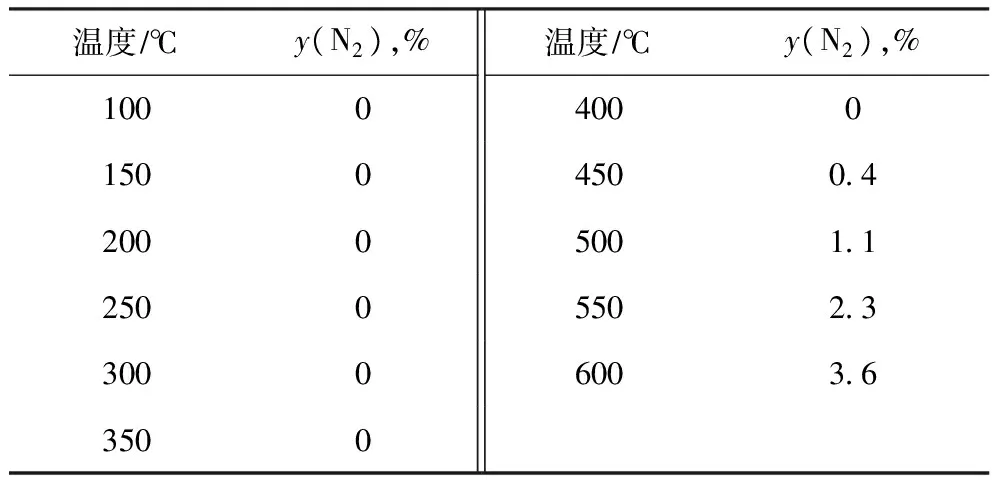
表3 无催化剂时H2还原NO的反应性能
由表3可以看出,不使用催化剂时,H2与NO按照化学计量比反应比较困难,600 ℃时NO转化为N2的生成率仅为3.6%。文献[12]报道,当H2体积分数超过NO理论耗氢量的8倍时,气相中NO完全转化的温度为450 ℃左右。
由于不使用催化剂时H2与SO2、NO按照化学计量比反应比较困难,要实现SO2、NO的完全转化,必须采用过量的H2,这会导致生成H2S,而非理想产物单质硫。因此,采用催化剂来克服反应动力学上的能垒很有必要。本文此后的研究均是在使用催化剂的条件下进行。
2.2 无氧与含氧条件下H2催化还原脱硫
由表4可见:不同于非催化脱硫反应,使用催化剂后反应(4)发生的倾向明显增强,两种气氛下SO2转化率均随反应温度的升高而增加;反应温度低于250 ℃时,含氧条件下的SO2转化率高于无氧条件下的SO2转化率;反应温度达到250 ℃之后,无氧条件下SO2的转化率高于含氧条件下的SO2转化率。
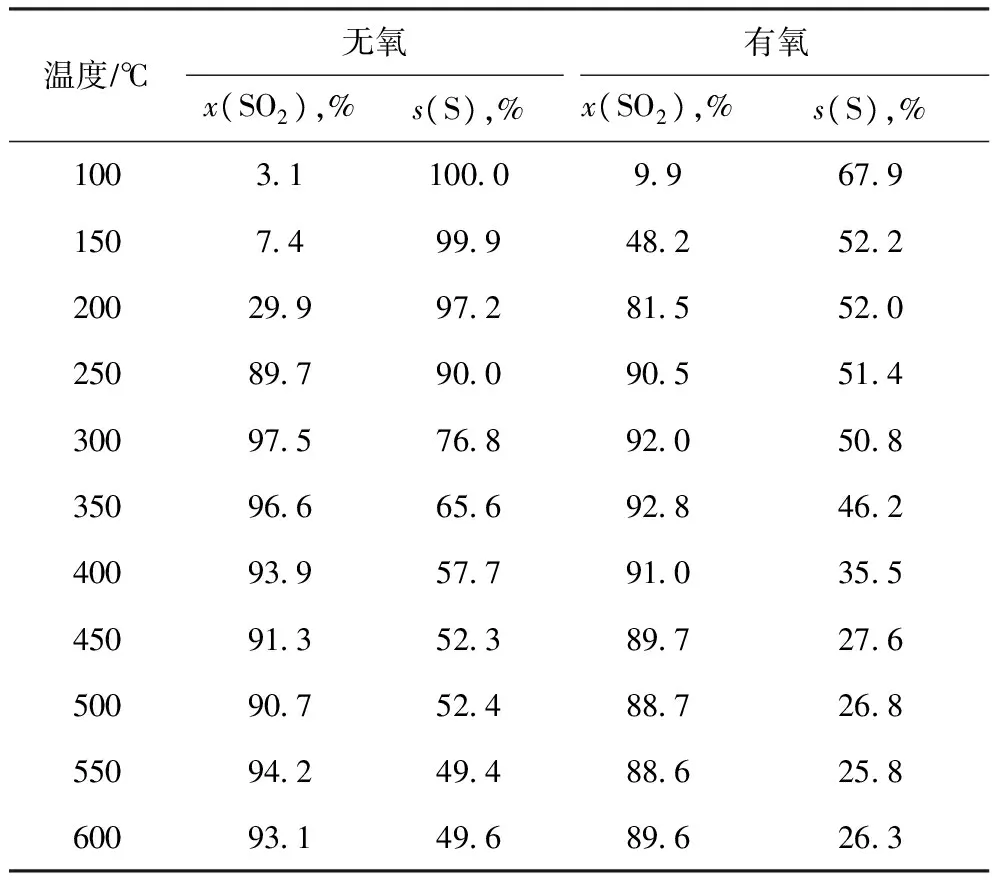
表4 无氧与有氧条件下H2脱除SO2性能对比
由表4还可以看出:两种条件下单质硫选择性均随反应温度的升高而下降;含氧条件下的单质硫选择性明显低于无氧条件下的单质硫选择性。
张登峰、利锋等[13-14]认为,使用催化剂时,H2还原SO2生成单质硫的反应由下面反应组成:
金属硫化物表面:
SO2+3H2=H2S+2H2O
(6)
Al2O3表面:
SO2+2H2S=3S+2H2O
(7)
总反应为式(4)。
通过热力学计算证明,式(6)是不可逆的吸热反应,反应温度在25~1 000 ℃的平衡常数为1×1015~1×1025。式(7)所示为Claus反应,是一个可逆的放热反应。反应温度升高,有利于式(6)所示SO2的转化,但不利于式(7)所示的Claus反应。因此随着反应温度的升高,SO2转化率增高,单质硫选择性降低。
含氧条件下进行催化还原脱硫时,H2与O2发生强放热燃烧反应,反应器内催化剂床层有较大温升(实验观察有30~50 ℃温升),加之低温下SO2转化反应对温度更敏感,所以反应温度低于250 ℃时,含氧条件下的SO2转化率高于无氧条件下的SO2转化率;当反应温度高于250 ℃时,SO2转化反应对温度不敏感,所以无氧和含氧条件下的SO2转化率比较接近;由于 H2与O2反应生成的水蒸气不利于SO2还原反应向生成单质硫的方向进行,使得含氧条件下的SO2转化率低于无氧条件下的SO2转化率。
含氧条件下,H2与O2的燃烧反应是造成单质硫选择性显著下降的主要原因。一方面,H2和O2反应放出大量的热导致催化剂床层的温升,不利于有放热效应的Claus反应的进行;另一方面,H2和O2的燃烧反应有水蒸气的生成,促进了Claus反应的逆向进行。
2.3 无氧与含氧条件下H2催化还原脱硝
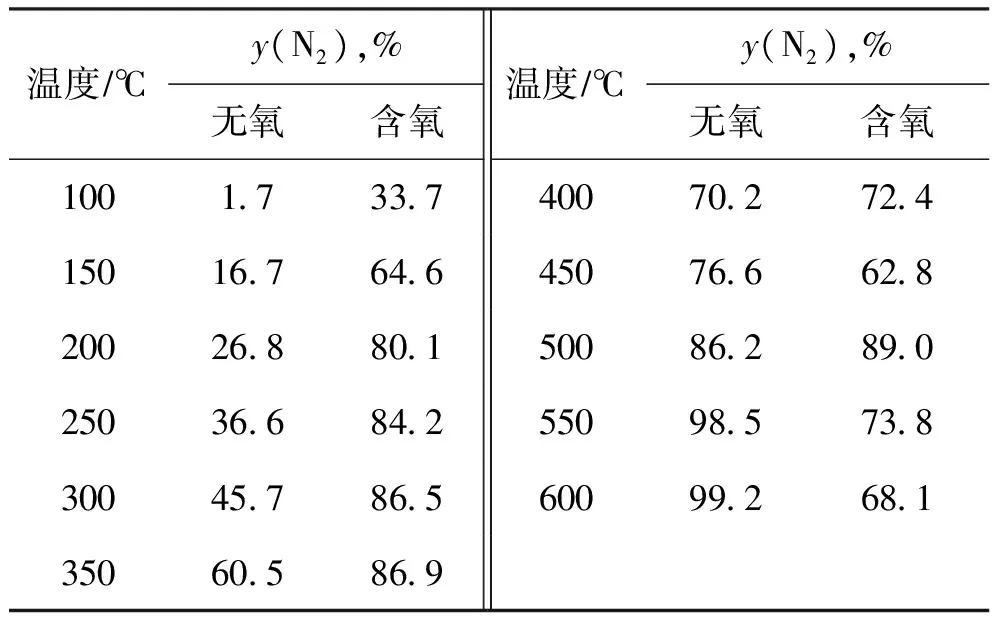
表5 不同条件下N2生成率随反应温度的变化
由表5可以看出,相对非催化脱硝反应,使用催化剂后反应(5)发生的倾向明显增强,说明经过预硫化后的NiMo加氢催化剂具有了良好的脱硝性能。由表5还可以看出,无氧条件下N2生成率随着温度的升高而增加,含氧条件下N2生成率随着温度的升高而高低波动。
朱鹏等[6]认为预硫化后的加氢催化剂中生成了金属硫化物,金属硫化物中的晶格硫构成了加氢脱硝反应的活性中心,因而使用催化剂后显著促进了反应(5)的进行。
造成无氧和含氧条件下NO还原反应的N2生成率差别比较大的原因,有如下几个方面:①含氧条件下,H2与O2燃烧反应导致催化剂床层温升,使得低温时含氧条件下催化还原脱硝的N2生成率较高;②无氧和含氧条件下催化还原脱硝时,催化剂表面的硫化物都会被氧化,造成晶格硫的流失,但无氧条件下晶格硫流失速率慢,少量晶格硫的流失对反应活性没有造成影响,而含氧条件下晶格硫流失速率相对较快,随着反应的进行,高温时N2生成率快速减小;③含氧条件下催化还原脱硝时,O2的存在导致晶格硫的大量流失以及催化剂表面较多硫酸盐的生成,反应温度高于450 ℃时,催化剂表面硫酸盐被H2还原分解使得脱硝活性升高。
2.4 无氧与含氧条件下H2同时催化还原脱硫脱硝
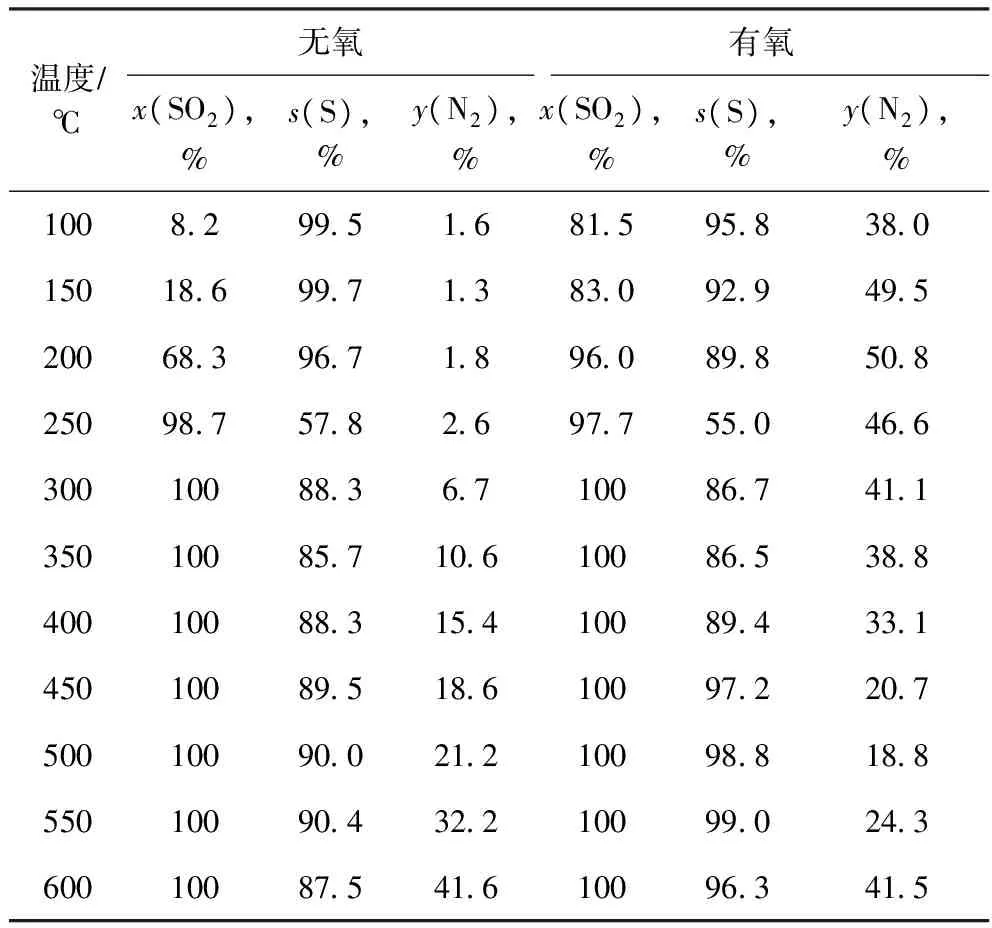
表6 不同条件下H2同时催化还原脱硫脱硝结果
由表6可见:两种条件下同时催化脱硫脱硝的反应中,SO2转化率随反应温度升高而增加,直至达到100%;生成单质硫的选择性和N2的生成率随着反应温度的升高而上下波动。

同时脱硫脱硝过程中单质硫选择性随反应温度的升高呈现先减小后增大、最后趋于稳定的变化规律。反应温度升高,单质硫选择性增大,很可能是由于高温下NO分解产生的催化剂表面吸附的氧Oad与生成的H2S进一步反应生成了单质S所致[6],反应式为:

(8)
因此也正是由于NO产生的协助作用,单质硫选择性随之增大。
反应温度高于400 ℃时,含氧条件下的单质硫选择性大于无氧条件下的单质硫选择性,是因为含氧条件下的催化剂床层温度高于无氧条件,这更有利于NO的解离,解离生成的Oad与O2都能与H2S反应生成单质硫,从而提高了单质硫的选择性。
尽管同时脱硫脱硝反应时,N2生成率仍然随着温度升高而增加,但远低于单独脱硝时,这说明SO2的存在对于NO的脱除是不利的。SO2和NO具有共同的吸附活性位,即金属原子的阴离子空位。朱鹏等[16]研究SO2和NO在硫化型CoMoAl2O3上的共吸附行为时,发现NO的存在对SO2的吸附没有抑制作用,而SO2的存在对NO吸附有很强的抑制作用。同时NO的存在能促进SO2在催化剂L碱位上吸附氧化生成硫酸盐,而实验中发现催化剂表面硫酸盐的存在对NO还原反应是不利的。
气氛的差异,使得同时催化脱硫脱硝过程中N2的生成率随温度的变化有很大差别;无氧条件下,N2的生成率随反应温度的升高缓慢增加。含氧条件下,反应温度低于500 ℃时,N2的生成率随反应温度升高先增大后减小,这是催化剂表面硫酸盐的生成所致;反应温度高于500 ℃时,N2的生成率随反应温度的升高而增大,推断此时催化剂表面的硫酸盐被H2还原分解,使得NO还原反应活性提高,NO转化为N2的几率增加。
整体而言,用H2同时脱硫脱硝时,含氧条件下的N2生成率大于无氧条件下的N2生成率,主要因为含氧气氛下H2与O2反应放出的热造成催化剂床层的温升,反应温度在脱硝过程中占主导作用。
2.5 同时脱硫脱硝反应前后催化剂表面物相分析
采用XRD对催化剂表面物相进行分析表征。图2给出了NiMoAl2O3催化剂在预硫化前、预硫化后、无氧条件下同时脱硫脱硝反应后以及含氧条件下同时脱硫脱硝反应后4个阶段的XRD图谱。

图2 不同阶段NiMoAl2O3加氢催化剂的XRD图谱 A—预硫化前; B—预硫化后; C—无氧同时脱硫脱硝反应后; D—含氧同时脱硫脱硝反应后。 ●—Al2O3; □—MoS2
由图2还可以看出,无氧和含氧条件下同时脱硫脱硝反应后催化剂的MoS2衍射峰强度都有所增强,表明在无氧和含氧条件下催化剂的硫化程度都有所提高。
在无氧和含氧条件下同时脱硫脱硝过程中,NO的存在导致催化剂表面晶格硫的流失,但同时反应过程中生成的大量单质硫可对催化剂表面晶格硫进行不断的补充。在流失和补充的动态平衡中,催化剂活性得以维持,最终催化剂表面的活性硫化物被进一步硫化,催化剂的硫化程度得到提高。这些结果从一个侧面支持了此前对不同气氛中NiMo催化剂同时脱硫脱硝结果的解释。
3 结 论
(1)单独脱硫时,随反应温度的升高,SO2转化率增高,单质硫选择性降低,其中含氧条件下的单质硫选择性明显低于无氧条件下的单质硫选择性。
(2)单独脱硝时,无氧条件下N2生成率随反应温度升高而增高,含氧条件下N2生成率随反应温度升高而上下波动。
(3)同时催化脱硫脱硝时,随反应温度的升高,SO2转化率增加,直至达到100%;单质硫的选择性先降低后增高。无氧条件下的N2生成率随反应温度的升高而增高;含氧条件下N2生成率随反应温度的升高而高低波动。含氧条件下同时脱硫脱硝时的SO2转化率、单质硫选择性、N2生成率整体优于无氧条件下同时脱硫脱硝时的结果。
(4)同时催化脱硫脱硝时的SO2转化率、单质硫选择均高于单独脱硫和脱硝时的数值,但N2生成率低于单独脱硝时的数值。
致谢:感谢中国石化石油化工科学研究院王锦业、陈西岩、王晓刚同志对本课题的协助和支持!
[1] 刘峰,陈庆岭.FCC再生烟气脱硫脱氮技术进展[J].化工中间体,2009(8):24-30
[2] 郭大为,张久顺,龙军,等.脱除烟气中硫氧化物和或氮氧化物的方法及烃油裂化方法:中国,CN101209391[P].2011-06-15
[3] 梁勇,马智,潘志爽.催化还原烟气中SO2到单质硫的研究进展[J].工业催化,2007,15(5):55-59
[4] Paik S C,Chung J S.Selective catalytic reduction of sulfur dioxide with hydrogen to elemental sulfur over Co-MoAl2O3[J].Applied Catalysis B:Environmental,1995,5(3):233-243
[5] 彭江杰,张文华,马运生,等.硫化CoMoAl2O3催化剂上H2同时催化还原SO2和NO的研究:Ⅰ.H2还原NO反应[J].催化学报,2002,23(3):262-266
[6] 朱鹏,李雪辉,王芙蓉,等.硫化CoMoAl2O3催化剂上H2同时催化还原SO2和NO:Ⅰ.催化剂的制备、表征及性能[J].无机化学学报,2008,24(11):1837-1845
[7] 朱鹏,李雪辉,徐建昌,等.硫化NiWAl2O3催化剂上H2同时催化还原SO2和NO: Ⅱ.SO2和NO的同时还原[J].催化学报,2005,26(10):905-910
[8] 郭大为,张久顺,毛安国,等.同时脱除烟气中硫氧化物、氮氧化物和一氧化碳的方法:中国,CN102895873A[P].2014-10-29
[9] 郭大为,张久顺,毛安国,等.一种脱除催化裂化再生烟气中的硫氧化物、氮氧化物的方法:中国,CN102895872A[P].2014-12-03
[10] 徐艳龙,艾中秋.RS-1100催化剂在柴油加氢装置上的工业应用[J].石油炼制与化工,2013,44(10):49-52
[11] 班志辉,王树东,吴迪镛.在RuAl2O3催化剂上用H2对SO2选择性催化还原的研究[J].环境污染治理技术与设备,2001,2(3):36-43
[12] 郭大为,李倩,陈西岩,等.烟气脱硫、脱氮吸附剂再生过程的考察[J].石油炼制与化工,2012,43(2):9-14
[13] 张登峰.烟气同时脱硫脱氮技术[J].环境科学与管理,2007,32(7):110-114
[14] 利锋.电子束照射法脱硫脱氮技术工艺[J].环境保护科学,2004,30(3):4-6
[15] Lowell P S,Schwitzgebel K,Parsons T B,et al.Selection of metal oxides for removing SO2from flue gas[J].Ind Eng Chem Process Des Dev,1971,10(3):384-390
[16] 朱鹏,李雪辉,王芙蓉,等.硫化CoMoAl2O3催化剂上H2同时催化还原SO2和NO:Ⅱ.催化反应活性相及机理探讨[J].无机化学学报,2008,24(12):1975-1982
[17] 辛勤,罗孟飞.现代催化研究方法[M].北京:科学出版社,2009:201

