柠檬酸对小鼠卵泡组织形态的影响
邓 雯,吕琼霞,刘玉梅,陈晓光,马彦博
(河南科技大学 动物科技学院,河南 洛阳 471003)
柠檬酸作为畜禽的饲料酸味剂和促生长剂,虽然能够提高畜禽胃肠酶活性,促进钙、磷和蛋白质的消化,促进猪或肉鸡的生长[1-3],降低料肉比[1,4],有利于猪的早期断奶[5]。但是,过多的外源性柠檬酸摄取也会给动物带来不利的影响。研究表明,小鼠口服每千克体重1~2 g柠檬酸能够降低脂多糖诱导的氧化应激,减少脑组织脂质过氧化和炎症,以及肝脏损伤和DNA的断裂,每千克体重口服4 g柠檬酸时,肝脏细胞的损伤作用及DNA的断裂加强[6];另有研究显示,小鼠体内过多的柠檬酸会致肝脏细胞胞质空泡化、细胞核膜内陷和肝细胞坏死,细胞间胶原纤维增生[7];大鼠每千克体重饲喂1.250 g柠檬酸,会致肾小球增生及肾小管上皮细胞粗颗粒变性[8]。肉鸡日粮中添加12.5~50 g/kg柠檬酸时,肝脏等组织细胞有明显损伤[9],家兔长时间采食添加柠檬酸(约5%)的日粮,睾丸管周会产生少量纤维化,间质轻微玻璃样变性[10]。体外研究表明,重组中国仓鼠卵巢细胞(CHO)批量培养过程中,柠檬酸明显抑制CHO的生长,阻碍细胞DNA的合成,使更多细胞发育阻滞在G1期,从而抑制细胞增殖[11]。在体情况下,柠檬酸对动物卵巢结构和卵泡发育的影响未见报道。本研究通过对小鼠进行腹腔注射柠檬酸,观察柠檬酸对卵泡的发育和卵巢组织学形态结构的变化,探索性研究柠檬酸对雌性动物生殖性能的影响,为养殖业柠檬酸的使用提供参考。
1 材料与方法
1.1 试验材料
试验用雌性小鼠为昆明系清洁级, 购自河南科技大学医学院。柠檬酸(AR,成都科龙化工试剂厂);氯化钠(AR,洛阳市化学试剂厂);10%的中性福尔马林溶液、无水乙醇、二甲苯(AR,莱阳市双双化工有限公司); 液体石蜡(CP,北京化学试剂三厂);HE染液(上海沪峰化工有限公司);切片石蜡、蛋白甘油、中性树胶(上海标本模型厂),CX-31型数码显微镜(Olympus公司)。
1.2 试验方法
1.2.1 动物分组及切片制作 将20~22 g小鼠60只,随机分为4组,每组15只。分别为对照组和柠檬酸处理组。各组每天每只小鼠分别腹腔注射0.2 mL的0.9%生理盐水或7.5 mg/mL、15 mg/mL、30 mg/mL柠檬酸(1/12,1/6,1/3 LD50)。
在第21天,每组分别取10只小鼠处死,摘取卵巢浸泡于4%的甲醛溶液中固定24 h,制作常规石蜡切片。采用苏木精伊红染色(HE)。用数码显微镜系统观察组织切片的形态学特征,并拍摄样片。
1.2.2 观察的指标 本研究卵泡发育阶段的分类方法参考已有文献[17]。原始卵泡定义为:卵母细胞周围有一层扁平卵泡细胞的卵泡。初级卵泡定义为:卵泡直径为20 μm左右,卵母细胞周围有一层立方细胞或多数为立方、少量扁平卵泡细胞的卵泡。次级卵泡定义为:卵泡直径为50 μm左右,卵母细胞周围有多于一层立方卵泡细胞的无腔卵泡。有腔卵泡包括:早期有腔卵泡,颗粒细胞层局部开始出现腔隙的卵泡。有腔卵泡,颗粒细胞层出现清晰腔隙的卵泡。排卵前卵泡(成熟卵泡),卵泡直径=200 μm,卵母细胞周围围绕有许多卵丘颗粒细胞的卵泡。随机选取不同柠檬酸剂量处理组21 d的卵巢切片5张,观察所有不同阶段的卵泡形态学变化,选取典型病变拍照。
2 结 果
2.1 各种卵泡的细胞形态显微结构特征
2.1.1 原始卵泡 由图1可见,对照组大多数原始卵泡位于卵巢皮质浅层,原始卵泡数量较多,单个或三两成群地分布在靠近白膜的皮质浅层,分布不均匀,由一层扁平的卵泡细胞和一个未分化卵母细胞组成。卵泡细胞染色深,紧贴卵母细胞,细胞核大而圆,核内异染色质少,核仁大而明显。见图1a小箭头所示。
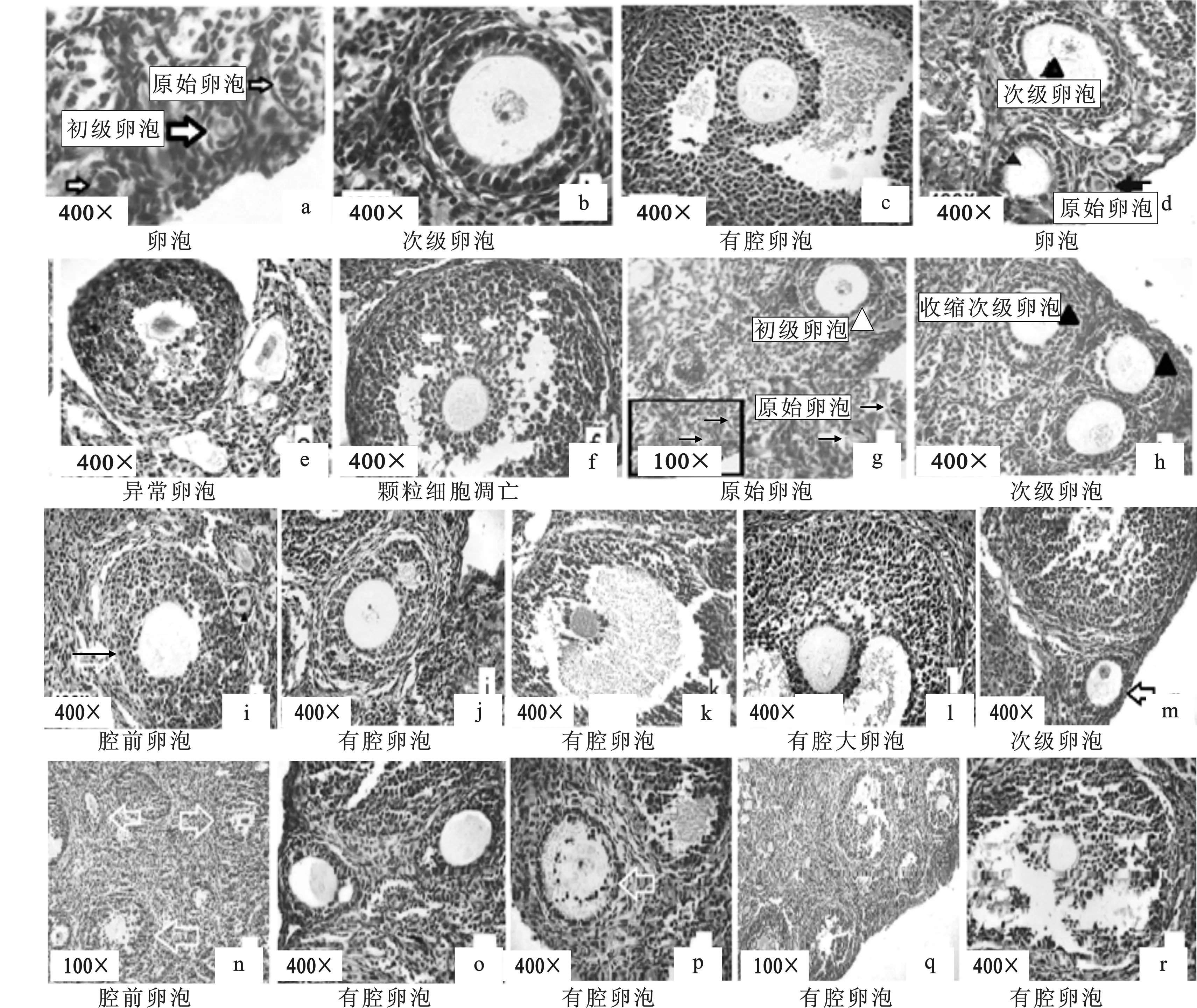
图1 柠檬酸对卵巢不同类型发育卵泡形态的影响a-c.对照组;d-f. 低剂量柠檬酸组;g-l.中剂量柠檬酸组;m-r.高剂量柠檬酸组Fig. 1 The influence of citric acid on morphological changes in different types of ovarian folliculara-c. control;d-f. low dose citric acid group;g-l. medium dose citric acid group;m-r. high dose citric acid group
2.1.2 初级卵泡 多位于皮质浅部,由单层柱状或单层立方卵泡细胞包围。卵母细胞体积有所增大,卵泡外围开始形成结缔组织的卵泡膜,透明带开始形成但很薄、且不完整。见图1a大箭头所示。
2.1.3 次级卵泡 随着卵泡的发育卵泡膜明显增厚、分化形成内膜细胞及外膜细胞两层。卵母细胞迅速增大,完整的透明带形成,位于卵泡内壁上的卵泡细胞变成立方或柱状后迅速增殖、密集排列成2~3 层以上的颗粒细胞层,颗粒细胞间虽有空隙,但未出现明显的卵泡腔(图1b)。
2.1.4 有腔卵泡 随着卵泡腔逐渐扩大,卵母细胞包围在一团颗粒细胞中,被挤向一边形成卵丘。卵母细胞圆形、核大而圆,核仁清晰可见;透明带增厚,染色后呈深红色;颗粒细胞层数在4层以上、排列紧密,分其泌的液体使颗粒细胞之间分离,形成不规则的卵泡腔(图1c)。卵丘细胞和卵母细胞间有细胞缝隙连接,可以传递各种细胞因子和信号,调节卵母细胞的减数分裂和成熟等过程。
2.1.5 卵泡膜 发育良好的卵泡,卵泡内膜和外膜清晰、完整,有较多的血管存在,外膜细胞呈长梭形,内膜细胞为圆形细胞或梭形,排列紧密,颗粒细胞发育良好,排列紧密(图2a)。发育不良的卵泡,卵泡膜变薄、血管数量减少,内膜与颗粒层细胞无明显分界、细胞数量减少、排列松散(图2b)箭头所示。
2.2 柠檬酸对卵泡中各类细胞形态显微结构的影响
2.2.1 柠檬酸对原始卵泡和初级卵泡细胞形态的影响 柠檬酸低剂量组原始卵泡、初级卵泡发育正常(图1d)箭头所示;中剂量组原始卵泡、初级卵泡细胞形态发育正常(图1g);高剂量组小鼠的卵巢中较难观察到原始卵泡和初级卵泡。
2.2.2 柠檬酸对次级卵泡细胞形态的影响 柠檬酸低剂量组大多数次级卵泡多发育基本正常,个别卵母细胞略有收缩、呈现退化倾向(图1d)▲所示。中剂量组次级卵泡异常发育的数量增加,但形态变化不一。卵泡内外膜细胞分化正常、卵泡膜清晰、完整,卵泡的颗粒细胞发育正常,颗粒细胞局部细胞间呈现裂隙时,卵母细胞发育均正常(图1j);卵泡膜界限清晰、完整,但卵泡内膜细胞分化较弱、细胞数量较少,卵泡层可见少量血管,此种卵泡虽然颗粒细胞发育及形态虽然正常,颗粒层细胞层数即使多至7~9层以上时颗粒层仍难见有细胞空隙出现,更无清晰的卵泡腔形成,但卵母细胞发育正常(图1i、图2e);卵泡膜仅有外层卵泡膜细胞,卵泡内膜细胞未分化形成,卵泡颗粒细胞数量减少、排列松散时,卵泡卵母细胞多呈现退化消失,透明带皱缩、折叠(图2f)△所示;含2~3层颗粒细胞的卵泡发育异常时,多表现为卵母细胞局部与颗粒层细胞分离,且退化、缩小(图1h)。高剂量组偶见发育正常的小次级卵泡(图1m),所有较大的次级卵泡多表现为不同的闭锁状态。
2.2.3 柠檬酸对有腔卵泡细胞形态的影响 柠檬酸低剂量组有较多的小的有腔卵泡发育不正常,卵母细胞退化,卵丘细胞数量减少或消失,卵丘基部有较多的颗粒细胞凋亡(图1e);卵母细胞发育基本正常的大有腔卵泡,卵泡膜内含有较多的血管,内膜和外膜清晰、完整,内膜细胞排列紧密、但圆形细胞数量减少,梭形细胞数量增加。此种卵泡的颗粒细胞排列虽紧密,但卵泡腔侧颗粒细胞及卵泡细胞的基膜部分呈现断裂现象,部分颗粒细胞脱落入卵泡腔,卵丘基部有颗粒细胞凋亡(图1f、图2c);发育不正常的有腔卵泡,卵丘颗粒细胞排列松散,部分颗粒细胞脱落,卵母细胞退化、变形,卵泡膜细胞层退化、变薄,内膜细胞基本消失,卵泡膜层难见血管存在(图2d)。中剂量组发育基本正常的卵泡,若卵泡膜清晰、完整,但卵泡膜内膜细胞数量和卵丘基部颗粒细胞数量减少、细胞排列松散时,卵母细胞形态异于正常的圆形,多呈现轻微变形或出现退化趋势(图1l);大的有腔卵泡如果卵泡膜内层细胞显著退化、数量减少,卵泡膜层变薄、不完整,与结缔组织和颗粒细胞的界限不清晰,卵泡膜层内无血管存在,卵丘细胞数量及层数减少或消失,颗粒细胞排列松散,则卵母细胞退化较早(从壁层颗粒细胞层数判断)、且退化明显(图1k);较多的有腔卵泡主要表现为卵泡膜不完整、界限不清,或卵泡膜内膜细胞和卵丘细胞退化消失,而壁层颗粒细胞卵泡腔侧可见大量核浓集的凋亡颗粒细胞,卵母细胞则已退化消失(图2f)☆所示卵泡。高剂量组有腔卵泡的形态学改变多表现为不同的闭锁状态。闭锁的卵泡多表现为:透明带皱缩,卵母细胞退化、变形或消失,卵泡膜内膜细胞数量减少、或转化为梭形细胞,内膜细胞间及卵泡膜外膜与卵泡周围结缔组织连接减弱,组织切片制作时易出现裂隙;颗粒细胞排列松散或分离,卵泡腔基膜断裂,部分卵泡细胞、颗粒细胞脱落入卵泡腔(图1n-r、图2g、图2h)。
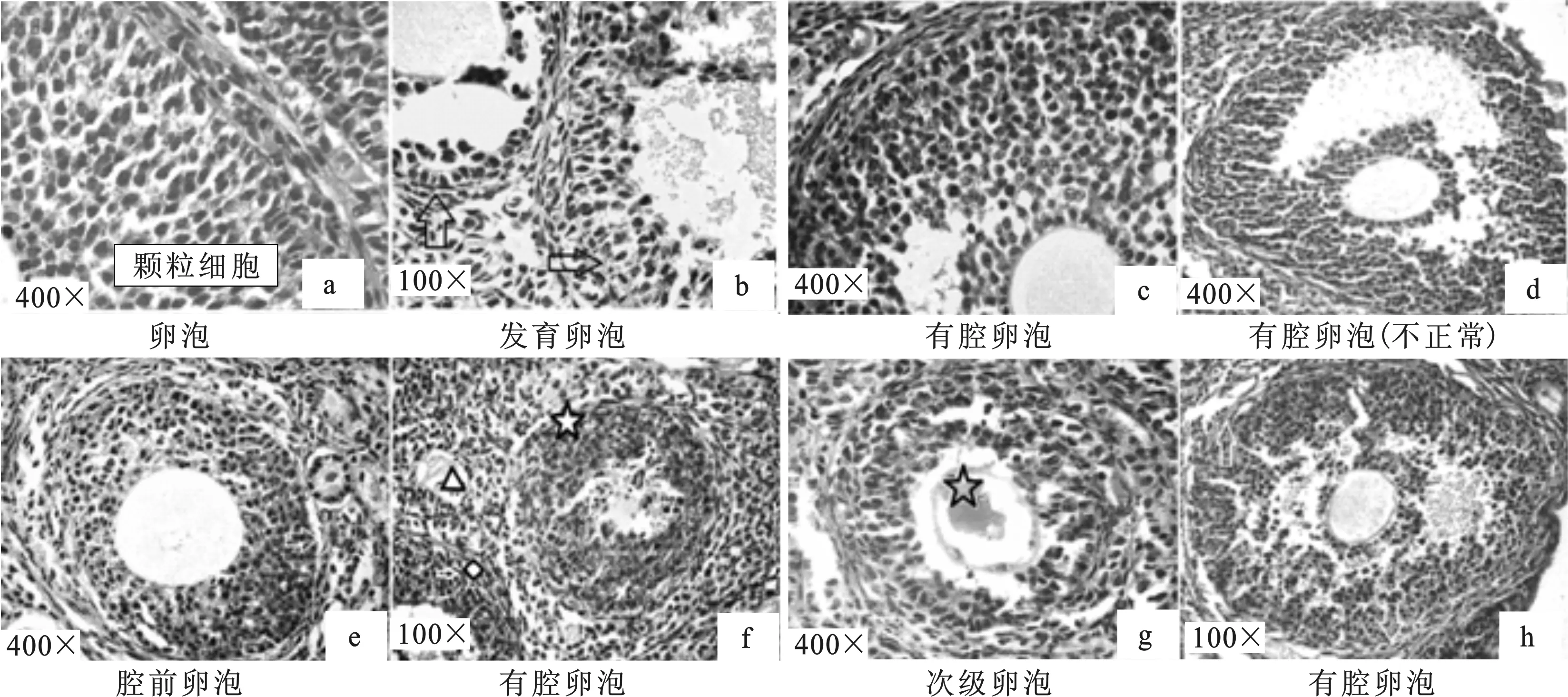
图2 柠檬酸对卵巢内卵泡膜细胞及颗粒细胞形态的影响a-b. 对照组;c-d. 低剂量柠檬酸组;e-f.中剂量柠檬酸组;g-h. 高剂量柠檬酸组Fig. 2 The influence of citric acid on morphological changes in ovarian theca cells and granular cellsa-c. control;d-f. low dose citric acid group;g-l. medium dose citric acid group;m-r. high dose citric acid group
3 讨 论
卵泡中的卵泡膜细胞、颗粒细胞和卵母细胞的功能及其相互作用与甾体激素合成、卵泡发育与闭锁密切相关。早期的卵泡发育与卵母细胞、颗粒细胞和卵泡膜细胞紧密相关[12]。在初级卵泡发育的过程中,卵母细胞和颗粒细胞间的间隙连接形成,有利于细胞间的营养成分、离子和信号传导分子等进行交换[13]。次级卵泡中的卵母细胞与颗粒细胞间隙连接处存在的间隙连结蛋白(connexin37)在卵母细胞的分裂和颗粒细胞的增殖调控中具有重要作用。缺乏connexin37的小鼠卵泡虽然卵母细胞、透明带和颗粒细胞形态都正常,但卵母细胞既不能成熟分裂,也不能调控颗粒细胞促黄体素受体、类固醇激素的合成,以及颗粒细胞的分裂增殖[13]。
卵泡膜功能性膜细胞层的形成是卵泡早期发育的生理学过程[14],源于颗粒细胞的信号物质可以促进卵泡基膜细胞向膜细胞的分化,并促进卵巢皮质的基膜细胞获得对LH的应答能力,从而促进卵泡的发育[15]。当膜细胞与颗粒细胞共培养时,膜细胞且具有合成雄激素的活性;当膜细胞单独培养时,雄激素生成量减少[16]。随着次级卵泡的发育开始分化出卵泡膜的内、外两层膜细胞,卵泡膜细胞层发生血管化,这些血管通过基底膜为颗粒细胞和卵母细胞提供营养和血液中卵巢调控因子,卵泡内膜细胞分泌的雄激素以旁分泌的形式扩散至颗粒细胞间,在卵泡发育和卵泡的闭锁调控中具有重要作用[17]。颗粒细胞能产生芳香化酶,催化雄激素转化为雌激素促进颗粒细胞的有丝分裂和卵泡的生长,且能产生多种生长因子调节促性腺激素对卵泡的作用[15]。只有雌激素量合成高、FSH受体多的优势卵泡才能发育为成熟卵泡,而其余雌激素合成量低、FSH受体数少的卵泡趋向闭锁[18]。卵泡闭锁是通过细胞凋亡方式实现的,细胞凋亡发生于卵泡发育的每个阶段,在早期闭锁的卵泡中发现,凋亡细胞首先出现于颗粒细胞,随绝大部分颗粒细胞凋亡整个卵泡发生闭锁[19]。
在柠檬酸对卵泡中各类细胞形态的影响中,颗粒细胞或卵母细胞产生的诸多形态异常时,均伴随有卵泡膜层的形态异常。卵泡内膜细胞分化阻滞和卵泡膜层血管形成的抑制,可能是柠檬酸造成次级卵泡发育及其内所含的各类细胞形态异常的主要原因;而有腔卵泡中颗粒细胞的形态异常或凋亡的发生,以及卵母细胞结构的退化或消失,可能主要源于卵泡内膜细胞的退化和卵泡膜层血管的消失。研究表明,柠檬酸不但能够抑制间期细胞DNA的复制,使更多的细胞捕获在G1或G2期,造成细胞的分裂增殖抑制[11-20],还能够降低小鼠肝脏、肾脏、睾丸组织细胞抗氧化酶GSH-Px和T-SOD活性,增加组织细胞的氧化应激,造成细胞的氧化损伤,导致不同组织细胞的形态学改变[21-23],并且诱导肾脏[21]、肝脏[22]、睾丸细胞[24]及癌细胞凋亡[25-26]。此外还能够显著抑制血管生成,减少血管分支,使小血管变短[27]。因此,柠檬酸对卵泡发育和卵泡各类细胞形态的影响机制概括而言可能有如下几个方面。首先,通过影响细胞分裂周期导致卵泡内各类细胞的分裂增殖抑制;其次,通过影响体内氧化与抗氧化系统酶的活性,导致卵泡内各类细胞的氧化损伤;第三,通过凋亡机制导致卵泡内各类细胞的形态改变,最终导致细胞功能和结构的退化,直至消失;第四,由于卵泡内膜细胞的退化及卵泡膜层血管的消失,导致卵泡内各类细胞的营养供应障碍和激素调控减弱或失衡。
4 结 论
研究结果表明,小鼠在低、中剂量柠檬酸暴露下对卵巢原始卵泡和初级卵泡的影响较小。低剂量柠檬酸主要导致有腔卵泡的各类细胞组织形态异常;中剂量柠檬酸主要影响次级卵泡和有腔卵泡发育与细胞组织形态结构;高剂量柠檬酸能够导致所有类型的卵泡产生闭锁。
[1] SURYANARAYANA M,SURESH J,Rajasekhar M.A study on the associated effect of probiotic and citric acid on the performance of pre-weaned piglets[J].Tamilnadu J.Veterinary & Animal Sciences, 2012,8(3):126-130.
[2] KHODAMBASHI E N,ZAFARI NAEINI S, RUIZ-FERIA C A.Growth performance, digestibility, immune response and intestinal morphology of male broilers fed phosphorus deficient diets supplemented with microbial phytase and organic acids[J].Livestock Science, 2013,157(2-3):506-513.
[3] BOLING S D,WEBEL D M,MAVROMICHALIS I,et al.The effects of citric acid on phytate-phosphorus utilization in young chicks and pigs[J].Journal of Animal Science, 2000,78(3):682-689.
[4] DEHGHANI-TAFTI N, JAHANIAN R.Effect of supplemental organic acids on performance, carcass characteristics, and serum biochemical metabolites in broilers fed diets containing different crude protein levels[J]. Animal Feed Science and Technology,2016,211:109-116.
[5] LIU S T,HOU W X,CHENG S Y,et al.Effects of dietary citric acid on performance, digestibility of calcium and phosphorus, milk composition and immunoglobulin in sows during late gestation and lactation[J].Animal Feed Science and Technology, 2014,191:67-75.
[6] ABDEL-SALAM O M,YOUNESS E R,MOHAMED N A,et al.Citric acid effects on brain and liver oxidative stress in lipopolysaccharide-treated mice[J].Journal of Medicinal Food,2014,17(5):588-98.
[8] ABD-AlGADIR M I,IHAIMER M M,SABAH-ELKHIER M K,et al.Effect of benzoic acid and combination of benzoic with citric acid as food additives on the renal function of experimental rats[J].Asian Journal of Clinical Nutrition,2009,1(2):83-87.
[10] PACKMAN E W, ABBOTT D D, HARRISSON J W E.Comparative subacute toxicity for rabbits of citric, fumaric and tartaric acids[J].Toxicology and Applied Pharmacology,1963,5(2):163-167.
[11] 黄剑峰,张元兴,张立.柠檬酸对CHO细胞生长和代谢的影响[J].华东理工大学学报(自然科学版),2006, 32(5):556-560.
[12] ORISAKA M,TAJIMA K,TSANG B K,et al.Oocyte-granulosa-theca cell interactions during preantral follicular development[J].Journal of Ovarian Research, 2009,2 (1):1-7.
[13] SIMON A M, GOODENOUGH D A,Li,et al.Female infertileity in mice lacking connexin37[J].Nature,1997,385(6616):525-529.
[14] MAGOFFIN D A.Ovarian theca cell[J].International Journal of Biochemistry & Cell Biology, 2005, 37 (7):1 344-1 349.
[15] ORISAKA M, MIZUTANI T,TAJIMA K,et al.Effects of ovarian theca cells on granulosa cell differentiation during gonadotropin-independent follicular growth in cattle[J].Molecular Reproduction & Development,2006,73(6):737-744.
[16] KOTSUJI F,KAMITANI N,GOTO K,et a1.Bovine theca and granulose cell interactions modulate their growth,morphology,and function[J].Biology of Reproduction,1990,43(5):726-732.
[17] WANG H,ANDOH K,HAGIWARA H,et al.Effect of adrenal and ovarian androgens on type 4 follicles unresponsive to FSH in immature mice[J].Endocrinology,2001,142 (11) :4 930-4 936.
[18] MIRO F,SMYTH C D,HILLIER S G.Development-related effects of recombinant activating steroid synthesis in rat granulose cells [J].Endocrinology,1991,129(6):3 388-3 394.
[19] MATSUDA-MINEHATA F, INOUE N,GOTO Y, et al.The regulation of ovarian granulosa cell death by pro- and anti-apoptotic molecules [J].Journal of Reproduction and Development, 2006,52(6): 695-705.
[20] YING T H, CHEN C W, HSIAO Y P,et al.Citric Acid Induces Cell-cycle Arrest and Apoptosis of Human Immortalized Keratinocyte Cell Line (HaCaT) via Caspase-and Mitochondrial-dependent Signaling Pathways[J]. Anticaner research,2013,33(10):4 411-4 420.
[21] CHEN X G,LV Q X,LIU Y M,et al.Effects of the food additive, citric acid, on kidney cells of mice[J]. Biotechnic & Histochemistry, 2015, 90(1): 38-44.
[22] CHEN X G,LV Q X,LIU Y M,et al.Study on injury effect of food additive citric acid on liver tissue in mice[J]. Cytotechnology,2014,66(2):2 752-2 782.
[23] 张鹏飞,吕琼霞,刘玉梅,等.柠檬酸对小鼠睾丸组织抗氧化酶活性的影响[J].动物医学进展,2012,33(8):115-118.
[24] CHEN X G,DENG W,LIU Y M,et al.Study of antagonism of citric acid on aluminum-induced toxicity in mice testis cells[J]. Molecular & Cellular Toxicology,2014,10 (4):443-450.
[25] XIONG Y , JIANG W,SHEN Y,et al. A Poly(gamma, L-glutamic acid)-citric acid based nanoconjugate for cisplatin delivery[J].Biomaterials,2012,33(29):7 182-7 193.
[26] WANG T A,ZHANG X D,GUO X Y.3-Bromopyruvate and sodium citrate target glycolysis, suppress survivin, and induce mitochondrial-mediated apoptosis in gastric cancer cells and inhibit gastric orthotopic transplantation tumor growth[J].Oncology Reports,2016,35(3):1 287-1 296.
[27] El SAYED S M,ABOU EI-MAGD R. M,SHISHIDO Y,et al.D-Amino acid oxidase-induced oxidative stress, 3-bromopyruvate and citrate inhibit angiogenesis, exhibiting potent anticancer effects[J].Journal of Bioenergetics & Biomembranes,2012,44(5):513-523.

