2种预处理对玉米组织全蛋白质双向电泳图谱的影响
安素妨,侯锦娜,王 艳,鲁丹丹,李保全(河南省农业科学院 作物设计中心,河南 郑州 450002)
随着拟南芥、水稻[1]等植物全基因组测序的完成,蛋白质组学成为了后基因组时代的重要领域。由O’Farrell[2]创立的双向电泳(two-dimensional electrophoresis,2-DE)是蛋白质组学研究的核心技术之一,已广泛应用于植物、动物、微生物等蛋白质组学的研究。双向电泳技术步骤较复杂,有很多因素如上样量、聚焦时间、pH胶条的选择、样品的制备等,均会影响双向电泳图谱的效果[2],其中样品的制备尤为关键,因为植物组织富含的蛋白酶、色素、酚类、多糖、脂类等物质均会严重干扰蛋白质的提取、分离,导致双向电泳的结果不清晰、拖带,而且重复性得不到保证。因此,双向电泳成功的前提和关键在于建立一套高质量的、有效的、重复性高的样品制备方法,使其有效去除杂质并尽可能多地保留蛋白质。目前,常用的全蛋白质提取方法一般为三氯乙酸(TCA)/丙酮沉淀法、苯酚抽提法、Tris-HCl提取法[3-6],但尚未见对玉米组织预处理方法的对比研究报道。
玉米是我国主要的粮食作物,关于玉米组织的蛋白质组学研究越来越受到人们的重视[5,7-8]。对玉米叶片和籽粒的蛋白质组学进行研究可以深入探索与玉米产量形成及调控相关的蛋白质和基因;而玉米花粉是玉米籽粒形成的生殖器官,研究玉米花粉的蛋白质组学差异对揭示玉米受精过程具有重要意义[9]。在玉米叶片和花粉的蛋白质组学研究中,玉米组织的样品制备是关键环节。鉴于此,以玉米叶片和花粉为材料,分别采用丙酮和TCA/丙酮预处理提取全蛋白质,进行双向电泳分离,并采用PDQuest软件对电泳图谱进行对比,分析蛋白质点的数量和图谱质量的差异,以期探索出一套适用于玉米蛋白质分析的双向电泳样品预处理方法,为玉米蛋白质组学研究提供技术条件。
1 材料和方法
1.1 试验材料
挑取籽粒饱满的郑单958玉米种子,用75%乙醇消毒15 min,用去离子水冲洗3次以去除种子表面的乙醇,再用3倍于种子体积的去离子水浸泡20 h(25 ℃),均匀地摆放到培养皿里,置于培养箱中培养3 d,取其黄化叶为材料。
玉米花粉采集于河南省农业科学院原阳试验基地种植的玉米品种郑单958。
1.2 仪器和试剂
主要试剂:SDS(十二烷基磺酸钠)、TRIS(三羟甲基氨基甲烷)、尿素、硫脲、碘乙酰胺、DTT(二硫苏糖醇)、CHAPS(胆固醇氨丙基二甲基氨基丙磺酸)、Tris-饱和酚、IPG buffer、pH值4~7的IPG 11 cm干胶条、考马斯亮蓝R350、矿物油、Arc、Bis等购自GE公司,蛋白质分子质量标准购自Fermentas公司,TCA、甘氨酸等购自索莱宝公司。
主要仪器:PROTEAN IEF cell等电聚焦系统(美国Bio-Rad公司)、JY-SCZ9(JUNYI)Werk Nr离心机(GeIImany)、紫外可见分光光度计(Shimadzu)。
1.3 玉米组织蛋白质的提取
1.3.1样品预处理研钵预冷,各称取培养好的黄化叶片4 g、花粉0.1 g两等份,叶片标记为L1、L2,花粉标记为P1、P2。称量好的叶片和花粉分别放入预冷的研钵中并用液氮充分研磨。L1、P1中加入预冷的丙酮,L2、P2加入预冷的10% TCA/丙酮,放于冰上再次研磨,用移液枪将匀浆转至2 mL离心管中,4 ℃条件下14 000 g离心5 min,弃上清,沉淀用冷丙酮冲洗2次,期间每次于-20 ℃下沉淀 30 min,同上条件进行离心。将沉淀冷冻干燥成干粉,于-20 ℃保存备用。
1.3.2蛋白质提取分别称取处理好的玉米叶片干粉和花粉干粉0.02 g。L1、L2、P1、P2加4 mL提取液(2% SDS、0.1 mol/L pH值7.8的Tris-HCl、20 mmol/L DTT)研磨提取全蛋白质,用移液枪分装至2 mL离心管。95 ℃水浴30 min,25 ℃条件下14 000 g离心5 min,取上清转至新的离心管中,加入等体积的Tris-饱和酚上下颠倒混匀,25 ℃条件下14 000 g离心5 min,取酚相加入5~7倍体积的0.1 mol/L乙酸铵/甲醇混匀后放置于-20 ℃冰箱过夜沉淀。4 ℃下14 000 g离心收集沉淀,沉淀用0.1 mol/L 乙酸铵/甲醇洗涤1次,再用预冷的丙酮洗涤2次,离心弃上清,冷冻干燥后的沉淀加入裂解液(8 mol/L尿素、2 mol/L硫脲、2% CHAPS、20 mmol/L DTT)充分溶解。
1.3.3蛋白质定量蛋白质定量采用Bradford[10]的方法。以标准蛋白质BSA做标准曲线,取待测蛋白质溶液10 μL,加入1 mL考马斯亮蓝G250显色液,混匀,在595 nm波长下测吸光度,根据标准曲线计算出待测蛋白质的浓度。并将每个样品的蛋白质含量最终定容至4 μg/μL。
1.4 双向电泳
1.4.1第一向:等电聚焦第一向采用PROTEAN IEF cell等电聚焦系统。主要参照Görg等[11]的方法以及Bio-Rad双向电泳操作指南进行,并根据实际情况确定了一套适合本试验的操作流程。将定容好的200 μL蛋白质溶液沿着水化槽的边缘由左向右线性加入样品,不要产生气泡,否则将影响到胶条中蛋白质的分布,从冰箱中取-20 ℃冷冻保存的IPG线性胶条(11 cm,pH值4~7),胶面朝下置于水化槽中样品溶液上,同时注意不要使胶面与溶液之间产生气泡,在每根胶条上覆盖2~3 mL矿物油,置于电泳仪上水化。20 ℃恒温条件下水化12 h后,按250 V 1 min、300 V 3 h、1 000 V 4 h、8 000 V 4 h、8 000 V 18 h进行等电聚焦。等电聚集结束后,将IPG胶条放于5 mL平衡缓冲液Ⅰ[6 mol/L 尿素、50 mmol/L pH值6.8的Tris-HCl、30%(V/V)甘油、2%(w/V)SDS、0.1 mol/L DTT]中振荡平衡15 min,再将胶条转入平衡液Ⅱ[6 mol/L尿素、50 mmol/L pH值6.8的Tris-HCl、30%(V/V)甘油、2%(w/V)SDS、0.25 mol/L碘乙酰胺]中振荡平衡15 min。
1.4.2第二向:SDS-PAGE凝胶电泳平衡结束以后将胶条转移到12.5%的SDS-PAGE凝胶(20×15×0.1)上,胶与胶条之间避免产生气泡,进行第二向电泳。LX-150温度控制仪控制循环水温为15 ℃,20 mA/gel恒功率30 min后,35 mA/gel恒功率直到溴酚蓝前沿到达距玻璃板底部1 cm处,结束电泳。电泳结束后固定(40%甲醇、10%乙酸,去离子水定容)40 min,倒出固定液,去离子水冲洗3次,用0.1%(w/V)考马斯亮蓝G250染色3 h,10%(V/V)冰乙酸脱色至胶背景清晰。相机拍照后用PDQuest(Version 6.2,Bio-Rad,UK)软件进行分析。
2 结果与分析
2.1 2种预处理对玉米组织蛋白质双向电泳图谱点数量的影响
分别用丙酮和TCA/丙酮预处理提取玉米叶片、花粉的总蛋白质,进行双向电泳,结果发现,2种预处理得到的蛋白质双向电泳图谱(图1、图2)背景浅、分布均匀、蛋白质点呈圆形或椭圆形,蛋白质点与点之间界限清晰、轮廓分明。丙酮预处理玉米叶片(图1A)可检测到的蛋白质点数为634个,丙酮预处理玉米花粉(图2A)可检测到的蛋白质点数为410个,主要分布在pH值4.5~6.0,但均有少量竖向拖尾;TCA/丙酮预处理玉米叶片(图1B)可得到540个清晰的蛋白质点数,TCA/丙酮预处理玉米花粉可得到320个清晰的蛋白质点数,明显少于丙酮预处理得到的蛋白质点数,但无明显横向和竖向拖尾,相对丙酮预处理的双向电泳图谱分辨率较高。
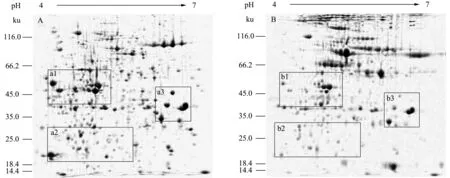
A.丙酮预处理;B.TCA/丙酮预处理图1 不同预处理玉米叶片全蛋白质双向电泳图谱

A.丙酮预处理;B.TCA/丙酮预处理图2 不同预处理玉米花粉全蛋白质双向电泳图谱
2.2 2种预处理对YUMI 组织蛋白质双向电泳图谱点丰度的影响
为了更清楚地解释分析2种预处理方法的差异,选取图1和图2中不同预处理相同部位的几个区域(a1和b1、a2和b2、a3和b3;c1和d1、c2和d2)放大(图3)并用PDQuest软件进行分析比较,玉米叶片放大部分双向电泳图谱(a1、a2、a3;b1、b2、b3)显示,在分子质量18.4~66.2 ku的区域,TCA/丙酮预处理的玉米叶片蛋白质点丰度较丙酮预处理下降;玉米花粉放大部分双向电泳图谱(c1、c2;d1、d2)显示,在分子质量35~116 ku的区域,TCA/丙酮预处理的玉米花粉蛋白质点丰度较丙酮预处理下降或消失了,可见,TCA/丙酮预处理会造成一些高丰度蛋白质点的减弱或丢失,而且丢失的蛋白质点大多在酸性区域。经10%TCA/丙酮预处理后,杂质去除的较为干净,样品蛋白质纯度较高,而且可除去糖、色素、酚等干扰电泳效果的物质;而直接用丙酮预处理过的蛋白质点较多,相比TCA/丙酮预处理杂质去除得不太干净。可见,用10%TCA/丙酮预处理比较理想。以上结果表明,TCA/丙酮预处理能更有效地去除植物组织中的杂质,减少拖尾,但同时也会造成一些高丰度蛋白质点的减弱或丢失。
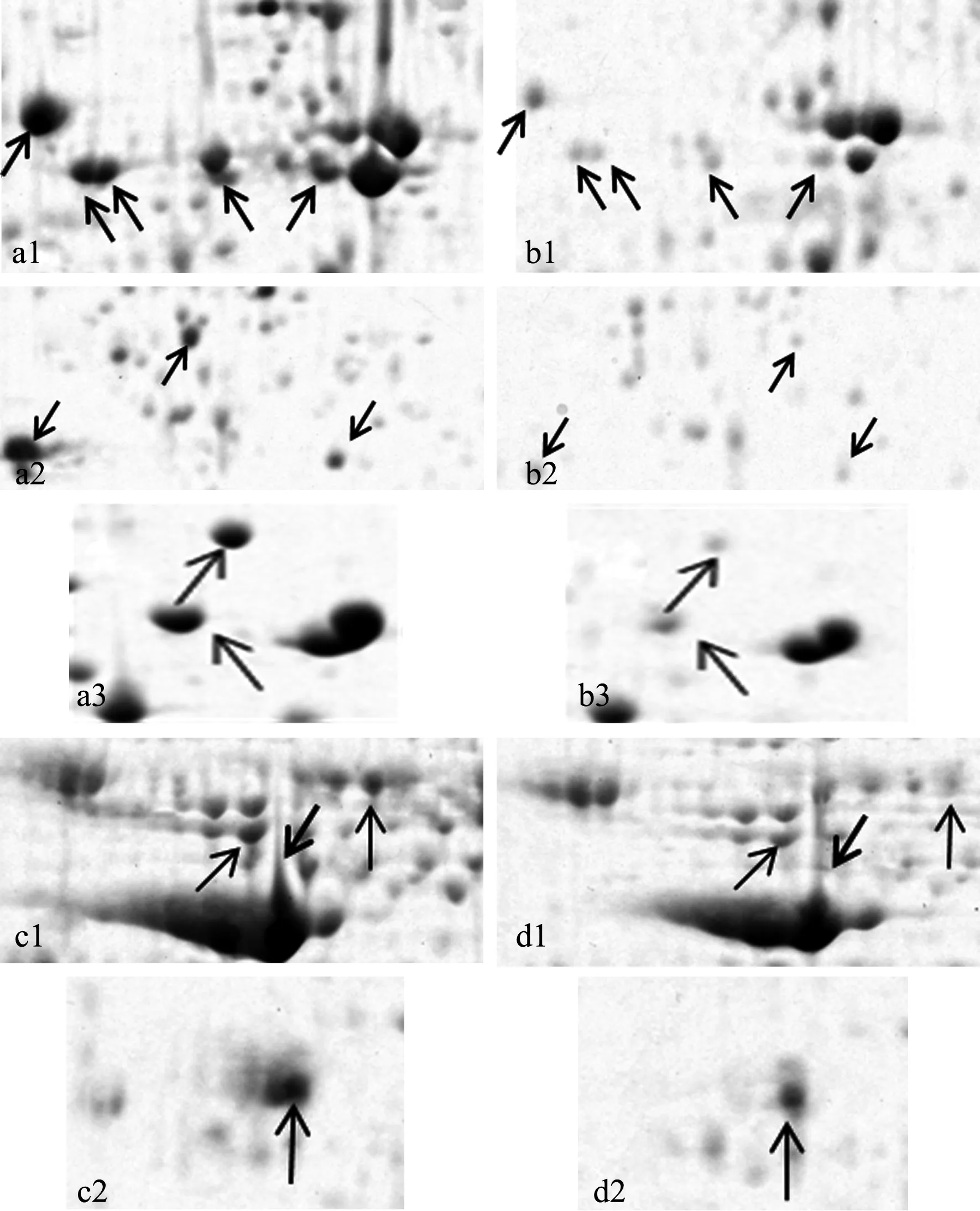
a1—a3:丙酮预处理叶片;b1—b3:TCA/丙酮预处理叶片;c1—c2:丙酮预处理花粉;d1—d2:TCA/丙酮预处理花粉箭头所指示的部分为丙酮预处理有而TCA/丙酮预处理没有或丰度降低的蛋白质点
3 结论与讨论
3.1 植物组织蛋白质提取预处理的作用
分离蛋白质组所有蛋白质的2个关键参数是其分辨率和可重复性。付忠军等[8]、徐幼平等[12]研究发现,植物未经预处理而直接用各种提取液进行蛋白质提取,再用有机溶剂沉淀,分离出的条带数量少,分离度较差。因此,在植物组织蛋白质提取之前的样品处理显得尤为重要。样品准备是获得高质量分辨率双向电泳图谱的最关键因素,但也存在很多问题:植物组织中具有丰富的干扰双向电泳的非蛋白质混合物,如酚类、糖类、有机酸等,致使在双向电泳中产生横向或纵向条纹以及拖尾等现象[13]。去除杂质有2种方法,一种是在蛋白质提取前去除,一种是在蛋白质提取后去除[14],由于玉米叶片和花粉中存在色素,杂质不易去除干净,所以在蛋白质提取前去除杂质效果较好。通常使用有机溶剂去除植物组织中的污染物,如丙酮和10%TCA/丙酮[7,14-17],本试验设置2种预处理,用考马斯亮蓝染色,pH值4~7的固相干胶条分离出的双向电泳图谱均显示杂质较少、分辨率较高、背景清晰。其中,丙酮预处理的玉米组织有少量拖尾,蛋白质点丰度高,适合做质谱分析;10%TCA/丙酮预处理的玉米组织没有拖尾,蛋白质点丰度较丙酮预处理低,适合做蛋白质差异分析。
3.2 蛋白质提取中其他的干扰因素
蛋白质的处理与提取方法有多种,由于其植物组织的化学成分和各试验的研究目的不同,采用的样品制备方法也不同[18-22]。蛋白质提取样品的质量会影响到电泳的分辨率、重复性和蛋白质图谱的分离效果。根据试验经验可知,干粉研磨得越细,杂质去除得越干净。由于液氮研磨后植物组织变得易碎,再进一步用丙酮或TCA/丙酮研磨,更易于研磨成细粉,然后再经过苯酚抽提,杂质去除得更干净。有时,样品预处理是影响双向电泳灵敏度的直接原因。大量研究证明,材料研磨应在4 ℃下进行,防止蛋白质降解。所有洗涤液需要在-20 ℃预冷至少1 h。用预冷的丙酮和TCA研磨以及预冷的乙酸铵/甲醇沉淀(-20 ℃,30 min或过夜),可有效减少叶片或花粉中色素、多酚对蛋白质纯度的影响。加样量也会影响电泳图谱的分析,高加样量有助于低丰度蛋白质的检测,而加样量过高又会掩盖与其相似的低丰度蛋白质的表达。根据经验可知,12.5% SDS-PAGE胶,11 cm的IPG胶条,加样量为800 μg最佳,蛋白质点数清晰。在对双向电泳图谱进行对比试验时,应选在同批次做,图谱结果才不会受到影响,所以要保证在相同的条件下进行电泳,比如试剂配方、电泳条件等。
总之,在植物组织蛋白质提取过程中,TCA和丙酮去除了大部分的干扰物质,有利于下一步蛋白质的苯酚抽提和双向电泳。尽管材料预处理耗时耗力,但是对于一些较难提取蛋白质的植物材料,却能提出较高质量的蛋白质样品。所以,蛋白质样品预处理是双向电泳成功分离蛋白质的关键,样品蛋白质的纯度和可溶性直接影响双向电泳的分离结果。本试验结果表明,用丙酮预处理研磨或10% TCA/丙酮预处理研磨玉米组织,并且在制备蛋白质干粉过程中采用预冷丙酮及预冷的TCA研磨蛋白质,不仅有效抑制了蛋白酶对蛋白质的水解作用,还可除去一些植物组织本身含有的干扰物质,从而获得较好的双向电泳图谱。
参考文献:
[1]Heazlewood J L,Howell K A,Whelan J,etal.Towards an analysis of the rice mitochondrial proteome[J].Plant Physiology,2003,132(1):230-242.
[2]O’Farrell P H.High resolution two-dimensional electrophoresis of proteins[J].J Biol Chem,1975,250:4007-4021.
[3]邰付菊,李扬,陈良,等.低温胁迫下棉花子叶蛋白质差异表达的双向电泳分析[J].华中师范大学学报(自然科学版),2008,42(2):262-266.
[4]孙立荣,胡盼盼,李亚平,等.棉花根总蛋白双向电泳方法的优化[J].河南大学学报(自然科学版),2014,44(3):329-333.
[5]石海波,王云生,冯勇,等.玉米籽粒蛋白质双向电泳技术体系的优化[J].华北农学报,2015,30(1):171-176.
[6]胡川,张智慧,王振中,等.适合于双向电泳的水稻叶片总蛋白提取方法的研究[C]//彭友良,王振中.中国植物病理学会2008年学术年会论文集.北京:中国农业科学技术出版社,2008.
[7]苏源,余萍,孔垂思,等.玉米幼苗根、茎、叶总蛋白质双向电泳方法的优化[J].西南农业学报,2012,25(6):2033-2036.
[8]付忠军,丁冬,进茜宁,等.玉米花丝蛋白质组双向电泳条件的优化[J].植物生理学通讯,2009,45(12):1215-1220.
[9]Wu X,Cai G,Gong F,etal.Proteome profiling of maize pollen coats reveals novel protein components[J].Plant Molecular Biology Reporter,2014,33(4):975-986.
[10]Bradford M.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical Biochemistry,1976,72:248-254.
[11]Görg A,Obermaier C,Boguth G,etal.Recent developments in two-dimensional gel electrophoresis with immobilized pH gradients:Wide pH gradients up to pH 12,longer separation distances and simplified procedures[J].Electrophoresis,1999,20(4/5):712-717.
[12]徐幼平,徐秋芳,蔡新忠.适于双向电泳分析的番茄叶片总蛋白提取方法的优化[J].浙江农业学报,2007,19(2):71-74.
[13]Görg A,Obermaier C,Boguth G,etal.The current state of two-dimensional electrophoresis with immobilized pH gradients proteomics and 2-DE[J].Electrophoresis,2000,21(6):1037-1053.
[14]Wang W,Scali M,Vignani R,etal.Protein extraction for two-dimensional electrophoresis from olive leaf,a plant tissue containing high levels of interfering compounds[J].Electrophoresis,2003,24(14):2369-2375.
[15]谢进,田晓明,刘淑欣,等.适用于毛白杨芽双向电泳分析的蛋白质提取方法[J].北京林业大学学报,2013,35(4):144-148.
[16]Damerval C,De Vienne D,Zivy M,etal.Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins[J].Electrophoresis,1986,7(7):52-54.
[17]Wang W,Vignani R,Scali M,etal.Removal of lipid contaminants by organic solvents from oilseed protein extract prior to electrophoresis.[J].Analytical Biochemistry,2004,329(1):139-141.
[18]王红,李浩戈,杨涛,等.黄瓜叶片蛋白质双向电泳条件优化[J].辽宁农业科学,2012(3):11-14.
[19]邵媛媛,柳展基,王龙龙,等.花生叶片蛋白质双向电泳的方法与优化[J].华北农学报,2010,25(2):136-139.
[20]郭晋隆,叶冰莹,黄庆煌,等.甘蔗叶片总蛋白提取及双向电泳条件的改进[J].生物技术通报,2008(5):112-114,125.
[21]李冠军,付凤玲.玉米叶片总蛋白提取和双向电泳技术的改进[J].玉米科学,2006,14(6):100-103.
[22]何瑞锋,丁毅,张剑锋,等.植物叶片蛋白质双向电泳技术的改进与优化[J].遗传,2000,22(5):319-321.

