肝片吸虫Ftn-1蛋白分子特征、抗原性及其抗体制备
王熙凤,孟庆玲*,乔 军,陈 英,钟文强,贡莎莎,黄运福,才学鹏(.石河子大学 动物科技学院,新疆 石河子 83003; .中国农业科学院 兰州兽医研究所,甘肃 兰州 730046)
肝片吸虫(Fasciolahepatica,Fh)属于吸虫纲、片行科、片行属的一种常见寄生虫,中间宿主主要是椎实螺科的淡水螺。肝片吸虫病在全球具有广泛的流行性[1-2],在我国呈地方性流行,多发于夏秋两季,内蒙古、青海、甘肃、新疆等畜牧业发达的省(区)发病较为严重,其中,羊的感染率一般为20%~60%,个别养羊业发达的地区可高达90%以上,发病率达10%~100%[3],成为低洼、潮湿牧区羊场羊病死的重要原因之一。肝片吸虫可感染多种哺乳动物宿主,特别是绵羊、山羊和牛,人也可以被感染,被感染后成虫主要寄生在肝脏、胆管内,以食血为主[4],可引起急性或者慢性肝炎和胆管炎。
近年来,随着环境和气候的变化,该病的流行率和发病率逐渐升高[5]。据统计,全球约有2.5亿~3.0亿牛羊和240万~1 700万人感染肝片吸虫,给家畜生产和人类健康带来严重危害,可引发家畜肝损坏、消化道感染、急性肾损伤等并发症,每年造成的经济损失可达200万美元[6-10]。但由于动物肝片吸虫感染初期无特征性临床症状,很难确诊,因此,建立该病感染的早期诊断方法具有重要的意义。
新疆是我国五大牧区之一,也是我国牛羊重要的养殖基地。然而,在新疆许多放牧地区,牛羊肝片吸虫病长期流行,给畜牧养殖业和牧民身体健康带来了严重的危害。因此,有效地防治该病对畜牧业的发展至关重要。目前,肝片吸虫病主要依靠药物防治,但易产生耐药性、药物残留等问题。因此,研究高效、安全的防治肝片吸虫病的疫苗意义重大。研究发现,铁蛋白样蛋白(Ftn-1)具有作为肝片吸虫早期诊断抗原的潜力,是抗肝片吸虫病的候选抗原。鉴于此,本研究对肝片吸虫Ftn-1基因进行克隆和分子特征分析,构建了原核表达载体并进行诱导表达,对表达的重组蛋白进行抗原性分析,旨在筛选特异性高、反应原性强的肝片吸虫诊断抗原。
1 材料和方法
1.1 菌株、质粒及试剂
菌株E.coliDH5α和E.coliBL21(DE3)、表达载体pET-32a(+)均由石河子大学寄生虫实验室保存。
限制性核酸内切酶EcoR I和XhoI、DNA Marker、pMD19-T克隆载体、T4 DNA 连接酶、IPTG、PCR Mixture、蛋白质Marker均购自TaKaRa公司;琼脂糖凝胶DNA回收试剂盒和质粒小量提取试剂盒均购自诺维森生物科技有限公司;辣根过氧化物酶标记的兔抗羊IgG、低背景化学发光检测试剂盒均购自康为世纪生物公司;DAB显色剂购自天根生化科技(北京)有限公司。
绵羊肝片吸虫阳性血清、羊肝片吸虫IgG抗体EISA检测试剂盒均由沙湾兽医站提供。
1.2 引物设计及合成
根据GenBank中已发表的Ftn-1基因序列,应用Primer Premier 5.0软件设计特异性引物,分别在上、下游引物5′端加入2个保护性碱基以及EcoR I和XhoⅠ 限制性酶切位点(下划线部分),上游引物:5′-CGGAATTCATGCGTGGTGGAAAATT-3′ (EcoR Ⅰ);下游引物:5′ -CCCTCGAGTCAATTCCATATGGGAGC-3′ (XhoⅠ),引物由华大基因生物公司合成。
1.3 肝片吸虫总RNA的提取
肝片吸虫成虫采自新疆乌鲁木齐市活畜屠宰场绵羊的肝脏,虫体采回后用PBS缓冲液清洗3~5遍,剪虫体的1/3(约20 mg),加入800 μL Trizol充分研磨,加200 μL氯仿静置后吸取上清,加入500 μL异丙醇静置离心后留下白色沉淀,沉淀中加入30 μL DEPC水,测定RNA浓度,于-80 ℃保存。
1.4 Ftn-1基因的RT-PCR扩增
利用RT-PCR 技术扩增Ftn-1基因。将提取后的肝片吸虫总RNA用反转录试剂盒反转录为cDNA,以反转录产物cDNA为模板,应用设计的特异性引物进行Ftn-1基因的扩增。PCR扩增体系为:ddH2O 10 μL,PCR Mixture 7 μL,cDNA模板2 μL,上、下游引物各0.5 μL。PCR扩增条件为:94 ℃预变性4 min;94 ℃变性40 s,64 ℃退火40 s,72 ℃延伸55 s,35个循环;72 ℃延伸10 min。PCR扩增产物用1%琼脂糖凝胶电泳进行检测,预期扩增片段大小为477 bp。
1.5 PCR产物的克隆、测序与分子特征分析
琼脂糖凝胶DNA回收试剂盒回收目的片段,将目的片段与pMD19-T克隆载体于4 ℃连接过夜,转化入E.coliDH5α感受态细胞内,通过PCR和双酶切进行阳性克隆的筛选。将阳性克隆测序,用在线软件Expasy、BepiPred 1.0 Server、Predictprotein、Swiss-mode对测序结果及Ftn-1基因编码的蛋白质的理化性质、抗原表位、二级结构和三级结构等进行分析。
1.6 Ftn-1基因原核表达载体的构建
将胶回收目的片段和原核表达载体pET-32a(+)分别用EcoRⅠ和XhoⅠ 进行双酶切,回收双酶切产物,与T4 DNA连接酶4 ℃连接过夜。将连接产物转化入E.coliDH5α感受态细胞,用PCR和双酶切进行阳性克隆的筛选和鉴定,将验证正确的重组质粒命名为pET-Ftn-1。
1.7 重组蛋白Ftn-1的诱导表达
将重组质粒pET-32a(+)-Ftn-1转化入E.coliBL21(DE3)感受态细胞,用含有Amp抗性的LB液体培养基培养至OD600值为0.6~0.8时,加入液体1.0 mmol/L IPTG(终浓度)进行诱导,在诱导后8 h分别收集菌液,采用SDS-PAGE检测重组蛋白是否表达。
1.8 重组蛋白包涵体的纯化
收集重组菌菌体,加入20 mL Lysis Buffer吹打混匀,反复冻融4次,用超声波破碎45 min,至菌体不再黏稠为止。破碎后将菌体9 000 r/min,离心30 min弃去上清,沉淀中加入8 mol/L尿素16 mL,室温过夜放置使沉淀溶解,经0.45 μm过滤器过滤后用蛋白质纯化仪纯化,进行SDS-PAGE检测。将纯化后的蛋白质在透析袋中分别置于8、6、4、2、1 mol/L尿素溶液中各透析6 h,透析后用蔗糖浓缩至终质量浓度为1 g/L,放置在-80 ℃保存备用。
1.9 重组蛋白Western blot 分析
将浓缩后的重组蛋白进行SDS-PAGE电泳后,用半干式转移盒转移到硝酸纤维素膜(NC膜)上,用含5%脱脂奶粉的TBST[11]封闭1 h,TBST洗涤3次,加入绵羊肝片吸虫阳性血清(1∶1 000稀释)37 ℃孵育1 h,TBST洗涤4次,辣根过氧化物酶标记的兔抗羊IgG(1∶3 000稀释)为二抗,37 ℃孵育1 h,洗涤3次后用DAB显色,去离子水终止显色。
1.10 重组蛋白Ftn-1 免疫原性检测
取15只雌性小鼠,10只为试验组,5只为对照组。将纯化后重组蛋白与等体积弗氏完全佐剂乳化混匀后,试验组每只小鼠皮下注射200 μL,间隔14 d后进行第2次免疫,将弗氏完全佐剂更换成弗氏不完全佐剂,免疫14 d后心脏采血,静置分离血清。用羊肝片吸虫IgG抗体ELISA检测试剂盒检测免疫小鼠血清是否产生抗体。
2 结果与分析
2.1 Ftn-1基因的RT-PCR扩增及双酶切鉴定结果
琼脂糖凝胶电泳检测发现,PCR扩增产物大小约477 bp,与预期目的大小一致,证明成功克隆到了Ftn-1基因(图1)。将克隆成功的Ftn-1基因转化入E.coliDH5α感受态细胞,筛选出阳性菌株,提质粒后经EcoR Ⅰ、XhoⅠ 双酶切,得到1条约2 692 bp的载体片段和1条约477 bp的插入片段,表明pMD19-T克隆载体中成功插入了目的片段(图2)。
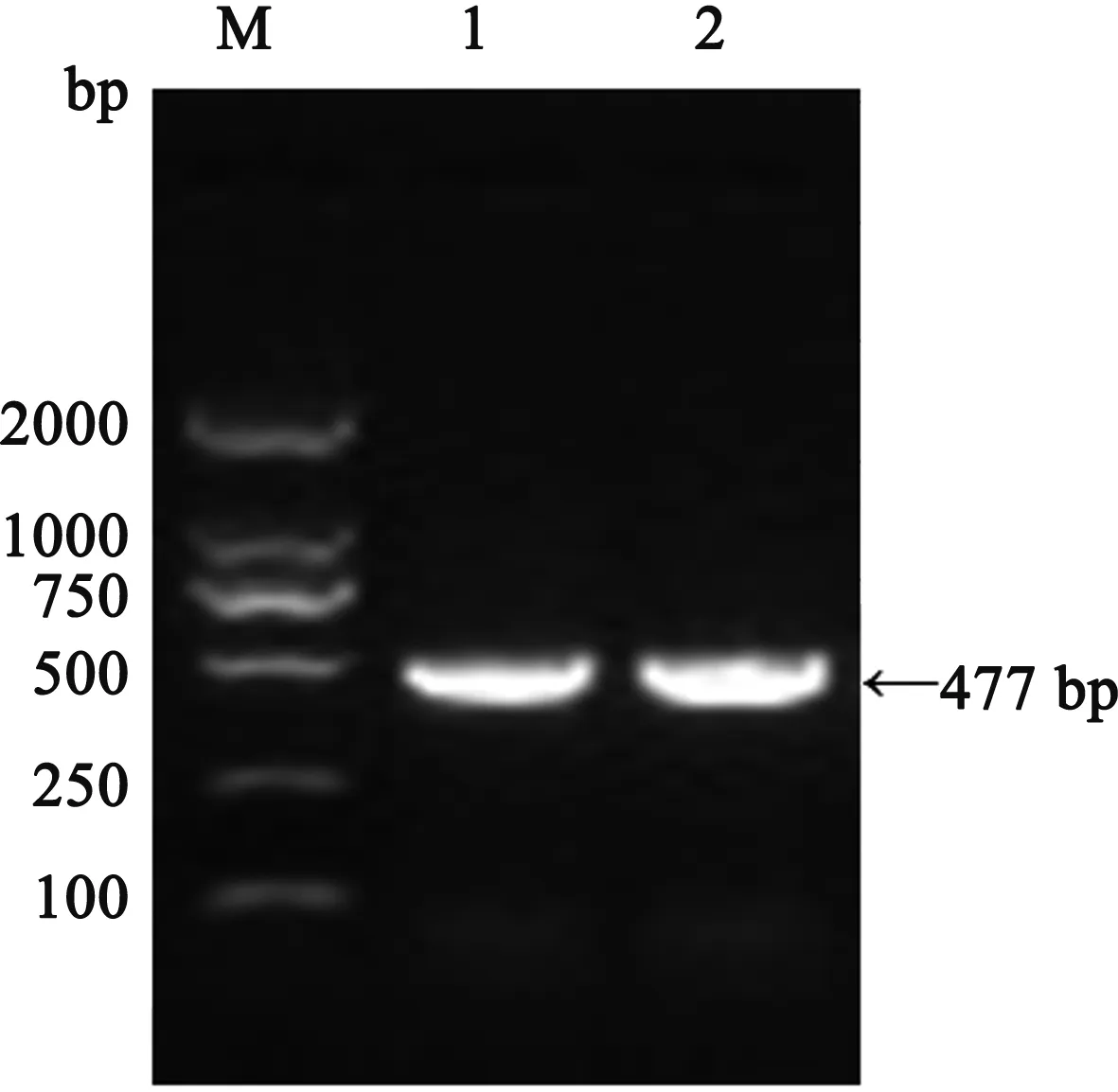
M:DL2000 DNA Marker;1、2:Ftn-1基因图1 Ftn-1基因RT-PCR 扩增结果

M:DL2000 DNA Marker;1、2:Ftn-1基因双酶切3:未经酶切的Ftn-1基因图2 Ftn-1基因的双酶切鉴定结果
2.2 Ftn-1基因测序结果及分子特征分析
测序结果表明,Ftn-1基因cDNA全长477 bp,编码158个氨基酸,与GenBank中已上传的肝片吸虫Ftn-1基因同源性为98.74%,推导出的氨基酸序列同源性为97.47%。在编码的氨基酸序列中有4个氨基酸差异,分别在第9(Q-R)、55(V-I)、100(L-S)、106(K-R)位。软件预测结果表明,Ftn-1蛋白为亲水性蛋白,无跨膜区和信号肽;其多肽抗原表位区集中在第33—57、83—87、113—146位;该蛋白含有2个酪蛋白激酶Ⅱ磷酸化位点(31—34、52—55位)、1个N-酰基化位点(83—88位)、2个蛋白激酶磷酸化位点(49—51、148—150位)、1个酪氨酸激酶磷酸化位点(85—93位)(图3);二级结构中α-螺旋(α-helix)、β-折叠(β-sheet)、无规卷曲(random coil)分别占53.2%、7.6%、39.2%;三级结构由无规卷曲连接2个α-螺旋和3个β-折叠构成“N”字形的空间结构(图4)。

Ftn-1基因引物序列(下划线);2个酪蛋白激酶Ⅱ磷酸化位点(斜体加粗);1个N-酰基化位点(双下划线);2个蛋白激酶磷酸化位点(波浪线);1个酪氨酸激酶磷酸化位点(阴影部分);抗原表位集中区(虚线框)图3 Ftn-1基因核苷酸序列及编码氨基酸序列

图4 Ftn-1蛋白的三级结构预测
2.3 重组表达载体的鉴定结果
重组质粒pET-Ftn-1经EcoR Ⅰ、XhoⅠ 双酶切,出现大小约5 900 bp的表达载体片段和约477 bp的目的条带,与预期结果相符(图5)。测序结果进一步证明,已成功将目的基因插入到原核表达载体pET-32a(+)中。
2.4 重组蛋白Ftn-1的诱导表达与纯化
将构建的重组质粒转化入E.coliBL21(DE3)感受态细胞内,分别诱导0、2、4、6、8 h后,经SDS-PAGE检测,在33.5 ku处均见到1条蛋白条带,且与目的蛋白预测大小一致,而在超声裂解上清的相同位置未见蛋白质条带,说明表达的重组蛋白以包涵体形式存在。纯化后重组蛋白经SDS-PAGE检测可见到单一的目的条带,透析后浓缩至终质量浓度为1 g/L(图6)。

M:DL5000 DNA Marker;1—4:重组质粒pET-Ftn-1双酶切;5:未经酶切的重组质粒pET-Ftn-1图5 重组质粒pET-Ftn-1双酶切鉴定结果

M:蛋白质Marker;1:pET-32a载体菌株IPTG诱导6 h;2—6:重组菌诱导0、2、4、6、8 h;7:纯化后的Ftn-1重组蛋白图6 Ftn-1重组蛋白表达产物的SDS-PAGE电泳检测结果
2.5 重组蛋白Ftn-1的Western blot 分析结果
将纯化的重组蛋白Ftn-1经SDS-PAGE后转移到NC膜上,以绵羊肝片吸虫阳性血清为一抗,以HRP标记的兔抗羊IgG为二抗,经显色后在目的条带处可见到单一的特异性条带(图7),证明表达产物具有良好的反应原性。
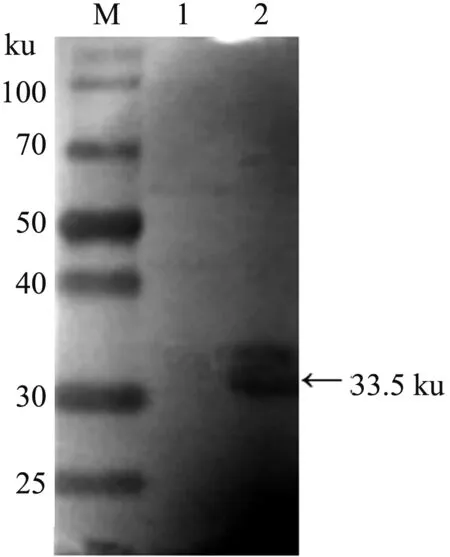
M:蛋白质Marker;1:重组蛋白Ftn-1上清液;2:重组蛋白Ftn-1沉淀图7 重组蛋白Ftn-1的Western blot 检测
2.6 重组蛋白免疫小鼠后血清检测结果
重组蛋白免疫小鼠后获得的血清用羊肝片吸虫IgG抗体ELISA检测试剂盒检测,结果显示,试验组10只小鼠血清均为阳性,对照组5只均为阴性,表明重组蛋白Ftn-1能够刺激机体产生相应的抗体,具有较强的免疫原性。
3 结论与讨论
目前,肝片吸虫病的诊断主要依赖于粪便中虫卵检查和免疫学检测方法。然而,虫体一般都在感染后2~3个月才能成熟排卵,因而虫卵检查不适用于肝片吸虫病的早期诊断。常用的免疫学诊断方法有间接血凝试验(IHA)、ELISA、斑点酶联免疫吸附试验(dot-ELISA)等。然而,目前免疫学诊断所使用的肝片吸虫诊断抗原多为虫体粗提抗原,其特异性较差。张雪娟等[12]以肝片吸虫提纯抗原为诊断液,该方法虽能检出1~3周龄的病羊,敏感性较高,但特异性较低。
筛选和鉴定特异性高、敏感性强的肝片吸虫抗原是建立特异敏感的血清学诊断方法的前提。McNulty等[13]对绵羊肝片吸虫成虫的全基因组进行了测序,共预测出14 642个编码基因,并预测分析了其中一些抗原基因。国内外学者对肝片吸虫一些重要抗原蛋白如鞘脂激活样蛋白2(SAP-2)、组织蛋白酶L(CatL)、谷胱甘肽S-转移酶(GST)、脂肪酸结合蛋白(FABP)[14-15]、血红蛋白(Hb)、亮氨酸氨基肽酶(LAP)等多个肝片吸虫蛋白进行了免疫学特性研究。Kazantseva等[16]纯化了肝片吸虫分泌代谢抗原Fas2蛋白,建立了检测肝片吸虫特异性抗体IgM的间接ELISA法,用建立的方法对76份感染肝片吸虫人阳性血清和24份感染其他寄生虫人血清及84份健康人血清样品进行了IgM抗体检测,结果表明,Fas2-ELISA检测方法的敏感性为43.4%,特异性为100%,与其他寄生虫阳性血清无交叉反应,提示分泌代谢抗原Fas2蛋白在肝片吸虫早期急性感染中具有一定的诊断价值。
Ftn-1蛋白是细胞内维持铁平衡的一种重要蛋白,具有吸收铁的能力,在寄生虫的发育和成熟过程中起调节作用,并参与生化反应[17-19];经二级结构分析发现,肝片吸虫Ftn-1蛋白中特殊螺旋E和F的存在可稳定蛋白质的构象,调节蛋白质功能[20]。Cabán-Hernández等[21]选择肝片吸虫Ftn-1重组蛋白作为包被抗原,通过ELISA方法检测健康人和感染肝片吸虫人的血清,发现该蛋白具有良好的反应原性。Espino等[22]通过荧光定量PCR分析发现,肝片吸虫Ftn-1基因在成虫和虫卵阶段的表达量均显著高于童虫和毛蚴阶段,提示Ftn-1蛋白具有作为肝片吸虫诊断抗原的潜力。对肝片吸虫Ftn-1蛋白的分子特征及其免疫学特性进行了研究,并高效表达了Ftn-1重组蛋白。Western blot分析证实,Ftn-1重组蛋白可被绵羊肝片吸虫阳性血清特异性识别,且具有良好的免疫原性,提示该蛋白在肝片吸虫免疫学诊断和亚单位疫苗研发中具有潜在的应用价值。
参考文献:
[1]Valero M A,Bargues M D,Khoubbane M,etal.Higher physiopathogenicity byFasciolagiganticathan by the genetically closeF.hepatica:Experimental long-term follow up of biochemical markers[J].Trans R Soc Trop Med Hyg,2016,110(1):55-66.
[2]Ashrafi K,Bargues M D,O’Neill S,etal.Fascioliasis:A worldwide parasitic disease of importance in travel medicine[J].Travel Med Infect Dis,2014,12:636-649.
[3]谢凤云,张钦凯,王百川,等.肝片吸虫的特性及肝片吸虫病的预防与治疗[J].畜牧与饲料科学,2014(1):72-74.
[4]Dalton J P,Neill S O,Stack C,etal.Fasciolahepaticacathepsin L-like proteases:Biology,function,and potential in the development of first generation liver fluke vaccines[J].Int J Parasitol,2003,33(11):1173-1181.
[5]Fox N J,White P C,McClean C J,etal.Predicting impacts of climate change onFasciolahepaticarisk[J].PLoS One,2011,6(1):e16126.
[6]Marcos L A,Yi P,Machicado A,etal.Hepatic fibrosis andFasciolahepaticainfection in cattle[J].J Helminthol,2007,81(4):381-386.
[7]Singh U C,Kumar A,Srivastava A,etal.Small bowel stricture and perforation:An unusual presentation ofFasciolopsisbuski[J].Trop Gastroenterol,2011,32(4):320-322.
[8]Karthikeyan G,Ramkumar V,Kumar S P,etal.Intestinal infestation withFasciolopsisbuskileading to acute kidney injury[J].Assoc Physicians India,2013,61(12):936-938.
[9]张吉丽,朱阵,李冰,等.肝片吸虫病的研究进展[J].黑龙江畜牧兽医,2016(11):58-61.
[10]Mas-Coma S,Bargues M D,Valero M A.Fascioliasis and other plant-borne trematode zoonoses[J].International Journal for Parasitology,2005,35(11/12):1255-1278.
[11]胡政香.绵羊肺炎支原体新疆塔城流行株的分离鉴定及油佐剂灭活苗免疫原性初步研究[D].新疆:石河子大学,2015.
[12]张雪娟,黄熙照,杨继宗,等.肝片吸虫诊断抗原提纯方法的研究[J].中国兽医科技,1992,22(6):8-9.
[13]McNulty S N,Tort J F,Rinaldi G,etal.Genomes ofFasciolahepaticafrom the Americas reveal colonization with neorickettsia endobacteria related to the agents of potomac horse and human sennetsu fevers[J].PLoS Genet,2017,13(1):1-25.
[14]Lopez-Aban J,Esteban A,Vicente B,etal.Adaptive immune stimulation is required to obtain high protection with fatty acid binding protein vaccine candidate againstFasciolahepaticain Balb/C mice[J].Parasitol,2012,98:527-535.
[15]Martínez-Fernández A R,Nogal-Ruiz J ,López-Abán J,etal.Vaccination of mice and sheep with Fh12 FABP fromFasciolahepaticausing the new adjuvant/immunomodulator system ADAD[J].Vet Parasitol,2004,126(3):287-298.
[16]Kazantseva L,Herrera-Velit P,Espinoza J R,etal.Anti-Fas2 IgM antibodies inFasciolahepaticainfected patients with positive IgG serology[J].Trans R Soc Trop Med Hyg,2017,111(3):102-106.
[17]Jones M K,McManus D P,Sivadorai P,etal.Tracking the fate of iron in early development of human blood flukes[J].Int J Biochem Cell Biol,2007,39(9):1646-1658.
[18]Levi S,Yewdall S J,Harrison P M,etal.Evidence of H- and L-chains have co-operative roles in the iron-uptake mechanism of human ferritin[J].Biochem Journal,1992,288(2):591-596.
[19]Harrison P M,Arosio P.The ferritins:Molecular properties,iron storage function and cellular regulation[J].Biochimica et Biophysica Acta,1996,1275(3):161-203.
[20]Espino A M,Hillyer G V.A novelFasciolahepaticasaposinlike recombinant protein with immunoprophylactic potential[J].The Journal of Parasitol,2004,90(4):876-879.
[21]Cabán-Hernández K,Gaudier J F,Ruiz-Jiménez C,etal.Development of two antibody detection enzyme-linked immunosorbent assays for serodiagnosis of human chronic fascioliasis[J].Journal of Clinical Microbiology,2014,52(3):766-772.
[22]Espino A M,Cabán-Hernández K,José F.Characterization and differential expression of a ferritin protein fromFasciolahepatica[J].Molecular and Biochemical Parasitology,2012,182(1):54-61.

