酿酒酵母ScCoA-Δ9脱氢酶种子特异表达载体构建及在棉花中的功能验证
刘宝玲,孙岩,张飞,郝青婷,吉夏洁,李润植,薛金爱*
(1.山西农业大学 农学院,山西 太谷 030801;2.山西农业大学 生命科学学院,山西 太谷 030801)
棉花(Gossypiumhirsutum)是我国主要的纤维经济作物,大量的棉籽也可用于制作食用油和生物燃油等[1]。作为日常食用的重要植物油,棉籽油仅含有限的几种脂肪酸,即棕榈 酸 (16∶0)、硬脂酸 (18∶0)、单不饱和油酸 (18∶1Δ9)、多不饱和亚油酸 (18∶2Δ9,12)和亚麻酸(18∶3Δ9,12,15)[2,3]。其中亚油酸含量最高,约为54%,这种脂肪酸含有两个双键,易氧化,难以长期储存,而在防氧化加工过程会产生大量反式脂肪酸,对人体健康非常不利,大大降低了棉籽油的食用价值[4]。棕榈油酸(16∶1Δ9) 是一种重要的稀有单不饱和脂肪酸(ω-7),具有极为广泛的应用价值。棕榈油酸可用来生产保健品,降低血液中胆固醇的含量,预防心脑血管疾病和抑制肿瘤发生等[5,6],还可用作工业1-辛烯的原材料和生物燃油等[7,8]。
然而,这种高附加值的棕榈油酸在棉籽中含量极低(<1%),但在猫爪草(DoxanthaunguiscatiL.)[9,10],澳洲坚果(Macadamiaintegrifolia)[11]和沙棘(HippophaerhamnoidesL.)[12]等野生植物种子中大量积累,含量分别为64%、30%和70%[4]。这些野生植物大多数仅能在部分地区生存,种子很小,产量极低,难以被用来大规模生产高含量棕榈油酸[13,14]。随着市场对棕榈油酸含量需求日益剧增,通过基因工程手段对大田油料作物脂肪酸合成代谢通路进行遗传修饰,以期提高种子棕榈油酸的积累量,已成为目前植物油脂代谢领域的热点话题[15]。
酿酒酵母(Saccharomyeescerevisiae)脂酰CoA-Δ9脱氢酶 (ScCoA-Δ9D)是一种定位于细胞内质网的膜结合蛋白酶,其在生物体内能够催化棕榈酸 (16∶0) 酯酰链上第9个碳原子上脱氢产生棕榈油酸(16∶1Δ9)[16,17]。据前人报道,一些外源的脂酰-Δ9脱氢酶已被用来提高植物棕榈油酸含量,尽管产生的棕榈油酸含量尚低于10%[18]。例如,在亚麻荠种子过量表达ScCoA-Δ9D基因,则使其种子内棕榈油酸(16∶1Δ9)含量升高了约2.7%[14],转ScCoA-Δ9D基因的烟草中棕榈油酸的含量也高于野生型[19]。棉花种子含有约25%的16∶0, 是大田油料作物中最高的[3]。因此,将对16∶0有较高特异性的ScCoA-Δ9D转入陆地棉种子,不存在该酶底物不足的限制因素。
为此,本试验以几乎不含棕榈油酸等ω-7脂肪酸的棉花为试验材料,利用农杆菌将含有酿酒酵母ScCoA-Δ9D基因的种子特异性表达载体转入陆地棉种子中,期望将棉籽内更多的棕榈酸(C16∶0)转化为棕榈油酸(C16∶1Δ9),减少C16∶0流向亚油酸(C18∶2)途径,从而从源头上改变其脂肪酸成分, 改良棉籽油的营养及工业用品质。
1 材料与方法
1.1 试验材料
本试验所用材料为陆地棉WC种子,由山西省农科院棉花研究所资源室提供。大肠杆菌DH5α,GV3101农杆菌均为本实验室保存。引物和测序工作由金唯智生物科技有限公司完成。pCAMBIA1303-ScCoA-Δ9D表达载体和带红色荧光蛋白的大豆种子特异性载体(pJC-DsRed)均由山西农业大学农学院分子农业与生物能源研究所实验室保存。测序和引物合成由宝生物工程(大连)有限公司完成。BamHI内切酶和T4连接酶购于NEB公司。
1.2 ScCoA-Δ9D基因的亚克隆及其种子特异性表达载体的构建
本试验在ScCoA-Δ9D基因的起始密码子和终止密码子两端设计一对特异扩增引物F:5'-CGggatccACCACGCCTCAGGTTCTC-3'和R:5'-CGggatccAAGCACAACCGAAGATAG-3',斜体部分为BamHI酶切位点,加粗字母为保护碱基,扩增的表达盒总长度为1 533 bp。以pCAMBIA1303-ScCoA-Δ9D为模板进行高保真PCR扩增,程序为94 ℃ 5 min;94 ℃ 30 s,60℃40 s,72℃40 s,30 个循环;72℃10 min。扩增产物经1%琼脂糖凝胶电泳检测后割胶回收,然后利用BamHI同时酶切ScCoA-Δ9D基因和pJC-DsRed质粒,酶切体系(NEB公司)为:Cutsmart Buffer 5 μL,BamHI 1 μL,pJC-DsRed质粒 4 μL,ScCoA-Δ9D扩增产物6 μL,然后加ddH2O补足至50 μL,酶切3 h后得到酶切产物。酶连接体系为:Buffer 2 μL,ScCoA-Δ9D产物为15 μL,pJC-DsRed质粒为 2 μL,T4连接酶为1 μL,总体积为20 μL,然后经过16 ℃过夜连接,得到酶连接产物,经转化和PCR分子鉴定,得到阳性DH5α菌并提取质粒转入农杆菌GV3101。
1.3 农杆菌介导的棉花遗传转化
1.3.1 棉花无菌苗的培养
选取籽粒饱满的WC种子,70%酒精清洗10 s,经过10% 的H2O2浸泡2 h后,用无菌水清洗3~5遍,并浸泡于无菌水中24 h直至种子露白。然后剥离种皮后,种植于1/2 MS培养基,置于25 ℃中,黑暗培养3 d,然后3 000 lx光照培养4 d[20]。
1.3.2 侵染及共培养
将成功转入二元表达载体的农杆菌GV3101,在含50 mg·L-1利福平和50 mg·L-1卡那霉素的LB液体培养基中28 ℃,200 r·min-1,振荡培养至OD600=0.5左右,然后8 000 r·min-1离心5 min,弃上清,用等体积的1/2 MS液体培养基重悬。取培养一周的棉花幼苗下胚轴,切成1 cm长的茎段,用农杆菌液浸泡10 min后用滤纸吸干菌液,放入新的共培养基上共培养2d[20,21]。
1.3.3 植株诱导再生
将上述共培养2 d后的茎段重新放置于含抗生素(500 mg·L-1头孢霉素、50 mg·L-1草氟安膦)和激素(0.05 mg·L-12,4-D和0.1 mg·L-1KT)的筛选培养基上诱导愈伤组织,并每隔15 d左右继代一次。经过3~4继代筛选后,取形态较好的抗性愈伤组织转移到不含任何激素和抗生素的改良MS培养基上分化形成胚性愈伤组织并再生出小植株。然后将再生小苗单独转移到试管苗培养基中,待其长出3~4片真叶时(图2G),在超净台中取1~2片提取DNA进行PCR扩增,等阳性植株继续长至5~6 cm用于嫁接(图2H)[20]。本文用
未浸染的无菌苗叶片做阴性对照。
1.4 转基因棉花DNA的提取及ScCoA-Δ9D基因的表达情况
采用改良的CTAB法[16]提取上述转基因棉花幼叶和阴性对照的DNA,进行PCR检测分析。ScCoA-Δ9D基因扩增PCR引物为1F:5'-TGTATCTTGTTTCATAGTTTGTCCC-3',1R:5'-CATAAAAACCCATCTCATAAATAAC-3',扩增片段大约为 501 bp,PCR 程序参考上述参数。利用艾德莱RNA试剂盒对各转基因事件中的棉花幼叶提取总RNA,经过凝胶电泳和核酸检测合格后,利用TAKARA公司反转录试剂盒将1μg RNA反转录为cDNA,以管家基因GhHistone3为内参,草铵膦基因(Bar)为转基因对照,对ScCoA-Δ9D基因进行qRT-PCR反应,其中非转基因棉花叶片作为外对照。反应体系为ABM公司(镇江爱必梦生物科技)Master EvaGreen Mix 为10 μL,正反引物各0.6 μL,cDNA各1 μL,ddH2O为7.8 μL,反应程序为95℃10 min;95℃15 s;58℃1 min,72 ℃30 s,40 个循环。利用2-ΔΔcq法计算相对表达量。各基因引物如下表1。

表1 qRT-PCR相对表达引物Table 1 Primers of relative expression of qRT-PCR
2 结果与分析
2.1 ScCoA-Δ9D基因的亚克隆与表达载体构建
经过PCR克隆方法得到1 533 bp的ScCoA-Δ9D为图3 A所示,利用通过割胶回收、BamHI酶切和T4酶连接反应,获得种子特异性超表达载体pJC-ScCoA-Δ9D-DsRed(图1C),图1 A为ScCoA-Δ9D超表达载体pCAMBIA1303载体的T-DNA区。图1B为含种子特异性表达盒的质粒pJC-DsRed T-DNA区。经过测序和PCR验证后,将该质粒转入GV3101农杆菌用于后续农杆菌介导的棉花遗传转化实验。
2.2 转基因再生植株的诱导过程
棉花种子经无菌培养、农杆菌浸染、共培养(图2 A)、诱导培养(图2B,2C)、分化培养(图2D~2F)等一系列处理后,在诱导培养继代2~3次(约1个月)后,在切断两端各生成一团透明的薄壁愈伤组织,继续诱导培养取下得愈伤,大约20 d时,愈伤逐渐彭大,并能产生部分叶绿素,使得部分愈伤为浅绿色(图2D)。然后,更换培养基为分化培养基,开始诱导薄壁组织分化为胚,在继代2~3次后,部分愈伤(图2D箭头所示)形成淡黄色米粒状致密的球形胚(图2E箭头所示),进而又分化为有明显生长点且能正常发育的转基因小苗(图2F),待小苗长到4~5片叶,约4~5 cm高时(图2G),取出瓶中的小苗,在温室中嫁接到生长健壮的海岛棉母体上,经过一段时间愈合培养,形成真正的转基因棉花(图2H),经过这样嫁接的小苗存活率一般能达到90%。
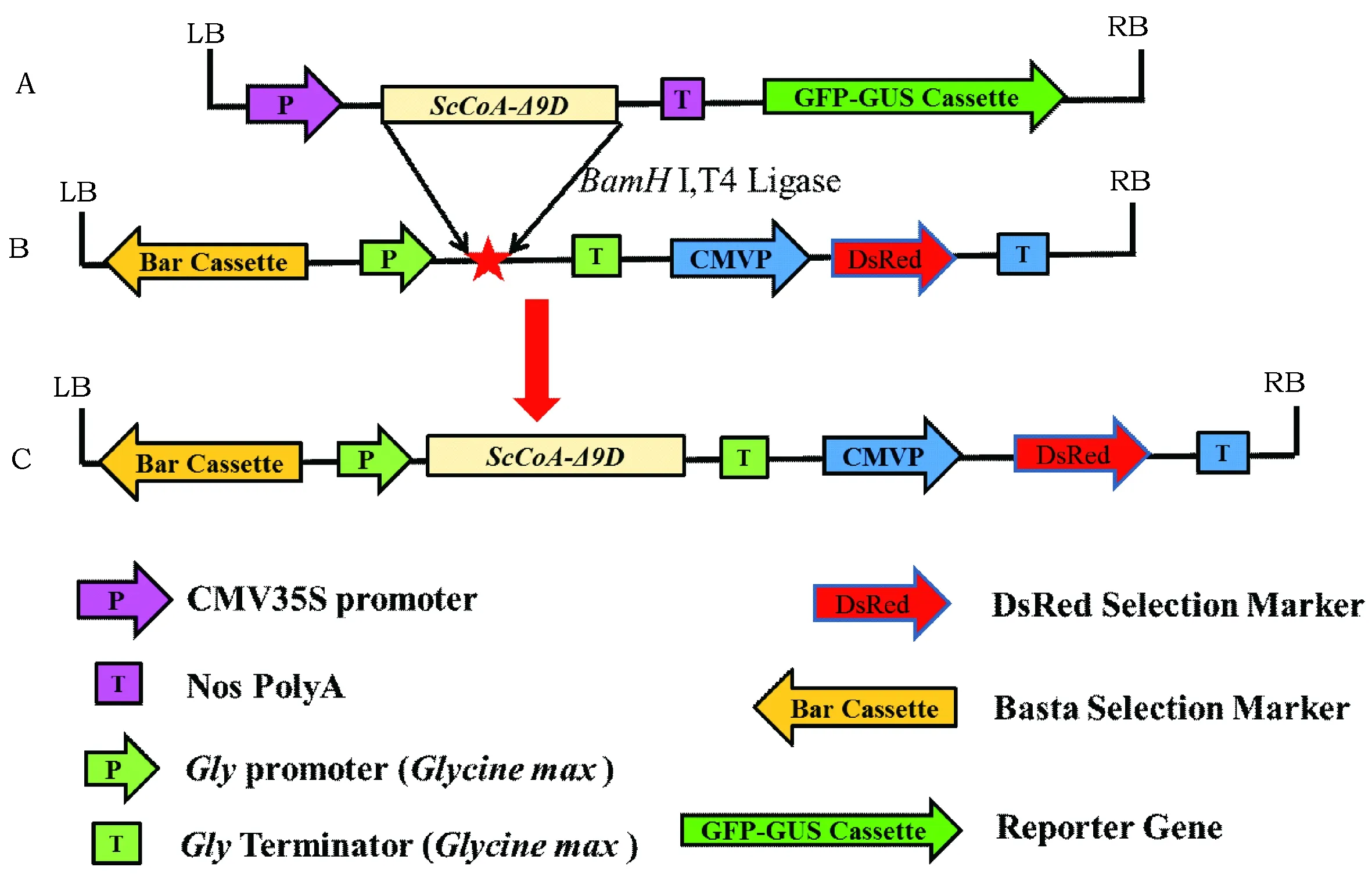
图1 种子特异性ScCoA-Δ9D超表达载体构建图Fig.1 Recombination of overexpression vector of ScCoA-Δ9D gene

图2 农杆菌介导的棉花遗传转化流程Fig.2 Cotton genetic transformation process with Agrobacterium-mediated method
2.3 阳性幼苗ScCoA-Δ9D基因的PCR检测和表达分析
本试验随机挑选18株经过抗生素筛选的阳性T0代转基因幼苗(图3B:1~18号)分别进行目的基因检测。结果表明:将近99%的再生苗能够扩增出501 bp大小的目的基因片段,只是扩增条带的强弱不同,表明扩增效率各不相同,这些片段大小与含上述表达载体的阳性质粒扩增片段(图3B“+”)大小一致,而在非转基因棉花的下胚轴中均未扩增出目的片段(图3B,“CK”),表明已经成功获得不同转化事件的转基因棉花株系。
对上述阳性幼苗作表达分析(图4),发现棉花叶片中该基因与草铵膦基因(Bar)相比,表达量很低,这可能是启动子类型不同造成的,驱动Bar基因表达的启动子为CaMV35S,而驱动ScCoA-Δ9D基因表达的是大豆种子特异性启动子。另外,该基因在非转基因棉花无任何表达,这表明,该基因不仅成功转入棉花中而且也能在叶片中有所表达。研究表明,这类型组织特异性启动子驱动下的基因仅在相应组织中是高量表达的[22],Cahoon等在亚麻荠中使用该类型启动子特异性分别同时驱动突变型Δ9-16∶0-ACP和Δ9-16∶0-CoA基因,结果使种子内包括棕榈油酸在内的ω-7脂肪酸含量从1.4%提高到约23%[14];王丕武等从大豆中分别克隆了种子、种皮和根特异性启动子,通过表达和GUS染色分析,表明这些组织特异性启动子均驱动基因在这些组织中高表达,且均比CaMV35S启动子驱动下的表达量低,而在叶,花等其他组织中表达均很弱[23]。
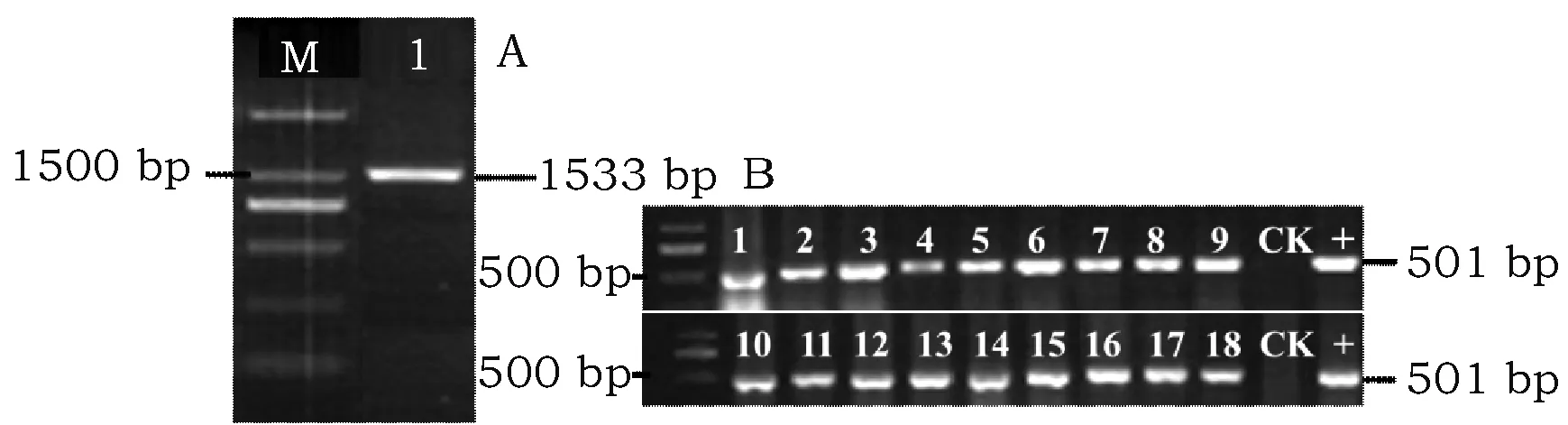
图3 ScScCoA-Δ9D基因亚克隆片段及阳性幼苗PCR检测图Fig.3 Subcloning fragment of ScScCoA-Δ9D gene and PCR detection for positive seedlings 注:A:1%琼脂糖凝胶电泳中的ScCoA-Δ9D亚克隆,“M”代表分子量为2 000 bp的Marker,“1”代表目的扩增片段;B:阳性转基因幼苗的PCR鉴定,“1~18”代表转基因棉花幼苗叶片,“CK”代表非转基因棉花下胚轴,“+”代表阳性pJC-ScCoA-Δ9D-DsRed质粒。Note:A: Subcloning of ScCoA-Δ9Dgene in 1% agarose gel electrophoresis,"M"represents marker with a molecular weight of 2 000 bp and "1" represents the target amplified fragment;B:PCR amplification of positive transgenic seedlings. "1-18" represents transgenic cotton seedlings, "CK" represents the hypocotyl of non-transgenic cotton, and "+" represents positive plasmid of GlyP-ScCoA-Δ9D-DsRed.
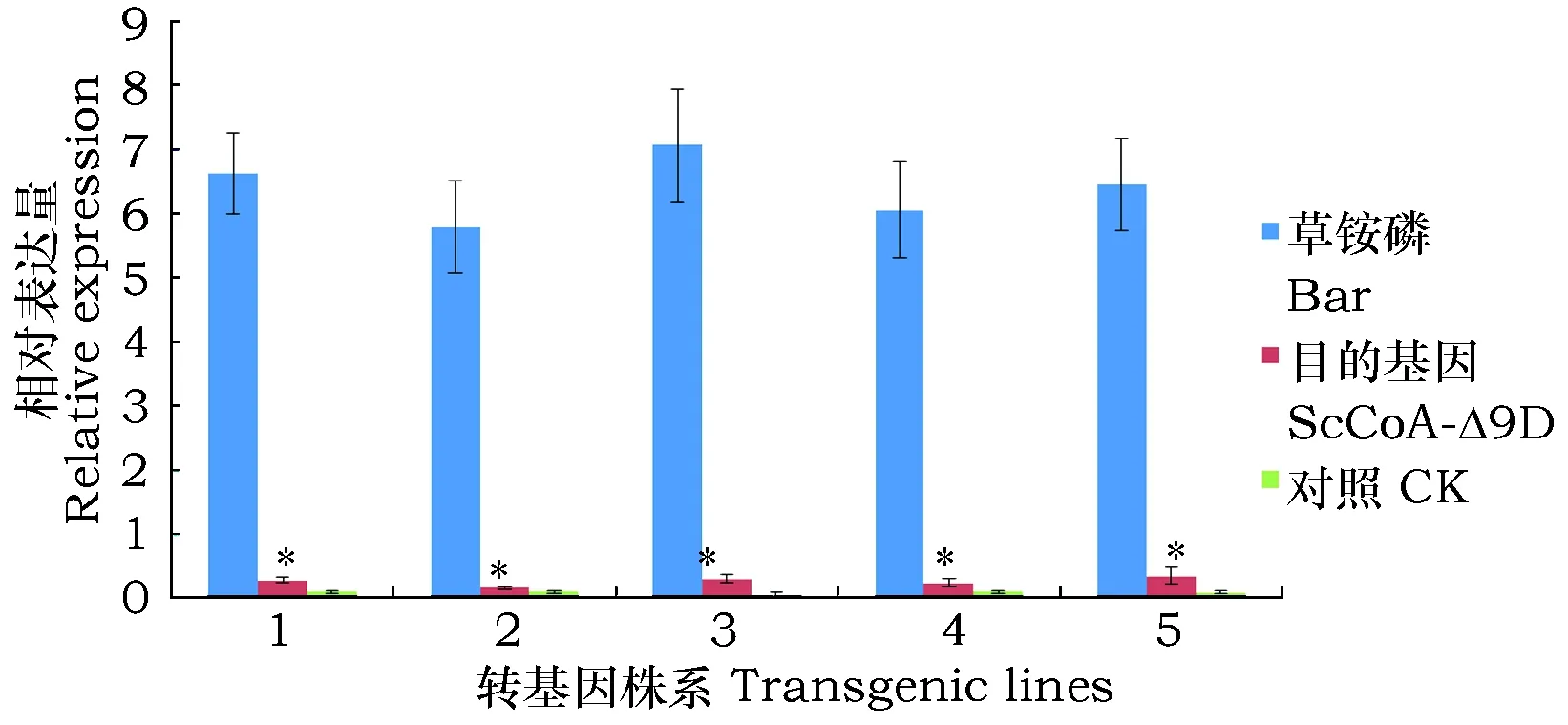
图4 转基因棉花ScCoA-Δ9D基因的表达情况Fig.4 The expression pattern of ScCoA-Δ9D in transgenic cotton 注:1~5种为转基因棉花。Note:"1~5"represent transgenic cotton.
3 讨论
棕榈油酸(C16∶1Δ9)是一类珍稀ω-7单不饱和脂肪酸,具有重要的营养和工业价值。比如,棕榈油酸能够修饰细胞膜转运系统、提高人体免疫力,还可对老年人中风等疾病具有特殊功效[24,25]。而较多的亚油酸则可升高血液中胆固醇的含量, 增加心脏疾病和结肠癌等各类疾病的发生率。为提高成品油抗氧化性,在加工过程中经常要进行氢化处理,而氢化处理则导致一些反式脂肪酸形成。反式脂肪酸对人体有害,可诱发各类疾病的发生率[26]。试验证明,ScCoA-Δ9脱氢酶是是一种膜结合蛋白,能特异性识别16∶0-CoA,选择细胞质膜上的16∶0-CoA为底物,将其催化脱氢形成16∶1-CoA,棉籽内含有约25%的棕榈酸,居于油料作物之首,可为ScCoA-Δ9脱氢酶提供充足的底物[3]。本研究从pCAMBIA1303单基因载体上亚克隆出ScCoA-Δ9D基因,并将其通过连接酶连入大豆种子特异性启动子驱动的表达载体中,旨在过量表达外源ScCoA-Δ9D基因,期望将棉籽内更多的C16∶0脱氢形成C16∶1Δ9,从而增加棉籽中棕榈油酸的含量。
目前,通过农杆菌浸染棉花下胚轴从而获得转基因棉花还是最为有效的方法。尽管组培过程较为漫长,但还是能够在含激素和抗生素培养基上成功诱导受浸染的棉花下胚轴切断长出抗性愈伤组织,随后愈伤分化为淡黄色致密的分化胚,最后形成转基因幼苗,经PCR基因鉴定,均能确定该基因已经整合进入棉花基因组中。通过棉花叶片表达分析表明,该基因在大豆种子特异性启动子驱动下的表达量非常低,明显低于CaMV35S启动子驱动下的Bar基因的表达量,这也验证了组织特异性启动子驱动下,基因在相应组织中高量表达的情况。这将为后续转基因棉籽中该基因的表达和脂肪酸成分检测打下良好的试验基础。
[1]Wang N H, Ma J J, Pei W F, et al.A genome-wide analysis of the lysophosphatidate acyltransferase (LPAAT) gene family in cotton: organization, expression, sequence variation, and association with seed oil content and fiber quality[J].BMC Genomics, 2017, 18(1):218-236.
[2]吴永美,毛雪,王书建,等.植物ω-7脂肪酸的系统代谢工程[J]. 植物学报,2011,46 (5): 575- 585.
[3]Wu Y M, Li R Z, Hildebrand D F.Biosynthesis and metabolic engineering of palmitoleate production, an important contributor to human health and sustainable industry [J]. Progress in Lipid Research,2012,51(4):340-349.
[4]张哲,于静,周正香,等.应用气相色谱法对63种市售散装植物油全脂肪酸组成的分析研究 [J].农产品加工(学刊),2013,10:76-78.
[5]Mozaffarian D, Cao H, King I B, et al. Trans-palmitoleic acid, metabolic risk factors, and new-onset diabetes in U.S. adults: a cohort study [J]. Annals of Internal Medicine, 2010,153(12):790-799.
[6]Yang Z H, Miyahara H,Hatanaka A. Chronic administration of palmitoleic acid reduces insulin resistance and hepatic lipid accumulation in KK-Ay Mice with genetic type 2 diabetes[J]. Lipids in Health and Disease,2011,10(1):120-128.
[7]Ciubota-Rosie C, Ruiz J R, Ramos M J, et al. Biodiesel from camelina sativa: a comprehensive characterisation [J]. Fuel, 2013,105: 572-577.
[8]Durrett T P, Benning C, Ohlrogge J,et al. Plant triacylglycerols as feedstocks for the production of biofuels [J]. Plant Journal,2008, 54(4):593-607.
[9]Nguyen H T, Mishra G, Whittle E,et al.Metabolic engineering of seeds can achieve levels of omega-7 fatty acids comparable with the highest levels found in natural plant sources [J]. Plant Physiology, 2010, 154(4):1897-1904.
[10]Cahoon E B, Shah S, Shanklin J, et al. A determinant of substrate specificity predicted from the acyl-acyl carrier protein desaturase of developing cat's claw seed [J]. Plant Physiology,1998, 117(2):593-598.
[11]Gummeson P O, Lenman M, Lee M, et al. Characterisation of acyl-ACP desaturases from Macadamia integrifolia Maiden & Betche and Nerium oleander L [J]. Plant Science, 2000,154(1):53-60.
[12]Olas B. The beneficial health aspects of sea buckthorn (Elaeagnusrhamnoides(L.)A.Nelson) oil [J]. Journal of Ethnopharmacology, 2017, 213:183-190.
[13]Nguyen H T, Mishra G, WhittleE, et al. Metabolic engineering of seeds can achieve levels of ω-7 fatty acids comparable with the highest levels found in natural plant sources [J]. Plant Physiology, 2010,154(4): 1897-1904.
[14]Nguyen H T, Park H, Koster K L,et al. Redirection of metabolic flux for high levels of omega-7 monounsaturated fatty acid accumulation in camelina seeds [J]. Plant Biotechnology Journal, 2015, 13(1):38-50.
[15]Bondaruk M, Johnson S, Degafu A, et al.Expression of a cDNA encoding palmitoyl-acyl carrier protein desaturase from cat's claw (Doxanthaunguis-catiL.) in Arabidopsis thaliana and Brassiea napus leads to accumulation of unusual unsaturated fatty acids and increased stearic acid content in the seed oil [J]. Plant Breeding,2007, 126(2): 186-194.
[16]Kinney A J, Cahoon E B, Hitz W D. Manipulating desaturase activities in transgenic crop plants [J]. Biochemical Society Transactions, 2002, 30(6): 1099-1103.
[17]Stukey J E, McDonough V M, Martin C E. The OLE1 gene of Saccharomyces cerevisiae encodes the delta 9 fatty acid desaturase and can be functionally replaced by the rat stearoyl-CoA desaturase gene [J]. Journal of Biological Chemistry, 1990, 265(33):20144-20149.
[18]Marillia E F, Giblin E M, Covello P S, et al. A desaturase-like protein from white spruce is a Delta(9) desaturase [J]. FebsLetters, 2002, 526(1-3):49-52.
[19]薛金爱, 毛雪, 吴永美, 等.酵母脂酰-Δ9 脱氢酶亚细胞定位表达及其对烟草脂肪酸合成的影响[J]. 生物工程学报, 2013,29(5): 630-645.
[20]南芝润, 李红芳,张换样,等.转反义GhADF1基因对陆地棉纤维品质的影响[J].中国农业科学,2009,42(12):4139- 4144.
[21]李燕娥,焦改丽,李淑君,等.转基因棉花纯度快速测定法[J].中国棉花, 1998, 25(8): 14-18.
[22]贺红霞,陈亮,林春晶,等.组织特异性启动子在作物基因工程中的研究进展[J].中国农学通报,2014,30(9): 225-231.
[23]曹译文,宋阳,渠可心,等.大豆组织特异启动子的克隆与功能分析[J]. 中国油料作物学报,2017,39(6): 771-777.
[24]Misra A, Singhal N, Khurana L. The metabolic Syndrome and type 2 diabetes in developing countries: Role of Dietary Fats and Oils [J]. Journal of the American College of Nutrition, 2010, 29(3): 289S-301S.
[25]Akazawa Y, Cazanave S, Mott JL,et al. Palmitoleate attenuates palmitate-induced Bim and PUMA up-regulation and hepatocyte lipoapoptosis [J]. Journal of Hepatology, 2010, 52(4): 586-593.
[26]Simonsen K B, Gothelf K V, Jørgensen K A. A Simple Synthetic Approach to 3,3'-Diaryl BINOLs [J]. The Journal of organic chemistry, 1998, 63(21):7536-7538.

