核酸适体-纳米材料复合物用于癌症的诊断与靶向治疗研究进展
白华荣,范换换,张晓兵,陈卓,谭蔚泓
湖南大学化学化工学院,湖南大学化学生物传感与计量学国家重点实验室,分子科学与生物医学实验室,生命科学学院,核酸适体湖南省工程实验室,长沙 410082
1 引言
尽管人类对疾病的了解与日俱增,但是癌症在全世界范围内依然具有较高的死亡率1。已有的癌症治疗手段,包括化疗与放疗,由于缺乏对癌细胞特异性的了解,治疗的同时往往会带来较为严重的毒副作用。因此发展能够有效杀死肿瘤细胞,同时不损害正常细胞的癌症治疗方法具有非常重要的意义2。
纳米材料,如二氧化锰纳米材料3,4、上转化纳米颗粒5、磁性纳米颗粒6和DNA纳米材料7-9等,具有独特的光、电、磁、热等性能。随着纳米技术的快速发展,纳米材料因其优异的性能在癌症治疗方面展现出巨大的潜力,并被广泛应用于生物医学领域10。作为药物载体,通过实体瘤的高通透性和滞留效应(enhanced permeability and retention effect,EPR,即相比于正常组织,特定尺寸的分子或颗粒更倾向聚集于癌组织),纳米材料能够非特异性地聚集在癌组织部位。但是 EPR效应的被动靶向效率较低11。通过将能特异性识别抗原或者肿瘤细胞标志物的靶向配体与纳米材料结合,可以实现纳米材料在肿瘤组织的主动靶向聚集,同时减轻对正常组织的毒性。例如,Tian等12报道在老鼠活体实验中,修饰了特异性识别癌细胞的靶向配体的胶束纳米材料,与不具有靶向性的胶束相比,前者能够更好地在肿瘤部位主动靶向聚集。近年来,在癌症治疗方面,肿瘤细胞特异性靶向的纳米材料已成为一项具有巨大应用潜力的技术。另外,因具有独特的光学特性、磁性或者光热效应等特点,纳米材料也可以实现对癌症的诊断与治疗。
核酸适体是指通过指数富集配体系统进化的技 术 (Systematic Evolution of Ligands by EXponential Enrichment,SELEX)筛选得到的具有20-60个碱基的单链寡核苷酸,并能够高亲和性和高特异性与靶标结合13,14。核酸适体的靶标范围很广泛,包括小分子15、蛋白质16,甚至是细胞与组织17-20。相对于抗体,核酸适体具有很多独特优势,比如分子量小,可人工合成,稳定性高,免疫原性低等21,22。这些优势表明核酸适体是癌症靶向治疗的理想工具。
将纳米材料与具有特异性识别能力的核酸适体结合,从而形成的核酸适体-纳米材料复合物可以为癌症治疗提供一种更有效的、低毒副作用的方法23-26。结合近几年我们课题组在核酸适配体与纳米材料方面的研究工作,本文主要总结了核酸适体-纳米材料复合物用于癌细胞的特异性识别及癌症诊疗新策略等方面取得的研究进展。

谭蔚泓,中国科学院院士,发展中国家科学院院士,现任湖南大学化学化工学院教授,博士生导师,国家“千人计划”入选者,长江学者特聘教授,化学生物传感与计量学国家重点实验室主任。主要研究方向为生物分析化学、化学生物学、纳米生物技术和生物医学工程。
2 核酸适体-纳米材料复合物用于癌细胞的识别
发展能够高灵敏、高选择性地检测癌细胞的新方法对于癌细胞的靶向治疗具有重大意义。近年来研究人员构建了多种核酸适体-纳米材料复合物来实现对癌细胞的特异性识别。
Zhu等27成功构建了基于核酸适体修饰的DNA 纳 米 器 件 (aptamer-tethered DNA nanodevices,aptNDs),用于特异性识别靶细胞,并可在靶细胞膜表面实现原位自组装。作者选择能特异性识别酪氨酸蛋白激酶 7(protein tyrosine kinase 7,PTK7)的核酸适体sgc8做为模型。其中PTK7在人急性淋巴细胞白血病 T淋巴细胞(CCRF-CEM)膜表面过表达,而在对照细胞人 B淋巴细胞瘤Ramos膜表面没有表达。如图1所示,核酸适体修饰的触发探针与两个部分互补的发卡形单体 M1和 M2通过杂交链反应(hybridization chain reaction,HCR)自聚形成 aptNDs (图 1A),或者核酸适体种子探针与两个部分互补的单体P1和P2通过级联交替杂交反应自聚形成 aptNDs (图1B)。通过对单体的DNA链直接进行化学修饰荧光分子或者通过荧光分子嵌入 DNA双链可以实现对aptNDs进行大剂量的荧光分子标记。荧光分子标记的aptNDs可以锚定在靶细胞表面,通过对荧光信号的检测,从而可以实现对靶细胞的检测。另外,Wang等28将顺铂前药修饰在核酸适体上,然后在细胞膜表面通过引发HCR反应,形成DNA纳米结构,该结构能够促进其内在化进入癌细胞进而达到药物传递的效果。
核酸适体对靶细胞的高特异性识别能力可以改善电化学和电化学发光方法对于癌细胞检测时的选择性29-31。利用荧光和电化学方法,一种信号放大的三明治结构策略,通过核酸适体-DNA串联的量子点探针的构建,实现了对癌细胞进行高选择性和灵敏的检测。该方法具有较高的灵敏度,检测限达到每毫升50个癌细胞32。另外,研究人员还开发了基于核酸适体和 RNA聚合酶的信号放大新策略,用于癌细胞的高灵敏、高选择性检测33。
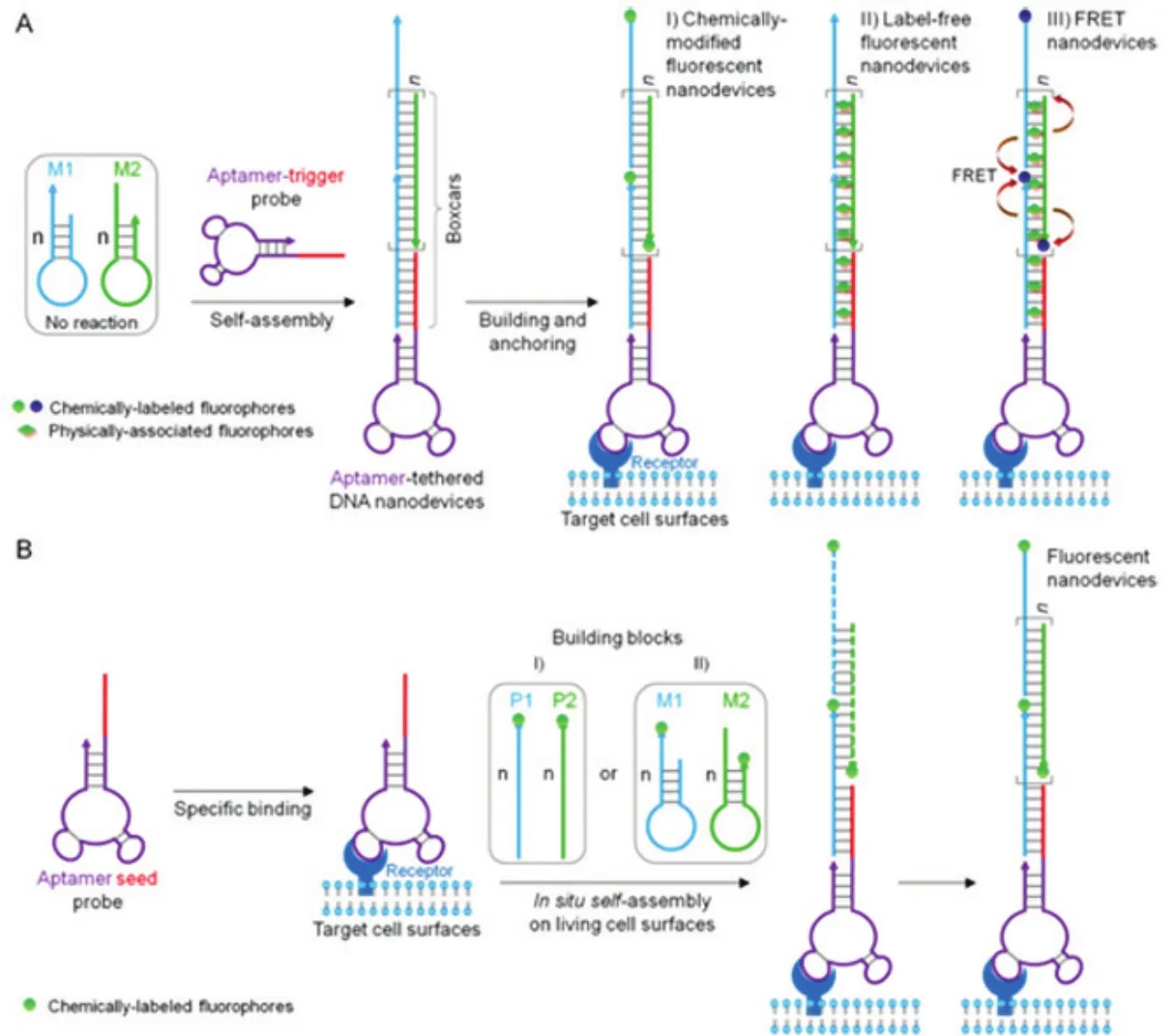
图1 在细胞膜表面原位自组装形成核酸适配体修饰的DNA纳米器件用于特异性识别靶细胞的示意图27 Fig.1 Schematic diagramof fluorescent DNA nanodevices on target living cell surfaces based on anaptamer-tethered DNA nanodevice platform27.
分子成像技术是肿瘤早期检测的一种重要方法。但是单一的分子成像技术存在很多缺点。例如,核磁共振成像具有较高的时空分辨与组织穿透能力,但是灵敏性不高34;而荧光成像技术灵敏性很高,可以实现对单细胞或亚细胞器的荧光成像,但是组织穿透能力较差35。因此,将两种或者多种成像技术相结合,可以达到更高的成像灵敏度、时空分辨和组织穿透能力36。
Zhao等37利用二氧化锰纳米片吸附标记有荧光团的核酸适体,开发了一种靶向可激活的荧光/核磁共振双模成像体系用于癌细胞成像与检测,如图 2所示。二氧化锰纳米片的原子几何结构是八面体,锰原子周围的六个氧原子可以将锰原子与周围的水环境隔离,从而使其不能影响质子的横向或纵向弛豫。因此,与Mn2+相比,二氧化锰纳米片是一个很弱的T1和T2核磁信号造影剂。另外,当标记有荧光团的核酸适体被吸附到二氧化锰纳米片上后,其荧光被猝灭。因此,二氧化锰纳米片既可以作为核酸适体的纳米载体促进其进入细胞,又可以猝灭荧光,还可以被细胞内的谷胱甘肽还原产生大量的Mn2+作为核磁共振成像的造影剂。没有靶细胞时,该探针的荧光信号和核磁信号都处于关闭状态,而一旦靶细胞出现,核酸适体就可以识别靶细胞并与之结合,这种结合会弱化核酸适体和二氧化锰纳米片之间的吸附作用,导致一部分的荧光恢复,细胞膜表面的荧光增强。同时,这种结合也会促进二氧化锰纳米片被细胞内吞,进入细胞的二氧化锰可以被谷胱甘肽还原为大量的Mn2+,Mn2+可以作为核磁共振造影剂用于核磁共振成像。多功能的二氧化锰纳米片具有较好的生物相容性可以促进其在癌症治疗方面的应用。因此,这一智能的纳米体系作为一种多功能治疗工具在生物医学领域具有很大的发展前景。

图2 核酸适配体-二氧化锰纳米探针用于荧光/核磁共振双模成像的激活机制37Fig.2 Activation mechanism of the MnO2nanosheet-aptamer nanoprobe for fluorescence/MRIbimodal tumor cell imaging37.
研究证明双亲性嵌段共聚物可自组装形成不同的形态,含有亲水性DNA片段和疏水性有机聚合物单元的共聚物在一定的条件下也可以形成DNA胶束38-40。对于DNA修饰的纳米颗粒复合物来说,高浓度情况下,无机组分的核可能会对细胞产生一定的毒性,但 DNA胶束没有无机的核,而且通常合成 DNA胶束的时间相较来说较短。为了赋予 DNA胶束更多的适用性和功能,Wu等41用核酸适体来取代普通DNA并连接上疏水的脂质尾。实验证实了构建在核酸适体-胶束复合物中的核酸适体依然能识别其特异性的靶标。核酸适体 TDO5在 37°C条件下无法识别靶细胞Ramos细胞42。但是由于胶束装载了密集的TDO5,所以在相同条件下TDO5-胶束复合物对其靶细胞表现出高亲和性和选择性。核酸适体-胶束复合物的优点还包括提高其亲和力,降低其从细胞膜上的脱落率,提高快速靶向能力和有效药物装载。因此,我们构建的核酸适体-胶束复合物在癌细胞识别和活体内药物运输方面具有很大的潜能。
3 核酸适体-纳米材料复合物用于癌细胞的靶向治疗
作为靶向识别配体,核酸适体能够通过区分癌细胞与正常细胞,从而选择性地将治疗药物运输到靶细胞以达到有效的化学药物治疗。核酸适体可以很容易地与生物相容的有机或无机纳米材料结合,从而可以为不同的配体和药物分子提供运输平台。核酸适体引导的药物传递系统,如脂质体和胶束,有机纳米颗粒和无机纳米颗粒,已经被研究人员广泛应用于抗癌药物的运输中43。接下来,本文讨论了几种具有代表性的核酸适体-纳米材料复合物应用于癌症的靶向治疗(表1)。
3.1 核酸适体功能化的有机纳米材料
生物相容性好和可降解的有机纳米材料是最常用的靶向药物运输载体。这些材料可以用来封装各种药物,并可通过核酸适体进行修饰以提高特异性,从而使肿瘤细胞中药物积累,同时系统性毒性相应降低。在此,我们主要讨论核酸适体修饰的脂质体,DNA树枝状纳米材料和球形DNA纳米颗粒等,用于靶向成像、化学药物治疗。
脂质体是临床上最常用于药物传输的纳米系统。我们将核酸适体sgc8修饰的脂质体用于靶细胞的药物运输,证实了核酸适体引导的脂质体传递系统的特异性和有效性。将我们开发的核酸适体-脂质体复合物与癌细胞孵育30 min之后,通过流式细胞仪检测,可知sgc8-脂质体复合物可特异地结合靶细胞CCRF-CEM细胞,而对其他非靶向细胞(NB4细胞)则没有结合44。在另一项研究中,脂质体表面连接了巯基修饰的 E-选择素核酸适体。在小鼠实验中将所得脂质体复合物静脉注射,结果证实脂质体复合物可以在乳腺肿瘤移植瘤血管中积累,且循环半衰期没有受影响45。
在癌症治疗方面,基于DNA的纳米材料也被用于靶向药物转运46。因此到目前为止,研究人员已经开发出了各种DNA纳米材料,如DNA折纸,DNA四面体,纳米小火车和纳米花(nanoflowers,NFs)。核酸适体和 DNA 纳米材料的结合可以将核酸适体的特异性识别能力与DNA纳米材料的高灵敏性的生物分析,与疾病相关的生物标志物检测以及靶向治疗手段相融合。通过分子和纳米工程,研究人员已经开发出各种核酸适体修饰的DNA纳米材料,作为药物载体,用于靶向治疗,并实现对靶细胞中的生物活动进行调控。Zhang等47开发了基于DNA树枝状纳米结构的一种多功能的药物运输载体用于靶向肿瘤细胞成像和药物传递。
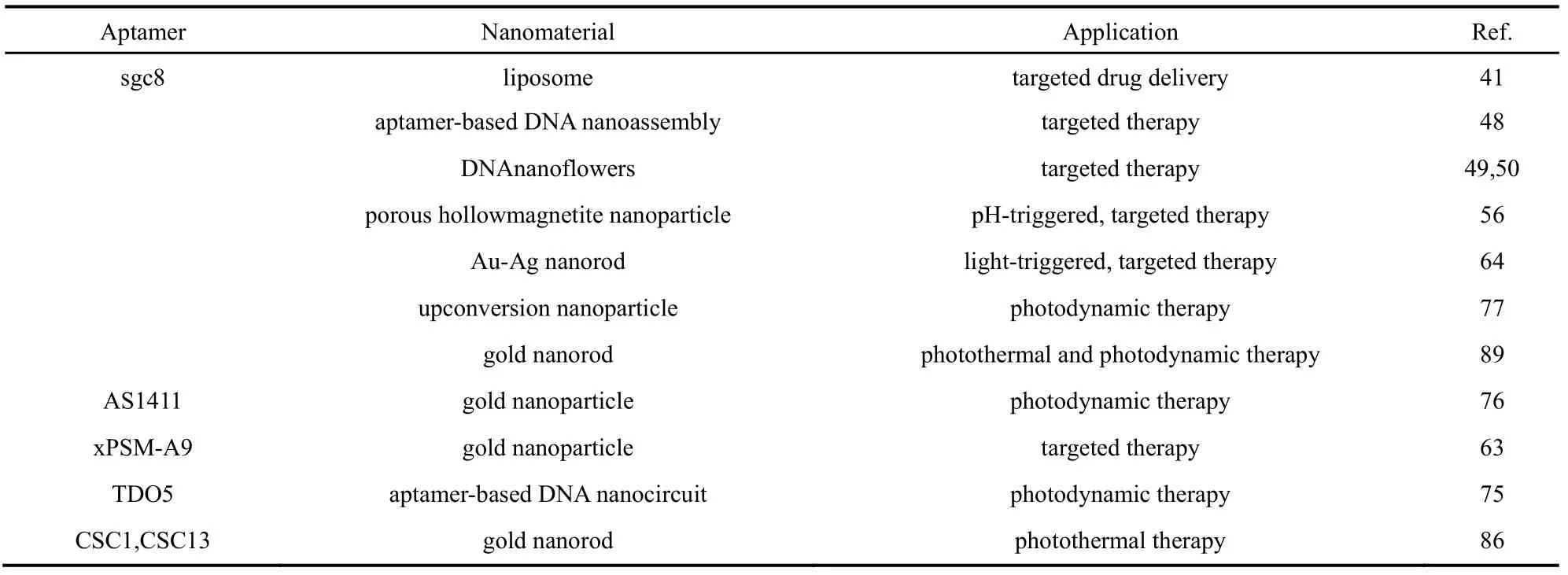
表1 核酸适体-纳米材料复合物用于肿瘤靶向治疗Table 1 Summary of aptamer-conjugated nanomaterials for targeted cancer therapy.
研究表明,基于DNA树枝状纳米结构和核酸适体,可以将核酸适体整合到树枝状 DNA框架上。通过树枝状DNA纳米结构将功能核酸有效地输送到活细胞中,实现对活细胞内生物分子的实时监控。如图 3所示,首先通过预先设计的碱基对杂交,设计不同的Y型DNA单体,包括具有靶向性的核酸适体,具有治疗效果的反义寡核苷酸和可装载抗癌药物。然后,通过互补序列,这些功能性DNA单体可以连接到一个X形的DNA核连接器上。最后,这些数以百计的(~100-200) 5ʹ端修饰丙烯酰胺基的基础构筑单元可以通过进一步光交联形成可编程和多功能的核酸适体修饰的DNA纳米载体。构建的核酸适体修饰的DNA纳米载体具有可编程性、简单的模块化设计和组装、选择性识别和运输,以及优异的生物稳定性和生物相容性等优点。实验结果也证实该DNA纳米药物载体对靶细胞有特异性的细胞毒性作用。DNA纳米载体中针对 P-糖蛋白的反义寡核苷酸可以抑制 P-糖蛋白表达,从而降低靶细胞的耐药性,其中 P-糖蛋白是一种药物外排泵,可将细胞内药物泵出细胞外,从而使细胞产生耐药性48。此外,实验结果表明,与核酸酶孵育24 h之后,该纳米结构能够稳定存在。该实验结果说明形成的DNA纳米结构能够增强该结构的抗核酸酶降解的能力
由于DNA的生物学特性,DNA纳米结构也可以通过酶反应得到。核酸适体修饰的DNA纳米花NFs是通过对DNA模板的滚环复制扩增产生的大量重复 DNA链自组装形成纳米颗粒(图4)。不同于传统的DNA纳米结构,如DNA四面体,DNA树枝状分子,DNA折纸和基于杂交链反应的DNA聚合物,DNA纳米花的组装是由液态结晶和重复DNA链的密集堆叠形成而不是通过DNA杂交驱动。基于DNA链的可编程性,通过对DNA模板的合理设计,可以很容易地将核酸适体、药物和染料分子整合在颗粒大小可调和结构稳定的纳米花结构中。实验表明 DNA纳米花与核酸酶孵育24 h之后,能够保持较完整的形态。而且在人血清中孵育24 h后,DNA纳米花也依然稳定存在49。DNA纳米花的高稳定性,使其在复杂的生理情况下具有很好的应用前景,如临床诊断、生物医学和生物技术方面。因此DNA纳米花可以实现靶向肿瘤细胞、生物成像和靶向药物传递,是一种理想的生物医学研究工具。
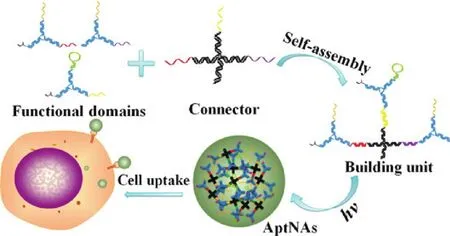
图3 多功能自组装纳米单元光交联形成纳米组装载体的示意图48Fig.3 Schematic illustration of multifunctional self-assembled nanoassemblybuilding units and photo-cross-linkednanoassembly structure48.
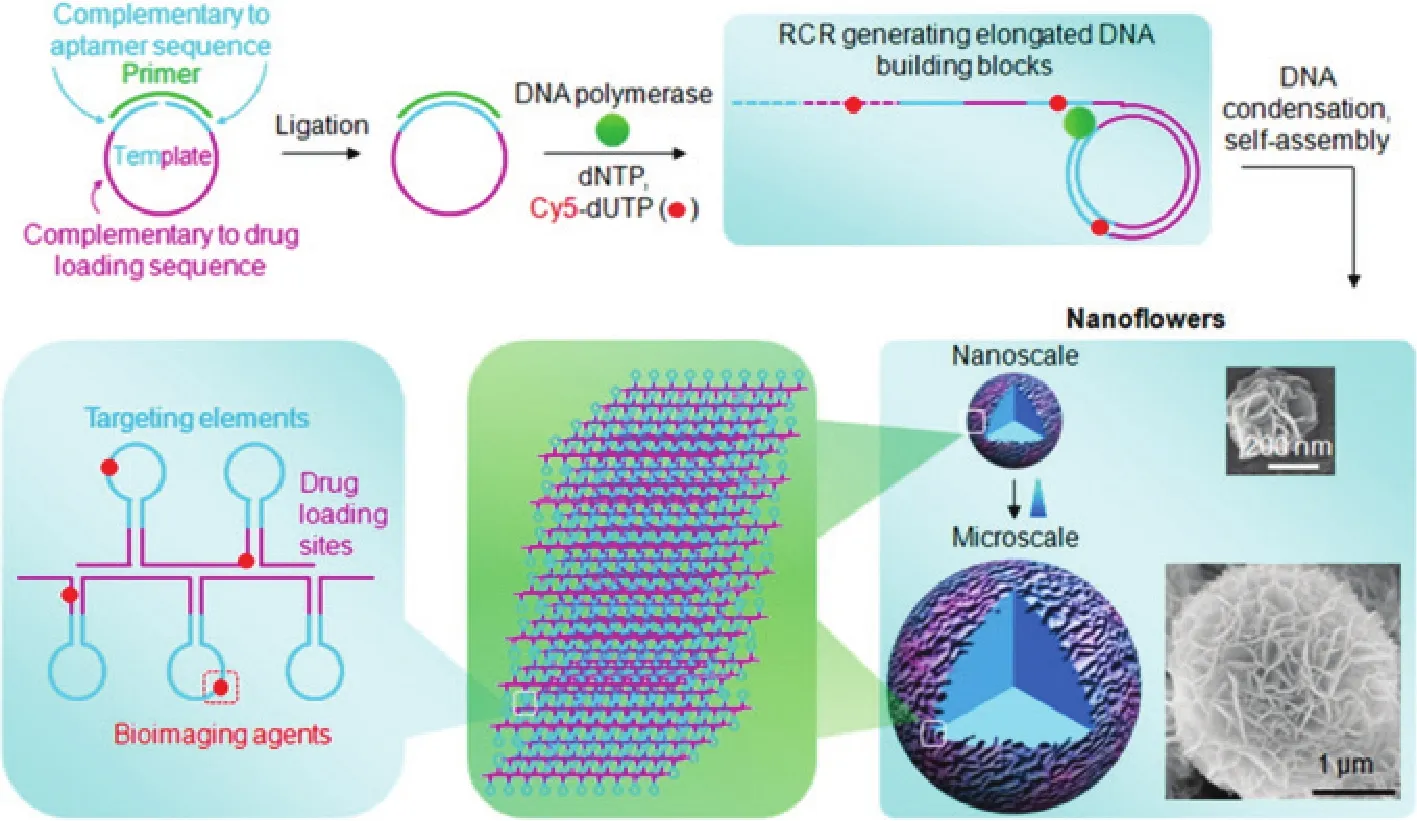
图4 DNA纳米花的形成原理图49Fig.4 Schematic illustration of noncanonical self-assembly of multifunctional DNA NFs49.
Hu等50使用类似的方法构建了核酸适体修饰的荧光共振能量转移(fluorescence resonance energy transfer,FRET)DNA 纳米花 FRET-NFs。将标记了不同荧光团的核苷酸,包括荧光素FAM修饰的脱氧尿苷三磷酸(FAM-dUTP),花菁染料Cy3修饰的脱氧尿苷三磷酸(Cy3-dUTP),和6-羧基-X-罗丹明 ROX 修饰的脱氧尿苷三磷酸(ROX-dUTP),通过滚环扩增反应可以同时将上述核苷酸整合到DNA纳米花上。改变酶反应中的这些荧光团的比例,可以对荧光共振能量转移介导的发射信号进行调节,这样在单激发波长下,DNA纳米花就能表现出不同荧光信号。因此,DNA纳米花不仅可以实现在单个波长的激发下表现出多重和极亮的荧光信号,而且还可以实现特异性靶向肿瘤细胞和药物运输。FRET-NFs还具有较大的斯托克斯位移,有利于其在复杂的生物环境中的应用。因此,核酸适体-DNA纳米材料复合物有望应用于多种生物医学领域。
3.2 核酸适体功能化的无机纳米材料
与传统的颗粒相比,无机纳米材料具有很独特的物理化学性质,比如表面效应、量子尺寸效应、小尺寸效应、宏观量子隧道效应等。由于较大的比表面积与独特的尺寸和形状,以及组成成分依赖的物理和化学性质,无机纳米材料已被广泛应用于生物医学领域51,52。结合核酸适体,无机纳米材料可以实现多种模式集于一体,如目标识别,检测,药物传递和控制释放。基于核酸适体功能化的无机纳米材料具有的良好特性,目前核酸适体修饰的氧化铁纳米颗粒、金纳米材料和二氧化硅纳米粒子吸引了研究人员的广泛关注。
磁性纳米颗粒可以增强来自周围水分子的质子磁共振信号。在这些生物相容的无机材料中,磁性纳米颗粒作为药物载体已推向临床试验应用53,54。而核酸适体修饰的磁性纳米颗粒可以实现药物传递和磁共振成像55。如图 5所示,基于可装载抗癌药物阿霉素 DOX的多孔空心四氧化三铁纳米颗粒、双官能团的聚乙二醇PEG和核酸适体sgc8,Chen等56成功构建了一个智能的多功能纳米颗粒(smart multifunctional Nanostructure,SMN)用于癌细胞的靶向运输药物和磁共振成像。核酸适体对SMN外层的修饰产生了多价效应,从而增强了SMNs对靶细胞的特异结合和内化作用。SMN进入溶酶体之后,酸性环境会使纳米颗粒上对酸性不稳定的孔释放阿霉素,从而有效杀死靶细胞。此外,实验证实 SMNs进入靶细胞之后,可以通过检测T2弛豫信号从而实现T2加权磁共振成像,说明该纳米结构可作为T2造影剂。
在另一项研究中,通过使用不同的 DNA片段,Zheng等57构建了一种可自聚的多功能DNA聚合物包裹的金纳米颗粒。该纳米颗粒由用于成像的荧光标签,可识别靶标的核酸适体和靶向传递药物组成了一个具有较高药物负载能力和特异性识别能力的纳米结构用于癌细胞的诊断与治疗。
金纳米材料因具有高稳定性和生物相容性,合成方便,易于表面修饰靶向分子等特点,在过去十年里,金纳米材料在药物运输与癌细胞治疗方面备受关注58,59。更重要的是,由于具有可调光学特性和强的光热效应,金纳米材料可达到无损及可控的调节光触发的基因/药物释放60,61。
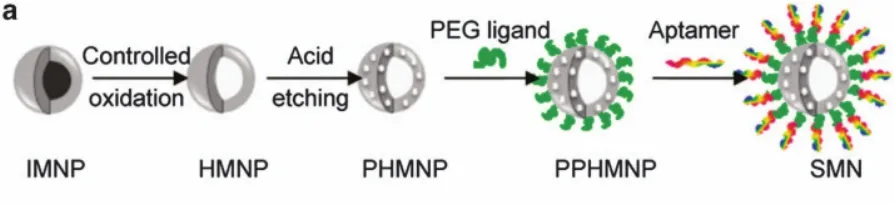
图5 多功能智能纳米颗粒的形成原理图56Fig.5 Schematic illustration of the synthesis of smart multifunctional nanostructures (SMNs)56.
据报道,许多核酸适体-金纳米材料复合物通过核酸适体对细胞膜表面的靶向识别,可以在特定类型的癌细胞表面聚集62。例如,Jon等63报道了一种多功能的核酸适体修饰的纳米金颗粒用于计算机断层扫描CT和癌症治疗(图6)。首先,在金纳米颗粒表面修饰特异性结合前列腺特异性膜抗原PSMA的核酸适体,然后在DNA双链中装载阿霉素DOX。Jon等采用表达PSMA的人前列腺癌细胞LNCaP做为靶细胞和不表达PSMA的人前列腺癌细胞 PC3作对照进行体外细胞检测实验。结果表明,PSMA核酸适体修饰的金纳米颗粒对LNCaP细胞的CT信号强度可达PC3细胞的4倍以上。此外,将装载DOX的金纳米颗粒与上述两种细胞孵育,实验结果显示该材料对靶细胞LNCaP具有更强的杀伤效果。
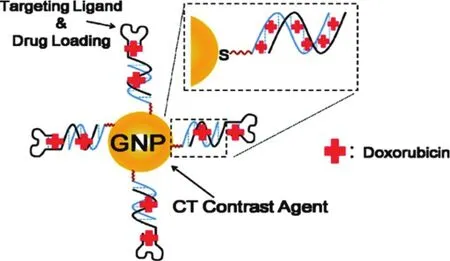
图6 构建装载有DOX的核酸适配体-金纳米颗粒复合物的原理图63Fig.6 Schematic illustration of the method for preparing Dox-loaded aptamer-conjugated gold nanoparticles63.
利用金-银纳米棒,Kang等64构建了DNA交联聚合物包裹的金-银纳米棒平台应用于近红外光响应的药物传递,如图7。在相应的近红外激光束的照射下,金-银纳米棒的光热效应导致周围凝胶温度快速升高,使封装的药物快速释放,从而达到可控释放。体外实验证实,核酸适体功能化的纳米材料可作为药物载体,用于靶向药物的近红外光远程控制释放,并具有高空间/时间分辨率。近红外区的波长位于700-1300 nm,在此范围内组织,血液和水的吸收与自发荧光最小,检测背景较低,因此该设计有望应用于活体检测。
在另一项研究中,利用DNA杂交技术在金纳米棒的侧面组装了载药的金纳米颗粒。当可被特定细胞内在化的核酸适体功能化之后,金纳米棒可以有效地聚集在细胞核周围。在近红外激光照射下,由于金纳米棒的光热效应,载药的金纳米颗粒将被释放,进入细胞核,进而药物分子在细胞核内被释放,达到有效的杀死癌细胞65。
以上研究表明,利用核酸适体作为癌症细胞的靶向配体,为探索核酸适体-纳米材料的复合物用于不同类型癌细胞的高效靶向药物运输提供了新的方法。
4 核酸适体-纳米材料复合物用于癌症治疗的新策略
除了作为靶向药物的运输载体外,纳米材料也已被用来开发新的癌症治疗策略66。将纳米材料独特的光学、电化学和磁性特性与核酸适体的特异性识别特性相结合,可以开发出一系列新的癌症治疗方法用来提高癌症疗效67。本文主要讨论光热治疗(photothermal therapy,PTT)和光动力治疗(photodynamic therapy,PDT)两种新兴模式。
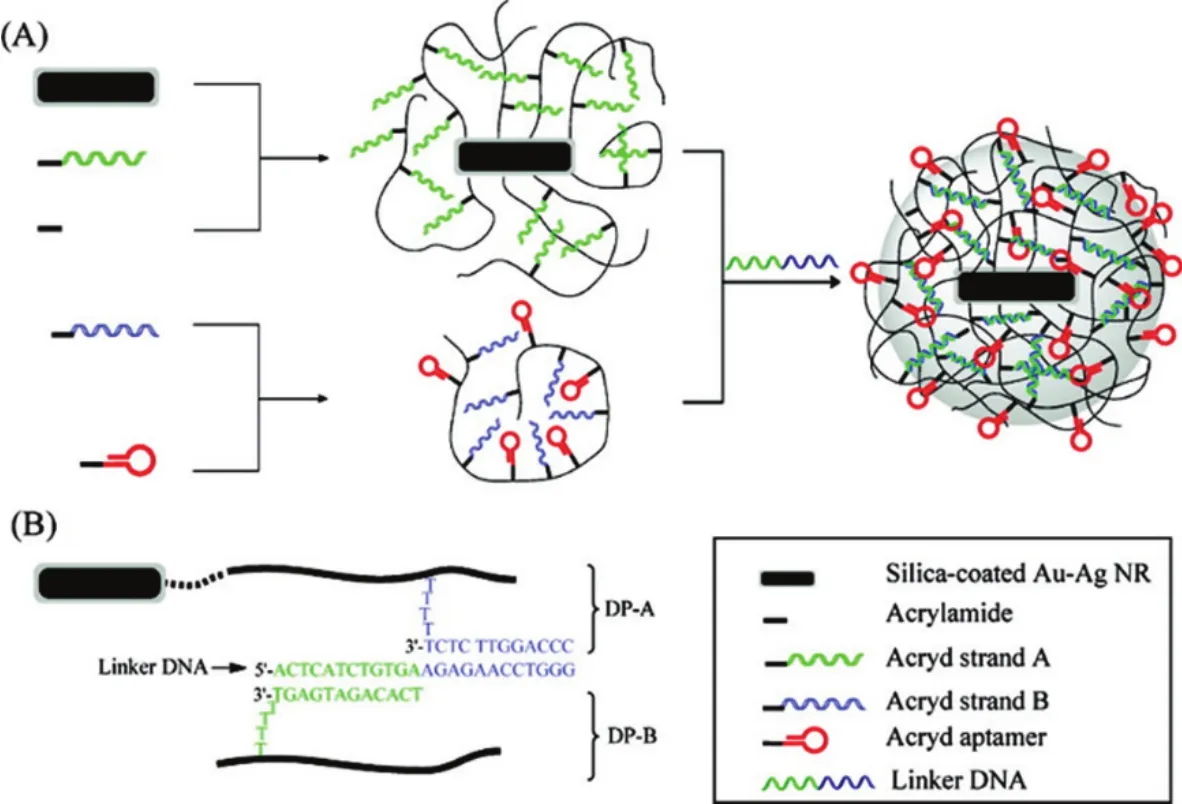
图7 形成核酸适配体功能化的核-壳纳米凝胶原理图64Fig.7 Schematic diagram illustrating the formation of an aptamer-functionalized core-shell nanogel64.
4.1 核酸适体-纳米材料复合物用于癌细胞的靶向PDT治疗
对于疾病治疗来说,光动力疗法是一种新兴的治疗方式68。光动力治疗是一种微创的方法,当光照射时,光敏剂会在氧气存在的情况下,产生活性氧(主要是单线态氧)。活性氧会攻击和损害周围的生物分子,导致细胞增殖抑制,细胞周期阻滞,细胞凋亡或坏死69。通过对光敏剂的光照控制可以在一定程度上实现光动力治疗的选择性,但目前仍然需要开发将光敏剂选择性地运输到病变组织或器官的新方法70。核酸适体修饰的纳米材料已被应用于提高光敏剂在肿瘤组织中的滞留和选择性光诱导癌细胞的损伤从而实现癌细胞的靶向光动力治疗效果71-73。
将光敏剂与核酸适体直接连接或单纯物理嵌入是提高光敏剂在靶点特异性积累的常用方法74。通过DNA自组装形成的DNA纳米载体可以被用于靶向光动力治疗。如图 8所示,核酸适体可以选择性地识别靶细胞,并与细胞膜上的特定蛋白结合。核酸适体DNA链末端延伸出的催化序列可以激活触发点介导的催化链置换反应,从而激活光敏剂 Ce6,达到放大治疗的效果。核酸适体与靶细胞特异性结合才能够激活DNA回路,这样可以将癌细胞与正常细胞区分开,从而减少对附近正常细胞的损害。此外,催化放大反应发生在靶细胞附近,可以使得局部的单线态氧浓度较高,实现选择性损伤靶细胞75。
基于核酸适体-纳米材料复合物的光动力疗法,除了光敏剂 Ce6之外,其他光敏剂也已被用于研究,例如 5,10,15,20-四-(N-甲基吡啶-4-基)-21H,23H-卟啉-四-(P-甲苯磺酸)即 TMPyP4。Huang等76报道了一种核酸适体功能化的金纳米颗粒用来同时递送两种抗癌药物从而提高药效的策略,如图 9所示。金纳米颗粒的表面组装上核酸适体AS1411,其中AS1411可以特异性地与肿瘤细胞膜上的核仁素受体结合。光敏剂 TMPyP4和DOX同时通过物理吸附结合在AS1411修饰的金纳米颗粒上,并传送到靶细胞中。当可见光照射时,光敏剂引起的光动力作用会产生丰富的活性氧,进而造成细胞损伤。将光动力疗法和化学药物疗法的结合可以增强对肿瘤细胞生长的抑制作用,而且得到理想的肿瘤细胞杀伤效果。
到目前为止,大多数光敏剂是可被可见光激活,而可见光的组织穿透深度浅这一特点限制了光敏剂的应用。如果将光敏剂连接到一个可见光发生器上,而发生器的可见光发射可以通过近红外控制,那么可见光的浅穿透深度问题就可以被克服。Yuan等77设想镧系元素掺杂的上转化纳米颗粒可以解决这一问题78。上转化纳米材料能够在近红外光的激发下发射较短波长的光子,这一特性使其成为优异的可见光发生器,并且能够通过近红外光进行远程遥控79,80。作者将一段富 G序列与核酸适体连接,从而形成一个既能装载TMPyP4,也可以特异性识别靶细胞的G4-核酸适体。G4-核酸适体连接在上转化颗粒表面之后,可以将光敏剂 TMPyP4靠近上转化颗粒,从而实现上转化颗粒和 TMPyP4之间的能量转移。当颗粒进入靶细胞之后,上转化颗粒受到近红外光的照射,从而发出可见光,进而激活 TMPyP4,最终产生足够的活性氧来有效损伤靶细胞。因此作者成功构建了一个核酸适体引导的G4 DNA纳米平台,用于靶细胞的生物成像和光动力治疗,它能够选择性识别靶细胞,可控和有效激活光敏剂,并提高治疗效果。

图8 细胞膜表面核酸适配体回路形成原理图75Fig.8 Working scheme of DNA aptamer circuit on cell membrane75.
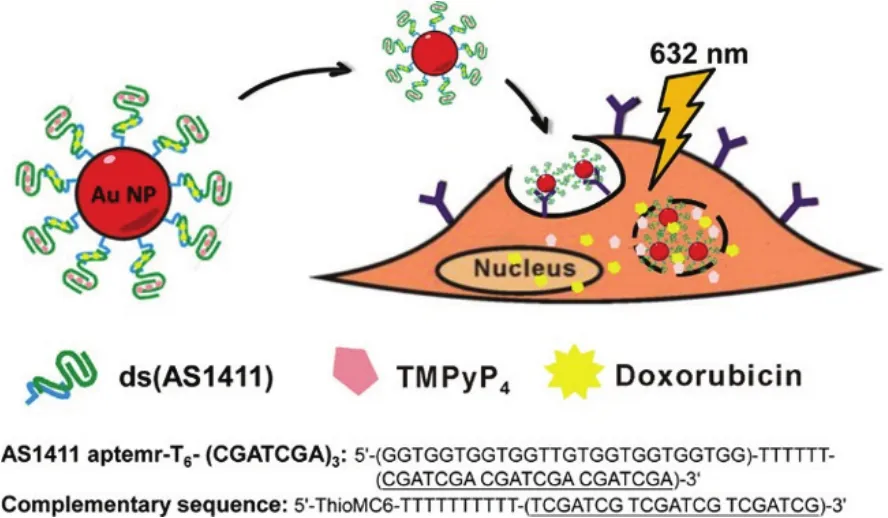
图9 构建负载不同药物的核酸适配体-金纳米颗粒复合物的原理图76Fig.9 Schematic illustration of co-drug-loaded aptamer-functionalized deliveryplatform based on AuNPs76.
4.2 核酸适体-纳米材料复合物用于癌细胞的靶向PTT治疗
与光动力疗法相似,光热疗法是一种相对无创和温和的癌症治疗方法。光热疗法利用相关材料将电磁辐射转化成热量从而诱导产生高温。这种治疗方式使生物组织暴露在高于正常温度的情况下,进而对异常细胞进行破坏81。具有光热效应的纳米材料包括金纳米材料,氧化石墨烯(graphene oxide,GO)等82,这些材料一般易于修饰核酸适体。将材料的EPR效应与核酸适体的特异性靶向相结合,可以实现癌细胞的靶向光热治疗83。
由于金纳米棒在近红外光谱区域的吸收波长可调节的特点,在光热治疗中,金纳米棒具有较高的应用潜能84,85。而与金纳米棒相比,金-银纳米棒具有更高的摩尔吸收率。因此,Huang等86构建了一种基于核酸适体的纳米结构,将金-银纳米棒的高吸收效率与核酸适体的特异性识别结合起来,从而形成一种高效的、选择性靶向癌细胞的光热治疗平台。两种不同的核酸适体修饰的金纳米棒也可以用来同时破坏不同的癌细胞。将特异性识别前列腺癌细胞DU145的核酸适体CSC1和特异性识别其肿瘤干细胞亚群的核酸适体CSC13修饰在金纳米棒表面。在近红外激光照射下,形成的纳米材料被成功地用于靶向和杀死肿瘤细胞和肿瘤干细胞。
5 核酸适体-纳米材料复合物用于癌症多模式联合治疗
由于光热治疗与光动力治疗的优异特性,将两者结合开发出的联合治疗策略在癌症治疗方面拥有巨大潜力,因此光动力疗法/光热疗法相结合的癌症联合治疗策略备受关注。目前研究人员正积极地开发核酸适体-纳米材料复合物应用于癌症联合治疗,以实现高特异识别癌细胞和增强治疗效果的目的。将金纳米颗粒/光敏剂复合材料或不同的纳米材料结合形成的复合材料进行核酸适体功能化,从而构建的多模式治疗方法可显著提高癌症的治疗效果。
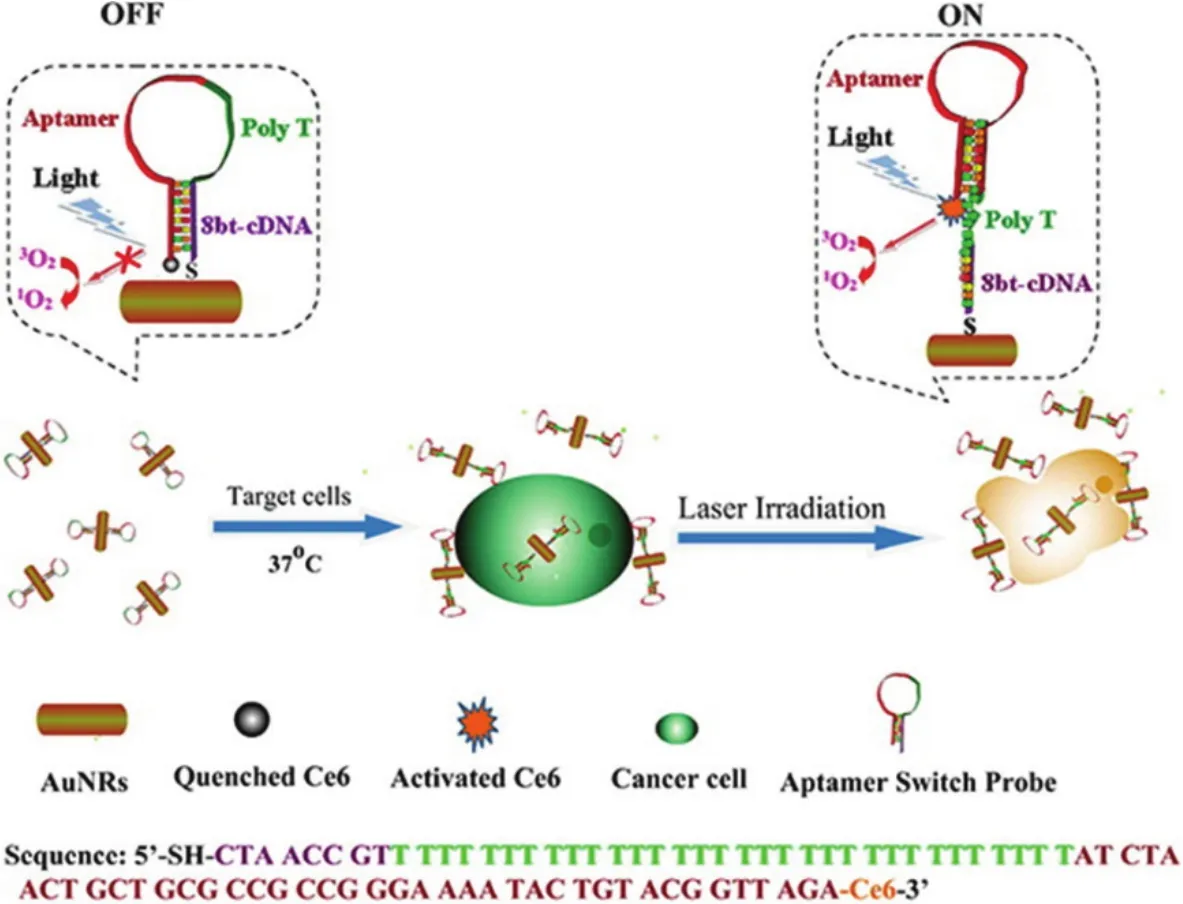
图10 核酸适配体开关探针-光敏剂-金纳米棒的作用原理图89 Fig.10 Schematic representation of aptamer switch probe-photosensitizer-gold nanoparticles for PTT and PDT89.
由于金纳米棒在近红外区域有较强的表面等离子体吸收,所以金纳米棒既可以有效的猝灭光敏剂87,又可以作为光热疗法材料88。结合以上优点,Wang等89将连接有光敏剂Ce6的核酸适体开关探针修饰在金纳米棒表面,用于光动力疗法/光热疗法相结合的多模式癌细胞治疗。如图10所示,当靶细胞不存在时,Ce6被金纳米棒猝灭,没有光动力治疗作用。但是在靶细胞存在的情况下,核酸适体会改变构象,从而促使光敏剂 Ce6远离金纳米棒表面,如果在光照射条件下,光敏剂Ce6就会产生单线态氧,从而实现光动力治疗效果。在近红外光照射时,金纳米棒还可以将光能转换成热,通过光热效应进一步破坏细胞。在光动力和光热效应的协同作用之后,癌细胞的死亡率有显著提高。因此,与单纯的光动力疗法或光热疗法相比,这种多模式的癌细胞治疗策略能够显著提高对癌细胞的协同治疗效果。
作为光热疗法试剂,碳纳米材料也可以吸收近红外光将光能转换为热从而破坏癌细胞90,91。因此可以将不同的材料与碳纳米材料结合形成复合材料,用来开发癌症治疗新策略92。Khan等93对修饰了金纳米笼颗粒的单壁碳纳米管(single wall carbon nanotubes,SWCNTs)复合材料进行了核酸适体功能化,用于靶向成像和光热破坏前列腺癌细胞。
6 总结与展望
长期以来,癌症一直是威胁人类健康的主要疾病之一。然而,传统的癌症治疗手段通常会损害正常组织从引起副作用,而且治疗效果不尽人意。目前,在癌细胞靶向药物运输方面,由于其良好的生物相容性和生物降解性能,脂质体、胶束和高分子纳米粒子等有机纳米材料是具有良好应用前景的材料。而与可生物降解的有机大分子相比,大部分无机纳米材料在生物系统中几乎不能降解。不过,研究人员构建的核酸适体-无机纳米材料复合物是将核酸适体与具有独特光学、电学、磁性、机械力、物理和化学等特性94-99并且具有良好生物相容性的无机纳米材料相结合,为癌症的靶向诊断与治疗提供了相对无创的手段。通过对近年来核酸适体修饰的不同纳米材料研究进展的总结,这些新型的核酸适体-纳米材料复合物能够通过对靶标的特异性识别来提高治疗效果,同时减少副作用的产生。在癌症的诊断和治疗发面,多功能的核酸适体-纳米材料复合物已经成为越来越重要的分子工具。除了作为靶向癌症治疗的平台之外,核酸适体-纳米材料复合物在生物医学领域还可以拥有更广泛的应空间用,例如在三维细胞培养和组织工程等方面。
Liang等100构建的核酸适体功能化的脂质体已成功应用于老鼠活体用于RNA干扰。另外,Tian等12将靶向识别癌细胞的核酸适体修饰在胶束纳米材料上,在老鼠活体实验中证明,该复合物能够在肿瘤部位主动靶向聚集,并对癌细胞有较好的治疗效果。以上结果都证明了核酸适体-纳米材料复合物向临床转化的可能。虽然核酸适体-纳米材料复合物在癌症的靶向诊断和治疗方面具有很大潜力,但这种靶向治疗工具在临床应用中同样也面临一些挑战,例如在活体传感和成像应用中,如何解决纳米材料的毒性和核酸适体的稳定性等。因此我们必须设计和合成出具有优异性能,能够提高核酸适体在活体内稳定性高,毒性低或无毒性的新型纳米材料用于癌症的诊断与治疗。在发展核酸适体-纳米材料复合物时,研究人员可以更多地关注新型纳米材料的开发和核酸适体识别性能与稳定性的增强等。为了提高核酸适体-纳米材料复合物的稳定性与靶向效果,我们可以对复合物的表面性质进行优化。除了调整材料表面的核酸适体密度之外,在纳米材料表面进行 PEG的包裹也可以提高核酸适体的稳定性,延长核酸适体-纳米材料复合物的血液循环时间,从而有效提高靶向效果。基于对多模式诊疗平台的发展和癌症有效治疗策略的研究,我们希望在不久的将来,核酸适体-纳米材料复合物能够在癌症治疗中得到持续快速发展。
(1) Mukerjee, A.; Ranjan, A. P.; Vishwanatha, J. K. Curr. Med. Chem.2012, 19, 3714.doi:10.2174/092986712801661176
(2) Barbas, A. S.; Mi, J.; Clary, B. M.; White, R. R. FutureOncol. 2010,6, 1117.doi:10.2217/fon.10.67
(3) Li, J.; Li, D. X.; Yuan, R.; Xiang, Y. ACS Appl. Mater. Interfaces 2017, 9, 5717.doi:10.1021/acsami.6b13073
(4) Lu, Q.; Ericson, D.; Song, Y.; Zhu, C. Z.; Ye, R. F.; Liu, S. Q.; Spernyak, J. A.; Du, D.; Li, H.; Wu, Y.; Lin, Y.H. ACS Appl. Mater.Interfaces 2017,9, 23325.doi:10.1021/acsami.6b15387
(5) Wei, R. Y.; Wei, Z. W.; Sun, L. N.; Zhang, J. Z.; Liu, J. L.; Ge, X. Q.; Shi, L. Y. ACS Appl. Mater. Interfaces 2016,8, 400. doi:10.1027/acsami.5b09132
(6) Venkateswarlu, S.; Lee, D.; Yoon, M. ACS Appl. Mater. Interfaces 2016,8, 23876.doi:10.1021/acsami.6b03583
(7) Wang, P. F.; Wu, S. Y.; Tian, C.; Yu, G. M.; Jiang, W.; Wang, G. S.; Mao, C. D. J. Am. Chem. Soc. 2016,138, 13579. doi:10.1021/jacs.6b06074
(8) Zhou, W. J.; Li, D. X.; Xiong, C. Y.; Yuan, R.; Xiang, Y. ACS Appl.Mater. Interfaces2016,8, 13303.doi:10.1021/acsami.6b03165
(9) Tian, C.; Kim, H.; Sun, W.; Kim, Y.; Yin, P.; Liu, H. T. ACS Nano 2017,11, 227.doi:10.1021/acsnano.6b04777
(10) Bamrungsap, S.; Zhao, Z.; Chen, T.; Wang, L.; Li, C.; Fu, T.; Tan, W. Nanomedicine2012,7, 1253. doi:10.2217/nnm.12.87
(11) Gu, F. X.; Karnik, R.; Wang, A. Z.; Alexis, F.; Levynissenbaum, E.; Hong, S.; Langer, R.; Farokhzad, O. C. NanoToday2007,2,14.doi:10.5772/51382
(12) Tian, J. W.; Ding, L.; Ju, H. X.; Yang, Y. C.; Li, X. L.; Shen, Z.; Zhu, Z.; Yu, J. S.; Yang, C. J. Angew. Chem.-Int.Edit.2014,53, 9544.doi:10.1002/anie.201405490
(13) Ni, X.; Castanares, M.; Mukherjee, A.; Lupold, S. E. Curr.Med. Chem. 2011,18, 4206. doi:10.2174/092986711797189600
(14) Chang, Y. M.; Donovan, M. J.; Tan, W. J. Nucleic Acids2013,2013, 817350.doi:10.1155/2013/817350
(15) Ellington, A. D.; Szostak, J. W. Nature 1990,346, 818. doi:10.1038/346818a0
(16) Huizenga, D. E.; Szostak, J. W. Biochemistry 1995,34, 656.doi: 10.1021/bi00002a033
(17) Duan, M.; Long, Y.; Yang, C.; Wu, X.; Sun, Y.; Li, J.; Hu, X.; Lin, W.; Han, D.; Zhao, Y. Oncotarget2016,7, 36436. doi:10.18632/oncotarget.9262
(18) Long, Y.; Qin, Z.; Duan, M.; Li, S.; Wu, X.; Lin, W.; Li, J.; Zhao, Z.; Liu, J.; Xiong, D. Sci. Rep. 2016,6, 24986. doi:10.1038/srep24986
(19) Wu, X.; Zhao, Z.; Bai, H.; Fu, T.; Yang, C.; Hu, X.; Liu, Q.; Champanhac, C.; Teng, I.; Ye, M. Theranostics2015,5, 985.doi:10.7150/thno.11938
(20) Hermann, T.; Patel, D. J. Science 2000, 287, 820. doi: 10.1126/science.287.5454.820
(21) Zhang, Y.; Hong, H.; Cai, W. Curr. Med.Chem.2011,18,4185.doi:10.2174/092986711797189547
(22) Li, X.; Zhao, Q.; Qiu, L.J. Control Release2013,171, 152.doi:10.1016/j.jconrel.2013.06.006
(23) Wang, H.; Yang, R.; Yang, L.; Tan, W. ACS Nano 2009,3, 2451.doi:10.1021/nn9006303
(24) Stadler, A.; Chi, C.; Der Lelie, D. V.; Gang, O. Nanomedicine2010,5, 319.doi:10.2217/nnm.10.2
(25) Lee, J. H.; Yigit, M. V.; Mazumdar, D.; Lu, Y. Adv. Drug Deliv. Rev. 2010,62, 592.doi:10.1016/j.addr.2010.03.003
(26) Chen, T.; Shukoor, M. I.; Chen, Y.; Yuan, Q.; Zhu, Z.; Zhao, Z.; Gulbakan, B.; Tan, W. Nanoscale 2011,3, 546. doi:10.1039/C0NR00646G
(27) Zhu, G.; Zhang, S.; Song, E.; Zheng, J.; Hu, R.; Fang, X.; Tan, W. Angew. Chem.2013,52, 5490. doi:10.1002/anie.201301439
(28) Wang, Y. M.; Wu, Z.; Liu, S. J.; Chu, X. Anal. Chem.2015,87, 6470. doi: 10.1021/acs.analchem.5b01634
(29) Ding, C. F.; Ge, Y.; Zhang, S. S. Chem.-Eur. J. 2010,16, doi: 10707.10.1002/chem.201001173
(30) Wu, M. S.; Yuan, D. J.; Xu, J. J.; Chen, H. Y. Anal. Chem.2013,85, 11960.doi:10.1021/ac402889z
(31) Yan, M.; Sun, G. Q.; Liu, F.; Lu, J. J.; Yu, J. H.; Song, X. R. Anal. Chim. Acta2013,798, 33. doi:10.1016/j.aca.2013.08.046
(32) Liu, H. Y.; Xu, S. M.; He, Z. M.; Deng, A. P.; Zhu, J. J. Anal.Chem. 2013,85, 3385.doi:10.1021/ac303789x
(33) Zhao, J. J.; Zhang, L. L.; Chen, C. F.; Jiang, J. H.; Yu, R. Q. Anal. Chim. Acta2012,745, 106. doi:10.1016/j.aca.2012.07.030
(34) Terreno, E.; DelliCastelli, D.; Viale, A.; Aime, S. Chem. Rev.2010,110, 3019.doi:10.1021/cr100025t
(35) van Dam, G. M.; Themelis, G.; Crane, L. M. A.; Harlaar, N. J.; Pleijhuis, R. G.; Kelder, W.; Sarantopoulos, A.; de Jong, J. S.; Arts, H. J. G.; van der Zee, A. G. J.; Bart, J.; Low, P. S.; Ntziachristos, V. Nat. Med. 2011,17, 1315. doi:10.1038/nm.2472
(37) Zhao, Z. L.; Fan, H. H.; Zhou, G. F.; Bai, H. R.; Liang, H.; Wang, R. W.; Zhang, X. B.; Tan, W. H. J. Am. Chem. Soc.2014,136, 11220.doi:10.1021/ja5029364
(38) Ding, K.; Alemdaroglu, F. E.; Boersch, M.; Berger, R.; Herrmann, A. Angew. Chem.-Int. Edit. 2007,46, 1172. doi: 10.1002/anie.200603064
(39) Alemdaroglu, F. E.; Alemdaroglu, N. C.; Langguth, P.; Herrmann, A. Macromol. Rapid Commun. 2008,29, 326. doi:10.1002/marc.200700779
(40) Zhao, Y. Q.; Duan, S. F.; Zeng, X.; Liu, C. J.; Davies, N. M.; Li, B. Y.; Forrest, M. L. Mol. Pharm. 2012,9, 1705. doi:10.1021/mp3000309
(41) Wu, Y. R.; Sefah, K.; Liu, H. P.; Wang, R. W.; Tan, W. H. Proc. Natl. Acad. Sci. U. S. A. 2010,107, 5. doi:10.1073/pnas.0909611107
(42) Mallikaratchy, P.; Tang, Z. W.; Kwame, S.; Meng, L.; Shangguan, D. H.; Tan, W. H. Mol. Cell. Proteomics 2007,6, 2230.doi:10.1074/mcp.M700026-MCP200
(43) Meng, H. M.; Fu, T.; Zhang, X. B.; Tan, W. H. Natl. Sci. Rev.2015,2, 71.doi:10.1093/nsr/nwv001
(44) Kang, H. Z.; O'Donoghue, M. B.; Liu, H. P.; Tan, W. H. Chem. Commun. 2010,46, 249.doi:10.1039/b916911c
(45) Mann, A. P.; Bhavane, R. C.; Somasunderam, A.; Montalvo-Ortiz, B. L.; Ghaghada, K. B.; Volk, D.; Nieves-Alicea, R.; Suh, K. S.; Ferrari, M.; Annapragada, A.; Gorenstein, D. G.; Tanaka, T. Oncotarget2011,2, 298. doi:10.18632/oncotarget.261
(46) Drmanac, R.; Sparks, A. B.; Callow, M. J.; Halpern, A. L.; Burns, N. L.; Kermani, B. G.; Carnevali, P.; Nazarenko, I.; Nilsen, G. B.; Yeung, G.; et al.Science 2010,327, 78.doi:10.1126/science.1181498
(47) Zhang, H. M.; Ma, Y. L.; Xie, Y.; An, Y.; Huang, Y. S.; Zhu, Z.; Yang, C. Y. J. Sci. Rep.2015,5, 10099. doi:10.1038/srep10099
(48) Wu, C. C.; Han, D.; Chen, T.; Peng, L.; Zhu, G. Z.; You, M. X.; Qiu, L. P.; Sefah, K.; Zhang, X. B.; Tan, W. H. J. Am.Chem. Soc. 2013,135, 18644.doi:10.1021/ja4094617
(49) Zhu, G. Z.; Hu, R.; Zhao, Z. L.; Chen, Z.; Zhang, X. B.; Tan, W. H. J. Am. Chem. Soc. 2013,135, 16438. doi:10.1021/ja406115e
(50) Hu, R.; Zhang, X. B.; Zhao, Z. L.; Zhu, G. Z.; Chen, T.; Fu, T.; Tan, W. H. Angew. Chem.-Int. Edit. 2014,53, 5821. doi:10.1002/anie.201400323
(51) Liu, Z.; Robinson, J. T.; Tabakman, S. M.; Yang, K.; Dai, H. J. Mater. Today 2011,14, 316. doi: 10.1016/S1369-7021(11)70161-4
(52) Yang, L.; Zhang, X. B.; Ye, M.; Jiang, J. H.; Yang, R. H.; Fu, T.; Chen, Y.; Wang, K. M.; Liu, C.; Tan, W. H. Adv. Drug Deliv. Rev. 2011,63, 1361.doi:10.1016/j.addr.2011.10.002
(53) Dobson, J. Nanomedicine: Nanotechnology, Biology, &Medicine 2006,1, 31.doi:10.2217/17435889.1.1.31
(54) Wang, A. Z.; Bagalkot, V.; Vasilliou, C. C.; Gu, F.; Alexis, F.; Zhang, L.; Shaikh, M.; Yuet, K.; Cima, M. J.; Langer, R.; Kantoff, P. W.; Bander, N. H.; Jon, S. Y.; Farokhzad, O. C. Chem. Med. Chem. 2008,3, 1311. doi:10.1002/cmdc.200800091
(55) Yu, M. K.; Kim, D.; Lee, I. H.; So, J. S.; Jeong, Y. Y.; Jon, S. Small 2011,7, 2241.doi:10.1002/smll.201100472
(56) Chen, T.; Shukoor, M. I.; Wang, R. W.; Zhao, Z. L.; Yuan, Q.; Bamrungsap, S.; Xiong, X. L.; Tan, W. H. ACS Nano 2011,5, 7866.doi:10.1021/nn202073m
(57) Zheng, J.; Zhu, G. Z.; Li, Y. H.; Li, C. M.; You, M. X.; Chen, T.; Song, E. Q.; Yang, R. H.; Tan, W. H. ACS Nano 2013,7, 6545.doi:10.1021/nn402344v
(58) Wijaya, A.; Schaffer, S. B.; Pallares, I. G.; Hamad-Schifferli, K. ACS Nano 2009,3, 80.doi:10.1021/nn800702n
(59) Yang, X. J.; Liu, X.; Liu, Z.; Pu, F.; Ren, J. S.; Qu, X. G. Adv.Mater. 2012,24, 2890.doi:10.1002/adma.201104797
(60) Chen, C. C.; Lin, Y. P.; Wang, C. W.; Tzeng, H. C.; Wu, C. H.; Chen, Y. C.; Chen, C. P.; Chen, L. C.; Wu, Y. C. J. Am.Chem. Soc. 2006,128, 3709.doi:10.1021/ja0570180
(61) You, J.; Zhang, G. D.; Li, C. ACS Nano 2010,4, 1033.doi:10.1021/nn901181c
(62) Yang, X.; Yang, M. X.; Pang, B.; Vara, M.; Xia, Y. N. Chem.Rev. 2015,115, 10410.doi:10.1021/acs.chemrev.5b00193
(63) Kim, D.; Jeong, Y. Y.; Jon, S. ACS Nano 2010,4, 3689. doi:10.1021/nn901877h
(64) Kang, H. Z.; Trondoli, A. C.; Zhu, G. Z.; Chen, Y.; Chang, Y. J.; Liu, H. P.; Huang, Y. F.; Zhang, X. L.; Tan, W. H. ACS Nano 2011,5, 5094.doi:10.1021/nn201171r
(65) Qiu, L. P.; Chen, T.; Ocsoy, I.; Yasun, E.; Wu, C. C.; Zhu, G. Z.; You, M. X.; Han, D.; Jiang, J. H.; Yu, R. Q.; Tan, W. H. Nano Lett. 2015,15, 457.doi:10.1021/nl503777s
(66) Park, H.; Yang, J.; Lee, J.; Haam, S.; Choi, I. H.; Yoo, K. H. ACS Nano 2009,3, 2919.doi:10.1021/nn900215k
(67) Park, J. H.; von Maltzahn, G.; Xu, M. J.; Fogal, V.; Kotamraju, V. R.; Ruoslahti, E.; Bhatia, S. N.; Sailor, M. J. Proc. Natl. Acad. Sci. U. S. A. 2010,107, 981. doi:10.1073/pnas.0909565107
(68) Dolmans, D.; Fukumura, D.; Jain, R. K. Nat. Rev. Cancer 2003,3, 380.doi:10.1038/nrc1071
(69) Bugaj, A. M. Photochem. Photobiol. Sci. 2011,10, 1097. doi:10.1039/c0pp00147c
(70) Vrouenraets, M. B.; Visser, G. W. M.; Snow, G. B.; van Dongen, G. Anticancer Res. 2003,23, 505.
(71) Ferreira, C. S. M.; Cheung, M. C.; Missailidis, S.; Bisland, S.; Gariepy, J. Nucleic Acids Res. 2009,37, 866. doi:10.1093/nar/gkn967
(72) Mallikaratchy, P.; Tang, Z. W.; Tan, W. H. Chem. Med.Chem.2008,3, 425.doi:10.1002/cmdc.200700260
(73) Wang, K. L.; You, M. X.; Chen, Y.; Han, D.; Zhu, Z.; Huang, J.; Williams, K.; Yang, C. J.; Tan, W. H. Angew. Chem.-Int.Edit. 2011,50, 6098.doi:10.1002/anie.201008053
(74) Shieh, Y. A.; Yang, S. J.; Wei, M. F.; Shieh, M. J. ACS Nano 2010,4, 1433.doi:10.1021/nn901374b
(75) Han, D.; Zhu, G. Z.; Wu, C. C.; Zhu, Z.; Chen, T.; Zhang, X. B.; Tan, W. H. ACS Nano 2013,7, 2312. doi:10.1021/nn305484p
(76) Shiao, Y.S.; Chiu, H.H.; Wu, P.H.; Huang, Y.F. ACS Appl Mater Interfaces 2014,6, 21832.doi:10.1021/am5026243
(77) Yuan, Q.; Wu, Y.; Wang, J.; Lu, D. Q.; Zhao, Z. L.; Liu, T.; Zhang, X. B.; Tan, W. H. Angew. Chem. Int. Edit. 2013,52, 13965.doi:10.1002/anie.201305707
(78) Li, L. L.; Zhang, R. B.; Yin, L. L.; Zheng, K. Z.; Qin, W. P.; Selvin, P. R.; Lu, Y. Angew. Chem. Int. Edit. 2012,51, 6121.doi:10.1002/anie.201109156
(79) Wang, M.; Mi, C. C.; Wang, W. X.; Liu, C. H.; Wu, Y. F.; Xu, Z. R.; Mao, C. B.; Xu, S. K. ACS Nano 2009,3, 1580. doi:10.1021/nn900491j
(80) Li, H.; Wang, L. Y. Chem.-Asian J. 2014,9, 153. doi:10.1002/asia.201300897
(81) Yuan, Q.; Wu, Y.; Wang, J.; Lu, D. Q.; Zhao, Z. L.; Liu, T.; Zhang, X. B.; Tan, W. H. Angew. Chem. Int. Edit. 2013,52, 13965.doi:10.1002/anie.201305707
(82) Fisher, J. W.; Sarkar, S.; Buchanan, C. F.; Szot, C. S.; Whitney, J.; Hatcher, H. C.; Torti, S. V.; Rylander, C. G.; Rylander, M. N. Cancer Res. 2010,70, 9855. doi:10.1158/0008-5472.can-10-0250
(83) Yang, H. W.; Lu, Y. J.; Lin, K. J.; Hsu, S. C.; Huang, C. Y.; She, S. H.; Liu, H. L.; Lin, C. W.; Xiao, M. C.; Wey, S. P.; Chen, P. Y.; Yen, T. C.; Wei, K. C.; Ma, C. C. M. Biomaterials 2013,34, 7204.doi:10.1016/j.biomaterials.2013.06.007
(84) Xiao, Q. F.; Zheng, X. P.; Bu, W. B.; Ge, W. Q.; Zhang, S. J.; Chen, F.; Xing, H. Y.; Ren, Q. G.; Fan, W. P.; Zhao, K. L.; Hua, Y. Q.; Shi, J. L. J. Am. Chem. Soc. 2013,135, 13041.doi:10.1021/ja404985w
(85) Jain, P. K.; Huang, X. H.; El-Sayed, I. H.; El-Sayed, M. A. Accounts Chem. Res. 2008,41, 1578.doi:10.1021/ar7002804
(86) Peer, D.; Karp, J. M.; Hong, S.; FaroKhzad, O. C.; Margalit, R.; Langer, R. Nat. Nanotechnol. 2007, 2, 751. doi:10.1038/nnano.2007.387
(87) Huang, Y. F.; Sefah, K.; Bamrungsap, S.; Chang, H. T.; Tan, W. Langmuir 2008,24, 11860.doi:10.1021/la801969c
(88) Kuo, W. S.; Chang, C. N.; Chang, Y. T.; Yang, M. H.; Chien, Y. H.; Chen, S. J.; Yeh, C. S. Angew. Chem. Int. Edit.2010,49, 2711.doi:10.1002/anie.200906927
(89) Wang, J.; Zhu, G. Z.; You, M. X.; Song, E. Q.; Shukoor, M. I.; Zhang, K. J.; Altman, M. B.; Chen, Y.; Zhu, Z.; Huang, C. Z.; Tan, W. H. ACS Nano 2012,6, 5070. doi:10.1021/nn300694v
(90) Robinson, J. T.; Tabakman, S. M.; Liang, Y. Y.; Wang, H. L.; Casalongue, H. S.; Vinh, D.; Dai, H. J. J. Am. Chem. Soc.2011,133, 6825.doi:10.1021/ja2010175
(91) Su, S. H.; Wang, J. L.; Wei, J. H.; Martinez-Zaguilan, R.; Qiu, J. J.; Wang, S. R. New J. Chem. 2015,39, 5743. doi:10.1039/c5nj00122f
(92) Li, Q.; Hong, L.; Li, H.; Liu, C. BiosensBioelectron2017,89,Part 1, 477.doi:10.1016/j.bios.2016.03.072
(93) Khan, S. A.; Kanchanapally, R.; Fan, Z.; Beqa, L.; Singh, A. K.; Senapati, D.; Ray, P. C. Chem. Commun. 2012,48, 6711. doi: 10.1039/c2cc32313c
(94) Parak, W. J.; Gerion, D.; Pellegrino, T.; Zanchet, D.; Micheel, C.; Williams, S. C.; Boudreau, R.; Le Gros, M. A.; Larabell, C. A.; Alivisatos, A. P. Nanotechnology 2003,14, R15. doi: 10.1088/0957-4484/14/7/201
(96) Pankhurst, Q.; Jones, S.; Dobson, J. J. Phys. D-Appl. Phys.2016,49, R167. doi: 10.1088/0022-3727/49/50/501002
(97) Cuenot, S.; Fretigny, C.; Demoustier-Champagne, S.; Nysten, B. Phys. Rev. B 2004, 69, 165410. doi: 10.1103/PhysRevB.69.165410
(98) Murray, C. B.; Kagan, C. R.; Bawendi, M. G. Annu. Rev.Mater. Sci. 2000, 30, 545. doi: 10.1146/annurev.matsci.30.1.545
(99) Albert, K.; Hsu, H.Y. Molecules 2016,21, 1585. doi: 10.3390/molecules21111585
(100) Liang, C.; Guo, B. S.; Wu, H.; Shao, N. S.; Li, D. F.; Liu, J.; Dang, L.; Wang, C.; Li, H.; Li, S. H.; et al. Nat. Med.2015,21, 288. doi: 10.1038/nm.37

