高、低产双黄蛋高邮鸭卵巢结构及生殖激素和相关基因差异
张 蕾, 张响英, 章敬旗, 张 扬, 常国斌, 陈国宏, 董 飚, 吴炳鑫, 王 健
(1.江苏农牧科技职业学院,江苏 泰州 225300; 2.扬州大学动物科学与技术学院,江苏 扬州 225009)
高邮鸭是江苏省的优良地方畜禽品种,尤以善产双黄蛋而享誉海内外。双黄蛋的产生,主要是由于禽类的2个卵泡同时成熟并排卵,而后2个卵子一同进入输卵管,在输卵管内依次被蛋白质、壳膜以及蛋壳等物质包裹后最终形成[1]。这一过程的触发与家禽的卵泡发育过程密不可分[2]。迄今为止,对高邮鸭双黄蛋性状的调控机制未见详细报道。
家禽的卵泡发育是由多因素调控的复杂过程,在此过程中下丘脑-垂体-卵巢这一生殖轴起到关键的调节作用。肝脏是家禽脂肪酸氧化分解的主要场所,同时也是合成脂蛋白、卵黄前体物质的主要场所,对家禽的产蛋量及蛋品质有重要的影响。已有研究结果表明,FSHR(卵泡刺激素受体)参与家禽卵巢的发育调节过程,并可能参与调控家禽等级卵泡的启动[3]。ERβ(雌激素受体β)由卵巢合成和分泌,对卵巢早期发育以及卵泡的生长发育等过程起着重要作用[4]。GnRHR(生长激素受体)调控FSH的合成与释放,从而调控卵巢的繁殖性能,有研究结果表明GnRHR与母鸡双黄蛋产蛋性能密切相关[5]。
本研究结合前期高邮鸭个体产蛋记录,筛选出双黄蛋高、低产高邮鸭个体,对比两组个体血液中激素水平,下丘脑、垂体、肝脏以及卵巢组织中繁殖性能相关基因的表达,并结合卵巢组织HE染色和FSHR免疫组化染色,从组织学和分子生化水平探究双黄蛋高、低产高邮鸭繁殖机能的差异性,为进一步研究高邮鸭双黄蛋发生的调控机制以及高邮鸭相关育种工作提供科学依据。
1 材料与方法
1.1 主要材料
试验动物为江苏省泰州市丰达水禽育种公司同一栋鸭舍内单只笼养的330日龄高邮鸭。根据个体产蛋记录筛选出双黄蛋高、低产组高邮鸭个体各6只。
主要试剂:MicroElute Genomic DNA 试剂盒、Trizol regent、mirVanaTM RNA分离试剂盒(Applied Biosystem p/n AM1556)、QIAGEN RNeasy©试剂盒、反转录试剂盒、LowInput Quick-Amp Labeling试剂盒、anti-FSHR(Biorbyt公司产品)、兔抗FSHR多克隆抗体(Zymed公司产品)、苏木精、伊红等(海南合辉公司产品)。
1.2 试验方法
1.2.1 RNA提取及反转录 采用硫氰酸胍-酚-氯仿法提取各组织总RNA,经紫外分光光度仪测定总RNA 浓度和纯度后,使用TaKaRa反转录试剂盒反转录成cDNA, -20 ℃保存备用。
1.2.2 血液生化指标检测 空腹翼静脉采血5 ml,静置30 min,以3 000 r/min迅速离心15 min,吸取上层血清,-20 ℃保存。全自动血液生化分析仪(Olympus Au 600)检测血清生化指标。
1.2.3 卵巢组织切片 试验鸭屠宰后,取卵巢组织流水冲洗,于4%多聚甲醛中固定24 h。梯度酒精脱水后进行石蜡包埋,5~8 μm厚度连续切片。参考姜晓龙等[6]的方法进行苏木精-伊红(Hematoxylin-eosin,HE)染色,参考吴馨培等[7]的方法进行FSHR免疫组化染色。用Olympus光学显微镜观察高邮鸭卵巢卵泡发育情况。
1.2.4 Image pro-plus 4.5图像分析 每只高邮鸭选取3张HE染色和FSHR免疫组化染色切片,根据卵泡发育水平,选取视野中发育阶段相似的卵泡,并进行卵泡等级分类,同时计数各级卵泡免疫组化阳性细胞数量[8]。
1.2.5 Quantitative Real Time PCR(qRT-PCR) 检测 试验鸭屠宰后,取下丘脑、垂体、肝脏以及卵巢组织,用RNeasy kit试剂盒提取细胞总RNA,并反转录成cDNA,以此为模板进行qRT-PCR。根据GenBank中收录的鸭相关基因mRNA序列,用Primer 5.0软件设计引物[9](表1),以β-actin基因为内参,使用SYBR荧光定量PCR试剂盒和ABI7500 System荧光定量仪器,检测相关基因的表达情况。
表1qRT-PCR引物信息
Table1PrimesinformationforqRT-PCR

基因 引物序列(5′→3′)退火温度(℃)产物大小(bp)FSHRF:GCAAGCCCAGATTTACAGAACAGACA60128R:CAAGTGATTTAGAGGAACCAGTGAERF:CAAGTGATTTAGAGGAACCAGTGA61126R:GCAGAAGAACCTGAAAGCAACAGnRHRF:TCTGCTGGACCCCCTACTAC55107R:GCCAAAGATGAAGAGGATGTGβ⁃actinF:ATGCAGAAGGAGATCACAGC58167R:GAGGGTCCGGATTCATCATA
1.2.6 数据分析 所有数据以平均数±标准差表示。应用GraphPad Prism5统计学软件,进行两样本均数间t检验。
2 结 果
2.1 高、低产双黄蛋高邮鸭卵巢形态结构差异
对高、低产双黄蛋高邮鸭卵巢组织切片进行HE染色,同等倍镜下观察对比卵泡发育情况。结果(图1)表明:高产双黄蛋高邮鸭卵巢上卵泡发育良好,卵巢上密布着小黄卵泡(6~8 mm)和大白卵泡(3~5 mm),而低产双黄蛋高邮鸭卵巢上小白卵泡(<2 mm)较多。高倍镜下对各组卵泡结构进行对比发现,低产双黄蛋高邮鸭卵泡膜层和颗粒层较薄,内外膜层分界不明显;高产双黄蛋高邮鸭卵泡膜层较厚,内外膜分界明显。由此可见,高、低产双黄蛋高邮鸭卵巢在组织结构上存在明显差异。
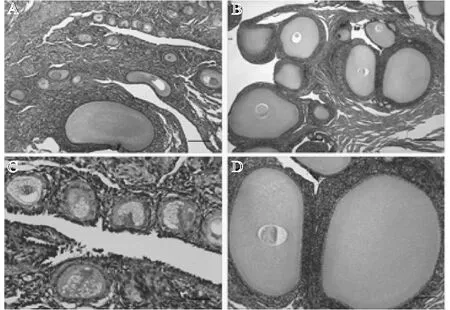
A、C分别为低产组高邮鸭卵巢×50、×100倍镜下图片,B、D分别为高产组高邮鸭卵巢×50、×100倍镜下图片。图1 高、低产双黄蛋高邮鸭卵巢HE染色切片Fig.1 The HE staining slices of high and low double-yolk egg laying Gaoyou duck
2.2 高、低产双黄蛋高邮鸭卵巢FSHR免疫组化分析
对高、低产双黄蛋高邮鸭卵巢组织切片进行FSHR免疫组化染色,FSHR阳性细胞中显现黄色或棕黄色反应颗粒,卵巢中FSHR免疫组化阳性反应颗粒多分布于颗粒细胞、膜细胞以及卵母细胞中(图2)。低产组卵巢中FSHR阳性细胞染色较浅、呈浅黄色,颗粒细胞松散呈单层结构;高产组卵巢中FSHR阳性细胞染色较深、呈棕黄色,颗粒细胞呈多层且排列紧密。可见,高、低产双黄蛋高邮鸭卵巢在结构及蛋白质表达上存在较大差异。
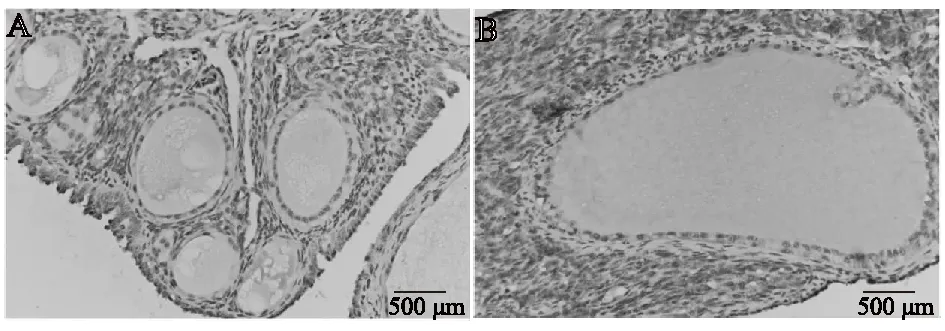
A为低产组;B为高产组。图2 高、低产双黄蛋高邮鸭卵巢FSHR免疫组化染色切片(×100)Fig.2 The FSHR staining slices of high and low double-yolk egg laying Gaoyou duck (×100)
2.3 高、低产双黄蛋高邮鸭血液激素水平差异
检测高、低产双黄蛋高邮鸭血清中卵泡刺激素(FSH)、黄体生成素(LH)、孕酮(P)、雌二醇(E2)以及睾酮(TEST)激素水平。结果(图3)表明:高产组FSH、E2和 P含量均极显著高于低产蛋组(P<0.01),而LH和TEST含量在两组之间均无显著差异。
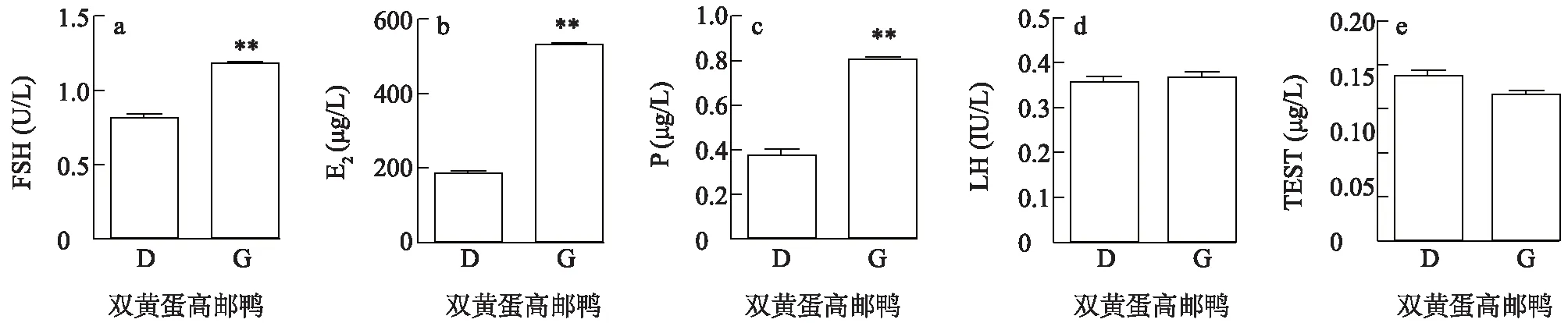
a:卵泡刺激素(FSH);b:黄体生成素(LH);c:孕酮(P);d:雌二醇(E2);e:睾酮(TEST)。D为低产组,G为高产组。图3 高、低产双黄蛋高邮鸭血清激素水平Fig.3 Hormonal level in high and low double-yolk egg laying Gaoyou duck serum
2.4 高、低产双黄蛋高邮鸭繁殖性状相关基因表达差异
采用qRT-PCR方法检测与繁殖性状相关的关键基因FSHR、ERβ和GnRHR在高邮鸭下丘脑、垂体、肝脏以及卵巢中的表达。结果(图4)表明:高产组高邮鸭下丘脑中FSHR表达量极显著高于低产组(P<0.01),而ERβ表达量极显著低于低产组(P<0.01),GnRHR在两组中的表达差异不显著;高产组高邮鸭垂体及肝脏中FSHR、ERβ和GnRHR的表达量均极显著高于低产组(P<0.01);卵巢中FSHR、ERβ和GnRHR的表达量在两组中差异不显著。
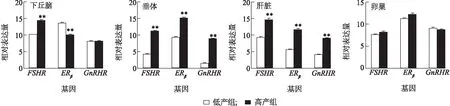
图4 高、低产双黄蛋高邮鸭繁殖相关基因的表达量Fig.4 Expression of reproduction-related genes of high and low double-yolk egg laying Gaoyou duck
3 讨 论
李佳宜等[8]通过观察东乡绿壳蛋鸡高、低产个体卵巢结构,发现高产组卵巢卵泡较低产组丰富,卵泡光滑而无塌陷。王岩等[10]对比高、低产乌鸡卵巢,发现高产组卵泡较多,而低产组初级卵泡数量占多数。本试验通过HE染色及FSHR免疫组化染色对高、低产双黄蛋高邮鸭卵巢进行对比观察,发现高产组卵泡发育良好,颗粒细胞丰富且排列紧密;低产组卵泡发育迟缓,大量闭锁,颗粒细胞疏松呈单层结构。
生殖轴激素是调控家禽卵巢发育及其产蛋性能的主要内分泌因子。Zhang等[11]研究结果表明FSH是调控卵泡发育的主要激素;杨淑华等[12]研究发现,E2主要由大中型卵泡分泌,P对卵巢排卵功能具有正负反馈调节作用。本试验发现,在所检测的5种激素中,FSH、E2和P在高产双黄蛋高邮鸭血清中的含量均显著高于低产双黄蛋高邮鸭,而LH和TEST无显著差异。FSH、E2和P 3种激素之间相互协同,对高邮鸭卵巢的功能以及卵泡的发育起到综合调控作用。
禽类的卵巢卵泡发育以及产蛋过程还受到多个基因的调节作用。本试验筛选出与繁殖性状相关的生殖激素受体基因FSHR、ERβ和GnRHR,并检测它们在高邮鸭下丘脑、垂体、肝脏以及卵巢中的表达。结果显示这3个基因在高、低产双黄蛋高邮鸭垂体和肝脏中的mRNA表达存在极显著差异(P<0.01),而在卵巢中的表达量差异不显著,FSHR和ERβ在下丘脑中也存在极显著差异(P<0.01)。这与陈杰[9]研究结果相一致,FSHR对卵巢早期发育起重要调节作用,随着卵泡的发育成熟,卵巢对FSH反应的灵敏性向LH迁移,FSHR对卵泡发育的调节功能减弱。说明高邮鸭双黄蛋产蛋机能与下丘脑、垂体和肝脏的调控作用密不可分。
禽类产蛋过程是一个复杂的发育生物学过程,受到生殖轴和生长轴激素的调节以及相关基因的调控。本试验依据前期高邮鸭的产蛋记录,筛选出高邮鸭双黄蛋高产组和低产组,对高邮鸭双黄蛋的产蛋性能进行了探讨,高、低产双黄蛋高邮鸭卵巢结构、激素水平和相关基因表达特征的对比分析结果表明高邮鸭双黄蛋的产蛋机能与下丘脑、垂体和肝脏调控功能密不可分,这为进一步研究高邮鸭双黄蛋的产蛋机制提供了一定的理论基础,但确切的调控机制仍需要后续更深入的研究。
参考文献:
[1] 陈文峰,朱文奇,胡 艳,等.高邮鸭GNRHR基因克隆及卵巢中mRNA表达分析[J]. 中国家禽,2014,36(8):14-17.
[2] 康 波,姜冬梅,王继文. 家禽卵泡发育相关生长因子的研究进展[J].中国畜牧杂志,2010,46(23):73-76.
[3] 倪迎冬,赵茹茜,王亚菊,等.出雏至性成熟绍鸭卵巢FSH-R与LH-RmRNA表达的变化[J].南京农业大学学报,2004,27(2):64-67.
[4] DUNN I C, MIAO Y W, MORRIS A, et al. A study of association between genetic markersin candidate genes and reproductive traits in one generation of a commercial broiler breeder hen population[J].Heredity,2004,92(2):128-134.
[5] 刘忠慧,储明显,陈国宏.促性腺激素释放激素基因与其受体基因的研究进展[J].中国畜牧兽医,2006,33(3):35-38.
[6] 姜晓龙,陈建伟,姚晓磊,等. 绵羊卵巢组织石蜡切片制作条件优化研究[J].上海畜牧兽医通讯,2013(6):2-3.
[7] 吴馨培,王树迎. 莱芜黑山羊卵巢FSHr、LHr的免疫组化定位研究[J].生命科学研究,2006(4):367-371.
[8] 李佳宜,陆应林,刘小凡,等. 高低产母鸡卵巢卵泡和相关基因表达差异的研究[J]. 南京农业大学学报,2017,40(5):1-5.
[9] 陈 杰.鸭部分繁殖性状杂种优势及其与相关基因表达关系的研究[D].扬州:扬州大学,2011.
[10] 王 岩,彭克美,宋 卉,等. 高产与低产乌鸡主要生殖器官的比较形态学研究[J]. 经济动物学报,2006,10(4):206-210.
[11] ZHANG C, SHIMADA K, SAITO N, et al. Expression of messenger ribonucleic acids of luteinizing hormone and folli cle-stimulating hormone receptors in granulose and theca layers of chicken preovulatory follicles[J].Gen Comp Endocrinol,1997, 105(3):402-409.
[12] 杨淑华,徐世文,李金龙,等. 生殖激素对禽类卵泡细胞凋亡的影响[J]. 吉林畜牧兽医,2005(10):12-14,17.
——高邮博物馆精华演绎

