聚二磷酸腺苷-核糖聚合酶抑制剂治疗晚期卵巢癌的安全性的系统评价
刘洪悦 郭子寒 杜琼 戴贤春 刘莹莹 余波 翟青

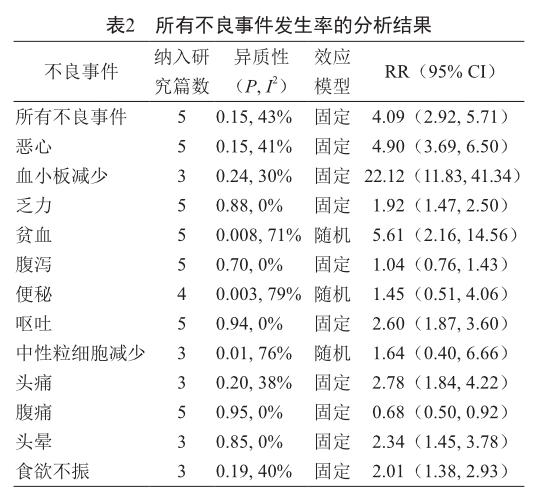
摘 要 为系统评价聚二磷酸腺苷-核糖聚合酶(polyADP-ribose polymerase, PARP)抑制剂治疗晚期卵巢癌的安全性,以neoplasm、ovarian cancer、PARP等为关键词检索PubMed、EMBASE、clinicltrials.gov、Cochrane Library和CNKI等数据库中2017年3月前发表的相关临床随机、对照试验文献,共纳入5篇文献进行分析。分析结果显示,PARP抑制剂治疗组的所有不良事件、恶心、血小板减少、乏力、贫血、呕吐、头痛、头晕和食欲不振的发生率均显著高于对照组,3 ~ 4级不良事件中的所有不良事件、血小板减少和贫血的发生率也显著高于对照组。但PARP抑制剂治疗的多数不良事件的严重程度较轻,血小板减少和贫血的严重程度较重,应当予以重视。
关键词 聚二磷酸腺苷-核糖聚合酶抑制剂 卵巢癌 安全性 系统评价
中图分类号:R979.19 文献标识码:C 文章编号:1006-1533(2018)05-0025-04
Systematic review of safety for polyADP-ribose polymerase inhibitors in the treatment of advanced ovarian cancer
LIU Hongyue1,2,3, GUO Zihan1,2,3, DU Qiong1,2,3, DAI Xianchun3, LIU Yingying3, YU Bo1,2,3, ZHAI Qing1,2,3
(1. Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Pharmacy, Shanghai Cancer Center, Fudan University, Shanghai 200032, China; 3. Proton and Heavy Ion Center of Shanghai Cancer Center, Fudan University, Shanghai 201321, China)
ABSTRACT In order to evaluate the safety of polyADP-ribose polymerase (PARP) inhibitors, we used neoplasm, ovarian cancer, PARP as keywords to search for studies published before March, 2017 at PubMed, EMBASE, clinicltrials.gov, Cochrane Library, CNKI and other database, total five articles were found. The incidence of all adverse events, nausea, thrombocytopenia, weakness, anemia, vomiting, headache, dizziness, and loss of appetite and the incidence of all adverse events, thrombocytopenia and anemia in the 3 ~ 4 grade adverse events were significantly higher in the treatment group of PARP inhibitor than in the control group. However, most of the adverse events occurred in the treatment group of PARP inhibitors were mild though thrombocytopenia and anemia were serious, to which attention should be paid.
KEY WORDS polyADP-ribose polymerase inhibitors; ovarian cancer; safety; systematic review
卵巢癌是婦科肿瘤中死亡率最高的一种癌症类型,2016年美国新发病例约2.2万例,死亡病例约1.4万例,占妇科肿瘤死因的5%左右[1]。晚期卵巢癌的初始治疗多采用手术治疗并在术后予以辅助化疗[2-3]。卵巢癌首次接触铂类药物时较敏感,但随着接触时间延长,铂类药物的疗效会逐渐降低,患者复发风险增大。若卵巢癌复发,可再次使用以铂类药物为基础的联合化疗方案治疗,但因铂类药物的累积毒性会随用药剂量增加而增加,加之部分患者已对铂类药物耐药,此类治疗的实际应用受到一定的限制[3]。对已对铂类药物耐药的患者应改用非铂类药物单药治疗,如脂质体多柔比星、环磷酰胺和多西他赛等[4]。
有研究提示,卵巢癌的发生可能与基因BRCA的突变有关[5]。BRCA1或BRCA2的突变会导致DNA修复能力的丧失,最终导致癌症的发生。聚二磷酸腺苷-核糖聚合酶(polyADP-ribose polymerase, PARP)是DNA单链断裂修复所必不可少的酶,抑制其便能通过促使DNA双链片段的形成而抑制有DNA修复缺陷的癌细胞,最终导致癌细胞的死亡[6-7]。美国FDA 2014年批准奥拉帕尼(olaparib)用于治疗BRCA突变的晚期卵巢癌患者,2017年3月又批准尼拉帕尼(niraparib)用于治疗对铂类药物治疗有完全或部分应答、但后又疾病复发的成人卵巢上皮癌、输卵管癌和原发性腹膜癌患者。PARP抑制剂治疗卵巢癌有效,但患者能否耐受,目前还无有关此类药物不良事件的系统评价。本文全面评价PARP抑制剂的安全性,为其临床安全、合理使用提供参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准
①研究类型:Ⅱ或Ⅲ期临床随机、对照试验(randomized controlled trial, RCT),不论发表与否。②研究对象:病理组织学或细胞学确诊的复发的卵巢上皮癌、原发性腹膜癌和输卵管癌患者,不论对铂类药物治疗敏感与否,也不论BRCA突变与否;Karnofsky功能状态(Karnofskys performance status)评分≤2分,肝、肾和骨髓造血功能正常。③干预措施:试验组为PARP抑制剂治疗组,对照组为传统化疗或安慰剂治疗组。④结局指标:包括所有不良事件以及恶心、血小板减少、乏力、贫血、腹泻、便秘、呕吐、中性粒细胞减少、头痛、腹痛、头晕和食欲不振。
1.1.2 排除标准
①无法提取数据的RCT;②不符合诊断标准的RCT;③重复发表的RCT。
1.2 检索策略
逐一检索PubMed、EMBASE、clinicltrials.gov、Cochrane Library和CNKI数据库中2017年3月前发表的相关Ⅱ或Ⅲ期RCT文献,同时检索美国癌症研究协会(American Association for Cancer Research)、美国临床肿瘤学学会(American Society of Clinical Oncology)和欧洲临床肿瘤学学会(European Society of Medical Oncology)等的年会资料;检索词为neoplasm、ovarian cancer、polyADP-ribose polymerase、PARP、olaparib、AZD2281、Ku-0059436、veliparib、ABT-888、rucaparib、AG-014699、PF-01367338、talazoparib、BMN 673、 MK-4827、niraparib、iniparib和BSI-201。
1.3 文献筛选、资料提取和质量评价
文献筛选、资料提取和质量评价由2名研究人员分别独立完成,有疑问或意见不一致时则通过讨论或征求其他专家的意见妥善解决。资料提取内容主要包括研究特征(RCT的注册号、完成年份、研究类型、样本量)、研究对象的基本特征(病名)、治疗方案(药物、剂量)和各种不良事件的发生例数。对RCT的质量采用《Cochrane系统评价手册(5.1版)》进行方法学评价,评价内容包括随机方法、盲法、分配隐藏、结果数据的完整性、有无选择性报告结果和有无其他偏倚来源。
1.4 统计学分析
采用RevMan 5.3软件进行荟萃分析。采用比值比和95%置信区间作为疗效分析的统计量,采用χ2检验对各研究结果进行异质性检验。当各研究结果间的异质性不显著(P≥0.10, I2≤50%)时,采用固定效应模型进行荟萃分析;当各研究结果间的异质性显著(P<0.10, I2>50%)时,采用随机效应模型进行荟萃分析。荟萃分析的检验水准为α=0.05[8-9]。
2 结果
2.1 文献检索结果
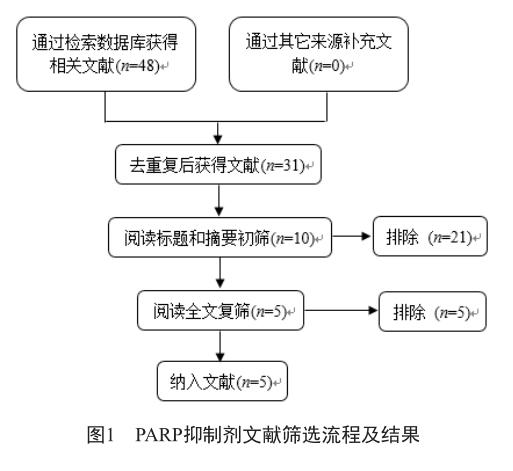
共检索得到48篇文献,经逐层筛选,最后纳入5篇文献,筛选流程及结果见图1。
2.2 纳入研究的基本特征
共纳入5项研究,其中4项为Ⅱ期临床试验、1项为Ⅲ期临床试验,它们设计合理、质量较高,基本特征见表1。
2.3 不良事件发生率的分析
2.3.1 所有不良事件的发生率
PARP抑制剂治疗组的所有不良事件以及恶心、血小板减少、乏力、贫血、呕吐、头痛、头晕和食欲不振的发生率均高于对照组,其余不良事件的发生率无显著性差异,具体情况见表2。
2.3.2 3 ~ 4级不良事件的发生率
PARP抑制剂治疗组的所有3 ~ 4级不良事件的发生率以及3 ~ 4级的乏力、血小板减少和贫血的发生率均高于对照组,其余3 ~ 4级不良事件的发生率无显著性差异,具体情况见表3。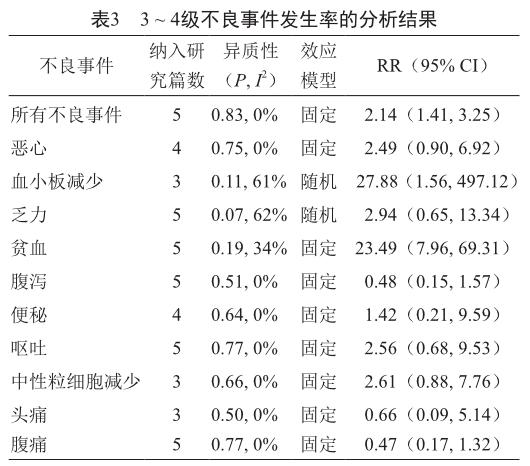
3 讨论
卵巢癌是常见的妇科恶性肿瘤,其患者的5年存活率不到40%[15]。虽然使用铂类和紫杉烷类药物治疗可使卵巢癌患者的总存活期延长最多达17.6个月[16-17],但卵巢癌易复发,患者的预后仍不容乐观。卵巢癌的发生与BRCA突变有关[18],而BRCA突变可能是PARP抑制剂的作用靶点[19],因此PARP抑制剂可用于复发的卵巢癌治疗。自PARP抑制剂被发现以来,至今已有奥拉帕尼、尼拉帕尼和雷迪帕尼获准用于临床。
虽然PARP抑制剂治疗卵巢癌有效,如奥拉帕尼治疗的有效率达34%,尼拉帕尼治疗可使BRCA突变的患者的疾病无进展存活期延长15.5个月,但此类药物的安全性亦应予以重视。本文对PARP抑制剂治疗复发的卵巢癌的不良事件进行了系统分析,共纳入5篇文献,合计包括1 070例患者。从分析结果可以看出,PARP抑制剂治疗组的惡心、血小板减少、乏力、贫血、呕吐、头痛、头晕和食欲不振的发生率显著更高,3 ~ 4级的血小板减少和贫血的发生率也显著更高。不过,本研究存在一定的局限性:①纳入的文献数少且多数为Ⅱ期临床试验报告,样本量不足;②各研究间存在一定的偏倚,如各研究的对照组均不相同等。因此,对本研究结论应持谨慎的态度,今后仍需采用大样本量的、高质量的研究进行验证和补充。
總体来说,PARP抑制剂治疗的不良事件的严重程度大多数较低,患者可以耐受,但血液学毒性较严重,特别是血小板减少和贫血,可能会引起严重的并发症,应予以重视。
参考文献
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016 [J]. CA Cancer J Clin, 2016, 66(1): 7-30.
[2] Erickson BK, Martin JY, Shah MM, et al. Reasons for failure to deliver National Comprehensive Cancer Network (NCCN)-adherent care in the treatment of epithelial ovarian cancer at an NCCN cancer center [J]. Gynecol Oncol, 2014, 133(2): 142-146.
[3] Ledermann JA, Raja FA, Fotopoulou C, et al. Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up [J]. Ann Oncol, 2013, 24(Suppl 6): vi24-vi32.
[4] Hanker LC, Loibl S, Burchardi N, et al. The impact of second to sixth line therapy on survival of relapsed ovarian cancer after primary taxane/platinum-based therapy [J]. Ann Oncol, 2012, 23(10): 2605-2612.
[5] Tutt A, Robson M, Garber JE, et al. Oral poly(ADP-ribose) polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and advanced breast cancer: a proof-ofconcept trial [J]. Lancet, 2010, 376(9737): 235-244.
[6] Farmer H, McCabe N, Lord CJ, et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy[J]. Nature, 2005, 434(7035): 917-921.
[7] Ashworth A. A synthetic lethal therapeutic approach: poly(ADP) ribose polymerase inhibitors for the treatment of cancers deficient in DNA double-strand break repair [J]. J Clin Oncol, 2008, 26(22): 3785-3790.
[8] DerSimonian R, Laird N. Meta-analysis in clinical trials revisited [J]. Contemp Clin Trials, 2015, 45(Pt A): 139-145.
[9] Higgins JP, Thompson SG. Quantifying heterogeneity in a meta-analysis [J]. Stat Med, 2002, 21(11): 1539-1558.
[10] Kaye SB, Lubinski J, Matulonis U, et al. Phase II, open-label, randomized, multicenter study comparing the efficacy and safety of olaparib, a poly(ADP-ribose) polymerase inhibitor, and pegylated liposomal doxorubicin in patients with BRCA1 or BRCA2 mutations and recurrent ovarian cancer [J]. J Clin Oncol, 2012, 30(4): 372-379.
[11] Kummar S, Oza AM, Fleming GF, et al. Randomized trial of oral cyclophosphamide and veliparib in high-grade serous ovarian, primary peritoneal, or fallopian tube cancers, or BRCA-mutant ovarian cancer [J]. Clin Cancer Res, 2015, 21(7): 1574-1582.
[12] Ledermann J, Harter P, Gourley C, et al. Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer [J]. N Engl J Med, 2012, 366(15): 1382-1392.
[13] Mirza MR, Monk BJ, Herrstedt J, et al. Niraparib maintenance therapy in platinum-sensitive, recurrent ovarian cancer [J]. N Engl J Med, 2016, 375(22): 2154-2164.
[14] Oza AM, Cibula D, Benzaquen AO, et al. Olaparib combined with chemotherapy for recurrent platinum-sensitive ovarian cancer: a randomised phase 2 trial [J]. Lancet Oncol, 2015, 16(1): 87-97.
[15] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[16] Pignata S, Scambia G, Ferrandina G, et al. Carboplatin plus paclitaxel versus carboplatin plus pegylated liposomal doxorubicin as first-line treatment for patients with ovarian cancer: the MITO-2 randomized phase III trial [J]. J Clin Oncol, 2011, 29(27): 3628-3635.
[17] McGuire WP, Hoskins WJ, Brady MF, et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer[J]. N Engl J Med, 1996, 334(1): 1-6.
[18] Alsop K, Fereday S, Meldrum C, et al. BRCA mutation frequency and patterns of treatment response in BRCA mutation-positive women with ovarian cancer: a report from the Australian Ovarian Cancer Study Group [J]. J Clin Oncol, 2012, 30(21): 2654-2663.
[19] Walsh CS. Two decades beyond BRCA1/2: homologous recombination, hereditary cancer risk and a target for ovarian cancer therapy [J]. Gynecol Oncol, 2015, 137(2): 343-350.

