血管活性肠肽抑制帕金森病MPTP模型小鼠纹状体中核因子-κB p65、肿瘤坏死因子α和单核细胞趋化蛋白-1的上调*
吕 娥 刘 飞 李 侃 李晓健 费学超 卢克良
(潍坊医学院,1 组织学与胚胎学教研室,2 2014级生物医学专业,3 2015级生物医学专业,4 2013级生物医学专业,5 麻醉医学教研室,潍坊 261053)
帕金森病(Parkinson’s disease,PD)主要病理改变是中脑黑质多巴胺(dopamine,DA)能神经元渐进性变性、死亡,导致黑质纹状体系统DA含量明显减少。然而,PD的发病机制仍不明确。近年来研究表明,神经炎症在PD的发病中起着至关重要作用[1]。神经炎症是由小胶质细胞介导的多种细胞损伤及其释放的炎症介质引起的[2],可加剧神经变性过程,最终导致神经元死亡[3]。核因子-κB(nuclear factor-κB,NF-κB)在活化的小胶质细胞中表达明显增加,参与调节许多促炎物质,如肿瘤坏死因子α(tumor necrosis factor alpha,TNFα),白介素1(interleukin 1,IL-1)和白介素6(interleukin 6,IL-6)等的转录[4]。单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)与PD神经炎症密切相关,可能是炎症反应起始因素中的一个关键因子[5]。血管活性肠肽(vasoactive intestinal peptide,VIP)是一种具有免疫调节和抗炎活性的神经肽[6]。Mario等[7]及本课题组[8]的研究均表明VIP可抑制中脑黑质小胶质细胞的活化,具有神经保护作用。本研究旨在通过1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)模型小鼠探讨VIP是否通过调节NF-κB p65的水平,从而抑制神经炎症,对纹状体发挥神经保护作用。
1 材料和方法
1.1 实验动物
成年雄性C57BL/6小鼠(12~14周龄),体质量25~31g,购买于济南朋悦实验动物繁育有限公司(动物合格证号:SCXK鲁20140007)。
1.2 主要试剂
MPTP·HCl、VIP、小鼠单克隆酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体、兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体和兔抗β-actin抗体均购买于美国Sigma公司;兔抗NF-κB p65抗体购买于上海良森生物有限公司;兔抗离子钙结合蛋白-1(ionized calcium-binding adaptor molecule-1,Iba1)购自日本和光公司;小鼠来源的TNF-α和MCP-1的酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒购自武汉CUSABIO公司;生物素-链霉卵白素免疫组织化学检测试剂盒购买于北京中杉金桥生物公司;实验中使用的主要仪器有德国Eppendorf公司紫外可见分光光度计、日本Olympus公司光学显微镜和德国Leica公司冰冻切片机。
1.3 PD亚急性MPTP小鼠模型的建立和动物分组
将动物随机分为生理盐水对照组(NS组)、MPTP组、MPTP+VIP组,每组8~12只。MPTP组以30mg·kg-1·d-1的剂量给予MPTP腹腔注射,1次/天,共5d。动物适应环境7d后开始实验,记为第1天,开始给予MPTP+VIP组小鼠隔天腹腔注射VIP[6](1.5mg/kg),共8次,NS组和MPTP组给予等体积的生理盐水腹腔注射。第5次注射VIP结束后2h,开始MPTP腹腔注射,MPTP组和NS组动物分别腹腔注射MPTP和相应体积的生理盐水,注射5d后各组小鼠水合氯醛麻醉,一部分于冰上快速剥离脑组织,分离出双侧纹状体,置于Eppendorf管中,放入液氮速冻,置于-80℃冰箱保存;另一部分采用4%多聚甲醛灌注固定后分离脑组织,用于各种指标的检测。
1.4 免疫组织化学显色
脑组织沉糖后,冰冻切片机将脑组织冠状切片(30μm),加入通透缓冲液0.3% Triton X-100,室温孵育30min。0.01mol/L的PBS溶液洗涤,5min×3次。3% H2O2溶液室温孵育30min,封闭内源性过氧化物酶。洗涤后血清工作液,室温封闭30min后,分别滴加小鼠抗TH抗体(1∶1000),兔抗GFAP抗体(1∶1000)及兔抗Iba-1抗体(1∶500),4℃孵育过夜,参照庄文欣等[7]的实验方法进行后续实验,直至脱水、透明和封片,并拍摄照片。用图像分析软件Image Pro Plus 6.0,对各组小鼠纹状体TH、GFAP和Iba1阳性染色的平均光密度值(optical density,OD)进行分析,统计各组小鼠纹状体的平均OD值与NS组均值比值间的差异。
1.5 酶联免疫吸附反应
将纹状体组织于磷酸盐缓冲液中冰上匀浆,再冻融两次后,4℃离心,保留上清,按照ELISA试剂盒说明书进行TNFα和MCP-1的含量变化的检测,酶标仪读取450nm波长的吸光度。统计各组纹状体平均吸光度与NS组均值比值间的差异。
1.6 免疫印迹检测
将样品从冰箱取出,准确称量。加入RIPA蛋白裂解液充分裂解后,超声破碎20s后,冰上静置30min后,4℃,12000r/min,离心10min,收集上清入Eppendorf管中,即为纹状体蛋白。二喹啉甲酸(bicinchonininc acid,BCA)法蛋白质定量后,调整样品蛋白浓度并加入凝胶加样缓冲液,95℃变性5min。而后参照文献[7]进行后续实验,其中孵育的一抗为兔抗NF-κB p65(1∶1000)或兔抗β-actin(1∶5000)的试管中。用Image Pro Plus 6.0图像分析软件进行条带平均吸光度(average absorbance,AA)分析,把各组NF-κB p65条带AA与β-actin条带AA比值与NS组比值相比较。
1.7 统计学处理
2 结果
2.1 VIP可保护MPTP小鼠纹状体TH的水平
免疫组织化学显色显示(图1A-TH),NS组纹状体TH阳性神经纤维染色呈现为棕色,MPTP组则染色浅淡,MPTP+VIP组纹状体TH染色明显较MPTP组深。图像分析结果(图1B)显示,MPTP组比NS组小鼠减少约60%,MPTP+VIP组比MPTP组增多约40%,差异均有统计学意义,表明给予VIP可改善MPTP诱导的小鼠纹状体TH水平的降低。
2.2 VIP可减轻MPTP小鼠纹状体星形胶质细胞胶质化和小胶质细胞的活化
GFAP是星形胶质细胞的特异性标记物,其免疫组织化学显色可检测星形胶质细胞的形态和激活改变。对纹状体区GFAP的免疫组织化学显色(图1A-GFAP)显示,NS组阳性细胞胞体小,突起细而长,染色浅淡。MPTP组阳性细胞呈现典型的胶质化形态,细胞染色深,胞体变大,突起多而粗,而MPTP+VIP组阳性细胞较MPTP组染色较浅,突起少而细。图像分析结果(图1C)显示,MPTP组比NS组显著增高(P<0.01),MPTP+VIP组比MPTP组明显降低(P<0.05)。以上结果表明,VIP可明显降低MPTP诱导的小鼠纹状体区星形胶质细胞的胶质化。
Iba1是小胶质细胞的特异性标志蛋白,其免疫组织化学显色可显示小胶质细胞的形态和激活状况。纹状体区Iba1免疫组织化学显色结果(图1A-Iba1)显示,NS组小鼠阳性细胞体积较小,染色浅,突起纤细且少;MPTP组阳性细胞聚集成团,细胞染色深,体积大,突起短而粗,为明显的阿米巴样激活状态。MPTP+VIP组阳性细胞比MPTP组细胞数量减少,体积较小,激活状态弱。图像分析(图1D)显示,MPTP组比NS组显著增加(P<0.01),MPTP+VIP组比MPTP组明显减少(P<0.05)。由以上结果提示,给予VIP明显降低MPTP诱导的PD小鼠纹状体区小胶质细胞的活化。
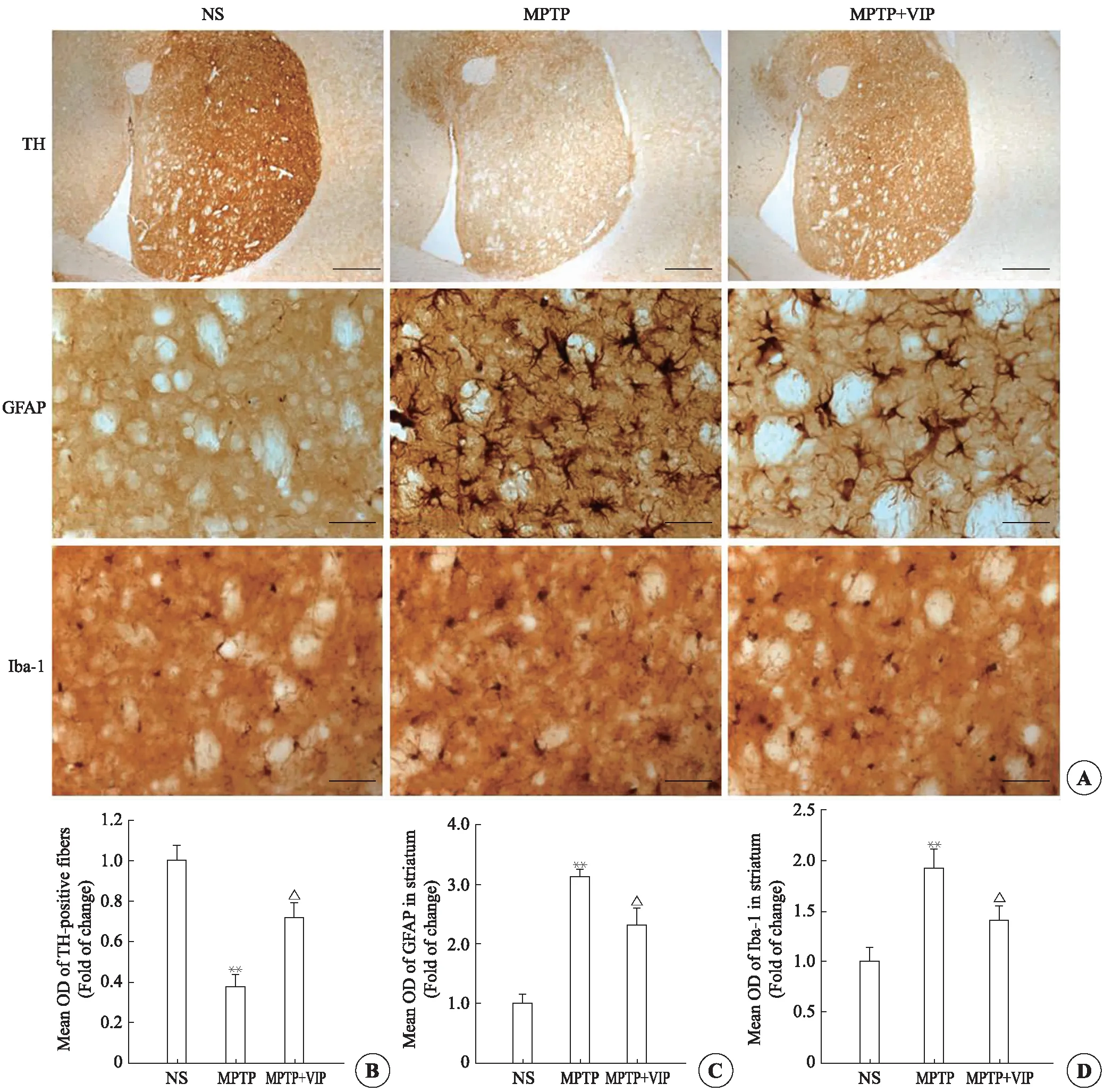
图1 VIP对MPTP小鼠纹状体区TH、GFAP和Iba1水平的影响。免疫组织化学法显示纹状体区TH、GFAP和Iba1的水平(A)。标尺=500μm(TH),标尺=50μm(GFAP和Iba1)。纹状体区TH阳性神经纤维(B)、纹状体区GFAP(C)和Iba1(D)的平均光密度统计分析(n=4)。**P<0.01vsNS组;△P<0.05vsMPTP组.
Fig 1 Effects of VIP on the levels of TH,GFAP and Iba1 in the striatum of MPTP-induced mice.(A) The levels of TH,GFAP and Iba1 in the striatum by immunohistochemistry.Scale bar=500μm (TH),Scale bar=50μm (GFAP and Iba1).Quantification of the mean OD of TH-positive fibers (B),GFAP (C) and Iba-1 (D) in the striatum (n=4).**P<0.01vsNS group.△P<0.05vsMPTP group.
2.3 VIP可降低MPTP小鼠纹状体TNFα和MCP-1的含量
ELISA法检测结果显示,与NS组相比,MPTP组小鼠纹状体TNFα(图2A)和MCP-1(图2B)的异常升高,而VIP明显逆转毒性MPTP导致的炎症因子TNFα和MCP-1的升高,结果表明,VIP可显著降低MPTP诱导的PD小鼠纹状体的神经炎症反应。

图2 VIP下调MPTP小鼠纹状体TNFα和MCP-1的含量Fig 2 VIP down-regulated the content of TNFα and MCP-1 in the striatum of MPTP-induced miceQuantification of the content of TNF-α (A) and MCP-1 (B) in the striatum by ELISA (n=6).*P<0.05,**P<0.01 vs NS group, △P<0.05,△△P<0.01 vs MPTP group
2.4 VIP可下降MPTP小鼠纹状体NF-κB p65的水平
用免疫印迹检测NF-κB p65的水平(图3A),统计结果(图3B)显示,MPTP组比NS组显著升高(P<0.05);MPTP+VIP组与MPTP组相比明显下降(P<0.05),表明VIP可降低MPTP诱导的PD小鼠纹状体NF-κB p65水平的异常升高。
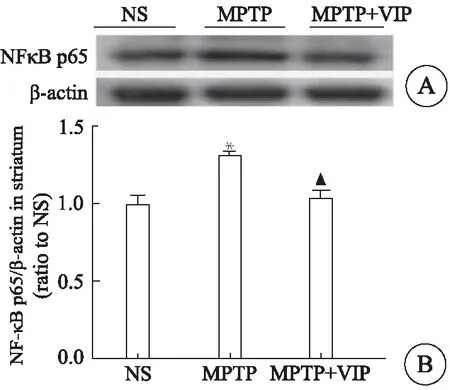
图3 VIP降低MPTP小鼠纹状体NF-κB p65的水平Fig 3 VIP restrained the level of NF-κB p65 in the striatum of MPTP-induced miceImmunoblot analysis of NF-κB p65/β-actin protein expression in the striatum (A).Quantification of NF-κB p65 (B) levels (n=4).*P<0.05 vs NS group,△P<0.05 vs MPTP group
3 讨论
最近的研究表明,炎症和炎症性应激反应是各种神经退行性疾病(包括PD)的主要因素[1]。PD患者和神经毒性物质诱导的PD模型均出现小胶质细胞显著激活和和星形胶质细胞的胶质化[9]。本实验中MPTP诱导的PD模型小鼠纹状体也出现明显的小胶质细胞的激活和星形胶质细胞的胶质化。激活的小胶质细胞和星形胶质细胞会影响周围局部组织环境中炎症因子,如细胞因子、趋化因子等的分泌[10]。因子释放失调可能是导致神经退行性疾病中神经元损伤的主要原因。有研究显示,炎症介质在体内或体外均可促进α-突触核蛋白的聚集并导致DA的继发性神经毒性反应[11]。因而,有学者认为抑制炎症在PD模型中发挥重要的神经保护作用,或许对PD患者也发挥至关重要的疗效[12]。
NF-κB是炎症发生过程的重要介质,可参与调节许多炎性物质的表达[4]。在脂多糖诱导的PD大鼠模型中,Sharma等[13]报道NF-κB及TNFα、白介素1等炎性因子在黑质DA能神经元表达明显上调。趋化因子MCP-1和细胞因子TNFα在神经炎症中发挥着重要作用。神经元和神经胶质细胞均可产生MCP-1,可以调节单核细胞的趋化性[5]。PD患者外周血MCP-1水平比健康对照组受试者明显增高,且与患者的认知功能和抑郁状况密切相关[14]。黑质中脑DA能神经元对具有促炎作用的细胞因子TNFα非常敏感[15],PD患者脑脊液和尸检脑组织均显示TNFα水平升高[16]。本实验中,给予神经毒素MPTP后,纹状体NF-κB p65、MCP-1和TNFα均明显上升,与文献[13-16]报道结果一致。
PD作为一种慢性、进行性和多因素神经系统疾病,目前尚无令人满意的治疗手段,如能发现具有对抗神经免疫炎症和氧化应激等多靶点的小分子物质,从而可以保护DA能神经元,延缓疾病的恶化,有可能从根本上解决PD治疗这一医学难题。Dogrukol-Ak等[17]研究表明,VIP可以在外周给药后,经由跨膜扩散系统通过血脑屏障,无需酶的降解。在体外和大鼠体内研究已显示VIP具有对抗6-羟基多巴胺(6-hydroxydopamine,6-OHDA)[18]和MPTP[7]的氧化作用。在MPTP诱导的PD小鼠模型中,通过脑内或外周给予VIP可阻止在黑质和纹状体中小胶质细胞诱导的神经炎症,并减少多巴胺能的丢失[19]其保护机制可能是通过降低细胞因子等的反应而发挥抗炎作用[20]。本实验结果显示,VIP可缓解MPTP损伤导致的纹状体区TH的减少,抑制小胶质细胞和星形胶质细胞的激活,与上述文献报道一致。进一步研究显示,VIP可减少MPTP诱导的纹状体TNF-α和MCP-1的分泌,并降低NF-κB p65的激活。
综上所述,VIP可改善MPTP诱导的小鼠纹状体TH的减少,明显降低小胶质细胞和星形胶质细胞的活化,减少TNFα和MCP-1的分泌,其机制可能是VIP通过抑制 NF-κB p65的水平从而降低TNFα和MCP-1的异常升高,减轻神经炎症反应,从而缓解对纹状体的神经损伤。通过本次初步研究,为进一步探讨VIP可能成为治疗PD潜在药物的作用机制提供了一定的实验依据。
参 考 文 献
[1] Kempuraj D,Thangavel R,Natteru P A,et al.Neuroinflammation Induces Neurodegeneration[J].J Neurol Neurosurg Spine,2016,1(1):pii:1003.
[2] Shabab T,Khanabdali R,Moghadamtousi S Z,et al.Neuroinflammation pathways:a general review[J].Int J Neurosci,2016,1-10.
[3] Ransohoff R M.How neuroinflammation contributes to neurodegeneration[J].Science,2016,353(6301):777-783.
[4] Li N,Liu B W,Ren W Z,et al.GLP-2 attenuates LPS-induced inflammation in BV-2 cells by inhibiting ERK1/2,JNK1/2 and NF-κB signaling pathways[J].Int J Mol Sci,2016,17(2):190.
[5] Pattarini R,Smeyne R J,Morgan J I.Temporal mRNA profiles of inflammatory mediators in the murine 1-methyl-4-phenyl-1,2,3,6-tetrahydropyrimidine model of Parkinson’s disease[J].Neuroscience,2007,145(2):654-668.
[6] Delgado M,Abad C,Martinez C,et al.Vasocative intestinal peptide in the immune system:potential therapeutic role in inflammatory and autoimmune diseases[J].J Mol Med,2002,80(1):16-24.
[7] Delgado M,Ganea D.Neuroprotective effect of vasoactive intestinal peptide (VIP) in a mouse model of Parkinson’s disease by blocking microglial activation[J].FASEB J,2003,17(8):944-956.
[8] 庄文欣,刘宗昱,王雪净,等.血管活性肠肽对帕金森病大鼠黑质胶质细胞活化及相关炎性因子释放的影响[J].解剖学报,2016,47(2):178-184.
[9] Gerhard A,Pavese N,Hotton G,et al.In vivo imaging of microglial activation with [11C](R)-PK11195 PET in idiopathic Parkinson’s disease[J].Neurobiol Dis,2006,21(2):404-412.
[10] Karthikeyan A,Patnala R,Jadhav S P,et al.MicroRNAs:Key players in microglia and astrocyte mediated inflammation in CNS pathologies[J].Curr Med Chem,2016,23(30):3528-3546.
[11] Su X,Maguire-Zeiss K A,Giuliano R,et al.Synuclein activates microglia in a model of Parkinson’s disease[J].Neurobiol Aging,2008,29(11):1690-1701.
[12] Bassani T B,Vital M A,Rauh L K.Neuroinflammation in the pathophysiology of Parkinson’s disease and therapeutic evidence of anti-inflammatory drugs[J].Arq Neuropsiquiatr,2015,73(7):616-623.
[13] Sharma N,Kapoor M,Nehru B.Apocyanin,NADPH oxidase inhibitor prevents lipopolysaccharide induced α-synuclein aggregation and ameliorates motor function deficits in rats:Possible role of biochemical and inflammatory alterations[J].Behav Brain Res,2016,296:177-190.
[14] Gao L,Tang H,Nie K,et al.MCP-1 and CCR2 gene polymorphisms in Parkinson’s disease in a Han Chinese cohort[J].Neurol Sci.2015,36(4):571-576.
[15] McGuire S O,Ling Z D,Lipton J W,et al.Tumor necrosis factor alpha is toxic to embryonic mesencephalic dopamine neurons[J].Exp Neurol,2001,169(2):219-230.
[16] Mogi M,Harada M,Riederer P,et al.Tumor necrosis factor-alpha (TNF-alpha) increases both in the brain and in the cerebrospinal fluid from parkinsonian patients[J].Neurosci Lett,1994,165(1-2):208-210.
[17] Dogrukol-Ak D,Banks W A,Tuncel N,et al.Passage of vasoactive intestinal peptide across the blood-brain barrier[J].Peptides,2003,24(3):437-444.
[18] Tuncel N,Korkmaz O T,Tekin N,et al.Antioxidant and anti-apoptotic activity of vasoactive intestinal peptide (VIP) against 6-hydroxy dopamine toxicity in the rat corpus striatum[J].J Mol Neurosci,2012,46(1):51-57.
[19] Korkmaz O,Ay H,Ulupinar E,et al.Vasoactive intestinal peptide enhances striatal plasticity and prevents dopaminergic cell loss in Parkinsonian rats[J].J Mol Neurosci,2012,48(3):565-573.
[20] Olson K E,Kosloski-Bilek L M,Anderson K M,et al.Selective VIP receptor agonists facilitate immune transformation for dopaminergic neuroprotection in MPTP-intoxicated mice[J].J Neurosci,2015,35(50):16463-16478.