运动疲劳小鼠皮层-纹状体突触可塑性受损的机制研究
马 婧,陈慧敏,张凌韬,刘晓莉,乔德才
运动疲劳(exercise-induced fatigue,EF)在竞技运动中普遍存在,它不仅严重影响运动员运动技能的执行,并且影响运动员的注意力和信息处理等认知功能(闫东旭等,2019)。长期运动疲劳导致神经肌肉功能下降,从而增加运动员的损伤风险(郭浩等,2021),并可能对其身心健康造成严重危害。因此,探究运动疲劳的中枢调控机制至关重要,但目前运动疲劳的发生或维持机制尚未被完全揭示。
皮层-纹状体突触可塑性被认为是随意运动、运动技巧性学习以及习惯性行为的细胞机制(Di Filippo et al.,2009),运动技巧性学习能够使人脑的突触可塑性发生变化(刘展,2020;任占兵等,2019)。皮层-纹状体突触可塑性能够调节基底神经节环路的功能,从而调控运动。其主要有两种表现形式,即长时程增强(long-term potentiation,LTP)和长时程抑 制(long-term depression,LTD)。纹状体同时接受皮层和丘脑的Glu能神经投射,以及黑质的DA能神经投射(Kreitzer et al.,2008;Kuhlmann et al.,2021),因此,皮层-纹状体突触可塑性同时受Glu能系统和DA能系统的调控。研究证实,皮层-纹状体通路LTP依赖于通过NMDA受体内流的Ca2+,以及NMDA受体和多巴胺1型受体(dopamine 1 receptor,D1R)的共同激活(Chepkova et al.,2012,2013)。而皮层-纹状体通路LTD依赖于通过L型Ca2+通道内流的Ca2+,以及代谢型谷氨酸1型受体(metabotropic glutamate receptor 1,mGluR1)、多巴胺2型受体(dopamine 2 receptor,D2R)和大麻素1型(cannabinoid 1,CB1)受体的共同激活(Chepkova et al.,2012;Gubellini et al.,2004)。研究发现,运动能够影响多巴胺能信号通路,增强多巴胺能系统的功能(冯俊鹏等,2019),并且多种运动功能障碍都与皮层-纹状体的突触可塑性异常有关,如亨廷顿舞蹈病(Huntington’s disease,HD)、帕金森病(Parkinson’s disease,PD)和肌张力障碍(dystonia)等模式动物都表现出皮层-纹状体通路的LTP和/或LTD受损(时凯旋 等,2021;Ghiglieri et al.,2019;Nouhi et al.,2017;Peterson et al.,2010)。运动疲劳后小鼠也会出现动作不协调、迟缓僵硬等行为表现,但鲜见关于运动疲劳后皮层-纹状体突触可塑性的变化研究。
前期利用场电位和膜片钳技术研究发现,小鼠运动疲劳后皮层-纹状体的LTP和LTD均受损,纹状体中型棘状神经元(medium spiny neurons,MSNs)自发型兴奋性突触后电流(spontaneous excitatory postsynaptic currents,sEPSCs)的幅度不变,但sEPSCs的频率升高,双脉冲反应比值(paired-pulse ratio,PPR)降低,NMDA/AMPA电流比值降低(Ma et al.,2018)。这些结果表明,小鼠运动疲劳后皮层-纹状体通路的双向突触可塑性受损,突触前Glu释放的概率升高,AMPA受体的功能不变,但NMDA受体的功能降低。
由于皮层-纹状体突触可塑性受Glu能系统和DA能系统的双重调控,因此,在前期研究发现运动疲劳小鼠皮层-纹状体突触可塑性受损的基础上,本研究从Glu能系统和DA能系统入手,分别采用高效液相色谱分析(high performance liquid chromatography,HPLC)和免疫印迹(Western Blot)技术,检测纹状体脑区Glu、DA的浓度,以及Glu受体和DA受体的表达含量,以期进一步揭示小鼠运动疲劳后皮层-纹状体突触可塑性受损的分子机制。
1 材料与方法
1.1 实验动物与分组
2月龄雄性C57BL/6小鼠(北京维通利华实验动物技术有限公司)分笼饲养,自由进食饮水,自然光照,室温(22±2)℃,相对湿度(50±10)%。小鼠适应性饲养3天后,随机分为对照组(Control,n=24)和运动疲劳组(EF,n=26)。
1.2 运动疲劳小鼠模型的建立
运动疲劳小鼠模型的创建方法同前期研究(马婧等,2018)。首先,对小鼠进行连续3天的适应性跑台训练,15 min/天,跑台速度为10 m/min。检测每只小鼠的最大运动速度,检测方法:小鼠以5 m/min的速度热身运动3 min后,将速度提高至10 m/min运动1 min,随后速度提高1 m/min,直到小鼠跟不上跑台速度,持续退落至跑台后方,该速度即为小鼠的最大运动速度。其次,进行连续7天的重复力竭跑台运动:以5 m/min的速度热身运动3 min后,将跑台速度设定为小鼠最大运动速度的85%,以此速度使小鼠持续运动至力竭。力竭的判定标准:小鼠不能维持预定速度,长期滞留于跑道后方不动,使用手连续触碰驱赶仍无效,并伴有呼吸急促、腹卧跑台、垂头不起等行为表现。Control小鼠暴露在相同的环境中,但不进行跑台运动。
1.3 高效液相色谱分析实验
1.3.1 小鼠纹状体匀浆样品制备
小鼠运动疲劳建模完成后即刻,对小鼠腹腔注射水合氯醛(400 mg/kg)麻醉处死。冰浴中快速分离双侧纹状体,以1∶10(组织质量/高氯酸体积)的体积比加入0.1 N的高氯酸,冰浴中匀浆,4℃14 000 r/min离心15 min后取上清液,用0.22 μm的滤膜过滤,再次4℃14 000 r/min离心15 min后取上清液,置于-80℃冰箱中保存待测。
1.3.2 柱前衍生荧光检测法测定Glu浓度
称取Glu标准品,利用0.1 N的高氯酸溶解分别配制浓度为10、1、0.1、0.01、0.001 μmol/L的Glu标准溶液。配制流动相A(0.1 mol/L磷酸二氢钾溶液,pH 6.6)和流动相B(40%纯甲醇)溶液,真空抽滤,超声波震荡脱气。首先进行仪器管道的清洗,设定流动相的速度为1 mL/min,排空管内的气体。调节流速为0.1~0.2 mL/min,连接色谱柱(QU-3C18-15021)和荧光检测器(RF-20A),柱温箱温度设定为25℃,荧光检测器的激发波长设为357 nm,发射波长设为455 nm。吸取20 μl的标准品溶液/样品匀浆液,加入10 μl邻苯二甲醛(OPA)衍生试剂和10 μl Na2CO3缓冲液,充分混匀后静置30 s,微量进样针抽取20 μl进样到HPLC系统中检测。
利用Glu标准品的不同浓度(10、1、0.1、0.01、0.001μmol/L)及色谱中对应的峰面积,设标准品浓度为横坐标x,峰面积为纵坐标y,计算得到Glu的标准曲线方程。将小鼠纹状体匀浆液色谱图中与标准品具有相同保留时间(±0.1 s)的色谱峰的峰面积带入标准曲线,从而计算小鼠纹状体匀浆液中的Glu浓度。
1.3.3 电化学检测法测定DA浓度
称取DA标准品,利用0.1 N的高氯酸溶解,分别配制成10、1、0.1、0.01、0.001 μmol/L 的标准液。流动相 A:将0.09 mol/L二水合磷酸二氢钠溶液、0.001 7 mol/L辛烷基磺酸钠、0.05 mol/L一水合柠檬酸和50 μmol/L的EDTA混合后,利用磷酸将其pH调至3.0。流动相B:纯甲醇(10%恒流洗脱),使用前经0.22 μm有机膜过滤,超声波震荡脱气,设置流动相的速度为0.2 mL/min。采用QU-3C18-15021色谱柱,柱温箱温度设定为30℃,工作电压0.52 V,灵敏度为0.1 nA。微量进样针抽取20 μl的标准品溶液/样品匀浆液进样到HPLC系统中进行检测。
利用DA标准品的不同浓度(10、1、0.1、0.01、0.001μmol/L)及色谱中对应的峰面积,设标准品浓度为横坐标x,峰面积为纵坐标y,计算得到DA的标准曲线方程。将小鼠纹状体匀浆液色谱图中与标准品具有相同保留时间(±0.1 s)的色谱峰的峰面积,带入标准曲线,从而计算小鼠纹状体匀浆液中的DA浓度
1.4 免疫印迹实验
小鼠运动疲劳建模完成后即刻,对小鼠腹腔注射水合氯醛(400 mg/kg)麻醉处死。冰浴中快速分离纹状体,利用膜蛋白提取试剂盒提取纹状体膜蛋白。将蛋白质样品置于95℃下,煮沸5 min,使蛋白变性。浓缩胶恒压80 V电泳约30 min,待样品进入分离胶后,恒压110 V电泳约100 min。4℃恒流0.25 A的条件下,采用湿转法转膜3 h。随后用5%脱脂奶粉-TBST室温下封闭PVDF膜1 h。TBST洗3次,每次10 min。加入2.5%脱脂奶粉-TBST配置的各一抗溶液,4℃孵育过夜。TBST洗3次,每次10 min。5%脱脂奶粉-TBST配置辣根过氧化物酶标记的山羊抗兔二抗(1∶10 000,Sigma,R4880)室温孵育1 h。TBST洗3次,每次10 min(马婧等,2018)。利用化学发光法进行显影定影,Quantity One软件扫描目的蛋白以及内参的灰度值,将Control小鼠中目的蛋白与内参的比值标准化为100%,EF以与Control小鼠的比值表示。
目的蛋白和内参的一抗浓度及型号信息如下:GluR1,1∶1 000,Abcam ab109450;GluR2,1∶1 000,Abcam ab52932;mGluR1,1∶1 000,CST 12551S;D1R,1∶1 000,Abcam ab81296;D2R,1∶1 000,Millipore AB5084P;β-actin,1∶10 000,Sigma A2066)。
1.5 数据处理
所有数据均以Mean±SEM表示。利用Student’s t-test分析组间差异。双侧*P<0.05定义为有统计学差异,**P<0.01为差异显著,***P<0.001为差异极显著。
2 结果
2.1 运动疲劳后小鼠纹状体Glu能系统的变化
2.1.1 纹状体Glu含量的变化
Glu标准品和小鼠纹状体匀浆液的色谱图如图1所示。根据Glu标准品浓度(横坐标x)和对应的色谱图中峰面积(纵坐标y),计算得到Glu的标准曲线方程:y=369 845x+1 406 929(R2=0.978 3)。统计结果显示,与Control小鼠相比,EF小鼠纹状体Glu的浓度增加[Control:(8.86±1.57)×10-6mol/L,n=7;EF:(14.23±1.33)×10-6mol/L,n=7;Student’s t-test,P<0.05;图2],表明小鼠运动疲劳后纹状体脑区Glu的含量增加。这与前期研究利用膜片钳技术发现的运动疲劳后小鼠纹状体突触前Glu的释放概率升高结果一致(Ma et al.,2018)。
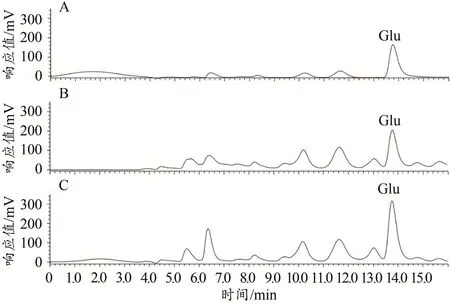
图1 Glu标准品和纹状体匀浆液的高效液相色谱图Figure 1.The HPLC Chromatograms of Glu Standards and Striatal Homogenates
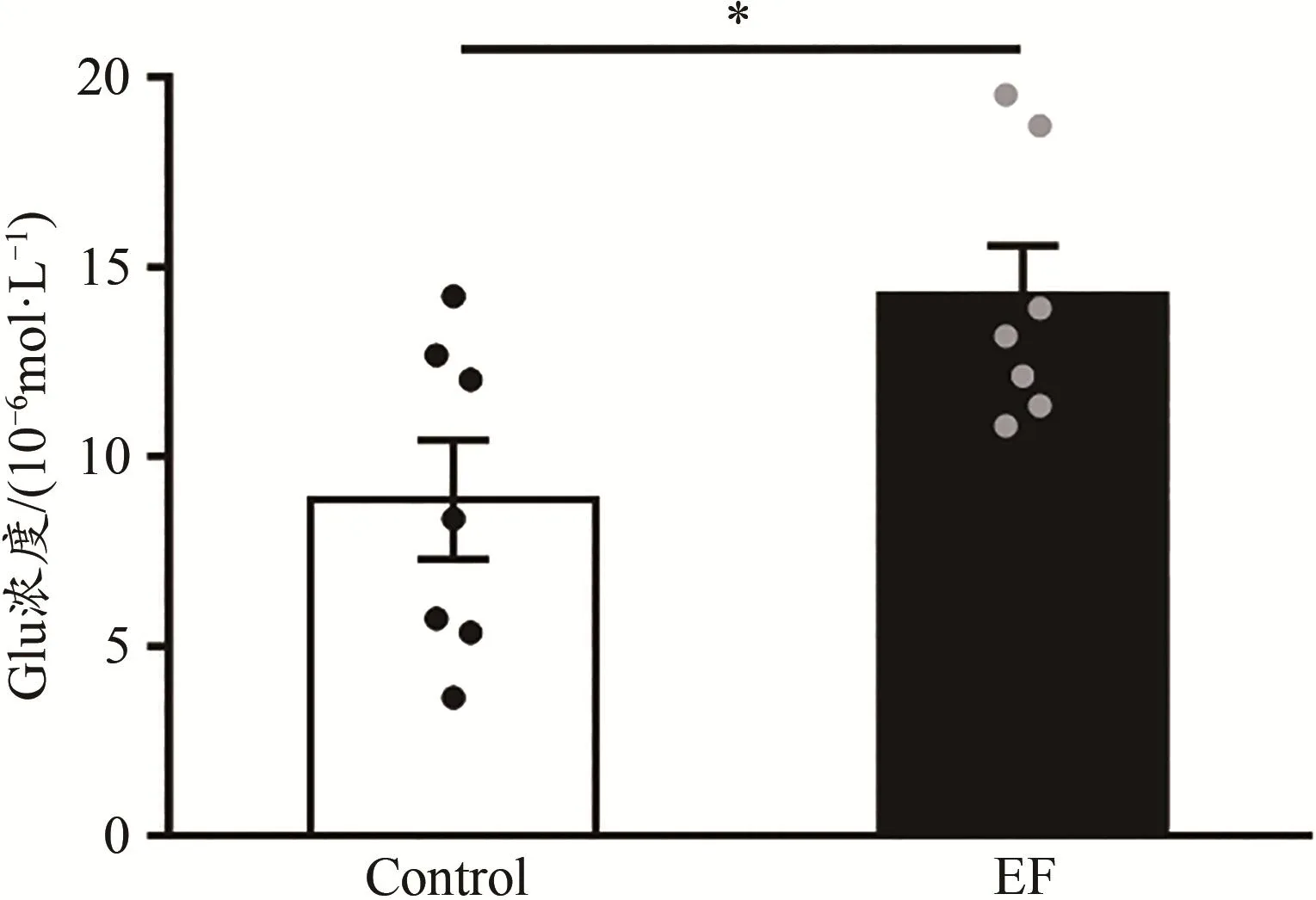
图2 运动疲劳组与对照组小鼠纹状体Glu的浓度对比Figure 2.Comparison of Striatal Glu Concentration between EF and Control Mice
2.1.2 纹状体Glu受体表达含量的变化
2.1.2.1 纹状体AMPA受体表达含量的变化
AMPA受体是离子通道型Glu受体的一种,介导哺乳动物大脑中的快速兴奋性突触传递。AMPA受体在纹状体脑区表达丰富,GluR1亚基和GluR2亚基是纹状体AMPA受体的主要组成亚基,在MSNs和中间神经元中广泛存在(Mao et al.,2013)。
利用Western Blot技术,检测纹状体膜蛋白中GluR1亚基和GluR2亚基的表达含量。结果显示,EF小鼠纹状体GluR1的表达含量与Control小鼠相比无差异[Control:(100.00±10.60)%,n=6;EF:(98.85±8.90)%,n=7;Student’s t-test,P>0.05;图3A、图3B],GluR2的表达也正常[Control:(100.00±5.07)%,n=7;EF:(98.93±4.57)%,n=7;Student’s t-test,P>0.05;图3C、图3D]。EF小鼠纹状体GluR1亚基和GluR2亚基的表达正常,提示,运动疲劳不影响纹状体AMPA受体的表达。
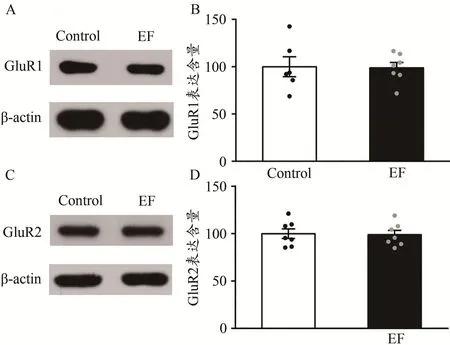
图3 运动疲劳组与对照组小鼠纹状体GluR1、GluR2的蛋白表达比较Figure 3.Comparison of Expression of GluR1 and GluR2 in Striatum between EF and Control Mice
2.1.2.2 纹状体mGluR1表达含量的变化
mGluR1为代谢型Glu受体的一种,已有研究证实,皮层-纹状体LTD依赖于mGluR1(Gubellini et al.,2001)。因此,为了检测mGluR1是否参与运动疲劳对小鼠皮层-纹状体LTD的损害,利用Western Blot技术检测了纹状体mGluR1的表达含量。结果显示,EF小鼠纹状体膜蛋白中mGluR1的含 量 显 著降低[Control:(100.00±9.88)% ,n=6;EF:(47.27±8.90)%,n=7;Student’s t-test,P<0.01;图4]。提示,小鼠运动疲劳后纹状体mGluR1的表达下调,mGluR1的表达下调贡献于运动疲劳对小鼠皮层-纹状体LTD的损害。
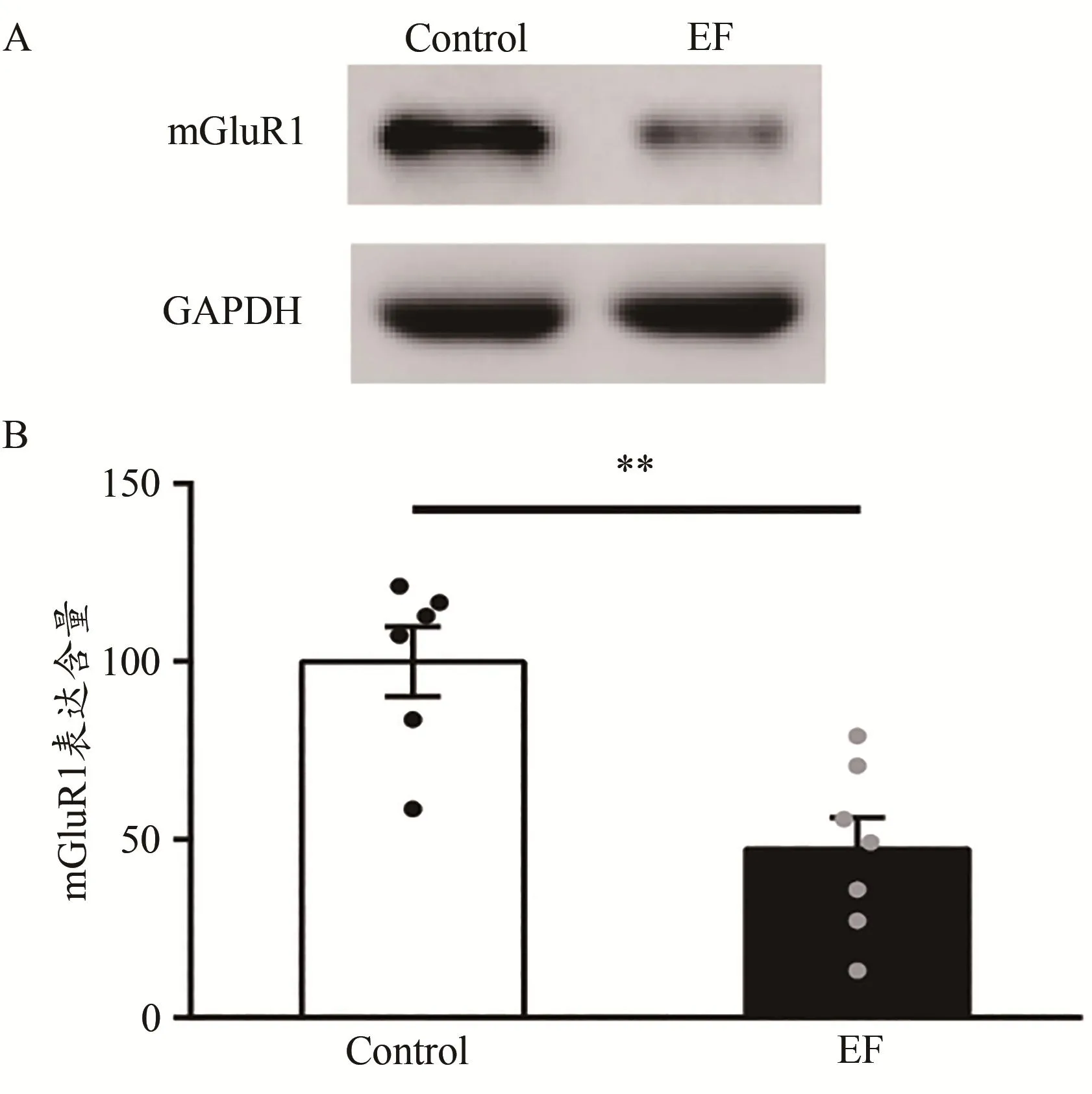
图4 运动疲劳组与对照组小鼠纹状体mGluR1的蛋白表达比较Figure 4.Comparison of Expression of mGluR1 in Striatum between EF and Control Mice
2.2 运动疲劳后小鼠纹状体DA能系统的变化
除了Glu能系统,皮层-纹状体突触可塑性也受DA能系统的调控。激活纹状体DA能系统对于自主运动以及诱导皮层-纹状体突触可塑性均为必需(Centonze et al.,2003)。因此,为了探究运动疲劳是否还通过影响DA能系统,进而影响皮层-纹状体突触可塑性,本研究对运动疲劳后小鼠纹状体DA能系统的变化也进行了探究。
2.2.1 纹状体DA含量的变化
DA标准品和小鼠纹状体匀浆液的色谱图如图5所示。根据DA标准品的浓度(横坐标x)和对应的色谱图中峰面积(纵坐标y),计算得到DA的标准曲线方程:y=114 473x+248 273(R2=0.948 3)。结果显示,与Control小鼠相比,EF小鼠纹状体DA的浓度显著降低[Control:(6.76±0.88)×10-6mol/L,n=5;EF:(2.36±0.90)×10-6mol/L,n=5;Student’s t-test,P<0.01;图6],表明小鼠运动疲劳后纹状体DA的含量降低。
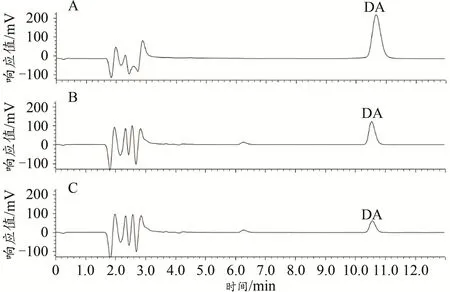
图5 DA标准品和纹状体匀浆液的高效液相色谱图Figure 5.The HPLC Chromatograms of DAStandards and Striatal Homogenates
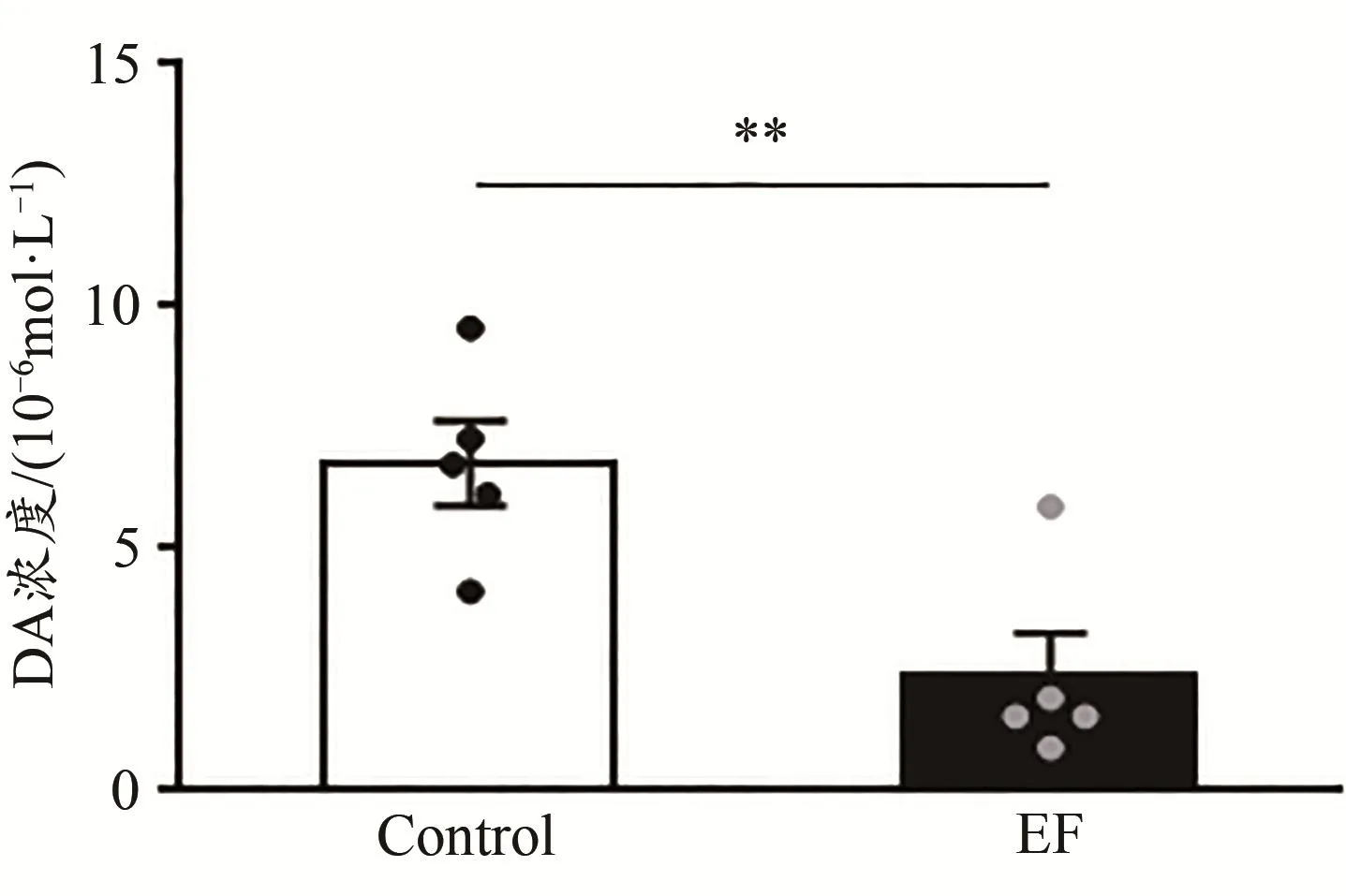
图6 运动疲劳组与对照组小鼠纹状体DA的浓度对比Figure 6.Comparison of Striatal DAConcentration between EF and Control Mice
2.2.2 纹状体DA受体表达含量的变化
纹状体中DA受体主要有两种类型,即D1R和D2R,两者具有不同的作用。其中,D1R位于直接通路的MSNs中,对于诱导皮层-纹状体LTP为必需,而D2R位于间接通路的MSNs中,对于诱导皮层-纹状体LTD为必需(Calabresi et al.,2019)。
采用Western Blot技术,检测两组小鼠纹状体膜蛋白中D1R和D2R的表达含量。统计显示,EF小鼠纹状体D1R的表达含量显著降低[Control:(100.00±2.44)%,n=6;EF:(60.46±5.85)% ,n=7;Student’s t-test,P<0.001;图7A、图7B]。并且,EF小鼠D2R的表达含量也显著降低[Control:(100.00±5.45)%,n=6;EF:(54.70±7.85)%,n=7;Student’s t-test,P<0.001;图7C、图7D]。提示,小鼠运动疲劳后纹状体D1R、D2R的表达均下调,D1R的表达下调可能与皮层-纹状体LTP受损有关,而D2R的表达下调可能与皮层-纹状体LTD受损有关。
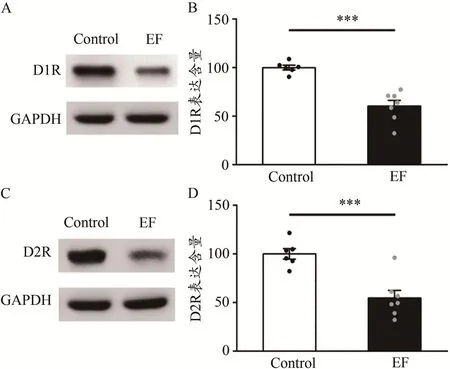
图7 运动疲劳组与对照组小鼠纹状体D1R、D2R的蛋白表达比较Figure 7.Comparison of Expression of D1R and D2R in Striatum between EF and Control Mice
3 讨论
3.1 Glu能系统在运动疲劳损害皮层-纹状体突触可塑性中的作用
前期研究发现,EF小鼠MSNs的sEPSC频率升高、PPR降低,两者一致表明,小鼠运动疲劳后纹状体突触前Glu的释放概率升高(Ma et al.,2018)。本研究采用HPLC技术进一步检测纹状体Glu的浓度,发现小鼠运动疲劳后纹状体Glu的浓度升高。运动疲劳后,小鼠纹状体Glu的含量以及释放增多,提示,纹状体接受来自皮层椎体神经元的兴奋性Glu能神经投射增强。本研究认为,运动疲劳造成纹状体Glu能神经投射增强,可能形成天花板效应,已经使突触强度达到了饱和,因此给予皮层重复高频刺激时,无法使突触强度再进一步增强,从而抑制了皮层-纹状体LTP的形成,这可能是运动疲劳后小鼠皮层-纹状体LTP受损的分子机制之一。而且,纹状体Glu能神经投射增强,Glu的过度累积也可能是直接导致皮层-纹状体LTD受损的机制之一。
AMPA受体是纹状体脑区介导快速兴奋性突触传递的一种离子通道型Glu受体(陈艳清等,2020)。采用Western Blot检测纹状体AMPA受体GluR1亚基和GluR2亚基的表达含量,发现EF小鼠纹状体GluR1亚基和GluR2亚基的表达含量均正常,运动疲劳不影响纹状体AMPA受体的表达。前期膜片钳实验结果显示,EF小鼠sEPSCs的幅度正常(Ma et al.,2018)。由于记录的sEPSCs为AMPA受体介导的突触后电流,因此sEPSCs的幅度正常表示小鼠运动疲劳后纹状体AMPA受体的功能正常。结合这两项实验结果,运动疲劳后纹状体AMPA受体的表达含量和功能均未见改变,表明小鼠运动疲劳后皮层-纹状体突触可塑性的异常并非是由于AMPA受体异常导致的。
NMDA受体是另一种离子通道型Glu受体,NMDA受体的激活,以及通过NMDA受体内流的Ca2+对于诱导皮层-纹状体 LTP为必需(Kuhlmann et al.,2021;Shen et al.,2008)。前期实验结果显示,EF小鼠纹状体NMDA/AMPA电流比值降低,提示,小鼠运动疲劳后纹状体NMDA受体的功能下调(Ma et al.,2018)。NMDA受体的功能下调使内流的Ca2+较少,胞内Ca2+较低,不足以成功诱导LTP,这可能是运动疲劳损害皮层-纹状体通路LTP的另一个原因。
mGluR1是一种代谢型Glu受体,皮层-纹状体LTD依赖于mGluR1。本研究采用Western Blot检测mGluR1的表达含量,发现EF小鼠纹状体mGluR1的表达含量显著降低。皮层椎体神经元释放的Glu与纹状体MSNs突触后膜上的mGluR1结合,激活G蛋白,与通过L型Ca2+通道内流的Ca2+两者共同作用,促使磷脂酰肌醇在磷脂酶C的作用下,经过一系列级联反应,合成内源性大麻素2-AG(张凌韬等,2018)。释放到突触间隙后,2-AG逆行回突触前膜,与突触前膜上的内源性大麻素受体——CB1受体结合,激活CB1受体,继而通过下游一系列分子的作用,最终减少突触前Glu的释放,形成内源性大麻素依赖的LTD(endocannabinoid-dependent LTD,eCB-LTD)(Robbe et al.,2002),这就是皮层-纹状体eCB-LTD的形成过程。内源性大麻素2-AG的合成依赖于mGluR1。因此,本研究认为,运动疲劳后小鼠纹状体mGluR1的表达下调造成内源性大麻素2-AG的合成减少,从而不利于突触前Glu释放的减少,使皮层-纹状体LTD受损。前期研究发现,EF小鼠纹状体CB1受体的表达上调(马婧等2018),这可能是机体对于Glu过度积累、LTD受损做出的一种代偿反应。
3.2 DA能系统在运动疲劳损害皮层-纹状体突触可塑性中的作用
除了接受来自皮层的Glu能神经投射,纹状体还接受来自黑质的DA能神经投射(王炳蔚等,2016)。黑质DA神经元释放DA,与纹状体MSNs突触后膜上的D1R和D2R结合。在背内侧纹状体微量注射D1R和D2R的拮抗剂,能够显著损害运动学习行为,提示,DA能系统在直接和间接通路上的调节作用为必需(Diao et al.,2021)。DA与D1R结合,激活D1R对于诱导皮层-纹状体LTP为必需。使用D1R的拮抗剂或者D1R被敲除的小鼠纹状体均不能成功诱导出 LTP(Kerr et al.,2001;Lovinger et al.,2003)。激活D1R后能够增强环磷酸腺苷和蛋白激酶A的活性,从而促进LTP的产生(Miranda-Barrientos et al.,2014)。DA与D2R结合,激活D2R对于诱导皮层-纹状体LTD为必需(Kreitzer et al.,2007)。DA能系统异常能够损害皮层-纹状体突触可塑性。例如,在PD模式动物中,纹状体DA能神经投射的缺失导致纹状体LTP和LTD的双向受损(Calabresi et al.,2007)。
为了探究运动疲劳后小鼠皮层-纹状体LTP和LTD的受损,是否与DA能系统异常有关,本研究对运动疲劳后小鼠纹状体的DA能系统进行了检测。实验结果显示,EF小鼠纹状体DA的浓度降低,D1R和D2R的表达含量也降低,提示,小鼠运动疲劳后纹状体接受的DA能神经投射减少。这与侯莉娟等(2018)采用免疫组织化学染色观察到的大鼠运动疲劳后D1R和D2R蛋白表达下调的结果一致。小鼠运动疲劳后,纹状体接受的DA能神经投射减少,DA的含量降低,D1R的表达下调,可能是导致皮层-纹状体LTP受损的分子机制之一;而纹状体DA的含量降低,D2R的表达下调,可能是导致皮层-纹状体LTD受损的分子机制之一。
李科等(2019)利用光遗传技术激活DA能系统改善大鼠运动疲劳后纹状体α和β频段震荡的异常,证实DA能系统在调控运动疲劳中发挥重要作用。前期研究发现,小鼠运动疲劳后MSNs的内在膜特性不变、突触前Glu的释放增多、NMDA受体的功能下调(Ma et al.,2018)。本研究进一步发现,小鼠运动疲劳后纹状体DA能神经投射减少。这与已有研究报道的DA能神经投射缺失不影响纹状体MSNs的内在膜特性,但是却增加皮层-纹状体突触终末的Glu浓度和释放(Calabresi et al.,1993;Lindefors et al.,1990),以及下调NMDA受体的功能(Steiner et al.,2010)相一致。提示,在正常的生理状况下,内源的DA能神经投射对Glu能突触传递起着负向的调节作用(余锋 等,2020;Pisani et al.,2005)。因此,本研究认为,运动疲劳导致小鼠纹状体DA能神经投射减少,DA含量降低,D1R和D2R的表达降低,DA能系统功能下调,进而引起纹状体Glu的浓度和释放增多、NMDA受体的功能降低,从而损害了小鼠皮层-纹状体通路的LTP和LTD,造成了小鼠的运动功能障碍。
4 结论
探讨小鼠运动疲劳后皮层-纹状体突触可塑性受损的神经分子机制,发现小鼠运动疲劳后纹状体Glu能系统出现异常,具体表现为Glu的含量增多,mGluR1的表达下调;小鼠运动疲劳后纹状体DA能神经投射减少,DA能系统的功能下调,具体表现为DA的含量降低,D1R和D2R的表达下调。Glu能系统和DA能系统的双重异常可能是导致小鼠运动疲劳后皮层-纹状体突触可塑性受损的原因之一。

