转化生长因子-β1对MC3T3-E1小鼠成骨细胞骨形成的影响
晋 瑞,李 嫚,雷 喆,金迎迎
1)西安交通大学第二附属医院医学影像科 西安 710004 2)西安市第三医院科教科 西安 710018 3)西安交通大学第二附属医院肿瘤科 西安 710004
骨形成的过程主要依靠成骨细胞,并由多种细胞和生长因子协同完成。转化生长因子-β(transforming growth factor-β,TGF-β)是一类在骨形态发生、干细胞分化、细胞凋亡等生理过程中发挥重要调控作用的细胞因子[1],包含TGF-β1、TGF-β2、TGF-β3、Activin A等多个成员,通过与其受体TGF-β超家族信号传导Type 1受体(activin like kinase, ALK5)的结合激活下游信号通路,在骨形成过程中起着重要的调控作用[2-4]。硬骨素(sclerostin, SOST)由骨细胞特异性表达,参与调节骨代谢,是骨形成的负性调控因子。大量动物和临床研究[5-6]表明,SOST在2型糖尿病、甲状腺功能亢进症等多种疾病的骨代谢异常的发生、发展中发挥着一定作用。有研究[7]报道:SOST可经TGF-β及其受体通路抑制成骨细胞分化和骨形成,但具体的作用机制尚不清楚。本研究以MC3T3-E1小鼠成骨细胞系为研究对象,检测TGF-β1诱导下细胞中SOST的表达变化。
1 材料与方法
1.1材料MC3T3-E1小鼠成骨细胞系(中科院上海细胞库)、胎牛血清、DMEM培养液(ATCC 公司),以ALK5基因为靶基因的特异性siRNA及阴性对照(Dharmacon Inc公司),Trizol(Invitrogen公司),ECL发光试剂盒、RIPA细胞蛋白裂解液、琼脂糖(BioWest公司),β-actin、兔抗小鼠Smad2/3 抗体及HRP标记的羊抗兔二抗(Sigma公司),BSA及BCA总蛋白定量试剂盒(Thermo Scientific公司),RNA反转录试剂盒和实时荧光定量PCR反应试剂盒(TaKaRa公司);定点诱变试剂盒(Stratagene公司)。
1.2TGF-β1处理对MC3T3-E1细胞中SOST、ALK5mRNA表达的影响采用快速融化法复苏细胞,用含体积分数10%胎牛血清、青霉素(100 g/L)、链霉素(50 g/L)的DMEM完全培养液将细胞配成2×106/mL的悬浮液,置于6孔板中,每孔2 mL。37 ℃、体积分数5% CO2常规培养48 h后更换为无血清的培养基继续培养24 h。然后分别加入终质量浓度为10 μg/L的甲状旁腺激素(parathyroid hormone, PTH)(PTH处理组)或终质量浓度为10 μg/L的TGF-β1(TGF-β1处理组)处理细胞6、12、24 h,然后取细胞,用实时荧光定量PCR法进行SOST、ALK5 mRNA水平的检测。以等量DMSO处理组为空白对照组。每组均设6个复孔。
1.3ALK5siRNA转染对MC3T3-E1细胞中SOSTmRNA和Smad2/3蛋白表达的影响取生长至对数期的MC3T3-E1细胞进行ALK5-siRNA转染,转染成功后进行后续实验。实验分组:对照组(不加任何处理),ALK5 siRNA处理组(单纯ALK5 siRNA转染),TGF-β1处理组(终质量浓度为10 μg/L的TGF-β1处理24 h),TGF-β1+ALK5 siRNA处理组(终质量浓度为10 μg/L的TGF-β1处理转染ALK5 siRNA的细胞24 h)。每组均设6个复孔。①SOST mRNA:采用Trizol抽提法提取细胞总RNA。按说明书步骤进行实时荧光定量PCR。PCR反应体系:10×扩增缓冲液10 μL,dNTP混合物(各200 μmol/L),引物(各100 pmol),模板DNA 2 μg,Taq DNA聚合酶 2.5 μL,加双蒸水至100 μL。PCR反应条件:94 ℃ 1.5 min;94 ℃ 1 min,64 ℃ 1 min,72 ℃ 1 min 40个循环;最后在72 ℃下延伸10 min,然后,根据目的基因和内参基因的Ct值求得各样本中SOST、ALK5 mRNA的表达水平。②Smad2/3蛋白:用RIPA细胞蛋白裂解液提取细胞蛋白,BCA法测定蛋白浓度。蛋白样品经SDS-PAGE电泳,后电转移至PVDF膜进行如下处理:BSA封闭过夜,兔抗小鼠Smad2/3一抗(按11 00稀释)室温孵育2 h,PBS洗涤3次,HRP-IgG(按1200稀释)室温孵育2 h,ECL显色,暗室曝光。应用Scion Image图像分析系统对所得条带进行分析,蛋白质的相对含量以目的蛋白与β-actin条带光密度的比值表示。
1.4统计学处理采用SPSS 13.0进行分析,应用单因素方差分析比较TGF-β1处理后MC3T3-E1细胞中SOST、ALK5 mRNA表达的差异,应用析因设计的方差分析比较ALK5 siRNA转染对MC3T3-E1细胞中SOST mRNA和Smad2/3蛋白表达的影响,检验水准α=0.05。
2 结果
2.1TGF-β1处理后MC3T3-E1细胞中SOST、ALK5mRNA的表达结果见表1。不同处理方式对MC3T3-E1细胞中SOST及ALK5表达水平均有显著影响, TGF-β1处理24 h后SOST及ALK5 mRNA相对表达量显著升高。
2.2ALK5siRNA转染对MC3T3-E1细胞中SOSTmRNA和Smad2/3蛋白表达的影响见图1和表2。由表2可知,ALK5 siRNA处理可部分抑制TGF-β1诱导的SOST mRNA和Smad2/3蛋白表达上调。
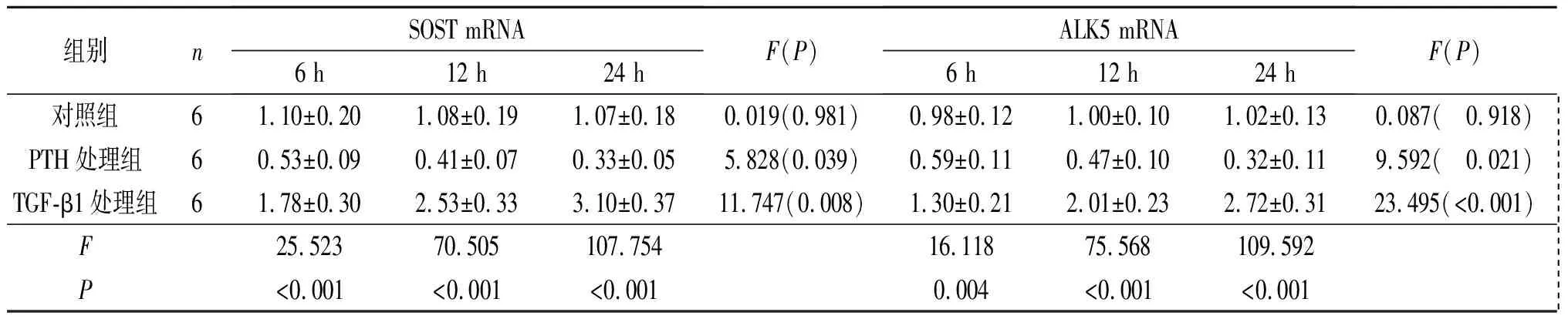
表1 TGF-β1处理后MC3T3-E1细胞中SOST、ALK5 mRNA的表达结果
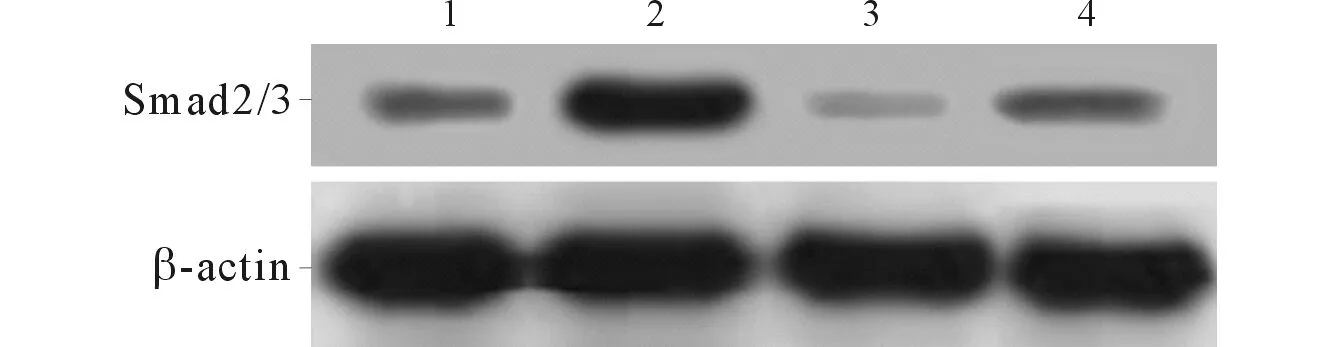
1:对照组;2:TGF-β1处理组;3:ALK5 siRNA处理组;4:TGF-β1+ALK5 siRNA处理组图1 不同处理条件对Smad2/3蛋白表达水平的影响
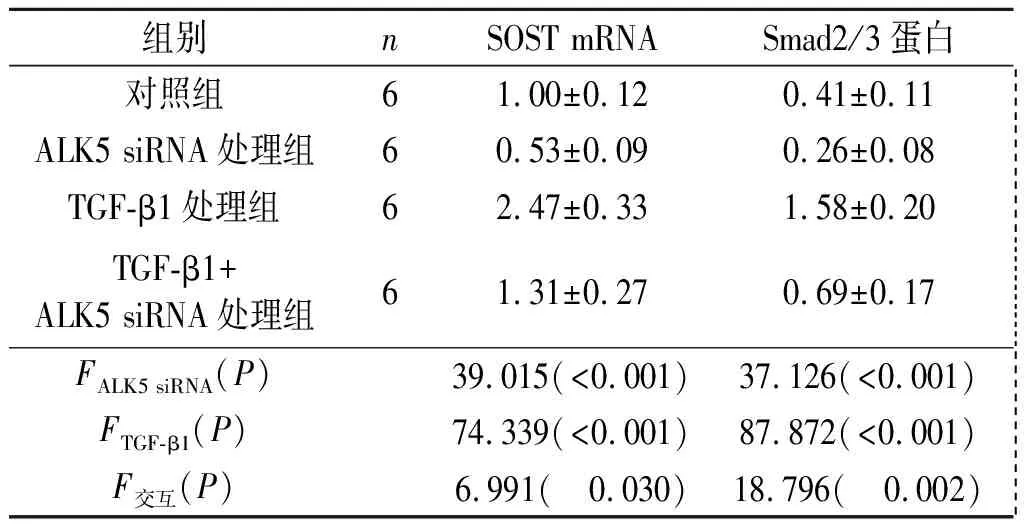
表2 ALK5-siRNA转染对MC3T3-E1细胞中SOST mRNA和Smad2/3蛋白表达的影响
3 讨论
骨的形成是一个复杂的生理过程, 受到多种细胞因子的调控。TGF-β是一类在细胞的增殖分化中发挥重要作用的调控因子,在骨的形成与代谢中也起关键作用。TGF-β1是TGF-β超家族成员中最具有代表性的成员,TGF-β受体(TGF-βR)属于丝氨酸/苏氨酸激酶受体家族,包括 TGF-βRⅠ、TGF-βRⅡ、TGF-βRⅢ,其中TGF-βRⅠ又称ALK5,在TGF-β信号传导中发挥着重要作用。
SOST是骨形态发生中的负性调控因子,位于常染色体17q12-21处,其表达具有高度的组织特异性。SOST仅存在于人和小鼠的骨组织中,且其分泌仅局限于骨细胞[8]。既往有研究[5]指出,TGF-β超家族在成骨细胞中可通过调节SOST基因的表达,影响成骨细胞分化。本研究结果显示,使用TGF-β1处理细胞可显著上调MC3T3-E1细胞中ALK5和SOST mRNA的表达,沉默ALK5后TGF-β1诱导的SOST mRNA的表达上调受到抑制,提示ALK5可能是TGF-β1上调SOST mRNA表达的必要因素。
Smad2/3为TGF-β信号通路中重要的中介体,能够参与调节多种细胞的生理活动,例如细胞增殖、分化、凋亡等。研究表明,TGF-β/Smad信号通路是实现骨骼肌卫星细胞增殖的信号通路之一[9]。本研究结果显示,经TGF-β1处理后Smad2/3蛋白表达水平升高,沉默ALK5后TGF-β1处理的MC3T3-E1细胞中Smad2/3蛋白化水平被显著抑制,提示TGF-β1与其受体ALK5结合后对Smad2/3蛋白水平进行调控。
既往研究[10]发现,在SOST基因上存在一个 250 bp 的进化保守序列——进化保守位点5 (evolutionarily con-served region 5, ECR5),为SOST基因的骨特异增强子元件。ECR5可被多种转录因子激活,进而促进SOST基因的表达。另有研究[11]发现,在增强子ECR5区含有Smad基因序列的特异性结合位点,而Smad2/3为TGF-β下游的重要信号蛋白,据此,结合本研究结果,作者推测,TGF-β通过调控Smad2/3表达从而影响Smad2/3与SOST增强子ECR5区的Smad特异性结合位点结合,进而实现对SOST的正向调控。因既往研究[12-13]已知SOST是骨形成中的负性调控因子,不利于成骨细胞分化,因此有效的降低SOST的表达,可为促进骨折愈合以及治疗骨质疏松等骨科疾病提供参考。
综上所述,该研究结果显示,TGF-β1与其受体ALK5结合后可上调Smad2/3蛋白表达,Smad2/3可能通过与SOST增强子ECR5区Smad特异性结合位点结合,上调SOST表达,从而影响成骨细胞骨形成。
[1] LI Y, JIE L, TIAN AY, et al. Transforming growth factor beta is regulated by a glucocorticoid-dependent mechanism in denervation mouse bone[J]. Sci Rep, 2017, 7(1): 9925
[2] GUGJOO MB, AMARPAL, ABDELBASET-ISMAIL A, et al. Mesenchymal stem cells with IGF-1 and TGF-β1 in laminin gel for osteochondral defects in rabbits[J].Biomed Pharmacother,2017, 93: 1165
[3] KALINICHENKO SG, MATVEEVA NY, KOSTIV RE, et al. Role of vascular endothelial growth factor and transforming growth factor-β2 in rat bone tissue after bone fracture and placement of titanium implants with bioactive bioresorbable coatings[J]. Bull Exp Biol Med, 2017, 162(5): 671
[4] WANG T, MUHETAER H, LI J.Experimental study of transforming growth factor-beta3 combined with dental pulp stem cells in promoting the implant′s osseointegration[J].Zhonghua Kou Qiang Yi Xue Za Zhi, 2017, 52(6): 367
[5] 熊雪松, 余显霞. 2型糖尿病与骨质疏松症相关性研究进展[J]. 中国骨质疏松杂志, 2017, 23(1): 130
[6] 张梦媛, 任安. 甲状腺功能亢进患者硬骨素与骨代谢的关系[J]. 天津医药, 2014, 42(9): 908
[7] MANOKAWINCHOKE J, SUMREJKANCHANAKIJ P, PAVASANT P, et al. Notch signaling participates in TGF-β induced SOST expression under intermittent compressive stress[J]. J Cell Physiol, 2017, 232(8): 2221
[8] POOLE KE, VAN BEZOOIJEN RL, LOVERIDGE N, et al. Sclerostin is a delayed secreted product of osteocytes that inhibits bone formation[J]. FASEB J, 2005, 19(13): 1842
[9] 林凯, 虞德兵, 解晓东, 等. TGF-β/Smad信号通路在Follistatin调节鸭骨骼肌卫星细胞增殖过程中的作用机制[J].中国农业科学, 2015, 48(12): 2460
[10]LOOTS GG, KNEISSEL M, KELLER H, et al. Genomic deletion of a long-range bone enhancer misregulates sclerostin in Van Buchem disease[J]. Genome Res, 2005, 15(7): 928
[11]LOOTS GG, KELLER H, LEUPIN O, et al. TGF-β regulates sclerostin expression via the ECR5 enhancer[J]. Bone, 2012,50(3):663
[12]陈聪, 康权, 罗庆, 等. 骨形成蛋白家族成员2、7对小鼠胚胎肝干细胞分化的体外研究[J]. 解放军医学杂志, 2013, 38(4): 260
[13]乔松, 许琦, 叶子青, 等. 骨保护素对高龄骨质疏松症患者骨代谢的影响[J]. 解放军医学杂志, 2015, 40(6): 472

