L-肉碱在罗非鱼体内的药代动力学
罗志远,周 宇,杨淇龄,黄 凯,唐 笑,武林华
( 1.广西大学 动物科学技术学院, 广西 南宁 530000; 2.广西水产科学研究院, 广西 南宁 530000; 3.河池市水产畜牧局, 广西 河池 547000 )
吉富罗非鱼(Oreochromisniloticus,GIFT)生长速率快、遗传性状稳定、出肉率高,我国罗非鱼的人工养殖产量已经达到世界第一位。肉碱能提高鱼类的生产速率,提高成活率,减少脂肪肝的发生[1]。
目前,国内外关于肉碱在人体内的药代动力学研究已有报道[2-4],且在血液透析患者体内L-肉碱水平研究上较为深入[5]。肉碱在水产畜牧饲料中的应用较普遍[6-8],但肉碱在畜禽及水产动物体内的药代动力学研究鲜有报道。笔者就肉碱经口灌给药的方式下,对相同规格罗非鱼不同剂量肉碱及不同规格罗非鱼体内L-肉碱的药代动力学进行研究,以期为水产饲料中合理添加肉碱提供参考。
1 材料与方法
1.1 试验动物及设计
试验对象为吉富罗非鱼,由南宁引育种中心提供,不同剂量试验组中罗非鱼体质量为(82.72±3.65) g,不同规格试验组中罗非鱼体质量分别为(82.72±3.65) g、(413.83±39.92) g,健康无伤病。饲养用水为充分曝气除氯的自来水,暂养及试验期间投喂全价颗粒料,日饲量为吉富罗非鱼初始体质量的2%,残饵用虹吸管吸出。试验期间持续充氧并对水体进行循环过滤,每日早晚投喂吉富罗非鱼配合饲料各1次,及时吸出残饵和粪便,每2 d换水1/2。给药与采样前 3 d 停饲,处理期间不投喂饲料,持续保持充气状态。
1.2 试剂及仪器
肉碱标准品(纯度99.0%,德国Dr.Ehrenstorfer公司);鱼旺四号(肉碱)(纯度10%,杭州天农生物营养技术有限公司);甲醇(色谱纯,Fisher Scientific公司);乙腈(色谱纯,Merck公司);三乙胺(色谱纯,天津市光复精细化工研究所);柠檬酸(分析纯,天津市大茂化学试剂厂);磷酸氢二钠(分析纯,天津市科密欧化学试剂有限公司);磷酸二氢钾(分析纯,天津市博迪化工股份有限公司);氧化银(分析纯,天津市科密欧化学试剂研发中心);对溴苯乙酰基溴(p-BPB)(阿拉丁公司);10%四丁基氢氧化铵(国药集团化学试剂有限公司);肝素钠(南京新百药业有限公司)。
UltiMate 3000高效液相色谱系统 (包括双泵3200A,手动进样器 3200,恒温柱温箱 330,可见波长检测器 3400RS)(Chromeleon戴安中国有限公司);精密电子天平[豪斯仪器(上海)有限公司];高速台式离心机(Sigma 公司);Vortex-Genie 2型漩涡混合器(美国 Scientific Industries公司);HW-100型恒温水浴箱(南京泰斯特试验设备有限公司);5200DT型超声清洗机(宁波新芝生物科技有限公司)。
1.3 溶液配制
L-肉碱贮备液:精密称取肉碱标准品 16.1 mg,10 mL双蒸水溶解,配制成10 mmol/L的肉碱储备液,4 ℃保存备用,以此配制肉碱标准溶液。
衍生剂配制:精确称取对溴苯乙酰基溴(p-BPB)40 mg于试管中,依次加入乙腈1 mL、10%四丁基氢氧化铵100 μL,充分混匀,注意只能在当日使用,避光存放。蛋白沉淀剂:乙腈∶甲醇=9∶1 (体积比)。
磷酸二氢钾和氧化银混合物:磷酸二氢钾∶氧化银混合物=9∶1 (质量比)。
柠檬酸缓冲液的配置:称取1.89 g柠檬酸 (C6H8O7·H2O) 于烧杯中,加入约400 mL超纯水溶解混匀后,再加入超纯水定容至500 mL。
1.4 给药与样品前处理
将试验鱼分为(82.72±3.65) g组和(413.83±39.92) g组,再将(82.72±3.65) g鱼随机分为12 mg/kg剂量组和120 mg/kg剂量组;(82.72±3.65) g规格120 mg/kg剂量组,按120 mL/kg鱼质量剂量灌药,而(413.83±39.92) g规格12 mg/kg剂量组,按12 mg/L剂量灌药。以上3个试验组每组约有180尾鱼。再将每个试验组分为15个小组,每小组有10尾鱼,口腔灌药给药。具体操作为:将药品摇匀后,用长10 cm软胶管自鱼口插入胃中,用注射器将药物灌入鱼胃,无回吐者为试验对象保留。每组分为15个时间点采样。给药前,试验动物禁食3 d,分别于口灌前(0 h)和给药后0.083、0.13、0.20、0.25、0.33、0.5、1、2、4、8、12、24、36 h和48 h采样,用经肝素钠润洗的注射器自尾静脉采血1.0 mL,置于含0.1%肝素钠处理过的离心管中混匀,4000 r/min,离心15 min。分离血浆,置于冰箱中-20 ℃保存备测。每个时间点6尾鱼,做6个平行样。
1.5 样品测定方法
取空腹尾脉血3 mL,离心后取上清液300 μL,加1000 μL 10%甲醇—乙腈溶液,混匀后,加入400 mg无水磷酸氢二钠+氧化银(9∶1)和400 mg无水磷酸二氢钾,立即剧烈振摇5 min,8000 r/min离心5 min,吸取上清液600 μL再加入衍生化试剂50 μL混匀后,70 ℃水浴90 min。冷却后进样20 μL作HPLC分析。该法的标准曲线的线性范围是1~400 μmol/L,肉碱衍生物色谱峰面积与待测肉碱的浓度线性关系良好,标准曲线回归方程为:y=0.08376x+0.09663 (n=6,r2=0.9995),回收率稳定为88.16%~101.48%,平均回收率为95.83%,日内变异系数为1.79%~5.56%,日间变异系数为9.83%~11.81%。
1.6 色谱条件及数据处理
色谱柱: Kromasil Sil 色谱柱(250 mm×4.6 mm,5 μm);流动相配制:乙腈—柠檬酸缓冲液(90∶10,体积比),每1 L流动相中含有 0.25 mL 三乙胺,在上机前流动相及样品均用0.45 μm 滤膜减压过滤;流速1.2 mL/min;柱温35 ℃;检测波长260 nm;进样量20 μL。
试验数据采用 SPSS 11.5 进行平均值和标准差的计算及标准曲线回归分析,用 Microsoft Office Excel 2003 绘制药—时曲线,采用WinNonlin 5.2软件非房室模型统计矩方法计算药动学参数和模型拟合。
2 结果与分析
2.1 不同剂量肉碱在吉富罗非鱼血浆中的浓度
单次口灌肉碱后,罗非鱼血浆中药物浓度随时间变化情况见图1。两种剂量罗非鱼血浆中药物浓度变化趋势基本一致,即给药后药物浓度迅速上升,0.5 h达最大值;在达最大浓度后至4 h之间,药物浓度以较大的速率下降,4~12 h药物浓度下降速率稍慢。在12 h又明显升高形成第二个峰,至48 h时肉碱浓度分别为1.0 μmol/L和0.73 μmol/L。较高剂量组鱼血浆中的药物浓度高于较低剂量组。
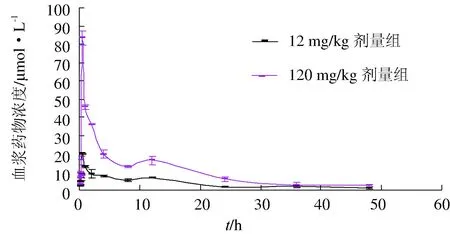
图1 不同剂量单次口灌给药后罗非鱼体内肉碱的药—时曲线
2.2 不同剂量的肉碱在罗非鱼体内药代动力学比较
12 mg/kg和120 mg/kg剂量口灌单次给药,有关动力学数据经 WinNonlin 5.2 药代动力学软件分析非房室模型的统计矩方法得出药动学参数(表1)。12 mg/kg剂量的肉碱经口灌进入鱼体后,迅速进入吸收部位,血药浓度达峰时间为0.5 h,达峰浓度为21.27 μmol/L。其消除半衰期为8.73 h,鱼体对药物的总清除率为0.10 L/h·kg-1,曲线下面积为 96.95 μmol/h·L-1。120 mg/kg剂量组口灌给药肉碱的血药浓度达峰时间、达峰浓度、消除半衰期、表观分布容积、总体清除率、平均滞留时间分别为0.5 h、82.28 μmol/L、9.71 h、3.90 L/h·kg-1、0.28 L/h·kg-1、12.27 h。由表1可知,120 mg/kg剂量组的达峰浓度、药时曲线下面积显著高于12 mg/kg剂量组的达峰浓度和药时曲线下面积(P<0.05),两者清除率和平均滞留时间差异不显著(P>0.05)。
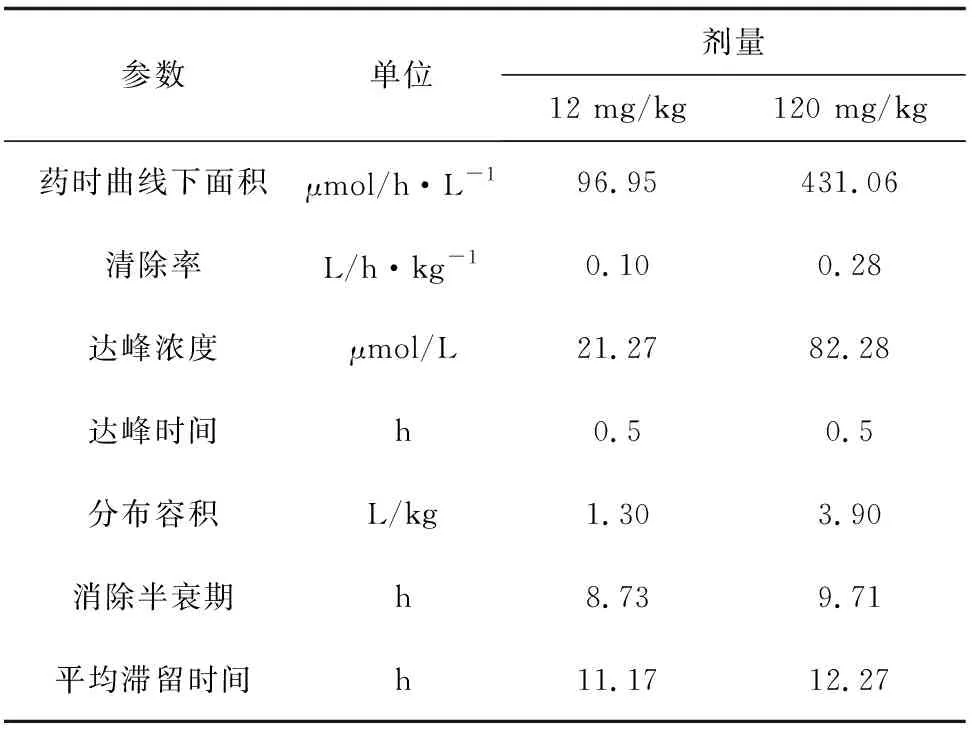
表1 不同剂量肉碱单次口灌给药后在吉富罗非鱼体内的药动力学参数(n=6,平均值±标准差)
2.3 不同规格吉富罗非鱼血浆中肉碱的含量
以相同剂量12 mg/kg的肉碱口灌不同规格的罗非鱼后,罗非鱼血浆中药物浓度随时间变化情况见图2。由图2可知,(82.72±3.65) g鱼比(413.83±39.92) g的分布要稍快;(82.72±3.65) g鱼0.5 h时到达峰值19.95 μmol/L,而(413.83±39.92) g 0.5 h时达到峰值为(22.38±0.51) μmol/L,(82.72±3.65) g鱼峰浓度略低于(413.83±39.92) g;12 h时两组又形成第二峰,24 h时二者基本处于同一水平,分别为1.73 μmol/L和1.61 μmol/L,以后二者在同一水平上波动下降,至48 h时(82.72±3.65) g和(413.83±39.92) g罗非鱼血药浓度降至1.00 μmol/L和1.05 μmol/L。
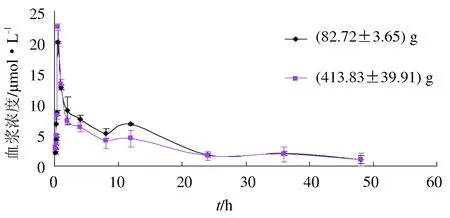
图2 单次口灌给药后不同规格罗非鱼体内肉碱的药—时曲线
2.4 不同规格吉富罗非鱼血浆中肉碱的药代动力学比较
采用WinNonlin 5.2 药代动力学软件的非房室模型统计矩原理对试验数据进行分析,结果见表2,其中达峰时间、达峰浓度为实测值,药时曲线下面积用梯形法计算。由表2可知,(413.83±39.92) g鱼和(82.72±3.65) g鱼的达峰时间相同,(413.83±39.92) g消除相半衰期较长、峰浓度较高;而(82.72±3.65) g鱼的表观分布容积比(413.83±39.92) g大,说明肉碱在(82.72±3.65) g鱼体内的分布程度比(413.83±39.92) g鱼广泛;(413.83±39.92) g鱼清除率低于(82.72±3.65) g鱼,(82.72±3.65) g鱼的平均滞留时间比(413.83±39.92) g长。
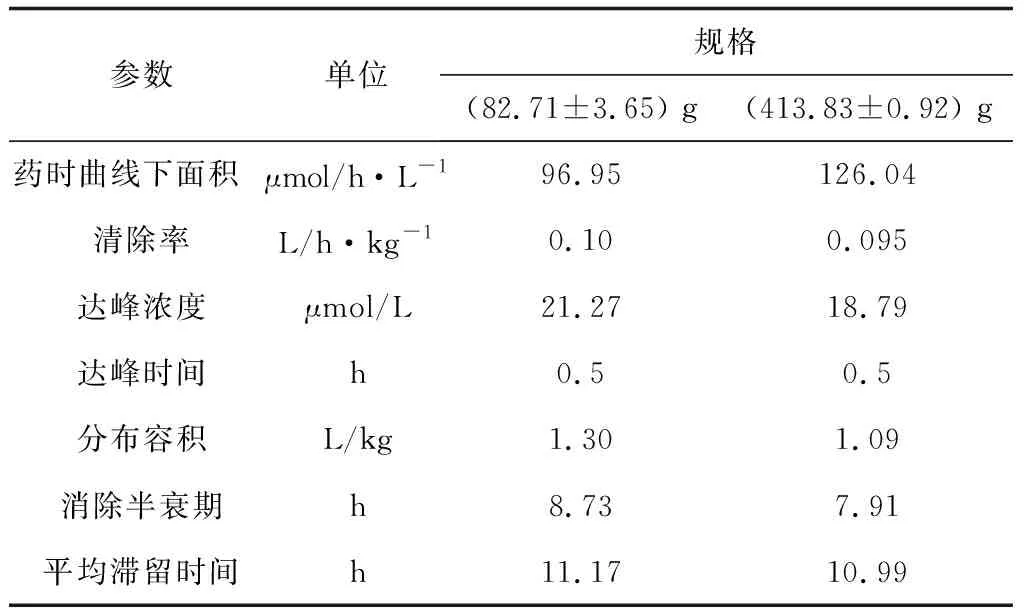
表2 单次口灌给药后不同规格罗非鱼体内肉碱的药代动力学参数(n=6,平均值±标准差)
3 讨 论
3.1 吉富罗非鱼体内药代动力学模型选择及特征
试验经过WinNonlin 5.2软件计算,得出统计矩参数,由于血药浓度—时间出现明显的多峰现象,而房室参数无法满足肉碱药代过程中客观描述的要求,对肉碱药代过程进行客观描述,因此本试验选择客观性较强的非房室模型进行分析。在大菱鲆(Scophthalmusmaximus)肌注和口灌恩诺沙星[9],硫酸新霉素口灌吉富罗非鱼[10]和甲基睾丸酮口灌罗非鱼[11]的药时曲线符合房室模型参数。而甲磺酸达氟沙星口灌银鲫(Carassiusauratusgibelio)[12],氟苯尼考、氟苯尼考胺口灌及肌注克氏原螯虾(Procambarusclarkii)[13]和褐牙鲆(Paralichthysolivaceus)口灌噁喹酸[14]则采用了非房室模型统计矩参数进行分析,由此可见,药物种类及研究对象不同影响房室模型的拟合。房室模型拟合的优点是将复杂的生物问题简单化,将其作为一种数据分析的手段推导出药动学参数,为临床用药提供了基本规律。
本试验表明,肉碱剂量120 mg/kg时(82.72±3.65) g鱼组肉碱在罗非鱼体内的分布最广和肉碱在人体内(药时曲线下面积为3738.93 mmol·h/L、2284.27 μmol·h/L)报道不一致[15],这可能与试验动物和给药剂量等有关。
试验结果表明在口灌给药的方式下,12 mg/kg剂量(82.72±3.65) g鱼组和120 mg/kg剂量(82.72±3.65) g鱼组及12 mg/kg剂量(413.83±39.92) g组表观分布容积为1.29 L/kg、3.9 L/kg、1.08 L/kg,大于1.0 kg/L,说明肉碱有较强的组织穿透性。
口灌给药下,以相同的剂量给药,比较肉碱在未成熟(82.72±3.65) g鱼和(413.83±39.92) g罗非鱼体内药动学差异显示。试验结果显示,(82.72±3.65) g鱼和(413.83±39.92) g鱼达峰时间均为0.5 h,但(82.72±3.65) g鱼消除半衰期、清除率分别为8.73 h、0.10 L/kg·h-1;(413.83±39.92) g鱼的半衰期、清除率分别为7.91 h、0.095 L/kg·h-1,可见(413.83±39.92) g鱼消除速率较快。笔者认为造成不同规格罗非鱼对肉碱消除速度差异的原因可能是(413.83±39.92) g鱼的肾脏排泄功能发育较未成熟(82.72±3.65) g鱼完全,亦或(82.72±3.65) g鱼相对于(413.83±39.92) g鱼更易受肉碱的影响而使其功能降低,影响肉碱的代谢,消除速度较(413.83±39.92) g鱼慢。
本试验中,以12 mg/kg剂量给罗非鱼口服肉碱,消除半衰期为8.73 h,而以120 mg/kg剂量时,消除半衰期为9.71 h;120 mg/kg剂量组的消除半衰期小于12 mg/kg剂量组,这与甲基睾丸酮在罗非鱼体内的药代动力学研究结果[16]类似。推测肉碱的剂量影响其在罗非鱼体内的药代动力学参数。
3.2 消除曲线多峰现象的探讨

研究药物动力学参数是选择药物种类、剂量以及用药周期重要依据,对确保人类的健康和水产养殖业的可持续发展具有重要意义。我国水产动物药理学研究发展空间和应用前景较大。
[1] 黄凯,陈涛,战歌,等.L-肉碱对奥尼罗非鱼生长、脂肪含量及血浆相关生化指标的影响[J].上海海洋大学学报,2010,19(2):201-206.
[2] Mendes G D, Zaffalon G T, Silveira A S, et al. Assessment of pharmacokinetic interaction between piracetam and l-carnitine in healthy subjects[J]. Biomed Chromatogr,2016,30(4):536-542.
[3] Dabrowska M, Starek M. Analytical approaches to determination of carnitine in biological materials, foods and dietary supplements[J]. Food Chemistry, 2013,142(3):220-232.
[4] Reuter S E, Evans A M. Carnitine and acylcarnitines pharmacokinetic, pharmacological and clinical aspects[J]. Clinical Pharmacokinetics,2012,51(9):553-572.
[5] 刘惠兰,张晓洁,曹峰.血液透析患者静脉应用左旋肉碱(可益能)的药代动力学研究[J].中国血液净化,2003,2(6):298-310.
[6] 徐少辉,武书庚,张海军,等.饲粮中添加L-肉碱对产蛋鸡生产性能、蛋品质及脂质代谢的影响[J]. 动物营养学报,2011,23(4):640-646.
[7] 柘丽曾,秋凤,丁雪梅,等.饲粮添加乳化剂与L-肉碱对肉鸡生长性能和血脂指标的影响[J]. 动物营养学报,2012,24(9):1754-1763.
[8] 徐少辉,张亚男,武书庚,等. L-肉碱对饲粮中添加葵花油的产蛋鸡抗氧化功能及鸡蛋品质的影响[J]. 动物营养学报,2011,23(7):1201-1208.
[9] 梁俊平,李健,张喆,等.肌注和口服恩诺沙星在大菱鲆体内的药代动力学比较[J].水生生物学报,2010,4(6):1122-1129.
[10] 宋洁,王贤玉,王伟利, 等. 硫酸新霉素在吉富罗非鱼体内的药代动力学及休药期[J]. 中国水产科学,2010,17(3):1358-1363.
[11] 洪二利,郑光明,孟娣,等. 甲基睾丸酮在罗非鱼体内的药代动力学[J].安徽农业大学学报,2011,38(6):911-915.
[12] 艾晓辉,陈正望. 磺胺二甲嘧啶在银鲫体内的药动学及组织残留研究[J]. 淡水渔业,2001,31(6):52-54.
[13] 陈文银,印春华. 诺氟沙星在中华鳖体内的药代动力学研究[J].水产学报,1997,27(3):434-437.
[14] 艾晓辉,陈正望,张春光,等. 喹乙醇在鲤体内的药物代谢动力学及组织浓度[J]. 水生生物学报,2003,27(3):273-277.
[15] 徐洪实,沈兰贞,梅长林,等. 尿毒症血透病人静脉应用左旋卡尼汀的药代动力学[J]. 中国药理学通报,1999,15(2):467-469.
[16] 洪二利,郑光明,孟娣,等.甲基睾丸酮在罗非鱼体内的药代动力学[J]. 安徽农业大学学报,2011,38(6):911-915.

[18] 魏广力,肖淑华,刘昌孝.爱普斯特在大鼠和犬的药代动力学[J]. 药学学报,2000,35(10):721-724.
[19] 冯敬宾,贾晓平. 2种水温条件下罗非鱼体内氟苯尼考的药物动力学比较[J]. 南方水产,2008,4(4):49-54.
[20] 杨先乐,湛嘉,胡鲲,等.氯霉素在尼罗罗非鱼血浆中的药代动力学研究[J].水产学报,2005,29(1):61-65.

