D-阿洛酮糖对Wistar大鼠脂质代谢作用的研究
黄维来, 江 波, 张 涛
(食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
肥胖是一个世界性的问题,它会增加冠心病、糖尿病和癌症的风险[1-4]。饮食和肥胖之间的联系非常紧密,有报道称约50%的高果糖浆以及果糖会转换成脂肪[5-6],同时也有报告显示果糖还会引起高血脂,胰岛素抵抗力下降和Ⅱ型糖尿病[7]。D-阿洛酮糖(D-ribo-2-hexulose),是 D-果糖在 C-3位置差相异构形成的一种稀有糖(图1),它天然存在于蔬菜和水果中,但其含量很低,甜度是蔗糖甜度的70%[8]。D-阿洛酮糖食用后不易被人体代谢,几乎不产生能量,而且具有良好的食品加工特性,它作为一种新型的功能性甜味剂配料,在食品开发中可以替代传统甜味剂,成为功能性食品添加剂研究领域的一项热门内容[9-10]。同时D-阿洛酮糖商业化生产的实现,使得对于D-阿洛酮糖进行的体内研究变得可行[11],目前作者所在实验室已经能够利用食品级微生物枯草杆菌实现D-阿洛酮糖3-差向异构酶的表达,为酶法生产D-阿洛酮糖奠定了基础[12]。作者用D-阿洛酮糖取代传统膳食的糖类,研究D-阿洛酮糖对大鼠肥胖以及脂质代谢的影响。

图1 D-果糖和D-阿洛酮糖的分子式Fig.1 Molecular structures of D-Fructose and D-Psicose
1 材料与方法
1.1 材料与仪器
D-阿洛酮糖:实验室自制备;动物总RNA快速提取试剂盒,基因引物设计和合成:上海捷瑞生物工程有限公司产品;RT-PCR试剂盒,SYBR荧光染料:TaKaRa生物有限公司产品;其他试剂均为分析纯试剂。
Nikon Ti倒置显微镜:日本Nikon公司产品;BIO-RAD680酶标仪:美国Bio-Rad公司产品;微量分光光度计Spectrophotometer:北京凯奥科技发展有限公司产品;CFX96荧光定量PCR仪:美国BIORAD公司产品;Centrifuge 5427R冷冻离心机:德国Eppendorf公司产品;V-1200型可见分光光度计:上海翱艺仪器有限公司产品;Forma 900系列超低温冰箱:美国Thermo公司产品;Modell RM2235组织切片机:德国Leica公司产品。
1.2 实验方法
1.2.1 实验动物 清洁级Wistar大鼠 (3周龄,雄性),购于上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2007-0005,饲养于清洁级实验动物中心(江南大学),温度(23±2 ℃),湿度 60%,自由饮水和采食。实验动物的护理和干预处理都依照《实验动物管理条例》相关规定进行。
1.2.2 实验设计和样品准备 25只雄性Wistar大鼠用基础饲料喂养一周后,随机分为5组(n=5),分别为基础对照组(AIN-76A)、葡萄糖组(AIN-Glu)、果糖组(AIN+Fru)、阿洛酮糖组(AIN+Psi)以及纤维素组(AIN+Cel)。适应一周后开始按饲料配方喂养。基础对照组饲料配方参照美国营养学会推荐的AIN-76A实验动物饲料配方配制而成[13],其他组在此基础上将其中的淀粉换成等量的葡萄糖、果糖、D-阿洛酮糖以及纤维素。
1.2.3 大鼠血液的采集与组织保存 饲喂满4周后,大鼠禁食12 h后,称重后,刺破心脏处死。从心脏中取血液进行相应生理生化指标检测。大鼠处死后,迅速打开腹腔,取出肝脏等主要器官,用生理盐水清洗后称重。另外取一部分肝小叶,用体积分数4%的中性甲醛溶液固定,再剪下一部分肝小叶置于RNA保存液中保存,剩余的用液氮速冻后快速转移到-80℃冰箱中保存以备下次使用。
1.2.4 血清和组织生化指标的测定 得到的全血通过室温静置 3 h,3 000 r/min,4℃离心10 min分离制备血清,血清中的总胆固醇 (TC)、三酰甘油(TG)、低密度脂蛋白(LDL-C),游离脂肪酸采用血液生化指标的试剂盒进行酶法测定,批号为20090228。
1.2.5 肝组织病理学切片 将适量的新鲜肝组织放入体积分数4%中性甲醛溶液固定,经脱水→浸蜡→包埋→切片→脱蜡→苏木素染色→冲洗→伊红复染→梯度脱水→封片等步骤,制作组织切片。于光学显微镜下观察肝细胞结构及病理改变。
1.2.6 分析基因表达的实时定量PCR 提取大鼠肝脏中的总RNA,逆转录合成cDNA。以GADPH作为内参基因,检测各个模板的Ct值,进行相对定量。大鼠肝组织中总RNA提取使用RNA提取试剂盒,以A260nm/A280nm光吸收比值鉴定RNA纯度。总RNA(1 μg)通过逆转录试剂盒逆转录合成cDNA。实时PCR使用CFX96荧光定量PCR仪,PCR反应混合物制备使用的是由12.5 μL的荧光染料SYBR,1 μL 的前引物,1 μL 的后引物,2 μL 的 DNA 模板和8.5 μL的灭菌蒸馏水组成的25 μL的体系。目标基因的表达水平均是相对于对照组基因的改变倍数,表1为所用到的引物序列。
1.3 数据统计处理方法
采用SPSS19.0软件进行统计分析,各组数据以均数±标准差(mean±SD)的形式表示。采用ANOVE方法对试验数据进行多重比较和差异显著性检验,组间比较采用Turkey检验,以p<0.05认为存在显著差异性。

表1 实时定量RT-PCR使用的引物序列Table 1 Sequences of primers used in quantitative realtime reverse transcription PCR
2 结果与讨论
2.1 D-阿洛酮糖对Wistar大鼠生长指标的影响
分组时各组实验大鼠体质量无统计学差异,实验期间各组大鼠体质量平稳增长,生长发育良好,同时AIN+Psi组的体质量变化最为缓慢,见图2。8周龄时,AIN+Psi组体质量明显低于其它3组 (P<0.05),且AIN+Psi组的体质量增长量明显小于其他组(P<0.05)。AIN+Cel组的大鼠体质量增加量仅次于AIN-76A组,可能存在的原因是纤维素增强了大鼠肠道对于食物的消化吸收,使得大鼠每日的饲料摄入量增加,能量摄入也随之增加,从而导致大鼠体质量上升。机体内的白色脂肪可以将机体内过剩的能量以脂肪的形式储存起来,这部分脂肪主要包括睾周脂,腹周脂以及肠周脂[15]。AIN+Psi组大鼠的睾周脂及腹周脂显著下降(p<0.05),而其他组都没有显著性变化。说明D-阿洛酮糖具有降低机体脂肪和减重的作用。

图2 实验期间各组大鼠体质量变化Fig.2 Body weight during the experiment
2.2 D-阿洛酮糖对大鼠血脂水平的影响
在实验刚开始的时候,各组大鼠的TC、TG指标无显著差异,喂养4周后,可以看出AIN+Psi组大鼠的TG显著低于其他组 (p<0.05)。其中AIN+Glu,AIN+Fru以及AIN+Cel组的TG指标无显著差异性,但都低于AIN+76A组。TC整体没有显示出明显的差异。
游离脂肪酸(FFA)是中性脂肪分解成的物质,当肌肉活动所需能源肝糖耗尽时,脂肪组织分解中性脂肪酸成为FFA来充当能源使用,血清中的FFA的浓度与脂肪代谢、糖代谢、内分泌有关。研究发现,FFA与其他血脂指标相比较,能更早、更灵敏的反映机体血脂代谢紊乱的情况,另外它也受很多因素影响,肥胖、摄食过多,β受体异常及交感神经兴奋等都可使FFA浓度升高[16-17]。由表2可知AIN+Glu、AIN+Fru以及AIN+Psi的 FFA浓度显著低于其他两组(P<0.05),其中AIN+Psi组是其中最小的。
低密度脂蛋白(LDL-C)是一种运载胆固醇进入外周组织细胞的脂蛋白颗粒,可被氧化成氧化低密度脂蛋白,当低密度脂蛋白,尤其是氧化低密度脂蛋白(OX-LDL)过量时,它携带的胆固醇便积存在动脉壁上,累计到一定的量容易引起动脉硬化。低密度脂蛋白被认为是致动脉粥样硬化的主要因素以及进行调脂治疗的第一指标[18]。由表2所示,与AIN-76A相比,其他4组LDL-C水平均显著下降(p<0.05), 其中 AIN+Psi组和 AIN+Cel组没有显著性差异,但是呈现一个最小的LDL-C值,可以看出,D-阿洛酮糖和纤维素具有一定的抗动脉粥样硬化的作用。
2.3 D-阿洛酮糖对大鼠肝脏组织形态的影响
解剖后发现AIN+Glu组和AIN+Fru组大鼠肝脏肿大,且伴有不同程度的色泽变浅,颜色由正常的暗红褐色转变为深黄褐色,质地较为粗糙,有颗粒感,同时其他组大鼠肝脏色泽深红,有一定光泽,细腻无颗粒感。Wistar大鼠肝脏组织病理学变化如图 3所示。由图可见AIN+Psi和AIN+Cel组大鼠的肝小叶结构清晰,肝板排列整齐,肝细胞未见明显异常变化。而AIN+Glu和AIN+Fru组大鼠肝脏细胞肿大,细胞间界线含糊,内部含有数量不等的脂肪空泡,有炎性细胞浸润。同时AIN-76A组较以上两组有所改善,但脂肪积累仍高于AIN+Psi和AIN+Cel组,说明D-阿洛酮糖可以减少大鼠肝脏脂肪积累。
2.4 肥胖相关性的基因表达的变化
如图4所示,AIN+Psi组大鼠PPAR-α基因的表达显著上升 (P<0.05),FAS基因的表达显著下降(P<0.05), 与 AIN-76A 组相比,AIN+Glu,AIN+Fru以及AIN+Cel组PPAR-α基因的表达无显著变化,但FAS基因的表达均显著上升(P<0.05)。
过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPARs),主要功能是参与肝脏脂肪代谢和脂肪细胞的分化,其中PPAR-α是PPARs的一种亚型,其高表达于肝脏中[19]。PPAR-α的作用机理是它通过与配体结合从而被激活,激活后的PPAR-α与9-顺式视黄醛受体α(RXRα)形成异二聚体,从而与靶基因启动子上的过氧化物增殖物反应原件(PPRE)结合,最后使该基因活化,调节转录表达[20]。其中含有PPRE结构的基因是一些参与脂质代谢的酶,包括脂酰基辅酶A氧化酶,过氧化物体双功能酶,肝脏脂肪酸结合蛋白,微粒体cYP4A,细胞色素P450,脂肪酸-羟化酶,超氧歧化酶,磷脂转移蛋白,解偶联蛋白家族成员等[21]。PPAR-α通过上述途径参与到脂质代谢的过程中。与其他组相比,AIN+Psi组的大鼠的PPAR-α表达显著上升(p<0.05),可以推测D-阿洛酮糖可以减少脂肪肝的风险,同时可以起到降血脂的作用。
脂肪酸合成酶(FAS)是脂肪酸合成的限速酶,在体内催化单酰辅酶A和丙二酰辅酶A结合成长链脂肪酸,FAS的活性将直接影响体内脂肪酸的合成,从而对机体的脂质代谢起到重要作用[22]。当FAS酶活力升高时,可是使得动物体内多余的脂肪酸通过酯化作用形成脂肪,增加脂肪在动物体内的沉积。有报告称在高脂饮食诱导的肥胖大鼠模型中,血清中TG水平升高的同时,FAS的表达水平也随之升高[23]。同时随着动物组织中FAS的表达增加,TG在体内沉积的速度加快,从而导致肥胖[24]。从图4可知,添加了D-阿洛酮糖的大鼠组的FAS值最小(p<0.05),可以推测D-阿洛酮糖通过减少FAS基因的表达,从而控制脂肪酸合成脂肪,起到一个控制体重的作用。

表2 不同糖对大鼠TG、TC、FFA以及LDL-C的影响Table 2 Effects of dietary carbohydrates on TG、TC、FFA and LDL-C
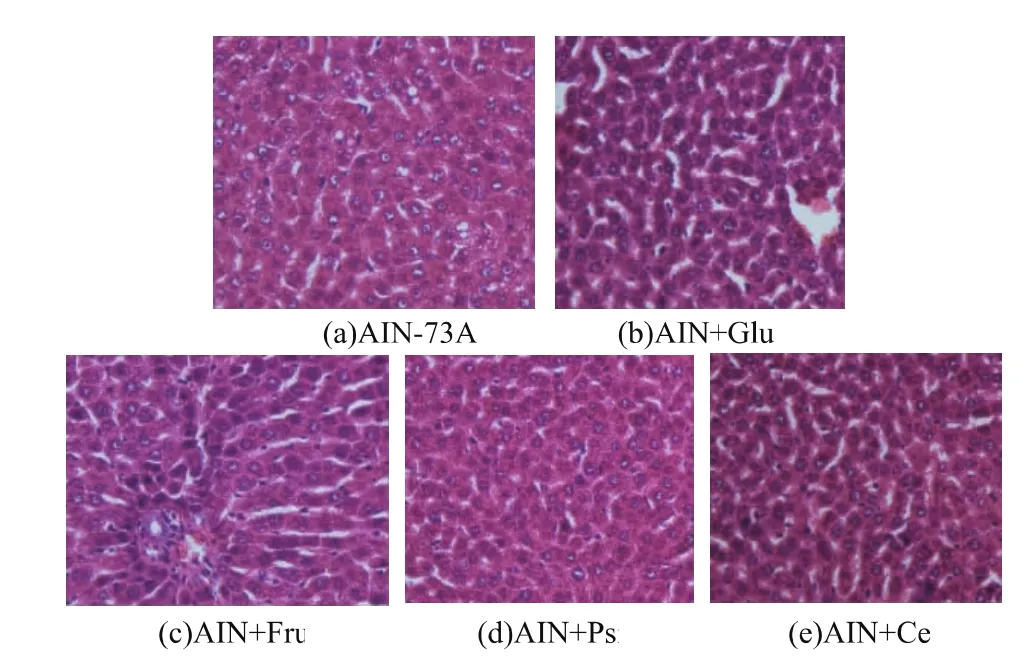
图3 D-阿洛酮糖对大鼠肝组织的影响(HE染色,400倍放大)Fig.3 Effect of D-psicose on rat(By HE stain×400)


图4 大鼠肝脏PPAR-α,FAS基因mRNA的表达Fig.4 mRNA expression of PPAR-α,FAS in the liver of Wistar Rat
3 结语
通过研究改变原有膳食中的碳水化合物的种类,发现D-阿洛酮糖具有降低血脂,控制体质量的作用。给予大鼠D-阿洛酮糖饮食后,与其他组大鼠相比,D-阿洛酮糖组体质量下降,血清中的TG、FFA、LDL-C 含量下降(p<0.05),但是 TC 变化不明显。实时定量PCR分析显示与其他组相比,D-阿洛酮糖通过上调肝脏中的PPAR-α基因的mRNA表达水平(p<0.05),同时下调FAS基因的mRNA表达水平(p<0.05),抑制肝脏中胆固醇的表达以及脂肪的合成从而起到降低血脂控制体质量的作用。
[1]VILLAREAL D T,APOVIAN C M,KUSHNER R F,et al.Obesity in older adults:technical review and position statement of the American Society for Nutrition and NAASO,The Obesity Society[J].Am J Clin Nutr,2005,82(5):923-934.
[2]HASLAM D W,JAMES W P.Obesity[J].Lancet,2005,366(9492):1197-1209.
[3]MALIKV S,SCHULZE M B,HU F B.Intake of sugar-sweetened beverages and weight gain:a systematic review[J].Am J Clin Nutr,2006,84(2):274-288.
[4]SCHULZE M B,MANSON J E,LUDWIG D S,et al.Sugar-sweetened beverages,weight gain,and incidence of type 2 diabetes in young and middleaged women[J].JAMA J Am Med Assoc,2004,292(8):927-934.
[5]AEBERLI I,MURER S B,HOCHULI M,et al.Moderate amounts of fructose consumption impair insulin sensitivity in healthy young men[J].Diabetes Care,2013,36(1):150-156.
[6]RUTLEDGE A C,ADELI K.Fructose and the metabolic syndrome:pathophysiology and molecular mechanisms[J].Nutr Rev,2007,65(6):S13-S23.
[7]ELLIOTT S S,KEIM N L,STERN J S,et al.Fructose,weight gain,and the insulin resistance syndrome[J].Am J Clin Nutr,2002,76(5):911-922.
[8]CHUNG M,OH D,LEE K W.Hypoglycemic health benefits of D-psicose[J].Journal of Agricultural and Food Chemistry,2012,60(4),863-869.
[9]ROTHROCK J W,HAMMES P A,MCALCCR W J.Isolation of diosgenin by acid hydrolysis of saponin[J].Ind Eng Chem,1957,49(2):186-188.
[10]LI Xiao,GAO Xiangtao,REN Yuzheng.Study on intensification effects of surfactant on the extraction of dioscin from dioscorea zingiberensis C.H.wright[J].Fine Chemicals,2009,26(2):122-125.(in Chinese)
[11]MU W,ZHANG W,FENG Y,et al.Recent advances on applications and biotechnological production of D-psicose[J].Appl Microbiol Biotechnol,2012,94(6):1461-1467.
[12]JIA Min,MU Wanmeng,ZHANG Tao,et al.Expression of D-Psicose 3-Epimerase in Bacillus subtilis[J].Journal of Food Science and Biotechnology,2014,11:1129-1135.(in Chinese)
[13]MATSUO T,IZUMORI K.Effects of dietary D-psicose on diurnal variation in plasma glucose and insulin concentrations of rats[J].Biosci Biotechnol Biochem,2006a,70(9):2081-2085.
[14]REEVES P G.Components of the AIN-93 Diets as Improvements in the AIN-76A Diet[J].Journal of Nutrition,1997,127(5S):838S-841S.
[15]SHIH C,LIN C,LIN Y,et al.Validation of the antidiabetic and hypolipidemic effects of hawthorn by assessment of gluconeogenesis and lipogenesis related genes and AMP-Activated protein kinase phosphorylation [J].Evidence-based Complementary and Alternative Medicine,2013:1-12.
[16]HENNES M I,DUA A,KISSEHAH A.Effects of free acids and glucose on splanchnic insulin dynarnics[J].Diaberes,1997,46(1):57-62.
[17]BODEN G,CHEN X,RUIZ J,et al.Mechanisms of fatty acids induced inhibition of glucose updake[J].Clin Invest,1994,93(6):2438-2446.
[18]ZHANG Nana,FENG Yanxian.The value of the non-HDL-C in coronary heart disease risk assessment[J].Journal of Southeast University(Medical Science Edition),2015,34(3):462-465.(in Chinese)
[19]KRISTINA S,BART S,JOHAN A.The peroxisome proliferator activated receptors (PPARs) and their effects on lipid metabolism and adipocyte differentiation[J].Biochimica et Biophysica Acta,1996,1302(2):93-109.
[20]BERNADETTE P N,JEAN F.Bart Staels.Role of the peroxisome proliferator-activated receptors (PPAR)in atherosclerosis[J].Biochemical Pharmacology,2000,60(8):1245.
[21]MANDRUP S,LANE M D.Regulating adipogenesis[J].J Biol Chem,1997,272(9):5367-5370.
[22]LIU Gui,YIN Liang,WANG Xiaohui,et al.Differential expression of FAS and ACAT-2 in livers of high fat diet induced obesity and obesity resistant rat[J].Journal of Shanghai University of Sport,2014,6:P105-109.(in Chinese)
[23]LIU Li,MA Shuang,LI Yanxi.Study on SOCS-3 and FAS expression of adipose tissues in rats fed with high-fat diet[J].Chinese Journal of Public Health,2009,25(4):428-429.(in Chinese)
[24]ZHAN Minxia,WU Guanzhong.Fatty acid synthase and disease[J].Asia-Pacific Traditional Medicine,2012,8(9):210-211.(in Chinese)

