Bacillus mucilaginosus荚膜多糖脱除与全蛋白双向电泳体系的建立
闫玉洁, 李 会, 王向栋, 马 洋, 史劲松, 许正宏
(江南大学 药学院,江苏 无锡 214122)
微生物多糖是某些微生物生长代谢过程中,在特殊的营养条件下,合成的对细胞具有保护作用的生物聚合物[1-2]。
胶质芽孢杆菌于20世纪初分离得到,它可分解云母、长石等硅酸盐矿石而释放出磷、钾元素,且在生长过程中能够产生丰富的胞外多糖。
目前,对于多糖BMPS过量合成的研究工作仅限于常规的发酵条件优化[3-4],导致其生产效率偏低、生产成本偏高,限制了该多糖的大规模工业应用。随着蛋白质组学技术的迅猛发展,作者希望通过蛋白组学的方式,分析不同条件下的差异蛋白,找出影响多糖合成的关键酶,并对其在分子水平和蛋白质水平上进行代谢调控,引导物质代谢流量朝着目标产物多糖的合成方向偏移,从而实现多糖的过量合成。然而由于蛋白质组自身的复杂性和不稳定性,至今尚未得到通用、简便、高效的技术支持[5],目前双向电泳技术结合质谱鉴定技术是差异蛋白质组学最常用的方法之一。作者研究了夹膜多糖的脱除,对菌体总蛋白质的提取方法进行改进,并优化双向电泳的条件,建立一套高分辨率、高灵敏度的双向电泳技术体系。
1 材料与方法
1.1 实验材料
1.1.1 菌株与培养条件 菌株:胶质芽孢杆菌SM-01,江南大学药学院制药工程实验室分离并保藏。
培养条件:从固体培养基上刮取适量菌体接入到50 mL的种子培养基中,置于30℃,200 r/min的往复式摇床中培养24 h;再将种子液按照体积分数4%接种量接入到发酵培养基中,置于30℃,200 r/min的往复摇床中发酵培养24 h。
1.1.2 试剂 IPG线性预制干胶条、两性电解质等:购自美国Bio-Rad公司;尿素、硫脲、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、甘氨酸、三羟甲基氨基甲烷(Tris)、四甲基乙二胺(TEMED)、过硫酸铵、溴酚蓝、低熔点琼脂糖、十二烷基磺酸钠(SDS)、pH7.5 Tris饱和酚、考马斯亮蓝G-250、蛋白测定试剂盒等:购自上海生工集团;蔗糖、甲醇、丙酮、冰醋酸、三氯乙酸(TCA)等:均为国产分析纯产品。
1.1.3 主要仪器 Ettan IPG-phor 3型等电聚焦电泳仪、Ettan DALTsix垂直电泳系统、Image MasterLabScan凝胶电泳图像分析系统:GE公司产品;CR22GH型高速冷冻离心机:日本日立公司产品;PDQuest 8.0.1分析软件:美国Bio-Rad公司产品。
1.2 实验方法
1.2.1 多糖去除与菌体收集
1)超纯水洗涤法 取100 mL发酵液,在4℃、12 000 r/min条件下离心10 min,弃去上清。用50mL超纯水悬浮洗涤菌体,在4℃、12 000 r/min条件下离心10 min,重复3次得菌体沉淀。
2)高浓度盐酸单次处理法 取100 mL发酵液,加入等体积的体积分数50%盐酸,搅拌1 h,在4℃、12 000 r/min条件下离心10 min,弃去上清。超纯水悬浮洗涤菌体3次得菌体沉淀。
3)低浓度盐酸多次处理法 取100 mL发酵液,加入等体积的体积分数30%盐酸,搅拌1 h,在4℃、12 000 r/min条件下离心10 min,弃去上清。沉淀中加入50 mL体积分数10%盐酸,搅拌30 min,离心,重复一次,超纯水悬浮洗涤菌体3次得菌体沉淀。
1.2.2 蛋白质提取
1)TCA-丙酮法 将收集到的菌体置于陶瓷研钵中,加入液氮研磨成粉,将粉末转移到50 mL离心管中。加入TCA-丙酮溶液30 mL,-20℃放置过夜,用于沉淀蛋白质。在4℃、14 000 r/min条件下离心30 min。用预冷的丙酮溶液(含1 g/L的DTT)悬浮洗涤沉淀,-20℃静置1 h,在4℃、14 000 r/min条件下离心30 min,重复2次,得蛋白质沉淀。
2)酚抽提法 根据Rocco[6]的方法并加以改进,将收集到的菌体用液氮在研钵中研磨成粉,加入5 mL酚提取缓冲液(0.5 mol/L Tris-HCl pH 7.5,0.7 mol/L蔗糖,0.1 mol/L KCl,0.05 mol/L EDTA),4 ℃放置 10min。加入等体积pH 7.5的Tris饱和酚,涡旋震荡混匀。在4℃、14 000 r/min条件下离心30 min,收集上层酚相,加入与酚相体积相同的提取缓冲液,重复上述提取步骤2次。沉淀分别用预冷的甲醇和丙酮悬浮洗涤2次,得蛋白质沉淀。
3)TCA-丙酮与酚抽提结合法 将收集到的菌体用液氮在研钵中研磨成粉,加入30 mL TCA-丙酮溶液沉淀蛋白质,-20℃放置过夜,在4℃、14 000 r/min条件下离心30 min,加入5 mL酚提取缓冲液,4℃放置10 min。加入等体积pH 7.5 Tris饱和酚,涡旋震荡混匀。在4℃、14 000 r/min条件下离心30 min,收集上层酚相,加入与酚相体积相同的提取缓冲液,将上述步骤重复2次。沉淀用预冷的甲醇悬浮洗涤2次,沉淀中加入30 mL TCA-丙酮溶液,-20℃放置过夜,在4℃、14 000 r/min条件下离心30 min。用预冷的丙酮溶液 (含1 mg/mL的DTT)悬浮洗涤沉淀,-20℃静置1 h,在4℃、14 000 r/min条件下离心30 min,重复2次,得蛋白质沉淀。
蛋白质沉淀中加入500 μL蛋白裂解液。至沉淀完全溶解后,并于在4℃、10 000 r/min条件下离心30 min,用Bradford方法定量蛋白质[7]。
1.2.3 双向电泳
1)第一向等电聚焦 移取300 μg全蛋白于1.5 mL EP管中,加入上样缓冲液至总体积为300μL,充分混匀后,缓慢均匀加入聚焦槽。将胶条胶面朝下覆盖于样品上,赶出气泡,加入2~3 mL的矿物油封闭聚焦槽,20℃进行等电聚焦(IEF)。
2)胶条平衡 聚焦完成后,取出胶条,胶面朝上放入平衡盘内,分别用平衡液Ⅰ(6 mol/L尿素,75 mmol pH 8.8 Tris-HCl,体积分数20%甘油,体积分数4%SDS,质量分数2%DTT)和平衡液Ⅱ(6 mol/L尿素,75 mmol pH 8.8 Tris-HCl,体积分数20%甘油,体积分数4%SDS,质量分数2%碘乙酰胺)平衡10 min。
3)第二向SDS-PAGE分离 将胶条从平衡槽中取出,快速浸入 TGS Buffer(Tris 3 g,SDS 1 g,甘氨酸 14.4 g,ddH2O定容至1 L)中,去除表面气泡。在封有质量分数12%SDS-PAGE的玻璃胶板中加入融化好的覆盖琼脂糖,将胶条压入其中,待覆盖琼脂糖凝固,将玻璃胶板放入装有TGS Buffer的电泳槽。
4)染色 将凝胶从玻璃板中剥离,加入约500 mL超纯水清洗1 min。加入适量的染色液(2.5 g/L考马斯亮蓝G-250,体积分数10% 冰醋酸,40%甲醇)置于摇床上染色约4 h,更换脱色液(体积分数10%冰醋酸,40%甲醇),脱色至点清晰,背景不明显。
5)图像采集与分析 采用 Image MasterLabScan凝胶电泳图像分析系统对双向凝胶电泳图谱进行扫描,并用PDQuest 8.0.1分析软件进行图像分析处理。
2 结果与分析
2.1 不同多糖预处理方法对菌体蛋白提取的影响
由于B.mucilaginosus SM-01能够合成大量的荚膜多糖,菌体被该多糖紧紧包裹,难以去除,对后续菌体蛋白的提取带来极大不便。使用超纯水洗涤多次仍无法有效洗去菌体外荚膜多糖,且处理后蛋白浓度过低,无法达到实验要求,见图1(b)与表1。由于该多糖易溶于酸性溶液中,故采用不同浓度的盐酸单次或多次处理菌体。图1(c)和图1(d)显示,两种酸法处理后荚膜多糖能够有效去除,且细胞完整,不影响后续实验。表1显示,低浓度盐酸多次处理法所得的蛋白浓度更高,且考虑到高浓度盐酸可能对细胞产生一定的伤害,故后续实验采用低浓度盐酸多次处理法。
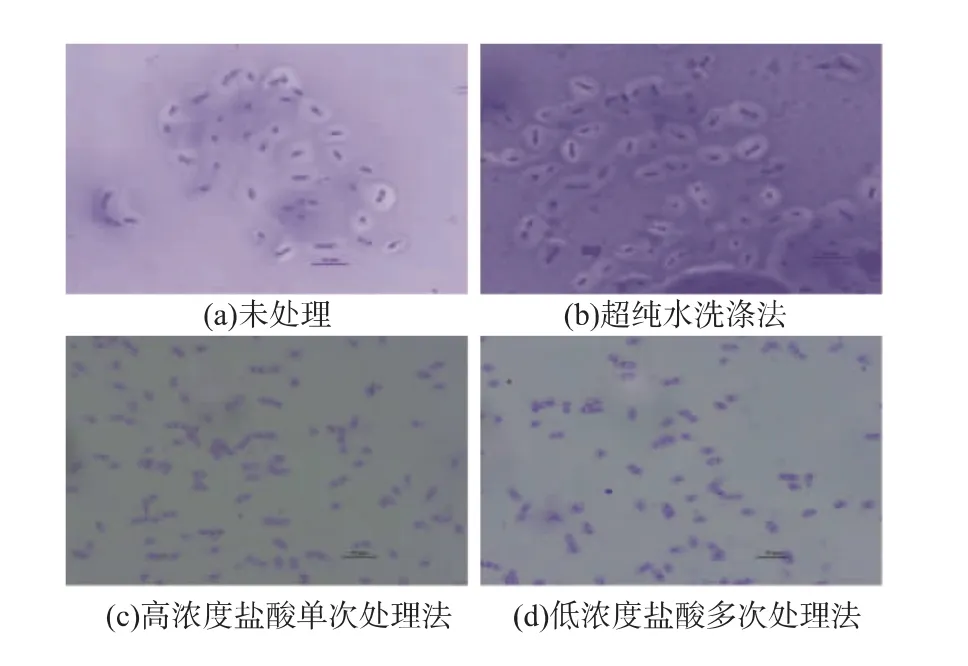
图1 不同多糖去除方法对细胞的影响Fig.1 Comparison of cells with different BMPS dissolution methods
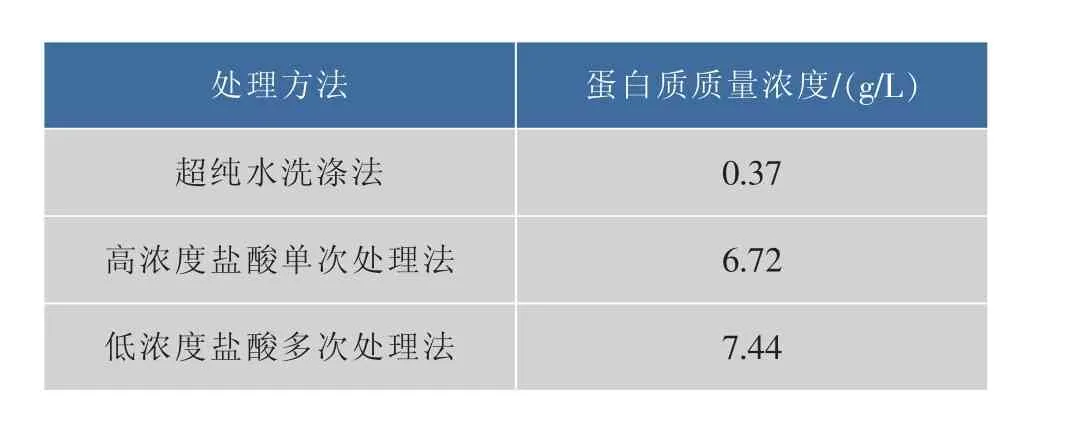
表1 不同多糖去除方法得到的蛋白质质量浓度Table 1 Comparison protein concentration with different BMPS dissolution methods
2.2 不同菌体总蛋白提取方法对双向电泳图谱的影响
蛋白质提取方法是双向电泳成败的关键[8],使用上述方法处理菌体后,仍有部分多糖存在,多糖难以去除且可溶于蛋白裂解液中,使蛋白质提取面临许多困难。TCA丙酮法是目前微生物全蛋白提取常用的方法[9-10],而酚抽提法则主要应用于植物组织蛋白的提取,有研究表明酚抽提法同样适用于细菌,甚至效果优于TCA丙酮法。作者比较了TCA丙酮法、酚抽提法和TCA丙酮与酚抽提结合法3种蛋白质提取方法对双向电泳图谱的影响,图2(a)和图2(b)表明,单独采用TCA丙酮法和酚抽提法时得到的图谱不清晰,且蛋白点聚集成团,基本无法分离,分析原因为荚膜多糖没有完全除去。图2(c)中,用TCA丙酮与酚抽提结合法得到的蛋白图谱,蛋白点基本得以分离,图谱较清晰。以上结果表明,TCA丙酮与酚抽结合法能够较好的除去多糖等杂质,提取得到的蛋白质纯度较高。因此,后续实验采用TCA丙酮与酚抽结合法作为B.mucilaginosus SM-01菌体蛋白质的提取方法。

图2 不同蛋白质提取方法的双向电泳图谱Fig.2 Comparison of 2-DE maps with different protein extraction methods
2.3 不同pH范围胶条对双向电泳图谱的影响
每个蛋白质都有各自不同的等电点(pI),这决定了蛋白图谱中蛋白点的横向分布。因此选择合适pH范围的IPG胶条对双向电泳图谱具有重要影响,较宽pH范围的IPG胶条能包含所有的蛋白质,但蛋白点可能聚集,难以有效分离;较窄pH范围IPG胶条有利于提高图谱的分辨率,但可能丢失pH值范围之外的蛋白质。作者首先采用17 cm、pH 3~10的线性IPG预制干胶条,得到的结果如图3(a)所示,蛋白点较集中,主要分布在pH 4~7附近,胶条没有得到有效的利用,而且蛋白点出现了堆积现象,分离效果不理想,进一步用PDQuest 8.0.1软件分析检测到447个蛋白点。基于上述实验结果,改用pH范围为4~7的线性IPG预制干胶条,得到的结果如图3(b)所示。此时蛋白点的分离效果较图3(a)显著提高,很好的解决了蛋白点重叠的问题,用PDQuest 8.0.1软件可检测得到616个蛋白点。因此,作者选择采用pH 4~7的IPG预制干胶条进行双向电泳的第一向等电聚焦电泳。
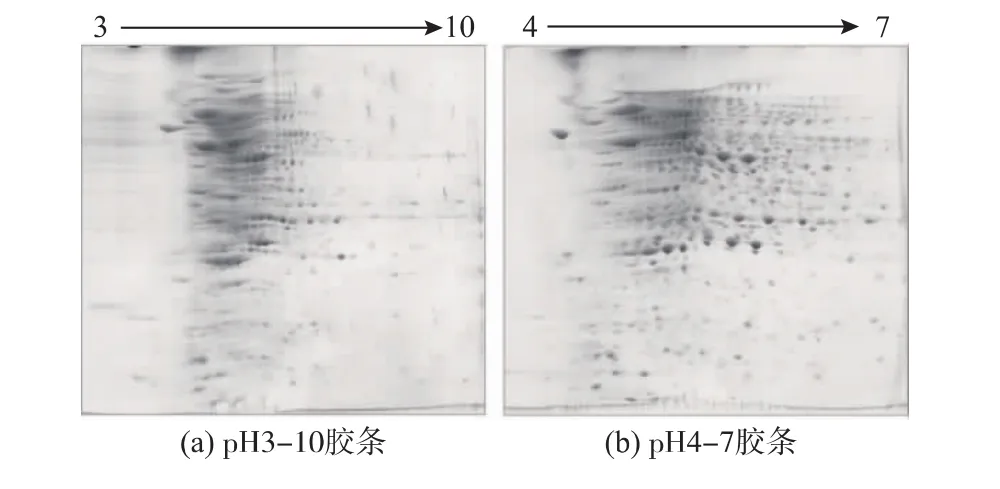
图3 不同pH范围胶条的双向电泳图谱Fig.3 Comparison of 2-DE maps with different IPG strips
2.4 不同等电聚焦程序对双向电泳图谱的影响
等电聚焦是双向电泳中至关重要的一步,聚焦时间不足容易造成高相对分子质量部分蛋白聚焦不完全以及点不圆等现象,聚焦时间过长则容易导致蛋白在其等电点位置时不稳定而产生横条纹。作者设置了3个不同的等电聚焦程序:程序I(100 V 30 min,1 000 V 3 h,6 000 V 5 h,6 000 V 50 000 Vh,500 V 20 h)、程序Ⅱ(100 V 30 min,1 000 V 3 h,8 000 V 5 h,8 000 V 60 000 Vh,500 V 20 h)和程序Ⅲ (100 V 30 min,1 000 V 3 h,10 000 V 5 h,10 000 V 70 000 Vh,500 V 20 h)。 3 个程序的区别为最高电压和聚焦功率不同,结果如图4所示。程序I条件下的蛋白图谱可分离的蛋白点极少,高相对分子质量部分出现较多横条纹;程序Ⅲ得到的结果见图4(c),程序I相比得到改善,但高相对分子质量部分的横条纹依然较明显,考虑可能的原因分别是聚焦不完全和聚焦过度。程序Ⅱ对应的图谱蛋白点更加清晰,横条纹的问题大大的得到了改善,用PDQuest 8.0.1分析检测可得737个蛋白点。因此,本实验选用程序Ⅱ进行双向电泳的第一向等电聚焦电泳。

图4 不同等电聚焦程序的双向电泳图谱Fig.4 Comparison of 2-DE maps with different IEF programs
3 结 语
建立了适用于B.mucilaginosus SM-01的全蛋白提取和双向电泳方法。确定采用低浓度盐酸多次处理法去除菌体外荚膜多糖,然后用TCA丙酮/酚抽提结合法提取全蛋白,所得到的蛋白质纯度较高。采用17 cm pH 4~7的线性IPG预制干胶条,在8 000 V 60 000 Vh的最高聚焦程序下进行第一向等电聚焦。在此条件下,图谱蛋白质点多达737个,图谱分离效果好,蛋白点清晰且背景较低,适用于B.mucilaginosus SM-01的蛋白质组学研究。
[1]SEVIOUR R J,MCNEIL B,FAZENDA M L,et al.Operating bioreactors for microbial exopolysaccharide production[J].Critical Reviews in Biotechnology,2011,31:170-185.
[2]YOON S,HONG E,KIM S,et al.Optimization of culture medium for enhanced production of exopolysaccharide from Aureobasidium pullulans[J].Bioprocess and Biosystems Engineering,2012,35:167-172.
[3]LI Donghua,YANG Bo.Application of response surface methodology to optimize the spore production of B.mucilaginosus GM1[J].Science and Technology of Food Industry,2012,33(22):206-209.(in Chinese)
[4]LIU Wuxing,XU Xushi.Study on fermentation of Bacillus mucilaginosus[J].Journal of Nanchang University (Natural Science),2002,26(3):299-302.(in Chinese)
[5]WRIGHTON K H.Technology:proteomics gets more selective[J].Nature Reviews Molecular Cell Biology,2013,14(3):131-131.
[6]ROCCO M,D'AMBROSIO C,ARENA S,et al.Proteomic analysis of tomato fruits from two ecotypes during ripening[J].Proteomics,2006,6(13):3781-3791.
[7]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of Protein-Dye binding[J].Analytical Biochemistry,1976,72:248-254.
[8]WISNIEWSKI J R,ZOUGMAN A,NAGARAJ N,et al.Universal sample preparation method for proteome analysis[J].Nature Methods,2009,6(5):359.
[9]SHENG L,ZHU G,TONG Q.Comparative proteomic analysis of Aureobasidium pullulans in the presence of high and low levels of nitrogen source[J].Journal of Agricultural and Food Chemistry,2014,62(43):10529-10534.
[10]ZHAO Shaohui,ZHOU Jingwen,DU Guocheng,et al.A preliminary study on differential proteomics of Corynebacterium crenatum in two oxygen supply models[J].Journal of Food Science and Biotechnology,2014,33(3):235-240.(in Chinese)

