绿豆皮黄酮的纯化工艺研究
周俊鹏,陆鹏飞,倪新雨,郭丽萍,吉义平
(武汉设计工程学院食品与生物科技学院,湖北武汉 430205)
绿豆皮,是绿豆芽、绿豆糕和粉丝等产品生产过程中的副产物,一般较多地被加工成饲料等初级产品,二次开发利用较少。事实上,绿豆皮中除含有50%左右纤维素[1]外,还有丰富的黄酮类物质、多酚、生物碱等天然活性成分[2],其中黄酮类因具有改善心血管系统、抗氧化、抗肿瘤及降血糖等多种生理活性而备受关注[3]。目前对绿豆皮黄酮类物质提取的报道较多,而有关绿豆皮黄酮纯化工艺的研究相对较少[4-6]。
黄酮类物质的纯化方法主要有膜分离法、柱层析法、高速逆流色谱法等,其中柱层析法分离效率高、操作简单、应用最为广泛。最常见的柱层析吸附剂有大孔树脂和聚酰胺。大孔树脂理化稳定性高、再生性强,对有机物选择性好,其中的多孔网状结构及表面的极性基团可与黄酮类物质中酚羟基形成氢键等作用力而表现出较好的吸附效果,在黄酮类物质的纯化应用中较多。任顺成等人[7]研究了大孔树脂对玉米须类黄酮的吸附分离特性,发现AB-8型树脂对玉米须类黄酮具有较好的吸附和解析效果;胡志军等人[8]研究了研究D-101型大孔吸附树脂分离纯化橘皮黄酮类物质的工艺条件;吴海霞等人[9]考查了AB-8,D-101,HPD-100型3种大孔树脂对银杏叶黄酮的吸附解析性能,筛选出最佳树脂AB-8并优化出了分离纯化银杏叶黄酮的最佳工艺;朱宏莉等人[10]用X-5型大孔树脂与聚酰胺树脂联用的方法对竹叶总黄酮进行了纯化,最终总黄酮含量可达78.97%。关于绿豆皮黄酮的纯化未见较多报道,仅有研究分析了NKA-9型大孔吸附树脂对绿豆皮黄酮的纯化工艺,纯化后黄酮的纯度可由37.14%提高到71.08%。故试验选择大孔树脂法对绿豆皮黄酮的纯化工艺进行研究,旨在为绿豆皮的综合利用及其黄酮的开发应用提供参考。
1 材料与方法
1.1 原料与试剂
绿豆皮,市售。
盐酸(分析纯),信阳市化学试剂厂提供;氢氧化钠、硝酸铝(分析纯),天津市凯通化学试剂有限公司提供;亚硝酸钠(分析纯),国药集团化学试剂有限公司提供;无水乙醇(分析纯),天津市天力化学试剂有限公司提供;AB-8型大孔树脂、LSA-10型大孔树脂、HPD-100型大孔树脂、ADS-7型大孔树脂(分析纯),郑州勤实科技有限公司提供;标准品芦丁(UV 98%),上海金穗生物科技有限公司提供。
1.2 主要仪器设备
FA1004型电子分析天平,上海越平科学仪器有限公司产品;752型分光光度计,天津市普瑞斯仪器有限公司产品;754PC型紫外可见分光光度计,上海光谱仪器有限公司产品;SHZ-D(III) 型循环水式真空泵,巩义市予华仪器有限责任公司产品;DHG-9240A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司产品;XFB-200型高速中药粉碎机,中国吉首忠诚制药机械厂产品;RE-52A型旋转蒸发仪器,上海亚荣生化仪器厂产品;HL-2S型恒流泵,上海沪西分析仪器厂有限公司产品;TS-2102型恒温摇床,上海天呈实验仪器制造有限公司产品;FD-1A-50型真空冷冻干燥机,北京博医康实验仪器有限公司产品;MDF-U73V型医用低温箱,日本松下公司产品;HH-2型数显恒温水浴锅,常州国华电器有限公司产品。
1.3 试验方法
1.3.1 绿豆皮黄酮的提取纯化工艺流程
绿豆皮→低温烘干(60℃) →粉碎→过40目筛→称取一定量样品→70%乙醇回流浸提→过滤并定容→黄酮粗提液→大孔树脂的预处理→上样吸附→解析→收集解析液→浓缩→冷冻干燥→黄酮粉末。
1.3.2 操作要点
(1) 绿豆皮的前处理。将市售的绿豆皮置于60℃烘箱中烘干至恒质量,用粉碎仪进行粉碎,然后过40目筛,置于干燥器中备用。
(2)绿豆皮黄酮粗提液的制备。用分析天平准确称取10 g绿豆皮粉置于500 mL的烧杯中,然后按照料液比1∶50加入40%乙醇溶液,将料液转移至500 mL平底烧瓶中,在70℃的水浴锅中冷凝回流120 min,最后将得到黄酮粗提液浓缩至1/10体积后定容备用[11]。
(3) 大孔树脂预处理。先用70%乙醇溶液将大孔树脂浸泡24 h,待其充分溶胀后装入层析柱中,然后用5%的盐酸溶液浸洗树脂,然后再用5%氢氧化钠溶液浸洗树脂,直至流出液不是白色浑浊,再用蒸馏水冲洗至流出液呈中性,最后在50℃的烘箱中烘干至恒质量,然后装入平皿放入恒温干燥器中备用。
(4)上样吸附与解析。通过恒流泵以一定上样速度、一定上样浓度、一定上样量将绿豆皮黄酮粗体液通过装有一定体积的大孔树脂的层析柱进行吸附。待达到吸附平衡后,用蒸馏水洗脱除去水溶性杂质,然后以一定浓度、一定流速、一定量的乙醇洗脱液对已饱和吸附的大孔吸附树脂进行洗脱,收集洗脱液。
(5)黄酮洗脱液的浓缩与干燥。将收集的黄酮洗脱液用旋转蒸发仪在40℃,120 r/min条件下进行浓缩,减少到大约为其原有体积的1/50,在医用低温箱中冷冻24 h后置于真空冷冻干燥机中,干燥完全可得到浅黄色的黄酮粉末。
1.3.3 黄酮含量的测定
(1) 标准品芦丁标准曲线的绘制。用分析天平准确称取14.5 mg芦丁标准品置于小烧杯中,加入15 mL 70%乙醇溶液置于40℃水浴中微热溶解芦丁标准品,转移至50 mL容量瓶中,然后用70%乙醇溶液定容至刻度处(0.290 0 mg/mL)。分别吸取标准品0,1.0, 1.5,2.0,2.5,3.0 mL于6个25 mL比色管中,分别加蒸馏水至6.0 mL,再分别加入5%的亚硝酸钠溶液1 mL,摇匀,放置6 min,加10%的硝酸铝溶液1 mL,摇匀,静置6 min,加4%的氢氧化钠溶液10 mL,再加水至刻度线,摇匀,放置15 min。此时每1 mL中含芦丁分别为0,0.011 6,0.017 4,0.023 2, 0.029 0,0.034 8 mg。以溶剂作为空白,用分光光度计于波长510 nm处分别测其吸光度,绘制吸光度和芦丁标准品质量浓度的标准曲线,计算得到线性回归方程:Y=23.31X+0.013 2,R2=0.999 9。
(2)绿豆皮中黄酮含量的计算。在试验中用移液管准确吸取提取液体积X(mL),然后根据试验需要稀释到V(mL),然后用上述步骤中相同的方法测定吸光度A,再将吸光度A代入线性回归方程中可计算出稀释液的质量浓度C(mg/mL),根据公式(1)可计算黄酮溶液的质量浓度。
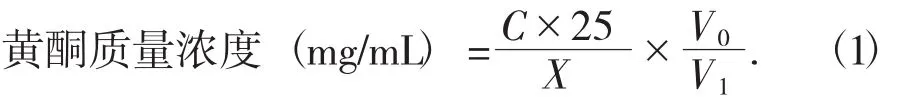
式中:C——测得的黄酮质量浓度,mg/mL;
25——比色管中定容的体积,mL;
V0——稀释后黄酮的体积,mL;
V1——取得稀释后黄酮的体积,mL;
X——稀释前黄酮的体积,mL。
1.3.4 最佳树脂的筛选
准确称取预处理好的4种湿树脂(AB-8,LSA-10,HPD-100,ADS-7)2.0 g,并将其分别装入250 mL具塞磨口锥形瓶中,向各瓶中加入50 mL质量浓度C0一定的绿豆皮黄酮溶液,封口后置于恒温摇床上(温度4℃,转速130 r/min)振荡吸附24 h,在前7 h内,每小时取1 mL吸附液测其吸光度,根据标准曲线计算得到一定时间后吸附液中黄酮的质量浓度C1,根据公式(2) 计算出吸附率Ee;24 h静态吸附饱和后,过滤吸附液,再将树脂浸泡在100 mL 70%的乙醇中,4℃振荡解析24 h,每1 h取1 mL解析液测其吸光度,根据标准曲线计算得到一定时间后解析液中黄酮的质量浓度C2,根据公式(4) 计算解析率Dd,根据吸附率和解析率筛选出最佳树脂。吸附率(Ee)、吸附量(Ff)、解析率(Dd)的计算公式如下[12]:
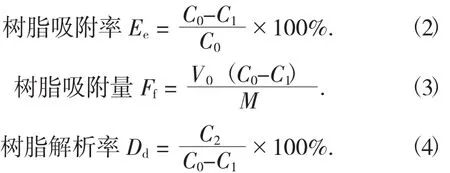
式中:C0——吸附前样液中黄酮质量浓度,mg/mL;
C1——吸附后上清液中黄酮质量浓度,mg/mL;
C2——解析液中黄酮质量浓度,mg/mL;
V0——样液的体积,mL;
M——湿树脂的质量,g。
1.3.5 最佳吸附条件的确定
在室温条件下,将已经筛选出的最佳树脂预处理后装入层析柱(30 mm×400 mm),分别以上样速度、上样质量浓度、上样量为单因素研究绿豆皮黄酮粗提液通过层析柱后流出液中黄酮质量浓度,测得吸附率Ee确定最佳的吸附条件。
1.3.6 最佳解析条件的确定
按照上述最佳吸附条件进行吸附平衡后,先用适量蒸馏水洗去水溶性成分,然后考查不同质量浓度、不同流速、不同量的乙醇洗脱液对已饱和吸附的大孔吸附树脂进行洗脱,收集洗脱液并测定吸光度,从而得到解析液的黄酮质量浓度,计算解析率Dd,确定最佳的解析条件。
1.3.7 黄酮纯度的测定
将预处理好的大孔吸附树脂装柱,采用上述最佳吸附和解析工艺条件对黄酮提取溶液进行纯化,收集洗脱液,再用旋转蒸发仪浓缩,用真空冷冻干燥机将浓缩的洗脱液干燥至恒质量,称质量,根据公式(5)公式计算,可以得出绿豆皮黄酮的纯度。
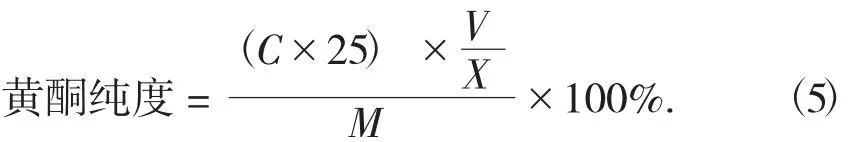
式中:C——洗脱液中黄酮的质量浓度,mg/mL;
25——取样稀释后的体积,mL;
V——洗脱液的总体积,mL;
X——取样体积,mL;
M——洗脱液浓缩冷冻干燥后的质量,mg。
2 结果与分析
2.1 大孔树脂的筛选结果
2.1.1 4种大孔树脂静态吸附量、吸附率和解析率的对比
4种大孔吸附树脂的饱和吸附量、吸附率和解析率见图1。
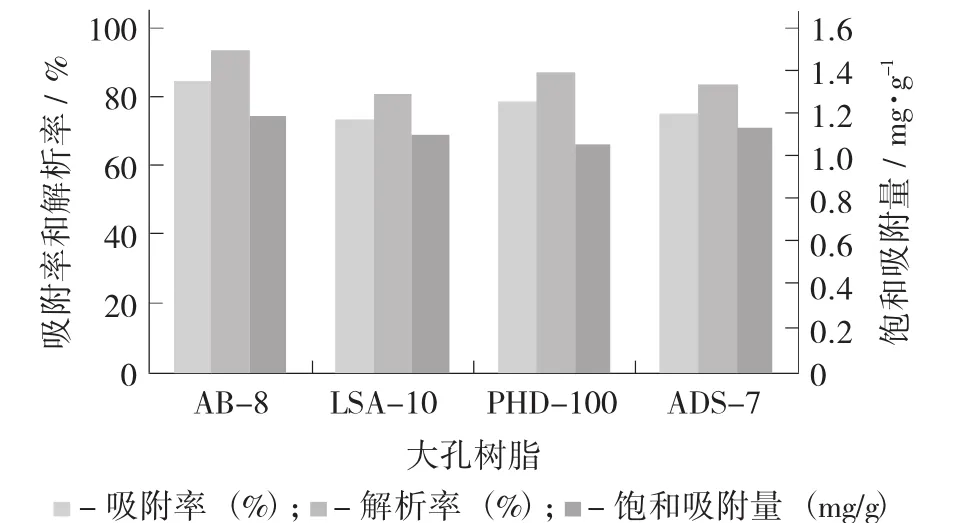
图1 4种大孔吸附树脂的饱和吸附量、吸附率和解析率
AB-8型对绿豆皮黄酮提取液具有最大的饱和吸附量,而另外3种型号大孔树脂相对较小;从解析率分析可知,AB-8,ADS-7型这2种树脂的解析率较另外2种大孔树脂较高,其中AB-8型树脂解析率最大,PHD-100型解析率小于另外3种;从吸附率分析可知,另外3种大孔树脂对绿豆皮黄酮的吸附率较AB-8型要差一些。综合考虑AB-8,LSA-10,PHD-100,ADS-7型4种树脂的吸附和解析特性可知,AB-8型为纯化绿豆皮黄酮较为理想的树脂。
2.1.2 静态吸附和解析动力学曲线
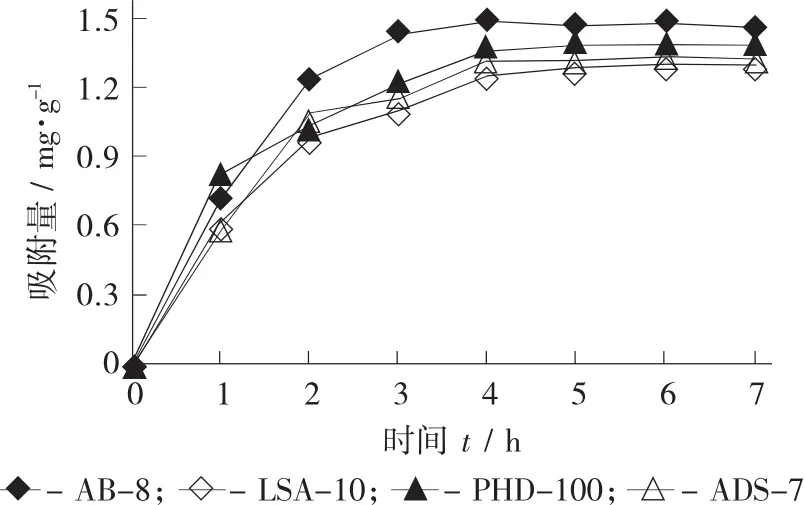
4种树脂的静态吸附动力学曲线(a) 和解析动力学曲线(b) 见图2。
静态吸附动力学曲线反映的是大孔树脂的吸附量(mg/g) 与吸附时间之间的变化。由图2(a) 可知,在4 h之前4种大孔树脂吸附速率快,吸附量变化大;在4 h后AB-8型的吸附量基本不变,到达吸附平衡状态,而LSA-10,PHD-100和ADS-7型在5 h后基本达到平衡。由此可见,AB-8型的吸附速率高于另外3种树脂,并且其吸附量也大于另外3种大孔树脂。
(a)静态吸附动力学曲线
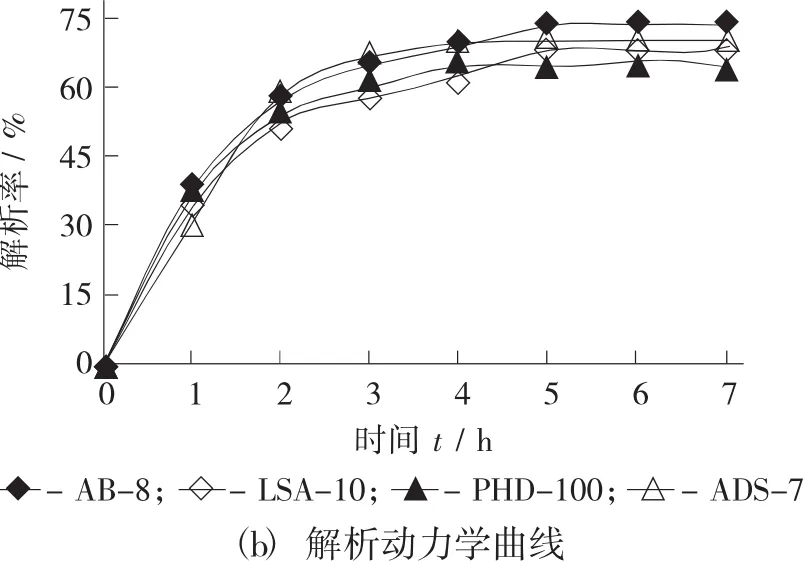
图2 4种树脂的静态吸附动力学曲线(a)和解析动力学曲线(b)
静态解析动力学曲线反映的是大孔树脂的解析率随着解析液对已饱和吸附树脂解析时间的变化趋势。如图2(b) 所示,用70%乙醇溶液对4种型号树脂在恒温摇床中振荡洗脱。在5 h内,AB-8到达解析平衡,其解析率增加明显;5 h后解析率变化不大;LSA-10,PHD-100和ADS-7型在5 h后解析率也趋于平缓,但5 h后AB-8型的解析率大于另外3种大孔树脂。由此可见,AB-8型的解析率比较好。
综合以上分析可知,AB-8型具有较好的静态吸附和解析动力学特性,因而较适于分离纯化绿豆皮黄酮。
2.2 AB-8型大孔吸附树脂最佳吸附条件的确定
2.2.1 上样速率对吸附效果的影响
在一定上样液质量浓度(0.060 4 mg/L) 和上样量(40 mL)的情况下,将样品溶液通过恒流泵按照0.61,1.98,2.81 mL/min的流速上样到层析柱,经过大孔吸附树脂进行吸附,每流出5 mL流出液测一次吸光度,根据标芦丁标准曲线计算出黄酮质量浓度(μg/mL),然后以流出液体积为横坐标、以流出液质量浓度(μg/mL)为纵坐标,绘制出泄漏曲线。以泄漏点(泄漏点是指流出液中的目的产物的质量浓度达到进口的10%时,即为吸附终点)出现最晚上样流速为最佳[13]。
上样速率对吸附效果的影响见图3。
由图3可知,上样速率不同,泄漏点出现的时间也不一样,其中上样速率为2.81 mL/min时泄漏点出现较早(10 mL),而以速率1.98 mL/min和0.61 mL/min上样时泄漏点出现较晚(15 mL),在相同的上样量的条件下,以1.98 mL/min的速度上样,既能有很好的吸附效果,同时还能够有效缩短吸附的时间,因此选用1.98 mL/min为最佳上样速率。
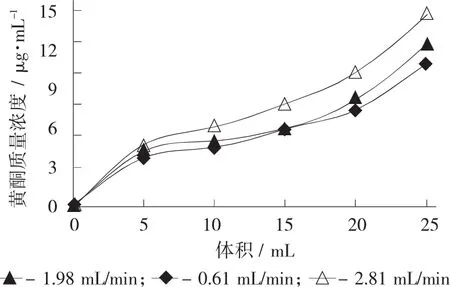
图3 上样速率对吸附效果的影响
2.2.2 上样质量浓度对吸附效果的影响
在上样速率为1.98 mL/min和上样量(40 mL)一定的情况下,以不同质量浓度样品分别上样,考查上样质量浓度(mg/mL) 对树脂吸附率Ee(%) 的影响。
上样质量浓度对吸附率的影响见表1。
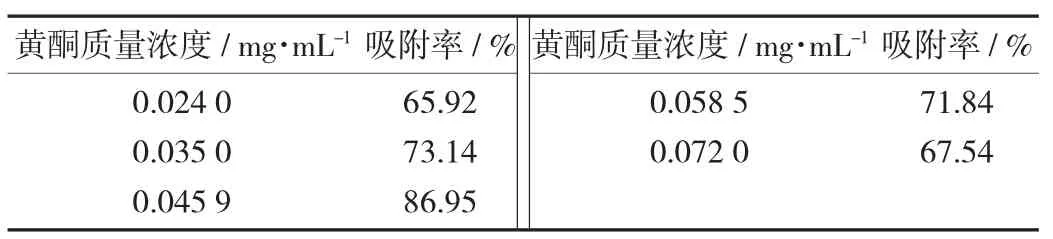
表1 上样质量浓度对吸附率的影响
由表1可得,当上样速率恒定,在一定质量浓度范围内,随着上样质量浓度的增大,树脂吸附率也在不断增加,当上样液质量浓度增加到0.049 5 mg/mL时,树脂达到最大吸附率;此后随着质量浓度的增加,吸附率不断的减少;因此该种树脂的最佳上样质量浓度为0.049 5 mg/mL;出现这种现象的原因可能是当较高质量浓度的样液通过树脂时,树脂的吸附已经趋向于饱和状态。
2.2.3 上样量对吸附效果的影响
上样量对吸附率的影响见表2。
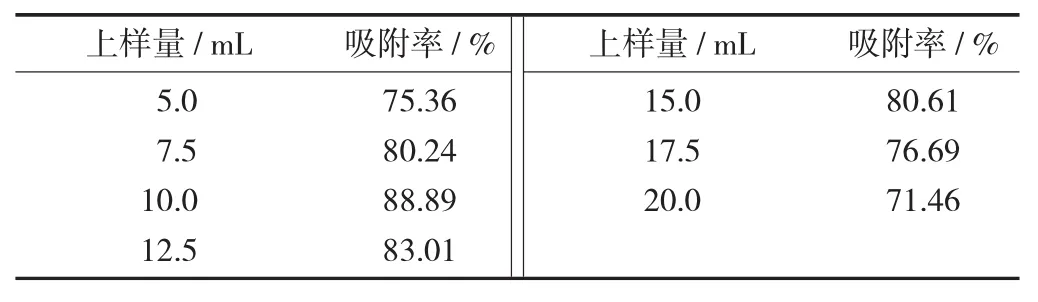
表2 上样量对吸附率的影响
由表2可知,当上样速率和上样质量浓度一定时,而上样量不同时,大孔树脂的吸附率和上样量之间存在着一定相关性变化。随着上样量的增大,树脂吸附率也在增大,当上样量增加到10 mL(2.0 BV)之后吸附率反而下降,这可能是树脂已经超过了饱和吸附量,导致大孔树脂发生部分中毒现象,产生这种现象的原因可能是样液在树脂的吸附过程中,上端的树脂首先发生吸附作用,此时如果上柱量过多,多层吸附就会在层析柱上端发生,导致树脂的吸附率降低,因此最佳上样量为10 mL。
2.3 AB-8型大孔吸附树脂最佳解析条件的确定
2.3.1 解析液质量分数对解析效果的影响
解析液质量分数对解析效果的影响见表3。
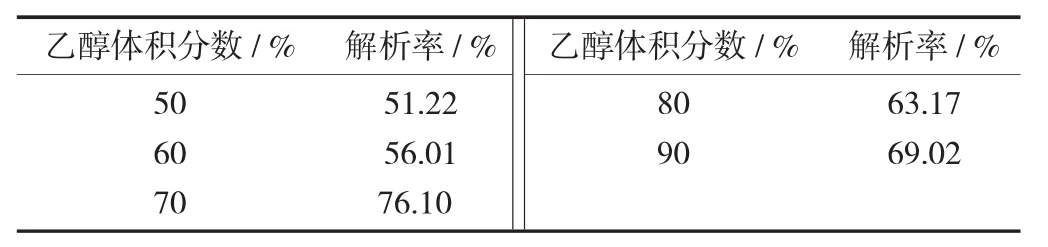
表3 解析液质量分数对解析效果的影响
由表3可知,在一定的解析液用量和流速下,用不同体积分数乙醇溶液将已饱和吸附的树脂进行洗脱,树脂解析率随着乙醇体积分数的提高而增大;当乙醇体积分数为70%时,树脂解析率达到最大值76.10%,在此之后树脂解析率不再出现较大提高,其解析率反而降低,这是因为乙醇体积分数太低,不能破坏树脂与黄酮形成的氢键,黄酮解析率低,随着乙醇体积分数增大,溶液极性与黄酮极性相差不断增大,依据相似相溶原理,黄酮的解析率将下降,故最佳解析液质量分数为70%。
2.3.2 解析液流速对解析效果的影响
解析液流速对解析效果的影响见表4。
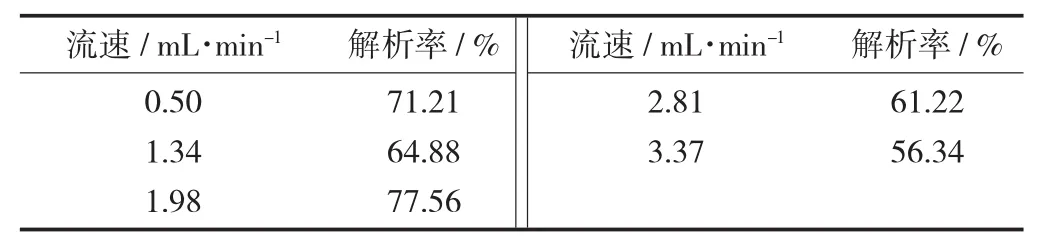
表4 解析液流速对解析效果的影响
由表4可知,在一定的解析液质量分数和解析液用量下,解析液的流速不同,解析率也不同;当解析液流速为1.98 mL/min时,其解析效果最好,解析率为77.56%,而增大和减少解析液流速都会影响解析效果;这是因为当降低解析液流速时可以使解析液在柱床中停留时间延长,有利于解析液向树脂颗粒较小空隙扩散,因此适当的降低洗脱液流速,对增强解析效果是有利的,但速率过慢时纯化过程耗时长,生产效率就会降低。综合考虑,故选择1.98 mL/min为解析液的流速。
2.3.3 解析液用量对解析效果的影响
解析液用量对解析效果的影响见表5。

表5 解析液用量对解析效果的影响
由表5可知,在一定的解析液质量浓度、一定的解析液流速下,解析液的用量不同,解析液用量的增大解析率随之增大;当解析液用量达到15 mL(5.0 BV)时,大孔树脂的解析率增长基本趋于平缓,因此考虑到节约成本,选择最佳解析液用量为15 mL,同时也便于后面解析液的处理。
3 结论
试验结果表明,AB-8型树脂是适用于从绿豆皮中提取黄酮纯化的最优树脂。其最佳吸附条件为以流速1.98 mL/min上柱吸附,吸附液质量浓度0.045 9 mg/mL,上样量10 mL,最大吸附率为88.89%;其最佳解析条件为乙醇体积分数70%,以流速1.98 mL/min洗脱,解析液用量25 mL,解析率为77.23%。在最佳的吸附和解析工艺条件处理绿豆皮黄酮粗提液,黄酮的纯度可由10.57%提高到72.19%,效果比较理想,且此法与超滤膜分离、超临界萃取和色谱分离等方法相比,具有工艺简便、成本低、条件温和和生成效率较高等优点,对于绿豆皮黄酮的初步纯化有较好的推广应用前景。
[1]曹维强,王静.绿豆综合开发及利用 [J].粮食与油脂,2003,17 (3):37-39.
[2]Furao L,Qibiao W,Lin L,et al.Antioxidant activities of water-soluble polysaccharide extracted from mung bean (Vigna radiata L).hull with ultrasonic assisted treatment[J].Carbohydrate Polymers,2010 (2):323-329.
[3]邓志汇,王娟.绿豆皮与绿豆仁的营养成分分析及对比 [J].现代食品科技,2010,26(6):656-659.
[4]裴凌鹏,惠伯棣,金宗濂,等.黄酮类化合物的生理活性及其制备技术研究进展 [J].食品科学,2004,25(2):203-207.
[5]汪少芸,叶秀云,饶平凡.绿豆生物活性物质及功能的研究进展 [J].中国食品学报,2004(1):98-102.
[6]吕萍,刘景圣,蔡丹,等.超声波法提取绿豆中的黄酮的最佳工艺研究 [J].粮油加工,2010,12(8):117-119.
[7]任顺成,定霄霖.大孔树脂对玉米须类黄酮的吸附分离特性的研究 [J].食品与发酵工业,2003,29(12):17-20.
[8]胡志军,郝利君,王南溪.D-101大孔吸附树脂分离纯化橘皮中的黄酮类物质 [J].食品科学,2010,31(8):65-69.
[9]吴海霞,吴彩娥,李婷婷,等.大孔树脂纯化银杏叶黄酮的研究 [J].现代食品科技,2013,29(12):2 964-2 969.
[10]朱宏莉,韦海洪,宋纪蓉,等.竹叶总黄酮的提取与纯化工艺研究 [J].食品科学,2005,26(8):158-161.
[11]陈婷婷,徐娟,赵珺.绿豆皮中黄酮类化合物提取工艺 [J].生物加工过程,2008,6(1):60-64.
[12]苗修港,余翔,张贝贝,等.NKA-9大孔树脂纯化香椿叶黄酮类物质工艺优化 [J].食品科学,2016,37(8):1-12.
[13]董文宾,徐颖,张建华,等.LSA-10型树脂纯化大豆异黄酮工艺条件的研究 [J].粮油加工与食品机械,2004(7):43-45.◇

