樱桃病毒PNRSV、CGRMV、PDV多重RT-PCR检测方法的建立与应用
周登攀, 郝小军, 向本春
(石河子大学农学院/新疆绿洲农业病虫害治理与植保资源利用自治区普通高校重点实验室,新疆石河子 832003)
樱桃种植业素有“黄金种植业”之称,已成为我国近年来果树产业结构调整的重要树种,樱桃栽培面积和总产量逐年增长,目前在山东、辽宁、河北、北京、山西、江苏、安徽、河南、甘肃、新疆等地均有栽培种植[1]。随着樱桃栽培规模不断扩大,病毒病日益加重,已成为制约樱桃种植产业发展及樱桃产量、品质的主要因素[2]。可以侵染樱桃的病毒达30多种,常见的约有20种[3-4],我国已报道的侵染樱桃的病毒包括李属坏死环斑病毒(prunus necrotic ring spot virus,简称PNRSV)、李矮缩病毒(prune dwarf virus,简称PDV)、樱桃绿环斑驳病毒(cherry green ring mottle virus,简称CGRMV)、樱桃病毒A(cherry virus A,简称CVA)、黄瓜花叶病毒(cucumber mosaic virus,简称CMV)、樱桃坏死锈斑病毒(cherry necrotic rusty mottle virus,简称CNRMV)、苹果褪绿叶斑病毒(apple chlorotic leaf spot virus,简称ACLSV)等12种病毒[5-11]。PNRSV和PDV属于雀麦花叶病毒科(Bromoviridae)等轴不稳环斑病毒属(Ilarvirus),其中PNRSV是我国二类进境检疫性有害生物[12];CGRMV属于线形病毒科(Flexiviridae)凹陷病毒属(Foveavirus),是在我国李属植物中发现的一种新病毒[8]。目前,这3种病毒已成为侵染樱桃较为普遍的病毒,不仅单独危害樱桃,表现出一定的症状,同时多种病毒常常复合侵染,引起樱桃表现综合症状,给樱桃种植业带来巨大的损失。因此,建立一种同时检测这3种病毒的检测方法十分必要。
目前,我国在对樱桃病毒病病原的检测方法主要有常规单重RT-PCR技术和酶联免疫吸附测定(enzyme linked immunosorbent assay,简称ELISA)检测。阮小风等利用单重 RT-PCR 技术对陕西、北京、大连、山东、河南等地区的甜樱桃病毒病病原PNRSV、PDV、CGRMV、ACLSV、CVA、CNRMV等进行检测[3,13-15];李青等利用ELISA法对北京地区樱桃中PNRSV进行检测[16]。然而这些方法往往只能对特定的某一种病毒的感染情况进行检测,须要大量的重复工作,同时又会消耗大量的检测试剂,单一病毒的RT-PCR检测已经不能满足检测工作的需求。多重RT-PCR技术是在单重RT-PCR基础上发展起来的一种检测技术,不仅具有单重RT-PCR技术的优点,且多重RT-PCR反应1次能同时快速检测多种病原的优点,能满足生产上同时对多种病原进行检测的要求。尽管2014年宗晓娟等建立了对PNRSV、PDV、樱桃小果病毒2(Littie cherry virus-2,简称LChV-2)进行多重RT-PCR检测的方法[17],但该方法并未对发病较为普遍的CGRMV进行多重RT-PCR检测。因此,本试验在前人研究的基础上,对PNRSV、CGRMV、PDV等3种病毒多重RT-PCR检测的方法进行研究,建立樱桃这3种病毒特异、高效的多重 RT-PCR 检测方法,以期对樱桃大量样品快速检测以及樱桃病毒病的防控等提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为采自新疆八师石河子地区疑似病毒病症状的樱桃叶片,以健康植株叶片为阴性对照。采集的样品分别装在不同的采集袋中,液氮速冻后置于-70 ℃冰箱中保存备用。
RNA提取试剂盒(TransZolTMPlant)、TaqPCR酶及dNTPs Mix均购自TaKaRa公司;反转录试剂盒购自Thermo公司;琼脂糖凝胶回收试剂盒、2 000 bp DNA marker均购自TransGen Biotech;其他化学试剂均为国产分析纯级试剂。PCR引物合成及测序由北京华大科技有限公司完成。大肠杆菌DH5α菌株由笔者所在实验室保存。
1.2 试验方法
1.2.1 植物组织总RNA的提取 在单一RT-PCR中,分别称取0.1 g感染病毒的叶片置于经高温灭菌处理的研钵中,加液氮磨成粉末;在多重RT-PCR中称取等量的分别感染3种病毒的樱桃叶片置于处理过的研钵中,加液氮研成粉末;用RNA提取试剂盒提取总RNA,最后用35 μL RNase free H2O溶解提取的总RNA。
1.2.2 引物设计 根据GenBank中PNRSV(FR773524.2)、CGRMV(AJ291761)、PDV(KF718661.1)的基因组序列,应用Primer 5.0软件分别设计3种病毒的特异性引物PNRSV-F/R、CGRMV-F/R、PDV-F/R。引物设计时尽可能保证各检测引物退火温度一致。引物序列的详细信息见表1。
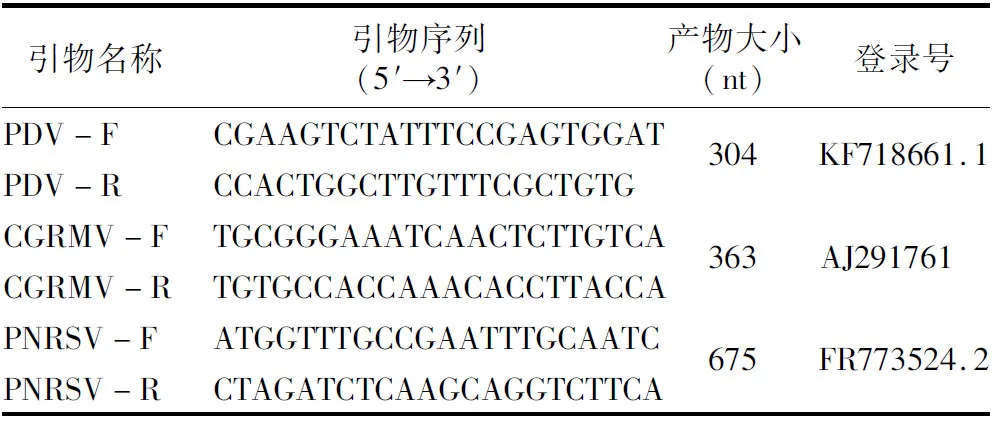
表1 RT-PCR法扩增病毒基因组特异性片段的引物
1.2.3 单重RT-PCR反应 cDNA第1链的合成:以5 μL提取的材料总RNA为模板、1 μL Oligo(dT)18为引物、1 μL随机六聚体引物、1 μL无核酸酶的高纯水轻轻混匀,65 ℃孵育5 min,迅速在冰上冷却2 min,加入10 μL 2×ES Reaction Mix、1 μL gDNA Remover、1 μL RT Enzyme Mix,轻轻混匀,25 ℃ 孵育10 min后42 ℃孵育30 min,85 ℃加热5 s终止反应,-20 ℃保存备用。
PCR反应:以合成的cDNA第1链为模板进行PCR,选用表中各引物分别检测甜樱桃样本中的3种病毒。25 μL反应体系:2.5 μL cDNA、2.5 μL 10×PCR buffer、1 μL dNTPs(2.5 mmol/L)、1 μL特异性引物(10 μmol/L)、0.3 μLTaqDNA聚合酶(5 U/μL),加16.7 μL ddH2O至终体积为 25 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,50~64 ℃退火30 s(温度根据引物设定),72 ℃延伸50 s,35个循环;72 ℃延伸10 min,4 ℃保存。PCR产物用1.2%琼脂糖凝胶电泳,用凝胶成像系统观察结果并照相。PCR反应在扩增仪上进行。
1.2.4 多重RT-PCR 选取混合提取的3种病毒的总RNA,用随机引物反转录成的cDNA第1链作为多重 RT-PCR 反应的模板。在同一个PCR反应体系中同时加入3种病毒引物组合,进行PCR反应。选用50 μL反应体系:10 μL cDNA 模板,加ddH2O至终体积为50 μL,其他条件与单重 RT-PCR 相同。
1.2.5 PCR产物的克隆、测序及分析 PCR扩增片段经回收纯化后,连接至pMD18-T载体中,转化大肠杆菌DH5α菌株后,通过菌落PCR以及酶切验证的阳性克隆,送至北京华大科技有限公司进行测序。利用GenBank数据库中的Blast程序对测序结果进行相似性检索(http://blast.ncbi.nlm.nih.gov/Blast.cgi),序列分析采用DNAMAN软件。
1.2.6 多重RT-PCR检测方法的实际应用 从新疆石河子地区采集122份樱桃病样叶片,按照上述多重RT-PCR方法对部分样品进行多重RT-PCR检测,观察并记录试验结果。
1.2.7 多重RT-PCR主要影响因素的优化 在有效的多重RT-PCR条件下,采用单一变量法考察多重RT-PCR主要影响因素,考察某一影响因素时,其他因素不变。退火温度分别设52、54、56、58、60、62、64、66 ℃等8个处理;dNTPs用量分别设0.1、0.2、0.4、0.6、0.8 mmol/L等5个处理;灵敏度分别设2、22、23、24、25、26倍等6个处理;循环数分别设25、30、35、40、45个循环等5个处理。
2 结果与分析
2.1 总RNA质量检测
用RNA提取试剂盒可从樱桃叶片上提取纯度较高的总RNA,用微量核酸蛋白分析仪测量其D260 nm/D280 nm均在1.7~2.0之间,表明组织中蛋白质、多糖、多酚等物质基本去除,提取的RNA纯度较理想,可用于后续研究。
2.2 单重RT-PCR验证
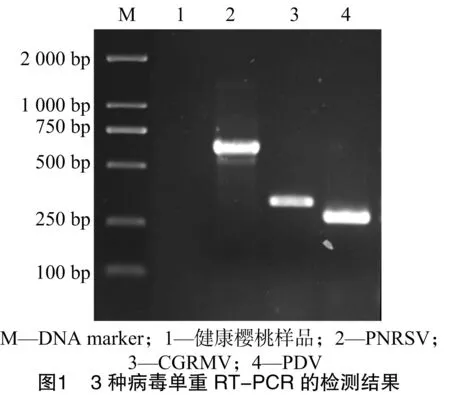
以设施樱桃病株材料的反转录产物作为PCR反应的模板,采用单重RT-PCR技术对表中各对引物进行初筛。结果表明,引物PNRSV-F/R、CGRMV-F/R、PDV- F/R均能稳定扩增出其各自的特异性片段,PCR产物经电泳观察分别得到680、360、300 bp左右的条带(图1),每种病毒特异性引物扩增获得的片段大小均与预期结果相同。
2.3 多重RT-PCR体系建立
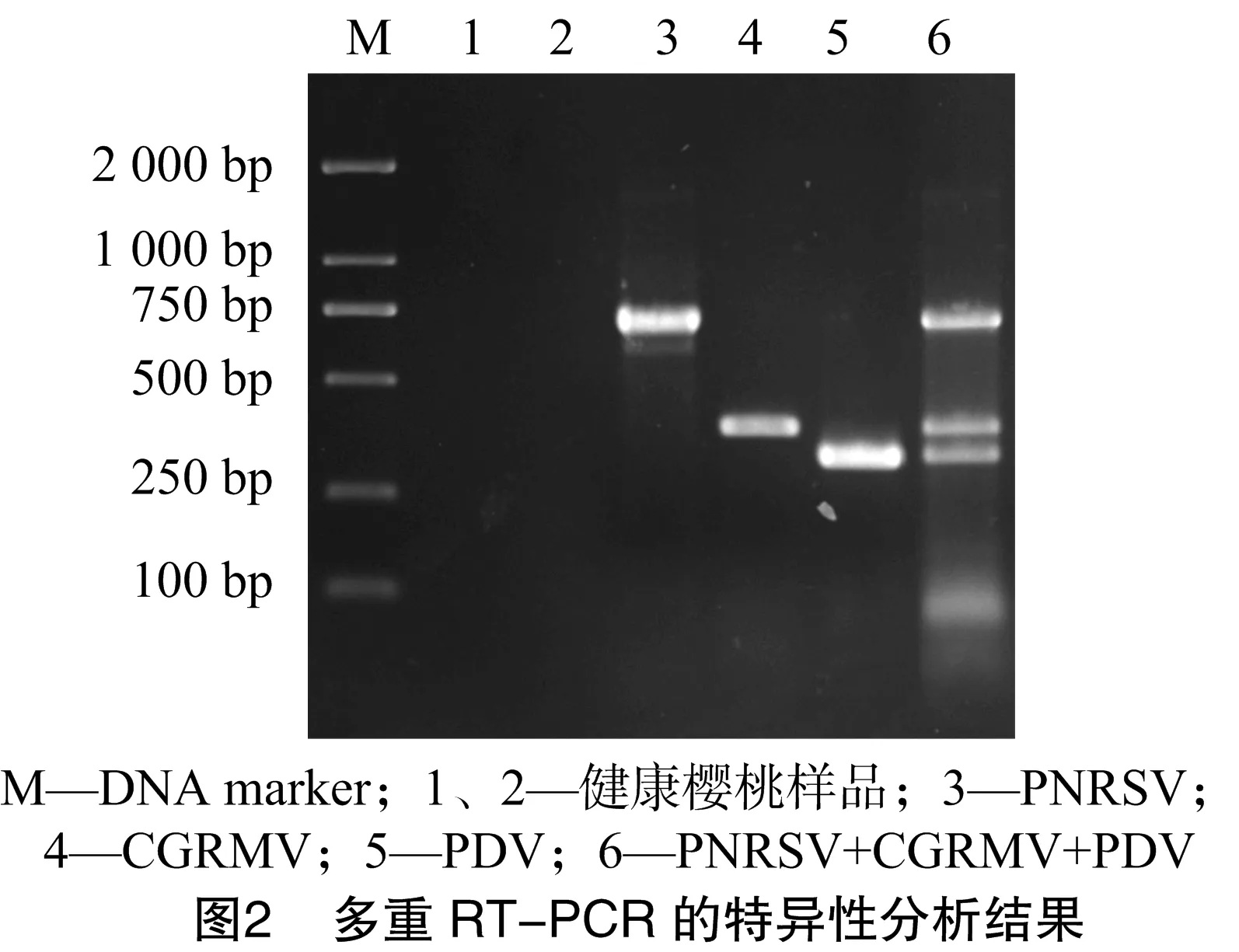
将混合提取的总RNA反转录的产物用于多重扩增PNRSV、CGRMV、PDV,结果能够扩增出PNRSV(675 bp)、CGRMV(363 bp)、PDV(304 bp)目的条带(图2),与单重 RT-PCR 扩出的目的条带一致,说明混合提取的3种病毒RNA的反转录产物能够用于多重PCR的扩增;用相同的反转录产物及樱桃健康叶片为样本,对该引物组合多重RT-PCR扩增的特异性进行分析。由图2可知,该引物组合均能特异性检测出其各自的靶标病毒,扩出的各目的条带与单重RT-PCR中各条带的大小相同,而健康樱桃样品均未能出现特异性条带,说明这3组引物组合可用于这3种病毒的多重 RT-PCR 检测。
2.4 多重RT-PCR检测体系优化
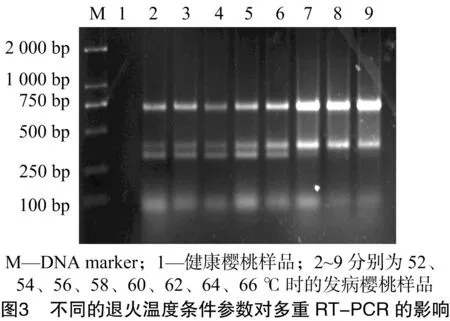
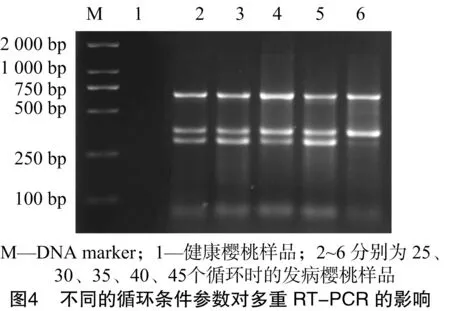
本研究对退火温度和循环次数进行优化,以相同稀释浓度的发病樱桃样品的cDNA为模板,选择不同的退火温度及PCR扩增循环数对多重RT-PCR扩增条件进行优化。由图3可知,退火温度为52~60 ℃条件下,均能进行特异性扩增,在58、60 ℃时条带最亮;当退火温度为62 ℃及以后时,PDV基本上不出现条带,因此选择最适退火温度为58 ℃。由图4可知,循环数对多重RT-PCR扩增的影响不大,25个循环即能达到检测目的,随着循环数的增加,扩增条带的强度增加,但到45个循环时PDV不能扩增出条带。为了兼顾检测效率与扩增效果,实际操作时选择35个循环。因此,多重 RT-PCR 的扩增条件最终选择退火温度为58 ℃,35个循环。
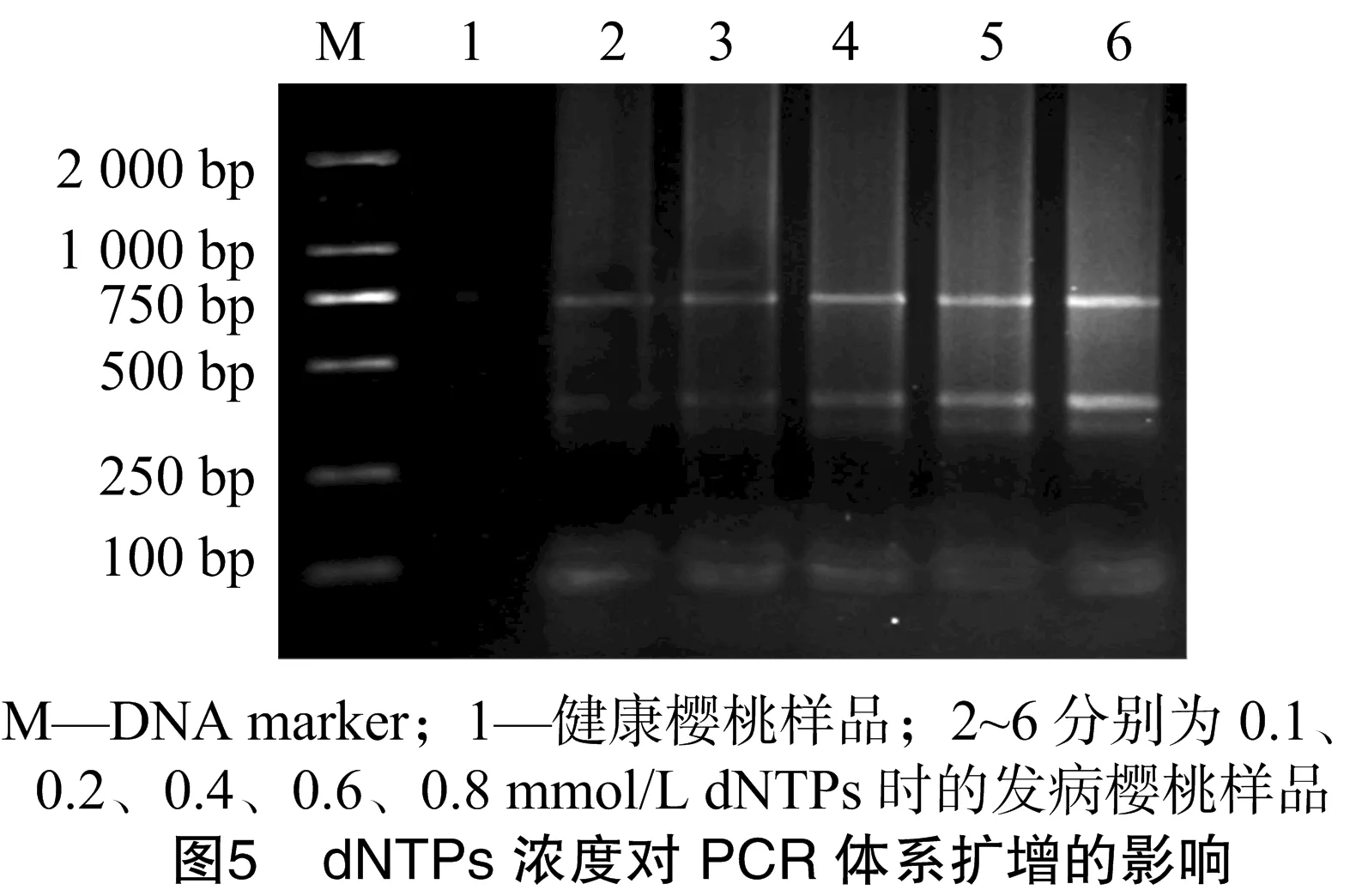
由图5可知,当dNTPs的浓度在0.2~0.8 mmol/L时均能扩增出较好的条带,对试验结果影响不大,但0.4~0.8 mmol/L dNTPs可以产生较清晰明亮的条带,因此优化体系选择dNTPs的浓度为0.6 mmol/L。
2.5 多重RT-PCR灵敏度的分析
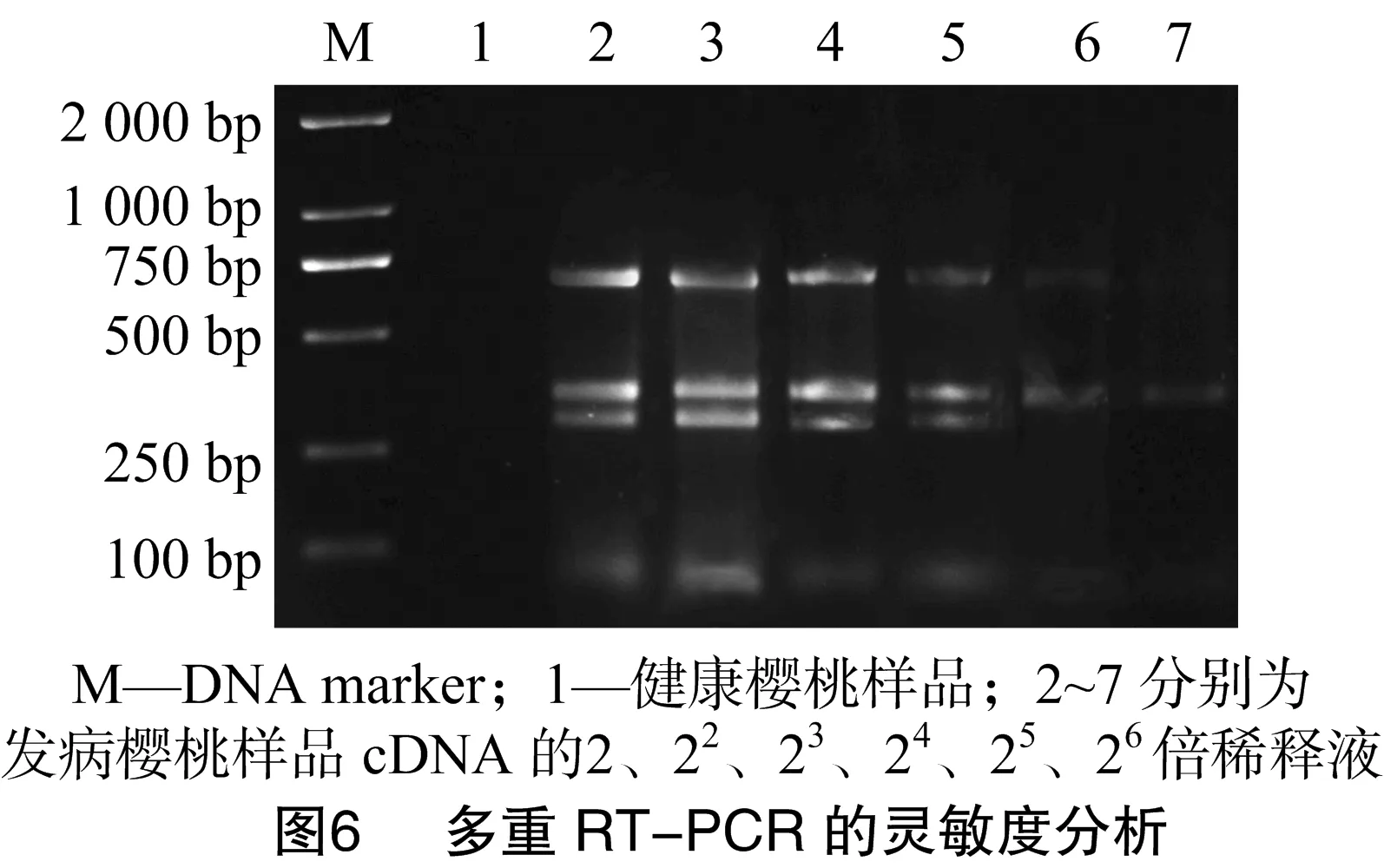
选取将混合提取的总RNA反转录产物为试验样本,采用紫外吸收法测定其初始浓度为958 ng/μL,将总RNA模板依次稀释2、22、23、24、25、26倍,对灵敏度进行分析。由图6可知,引物组合在稀释24倍的cDNA中仍能特异性扩增,但引物PNRSV-F/R扩增出的条带较微弱。稀释24倍后,PNRSV、CGRMV的条带很弱,引物组合几乎检测不到病毒条带。因此,引物组合对植物cDNA的最低检测浓度为 59.7 ng/μL。
2.6 扩增产物的测序结果及序列分析
将多重RT-PCR扩增的特异性条带分别进行凝胶回收,纯化后连接至pMD18-T载体,挑取阳性克隆测序。结果显示,PNRSV、CGRMV、PDV的扩增产物分别由675、363、304个核苷酸组成,与预期产物大小相同,与GenBank中已报道的病毒分离物的核苷酸序列同源性分别为91%~99%、91%~99%、90%~99%,这证明了多重RT-PCR检测结果的可靠性。
2.7 应用多重RT-PCR技术检测新疆石河子地区樱桃带毒情况
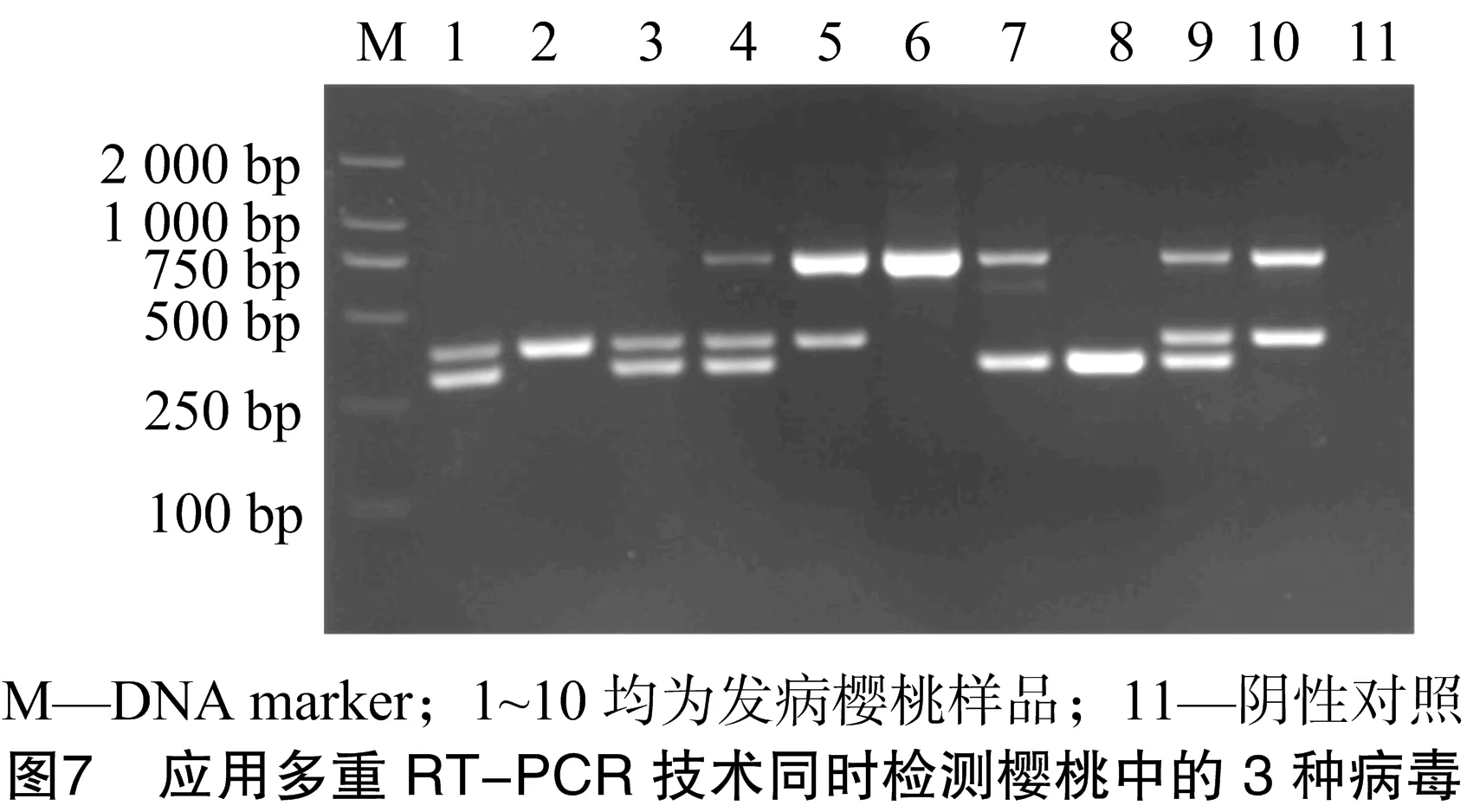
利用优化后的多重RT-PCR体系对采集的樱桃田间样品进行检测。由图7可知,10个样品均呈阳性,且多存在复合侵染;其中有3个样品只感染1种病毒,样品2感染CGRMV,样品6感染PNRSV,样品8感染PDV;有5个样品感染2种病毒,样品1、样品3均感染CGRMV、PDV,样品5、样品10均感染PNRSV、CGRMV,样品7感染PNRSV、PDV;样品4和样品9复合感染3种病毒。
3 结论与讨论
近年来樱桃栽培在我国发展较快,栽培面积不断扩大以及栽培中的苗木引种和调运、无性繁殖代数增多等因素,加快了樱桃病毒病的传播。目前,樱桃病毒病在我国已广泛发生。苗木引种、病毒的检测一直是检疫系统的难点。由于病毒在木本植株体内的含量低、分布不均且具有复合侵染的特性[12],在检疫工作中会出现漏检、误检等现象。分子生物学可以有效解决这一难题,PCR方法灵敏度高,对含量较低的靶标病毒一般也不会出现漏检情况,且对扩增产物进行测序,又能有效避免错检发生。多重RT-PCR在单一RT-PCR基础上发展而来,具有快速、简便、灵敏的特点。自1988年Chamberlain等首先将多重RT-PCR技术用以诊断杜氏肌营养不良征[18]以来,多重RT-PCR技术已被广泛应用于烟草[19]、菊花[20]、葡萄[21]等作物及园艺植物的病毒检测中。虽然宗晓娟等利用多重RT-PCR技术检测了PNRSV、LChV-2、PDV等3种甜樱桃病毒[17],但新疆地区尚未发现用多重 RT-PCR 技术检测樱桃病毒。PNRSV是一种世界范围内分布的病毒,是我国二类进境检疫性有害生物[12]。PDV、CGRMV虽未列入其中,但在我国多地均有检出,且常伴有复合侵染,严重影响了设施樱桃的产量和品质,危害严重。因此,本研究通过单一RT-PCR进行引物特异性筛选,确定出适合多重RT-PCR反应的引物组合,即PNRSV-F/R、CGRMV-F/R、PDV-F/R,特异性、灵敏度及克隆测序分析结果证明,该方法可应用于樱桃的样品检测。并通过多重 RT-PCR 条件的优化,确定出最佳RT-PCR反应条件:退火温度为58 ℃、35个循环、dNTPs浓度为0.6 mmol/L、最低检测浓度为59.7 ng/μL。通过最适反应条件对新疆石河子周围团场及葡萄研究所采集的部分樱桃样品进行检测,结果表明该地区樱桃带毒率较高,且多为复合侵染。该方法与常规的单一RT-PCR检测方法相比,成本低、操作简便、快速、适用于3种病毒单一或复合感染样品的检测。
本研究经过多次优化试验条件建立了可同时检测PNRSV、CGRMV、PDV的多重RT-PCR方法,该方法稳定、快速、准确、灵敏、检测成本低,可应用于樱桃毒害单一或复合侵染的同步检测。对控制我国樱桃病毒病的传播、樱桃病毒病的检测和及时防治具有重要意义。
参考文献:
[1]Rao W L,Zhang Z K,Li R. Frist report of cherry virus A in sweet cherry trees in China[J]. Plant Disease,2009,93(4):425.
[2]卢美光,吴 冰,高 蕊,等. 我国部分地区樱桃病毒病害初步调查和病原检测[J]. 植物保护,2015,41(1):98-103.
[3]刘聪利,李 明,赵改荣,等. 河南甜樱桃病毒病害调查及病原检测[J]. 植物保护,2016,42(4):200-204.
[4]王文文,宗晓娟,陈立伟,等. 中国甜樱桃病毒病及其检测技术研究进展[J]. 湖北农业科学,2012,51(18):3929-3933,3940.
[5]Isogai M,Aoyagi J,Nakagawa M,et al. Molecular detection of five cherry viruses from sweet cherry trees in Japan[J]. Journal of General Plant Pathology,2004,70(5):288-291.
[6]Zhou Y Y,Ruan X F,Wu C L,et al. First report of sweet cherry viruses in China[J]. Plant Disease,1996,80(12):1429.
[7]Tan H D,Li S Y,Du X F,et al. First report of cucumber Mosaic virus in sweet cherry in the People’s Republic of China[J]. Plant Disease,2010,94(11):1378.
[8]Zhou J F,Wang G P,Kuang R F,et al. First report of cherry green ring mottle virus on cherry and peach grown in China[J]. Plant Disease,2011,95(10):1319.
[9]Rao W L,Li F,Zuo R J,et al. First report of little cherry virus 2 in flowering and sweet cherry trees in China[J]. Plant Disease,2011,95(11):1484-1485.
[10]Zhou J F,Wang G P,Qu L N,et al. First report of cherry necrotic rusty mottle virus on stone fruit trees in China[J]. Plant Disease,2013,97(2):290-291.
[11]Lu M G,Gao R,Chen R R,et al. First report of little cherry virus 1 in sweet cherry trees in China[J]. Plant Disease,2015,99(8):1191.
[12]周灼标,郑雷青,管 维,等. 用二重PCR方法检测李痘病毒和李坏死环斑病毒[J]. 植物保护,2006,32(4):107-109.
[13]阮小凤,杨 勇,马书尚,等. 甜樱桃病毒病的ELISA检测研究[J]. 山东农业大学学报(自然科学版),1998,29(3):277-282.
[14]侯义龙,杨俊玲,李春敏. 李矮缩病毒RT-PCR方法建立及检测应用[J]. 中国农业科学,2005,38(2):425-427.
[15]王文文,宗晓娟,王甲威,等. 环渤海湾地区甜樱桃小果病毒及樱桃病毒A的鉴定与调查[J]. 植物保护,2013,39(2):128-133.
[16]陈君帜,李 青. 李属植物脱毒技术及病毒检测研究进展[J]. 北京林业大学学报,2001,23(5):71-74.
[17]宗晓娟,王文文,魏海蓉,等. 3种甜樱桃病毒PNRSV、PDV及LChV-2的多重RT-PCR检测方法的建立与应用[J]. 中国农业科学,2014,47(6):1111-1118.
[18]Chamberlain J S,Gibbs R A,Ranier J E,et al. Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification[J]. Nucleic Acids Research,1988,16(23):11141-11156.
[19]Dai J,Cheng J,Huang T,et al. A multiplex reverse transcription PCR assay for simultaneous detection of five tobacco viruses in tobacco plants[J]. Journal of Virological Methods,2012,183(1):57-62.
[20]Song A,You Y,Chen F,et al. A multiplex RT-PCR for rapid and simultaneous detection of viruses and viroids in chrysanthemum[J]. Letters in Applied Microbiology,2013,56(1):8-13.
[21]裴光前,董雅凤,张尊平,等. 4种葡萄卷叶伴随病毒多重RT-PCR检测[J]. 植物病理学报,2010,40(1):21-26.

