考马斯亮蓝法测定蛋白质含量中的细节问题
蒋大程,高 珊,高海伦,邱念伟
(曲阜师范大学生命科学学院,山东 曲阜 273165)
1921年,Folin首创了测定可溶性蛋白质含量的方法,此法的原理是蛋白质分子中酪氨酸和色氨酸残基(酚基)与酚试剂(磷钨酸-磷钼酸)可发生蓝色反应,蓝色化合物的颜色深浅与蛋白质浓度呈正比。这一方法被命名为Folin-酚试剂法,该法的缺点是灵敏度较低[1]。1951年,Lowry对Folin法进行了改进,他发现在碱性溶液中,蛋白质分子中的肽键可与碱性铜试剂中的Cu2+螯合,形成蛋白质-铜复合物,该复合物能够与Folin酚试剂反应产生蓝色化合物[1-2],这一改进大大提高了测定的灵敏度,改进后的方法被称为 “Lowry法”。不过Lowry法仍存在测定范围窄、使用试剂多、干扰物质多、耗费时间长及反应时间难以控制等缺点[3-4]。1976年美国科学家 Bradford建立了用考马斯亮蓝G250与蛋白质结合的方法来定量测定蛋白质含量。考马斯亮蓝法是目前实验室中最常见、灵敏度最高的一种测定蛋白质含量的方法[5-6]。它将比色法和染料结合法相结合,与其他传统方法相比具有许多突出的优点,被广泛应用于各类生物材料的可溶性蛋白含量测定,是生物化学、植物生理学、分子生物学及食品科学等实验课程中的经典实验项目之一。首先,此法所需的样品量少,蛋白质与染料结合后产生的复合物颜色稳定,消光系数高,光吸收值随蛋白质含量的变化比Lowry法灵敏得多,可检测的蛋白质数量低达1 μg[7]。其次,测定速度快,完成一个样品的测定,只需要5 min左右。第三,该方法操作简便,只需加一种考马斯亮蓝试剂,不像Lowry法需要试剂较多,费时费力,需要严格控制反应时间[8],适合大批量样品蛋白质含量的测定。此外,该方法还具有干扰物质少的优点。
此方法虽然操作简单,但在操作过程中,仍有许多细节问题容易被忽视,从而导致实验结果出现偏差甚至错误。相关教材和文献中只介绍了3~4项重要的注意事项[9-11],还有很多操作细节并未提及。本实验室在长期的教学和科研中积累了测定蛋白质含量的丰富经验,总结了30余条实验注意事项,分为仪器设备的操作、试剂的配制与保存、标准曲线的绘制、样品蛋白质的提取和样品吸光度的测定等5个方面,旨在培养精益求精、一丝不苟的科学态度。
1 实验原理
考马斯亮蓝G250(coomassie brilliant blue G250)法测定蛋白质含量的原理是:在酸性溶液中,考马斯亮蓝G250染料主要与蛋白质中的碱性氨基酸 (特别是精氨酸和赖氨酸)[12]和芳香族氨基酸的残基通过疏水力相结合,从而使染料的最大吸收峰(lmax)由465 nm变为595 nm,溶液的颜色由棕红色变为蓝色[13]。在一定蛋白质浓度范围内(1~1 000 μg/mL), 溶液在 595 nm 处的吸光度与蛋白质浓度呈线性关系。根据标准蛋白溶液绘制标准曲线,就可通过测定样品在595 nm的吸光度计算样品的蛋白质浓度。然后根据公式计算生物样品的可溶性蛋白质含量。
2 实验试剂与仪器
2.1 试剂
1)考马斯亮蓝试剂:取考马斯亮蓝G250 100 mg溶于50 mL 95%乙醇中,加入100 mL 85%(W/V)磷酸,用蒸馏水稀释至1 000 mL,过滤后备用。
2)标准蛋白质溶液:用0.2 mol/L pH 7.0磷酸缓冲液(phosphate buffered saline,PBS)将结晶牛血清蛋白配制成1 mg/mL标准蛋白质溶液。
3)磷酸缓冲液:用蒸馏水将KH2PO42.12 g和K2HPO45.56 g分别溶解,混合后定容至200 mL,配成0.2 mol/L pH 7.0的磷酸缓冲液。
2.2 仪器
紫外-可见光分光光度计、比色皿、移液枪、冷冻离心机、离心管、分析天平、药匙、研钵、研杵、烧杯、量筒、试管、试管架、玻璃棒、剪刀。
3 实验步骤
3.1 制作标准曲线
1)取7支试管,按如表1所示溶液量进行操作,每种浓度重复做3次。加入标准蛋白溶液和考马斯亮蓝后,立即摇匀,5~20 min内以1号管为空白对照,在595 nm处测定吸光值,填入表1。
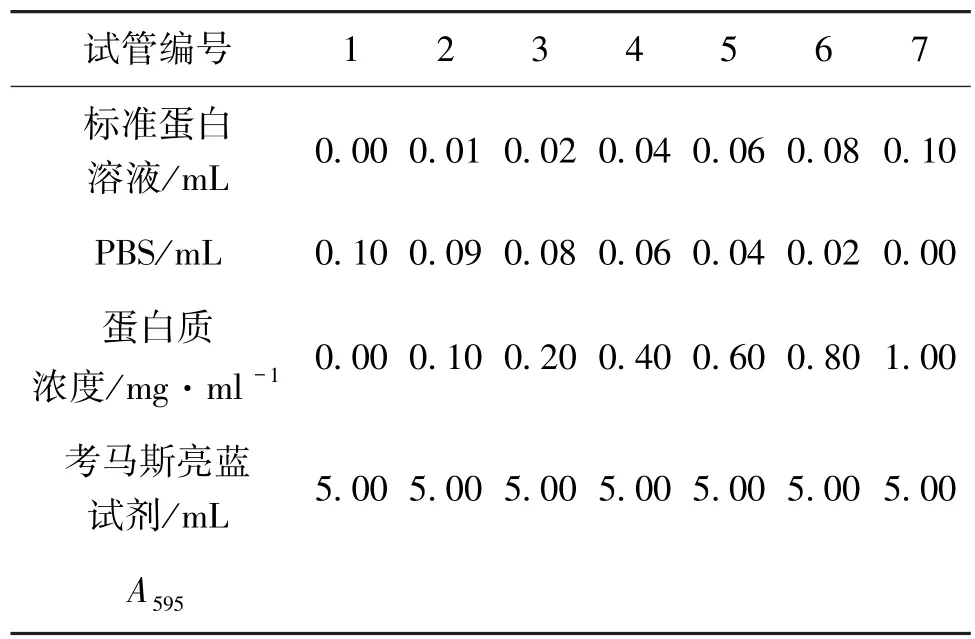
表1 标准溶液吸光度的测定
2)绘制标准曲线:以标准蛋白质浓度为横坐标,以A595为纵坐标,参照文献[14]的方法,用Excel办公软件绘制蛋白质标准曲线。
3.2 未知样品蛋白质含量测定
取待测植物材料1.0 g,用少量的石英砂和10 mL PBS研磨提取,研磨后经两步离心(12 000 g 6 min和26 900 g、16 min),取其上清液即为蛋白提取液。将0.1 mL蛋白提取液和5 mL考马斯亮蓝试剂混合,2 min后即可测定其吸光度。每个样品重复做5次,取其吸光度的平均值代入标准曲线方程,求出样品蛋白质浓度。然后代入式(1)计算植物材料蛋白质含量。

4 注意事项
4.1 实验仪器设备
1)用到的所有玻璃器皿必须用蒸馏水清洗干净,晾干备用。因为在实验过程中,仍有一些物质干扰蛋白质含量的测定,主要的干扰物质有强碱性缓冲液、去污剂、Triton X-100及十二烷基硫酸钠等[15]。所以在清洗玻璃器皿过程中使用去污剂、强碱性物质时,一定要冲洗干净。
2)比色皿内外壁都需清洗,保证比色皿干净透明,晾干或冷风吹干后待用(湿润的比色皿壁接触考马斯亮蓝溶剂后会发蓝)。为减小实验误差,测定前可先用少量待测液润洗比色皿,然后再进行测定。
3)待测液体积大约为比色皿容积的2/3即可,溶液过满容易外溢。流到比色皿外壁的待测液要及时用沾有酒精的吸水纸擦拭干净,以免影响比色皿的透光率。
4)比色皿使用后,会残留蓝色染料,干燥后很难清洗,需用酒精及时洗涤干净。一定不能将比色皿长期浸泡在酒精中,否则比色皿会因粘胶被溶解而散架 (比色皿上的两块透明玻璃是用胶粘上的)。
5)拿取比色皿时,只能接触两侧的毛玻璃面,严禁用手指触摸透光面[16],以免留下指纹,影响测定准确性。
6)严禁用硬物擦拭比色皿的透光面,以免产生划痕,应使用镜头纸或丝绸顺着同一方向擦拭干净。
7)考马斯亮蓝可以与石英比色皿产生强烈的结合,因此本实验建议使用玻璃或塑料比色皿[17]。
8)测试的同一批样品必须使用同一套比色皿[18],不同厂家、不同批次的比色皿透光率不同,影响测定结果。
9)分光光度计使用前应预热20 min[19],使光源达到稳态,此时测量的数值会比较稳定。
10)使用移液管或移液枪移取液体体积要精确,为减小人为误差,最好同一个人操作。
4.2 试剂的配制与保存
1)在配制考马斯亮蓝试剂时,应先加入考马斯亮蓝G250粉末和乙醇,溶解后再加入磷酸,最后用蒸馏水定容。考马斯亮蓝试剂必须要经过过滤后才能使用,滤液应为浅棕红色,与蛋白质结合后呈蓝色,配制好的试剂可在4℃下棕色瓶中保存1个月。
2)考马斯亮蓝有G-250和R-250两种类型。测定蛋白质含量必须使用考马斯亮蓝G-250;考马斯亮蓝R-250与蛋白质反应缓慢,可以被洗脱,只能用于蛋白质电泳条带的染色[20]。
3)应预先通过微量凯氏定氮法测定结晶牛血清蛋白的氮含量,根据其纯度,再用磷酸缓冲液配制标准蛋白质溶液[13]。配置好的标准蛋白质溶液分装后可冷冻保存6个月。
4)标准蛋白溶液母液(1 mg/mL)可以先分别稀释成不同浓度梯度的标准溶液,然后分别吸取0.1 mL绘制标准曲线,以减少取样误差,稀释液如表2所示。

表2 标准蛋白溶液的稀释
5)标准蛋白质溶液、考马斯亮蓝试剂、磷酸缓冲液恢复至室温后再使用,因为低温影响染色效果,并使比色皿壁产生水雾。
4.3 标准曲线的绘制
1)各种蛋白质中碱性氨基酸(特别是精氨酸)和芳香族氨基酸含量不同,因此考马斯亮蓝法用于测定不同蛋白质含量时有较大偏差,为减少这方面的偏差,在制作标准曲线时,一般以牛血清蛋白作为标准蛋白质。
2)由于试剂保存时间及贮藏条件等因素的影响,各试剂成分会有变化,影响测量结果。因此,每次实验均需重新绘制标准曲线。
3)实验过程中,若考马斯亮蓝试剂不足,重新配置后,应重新绘制标准曲线。
4)标准曲线上的每个浓度点应做3个重复,若无异常值,则取3个重复的平均值;若有异常数据,则去掉异常数据后取平均值。若某个浓度点的3个数据全部异常,则应重做该浓度点或者删除该浓度点。
5)一般要求标准曲线的相关系数(r)达到0.99,才能保证实验结果的精确性[14]。
6)标准蛋白浓度过高时,该浓度点会偏离标准曲线,应将该点删除。
7)徒手绘制标准曲线误差较大,标准曲线应采用Excel等办公软件绘制[14]。
4.4 样品蛋白质的提取
1)每种样品建议做5个以上重复,取材要均一,以增加实验结果的可靠性和稳定性。
2)蛋白质提取过程中用到的研钵、研杵等仪器及磷酸缓冲液需提前预冷,提取过程(包括离心)应在低温(0~4℃)下进行,以防止植物组织中的蛋白酶降解蛋白质。
3)研磨要充分,研磨时应先加2 mL磷酸缓冲液,研磨成匀浆后(提取液加入过多,叶片漂浮在液面上,难以研磨充分),再用2~3 mL磷酸缓冲液继续研磨提取。最后用剩余的磷酸缓冲液冲洗研钵和研杵,合并蛋白质提取液,混匀后离心。
4.5 样品吸光度的测定
1)测定样品在595 nm处的吸光度时,以5 mL考马斯亮蓝试剂和0.1 mL磷酸缓冲液混匀后调零。
2)在加入考马斯亮蓝溶液和蛋白样品混匀后,染料与蛋白质的结合约需2 min达到平衡。在5~20 min内,结合最为稳定,此时测定吸光度最为可靠[21]。超过1 h蛋白质就会明显沉淀。
3)为避免反复清洗比色皿,测定标准样品吸光度时,可从低浓度到高浓度测定,这样干扰和误差较小。
4)做标准曲线及测定样品时,吸光度应在0.1~0.6之间(常见实验中吸光度一般要求在0.1~0.8),因为考马斯亮蓝溶液在595 nm处的本底吸光度较高,约为0.2~0.3。所以样品吸光度高于0.6时,吸光度与蛋白质浓度已不成正比,此时应将蛋白质提取液用磷酸缓冲液稀释至合适浓度后再进行测定。
5)不必每测定一个样品清洗一次比色皿,同一处理的多个重复样品可用同一个比色皿连续测定。不同处理的样品应清洗比色皿,并晾干或吹干后再进行测定。
6)测定结束后可用乙醇将比色皿中的蓝色染料溶解洗涤下来,然后用蒸馏水冲洗干净,晾干备用。
7)考马斯亮蓝试剂不与单体氨基酸及相对分子量小于3 kDa的多肽结合,多肽类激素和很多重要的活性肽分子量都低于3 kDa,考马斯亮蓝法不能用于这些蛋白质和氨基酸的浓度测定[22]。
5 结束语
蛋白质含量测定是生物学中的经典实验,该实验涉及很多技术细节和专业知识,忽视任何一个细节都会导致实验结果出现偏差,没有经验的初学者测定的结果往往是错误的,他们既不知道实验结果的可靠性,也不知道实验失败的原因。本文从5个方面系统总结了本实验项目的操作细节,不仅有助于学生熟练掌握该项实验技术,而且对其他类似实验项目也具有很好的参考价值。我们已经将上述实验技术细节应用到科研和教学中,使得蛋白质含量测定结果的准确性和稳定性大大提高,也拓展了学生的专业知识,提高了学生的实验技能,培养了学生严格、认真、细致的科研素质。
[1]刘汉才,陈舒丽.生物化学与分子生物学实验教程[M].北京:科学出版社,2013.
[2]高国全,王桂云.生物化学实验[M].武汉:华中科技大学出版社,2014.
[3]胡琼英,秦春,陈敏.生物化学与分子生物学实验技术[M].3版.北京:化学工业出版社,2014.
[4]李凌.生物化学与分子生物学实验指导[M].2版.北京:人民军医出版社,2015.
[5]BRADFORD M M.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 1(72):248-254.
[6]王贵.紫外可见分光光度计及其应用[J].广州化工,2016, 44(13):52-53.
[7]王镜岩,朱圣庚,徐长法.生物化学[M].3版.北京:高等教育出版社,2002.
[8]LOWRY O H, ROSEBROUGH N J, FARR A L, et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry, 1951, 193(1):265.
[9]王元秀,李华,张恒.生物化学实验[M].武汉:华中科技大学出版社,2014.
[10]欧芹,林雪松.生物化学与分子生物学实验教程[M].2版.北京:北京大学医学出版社,2015.
[11]罗先群,曹献英.生物化学实验[M].北京:化学工业出版社,2015.
[12]SEDMAK J J, GROSSBERG S E.A rapid, sensitive,and versatile assay for protein using Coomassie Brilliant Blue G250 [J]. Analytical Biochemistry, 1977,79(1):544-552.
[13]夏俊,段巧玲.医学生物化学实验与习题指导[M].合肥:中国科学技术大学出版社,2016.
[14]马宗琪,衣宁,赵文倩,等.生物学实验中标准曲线的绘制——以蛋白质标准曲线为例[J].实验科学与技术,2014,12(5):8-10.
[15]何凤田,连继勤.生物化学与分子生物学实验教程[M].北京:科学出版社,2016.
[16]何晓明,党云洁,李志强,等.紫外光度实验中比色皿的鉴别、使用和管理维护[J].实验室科学,2016, 19(2):53-56.
[17]CHIAL H J, THOMPSON H B, SPLITTGERBER A G.A spectral study of the charge forms of Coomassie Blue G250[J].Analytical Biochemistry, 1993, 209(2):258-266.
[18]刘新,汪玉琼,宋庆雄.浅谈使用分光光度计易出现的几个问题[J].福建分析测试,2007,16(4):50-52.
[19]李位.分光光度计使用中不容忽视的几个问题[J].广州化工,2016,44(11):172-174.
[20]萨姆布鲁克,弗里奇,曼尼阿蒂斯.分子克隆实验指南[M].2版.北京:科学出版社,1992.
[21]武金霞.生物化学实验教程[M].北京:科学出版社,2012.
[22]FRIENDENAUER S,BERLET H H.Sensitivity and variability of the bradford protein assay in the presence of detergent[J].Analytical Biochemistry, 1989, 178(2):263-268.

